缬沙坦对扩张型心肌病心衰大鼠心肌细胞凋亡相关蛋白的影响
张赢予 张馨木 苏兆亮 李卫东 尹春阳 陈建华 张国辉
(江苏大学附属人民医院,江苏 镇江 212002)
美国国立卫生院(NIH)制订的心血管疾病战略,鼓励从凋亡等方面,将心力衰竭和扩张型心肌病(DCM)的分子细胞机制联合研究〔1〕。血管紧张素Ⅱ 1型受体(angiotensin II type 1 receptor,AT1R)拮抗剂缬沙坦(Valsartan,Val)对于治疗老年心力衰竭、自发性高血压能够有效抑制心肌细胞凋亡〔2~6〕,在心肌缺血再灌注损伤中也能减轻心肌细胞凋亡,减轻缺血再灌注损伤,保护心脏〔7〕。而 Val对于 DCM心肌细胞凋亡的影响及其相关机制尚未见系统研究。本研究通过观察 Val对DCM心衰大鼠心肌细胞凋亡的影响,探讨 Val降压外的心脏保护作用机制。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠,8周龄,体重 220~260 g,由江苏大学实验动物中心提供〔许可证号:SYXK(苏)2008-0024〕。
1.2 实验仪器及试剂 X-22R型冷冻离心机(美国 Beckman公司),匀浆机(德国 IKA公司),冰冻切片机、荧光倒置显微镜(德国 Leica公司),垂直电泳仪(美国Bio-Rad公司)。阿霉素(浙江海正药业有限公司,批号:070301),Val(北京诺华制药有限公司,批号:080401),氯胺酮(江苏恒瑞医药有限公司,批号:HK071105)。试剂:考马斯亮蓝蛋白定量试剂盒(南京建成生物工程有限公司,批号 20090511),甘露醇、蔗糖、琥珀酸(Sigma公司),Hepes(Amresco公司),EDTA(上海五联化工厂),Tris(上海润捷化学试剂有限公司)。
1.3 动物分组及处理 将 40只 SD大鼠完全随机分为模型组(DCM组,n=15),Val干预组(DCM+Val组,n=15)和对照组(C组,n=10)。DCM组及 DCM+Val组给予阿霉素(2 mg/kg,1次/w)腹腔注射,C组给予相同体积生理盐水腹腔注射。DCM+Val组每日给予Val(30 mg/kg)灌胃给药,DCM组及 C组给予同体积生理盐水灌胃,持续给药 8 w。于第 8周实验结束时麻醉大鼠,采血后迅速取出心脏,一部分 4%中性甲醛固定,另一部分用生理盐水制成 10%组织匀浆,测定相关指标。
1.4 Western印迹检测 VDAC、Smac蛋白的表达 采用 Western印迹检测电压依赖阴离子通道(voltage-dependent anion channels,VDAC)、第二个线粒体来源的胱氨酸酶激活剂(second mitochondria-derived activator of caspase,Smac)蛋白表达情况。步骤如下:提取各组大鼠心肌组织总蛋白,Bradford法进行蛋白定量后进行 SDS-PAGE,电泳结束后将蛋白转印至 PVDF膜,用含 5%脱脂奶粉的TBST 4℃封闭过夜,TBST洗涤。一抗孵育过夜,洗涤后加入辣根过氧化物酶标记的二抗,室温孵育1 h,洗涤后用ECL plus显色,Typon多功能激光扫描成像系统扫描,用凝胶图像处理系统分析目标带的分子量和净光密度值,相对灰度值的计算为各蛋白与内参 β-actin的比值,表示蛋白的相对表达水平。
1.5 免疫组化染色法检测VDAC、Smac蛋白的表达 各组大鼠心肌组织固定 24 h,常规石蜡包埋、切片,厚度约 4~5μm,贴附于涂有多聚赖氨酸的载玻片上,采用免疫组化SP法检测VDAC、Smac蛋白的表达。判定标准:阳性细胞胞浆呈棕褐色,着深棕色者为强阳性表达细胞,不着色者为阴性表达细胞,介于两者之间者为弱阳性表达细胞。
1.6 心肌细胞凋亡指数(cardiac myocyte apoptosis index,CMAI)的检测 采用 Td T介导的 d UTP缺口末端标记技术(TUNEL)检测各组石蜡切片 CMAI,参照文献方法〔8〕,按照试剂盒说明书操作。200倍光镜下观察结果,每张切片随机选择5个高倍镜视野,计数视野中凋亡阳性染色的心肌细胞数及心肌细胞总数的比例即 CMAI。判断标准:核蓝染者为阴性细胞,即未发生凋亡的正常心肌细胞;胞核中有棕黄色颗粒者为阳性细胞,即凋亡细胞。按公式计算:CMAI=阳性细胞数/心肌细胞总数 ×100%。
1.7 统计学方法 所有数据用 SPSS16.0统计软件进行单因素方差分析(one-way ANOVA),计量资料数据以 x±s表示,多组间均数比较采用 Student-Newman-Keuls法。
2 结 果
2.1 各组大鼠心肌组织 VDAC、Smac蛋白表达的 Western印迹结果比较 DCM组和DCM+Val组大鼠心肌组织中 VDAC、Smac蛋白相对表达水平显著高于 C组(均 P<0.05);但与DCM组相比,DCM+Val组大鼠心肌组织中两种蛋白的表达水平显著下降(P<0.05)。见图 1。

图1 各组大鼠心肌组织 VDAC、Smac蛋白的表达
2.2 各组大鼠心肌组织VDAC、Smac蛋白表达的免疫组化结果比较 C组大鼠心肌组织中,大部分为胞浆蓝染的阴性细胞,仅见少量的 VDAC、Smac阳性细胞;DCM组和 DCM+Val组大鼠心肌组织中 VDAC、Smac阳性细胞数显著高于 C组,胞浆中可见大量的棕黄色颗粒;与 DCM组相比,DCM+Val组大鼠心肌组织中两种蛋白阳性的细胞数显著减少。见图 2。
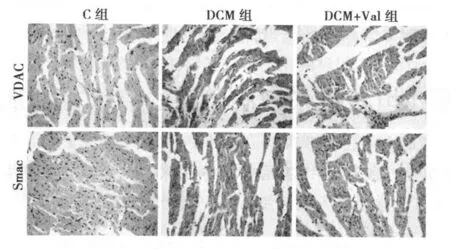
图2 各组大鼠心肌组织 VDAC、Smac蛋白表达的免疫组化结果(×200)
2.3 各组大鼠心肌 CMAI的比较 与 C组相比,DCM组和DCM+Val组大鼠 CMAI显著升高(P<0.05);与 DCM组相比,DCM+Val组大鼠CMAI有所降低,但差别无统计学意义(P>0.05)。 见图 3,图 4。
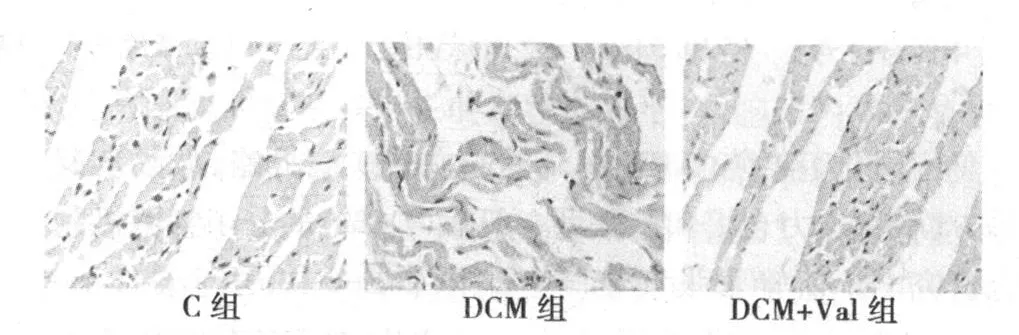
图3 各组大鼠心肌组织 TUNEL结果(×200)

图4 各组大鼠心肌CMAI的比较
3 讨 论
心肌细胞凋亡广泛存在于心力衰竭、心肌梗死、心肌缺血再灌注和冠状动脉微栓塞中,是导致心血管疾病的重要原因〔9〕。细胞凋亡的两条经典通路为死亡受体通路(外源性通路)和线粒体通路(内源性通路),其中线粒体凋亡通路在细胞凋亡中发挥重要的作用。心肌组织是高耗能组织,线粒体的含量极其丰富,因此,线粒体凋亡通路在心肌凋亡中扮演着重要的角色。
VDAC是存在于线粒体外膜上含量最丰富的膜蛋白,是细胞色素酶 C释放通道外膜的组成成分,也是促凋亡和抗凋亡蛋白的瞄定点,具有单通道传导性、选择性、电压依赖性。其闭合可以抑制线粒体功能,导致线粒体膜通透性的改变,使得细胞色素 C、Smac/Diablo、细胞凋亡因子等释放,最终导致凋亡。VDAC受多种因素的影响,如缺氧、细胞低氧、乙醇、活性氧和活性氮、细胞因子、激酶、NADH的增加可以抑制 VDAC,促进呼吸链底物如短链脂肪酸和乙醛氧化〔10~15〕。促凋亡线粒体蛋白Smac是细胞凋亡线粒体信号通路中的重要调节分子之一。在心肌组织中含量丰富,但是否参与了阿霉素损伤导致的心肌细胞凋亡,目前尚未见报道。大量研究表明,Smac在凋亡发生过程中起着关键作用。正常情况下,Smac位于线粒体膜间隙。在细胞受到各种凋亡诱导因素刺激时,其线粒体定位信号肽被切除,形成有活性的蛋白,由线粒体释放入胞质,特异结合凋亡抑制蛋白(IAPs),并解除其对 caspases等的活性抑制作用,从而使 caspase-3、caspase-9活性增强,促进细胞凋亡发生〔16,17〕。本实验 Western印迹和免疫组化研究结果显示,DCM组大鼠心肌组织中 VDAC、Smac蛋白表达较 C组显著升高,说明这两种蛋白参与了阿霉素诱导的扩张型心肌病心衰大鼠的心肌凋亡过程,而DCM+Val组大鼠心肌组织中两种蛋白的表达较DCM组显著下降,可能的机制为 Val通过 AT1受体的作用,部分阻断了心衰发生发展过程中 AngⅡ引起的心肌细胞凋亡。本实验测观测到 Smac参与阿霉素心肌损伤后的病理生理改变,推测在损伤过程中 Smac可能是通过线粒体凋亡途径来介导心肌凋亡的。本实验结果显示,DCM+Val组大鼠CMAI较 DCM组有所降低,但无统计学意义,其原因可能为在 DCM心肌细胞凋亡的晚期阶段,心肌细胞已经发生了不可逆的变化,Val的干预只能部分减缓凋亡发生的进程,而不足以阻止凋亡的发生。
综上所述,DCM发生发展过程中,线粒体蛋白参与了心肌细胞的过度凋亡,进而引起心肌组织的损伤。外源性给予 Val可以通过某些途径抑制线粒体参与凋亡的蛋白的改变,进而起到保护心脏的作用,但其具体作用机制尚需进一步研究确定。而且,在DCM心衰发展的病理生理过程中,线粒体凋亡通路中是否还存在其他影响因素,尚需进一步研究。
1 马文珠,张寄南.心肌疾病〔M〕.南京:江苏科学技术出版社,2000:9.
2 张忠杰,燕慧玲,王 荻,等.缬沙坦治疗老年心力衰竭的临床观察〔J〕.中国老年学杂志,2004;24(6):556.
3 Akashiba A,Ono H,Ono Y,et al.Valsartan improves l-NAME-exacerbated cardiac fibrosis with TGF-beta inhibition and apoptosis induction in spontaneously hypertensive rats〔J〕.J Cardiol,2008;52(3):239-46.
4 Li W,Sun N,Liu W,et al.Influence of Valsartan on myocardial apoptosis in spontaneously hypertensive rats〔J〕.Chin Med J(Engl),2002;115(3):364-6.
5 刘 巍,李为民,孙宁玲.缬沙坦对自发性高血压大鼠心肌 Bcl-2和Bax蛋白表达的影响〔J〕.中国临床康复,2004;8(36):8046-7.
6 焦 阳,洪小苏,陈建昌 .降压药物对未成年自发性高血压大鼠心肌细胞凋亡的影响〔J〕.高血压杂志,2003;11(5):468-72.
7 王爱华,寇俊杰,卫 丹,等 .IPC和缬沙坦在心肌缺血再灌注损伤中抑制心肌细胞凋亡的作用〔J〕.中外健康文摘,2009;6(7):47-8.
8 朱汉华,李 浪,汪 熠,等.TUNEL检测心肌细胞凋亡的影响因素探讨〔J〕.广西医科大学学报,2009;26(1):24-6.
9 Crow MT,Mani K,Nam YJ,et al.The mitochondrial death pathway and cardiac myocyte apoptosis〔J〕.Cir Res,2004;95(10):957-70.
10 Bayrhuber M,Meins T,Habeck M,et al.Structure of the human voltagedependent anion channel〔 J〕.Proc Natl Acad Sci,2008;105(40):15370-5.
11 Colombini M.VDAC:the channel at the interface between mitochondria and the cytosol〔J〕.Mol Cell Biochem,2004;256-257(1-2):107-15.
12 Rostovtseva Tk,Tan W,Clombini M.On the role of VDAC in apoptosis:fact and fiction〔J〕.J Bioenerg.Biomembranes,2005;37(3):129-42.
13 Lemasters JJ.Dying a thousand deaths:redundant pathways from different organelles to apoptosis and necrosis〔J〕.Gastroenterology,2005;129(1):351-60.
14 Green DR,Kroemer G.The pathophysiology of mitochondrial cell death〔J〕.Science,2004;305(5684):626-9.
15 刘昱圻,李 泱,王士雯.线粒体膜电压依赖阴离子通道〔J〕.中华医学实践杂志,2006;5(10):1106-8.
16 Du C,Fang M,Li Y,et al.Smac,a mitochondrial protein that promotes cytochrom c-dependent caspase activation by eliminating IAP inhibition〔J〕.Cell,2000;102(1):33-42.
17 Srinivasula SM,Hegde R,Saleh A,et al.A conserved XIAP interaction motif in caspase-9 and Smac regulates caspase active and apoptosis〔J〕.Nature,2001;410(6824):112-6.

