PPARγ配体对人肺癌细胞 95-D增殖的影响及机制探讨
于鹏飞,曾波航
(广州医学院,广东广州 510182)
过氧化物酶体增殖体激活受体 γ(PPARγ)是一类由配体激活的核转录因子,为核激素受体超家族中的成员。研究表明,这些配体对多种人类肿瘤细胞的增殖、分化及凋亡具有调节作用。2000年 7月~2007年 7月,我们观察了 PPARγ合成配体曲格列酮(TGZ)和天然配体 15-脱氧前列腺素 J2(15-PGJ2)对高转移肺腺癌细胞株 95-D细胞增殖、凋亡、分化及其对 PPARγ表达水平的影响,研究PPARγ通路与细胞增殖和凋亡之间的关系,探讨PPARγ作为肺癌诊疗的新靶点的可行性。
1 材料与方法
1.1 材料 95-D细胞,15-PGJ2,TGZ,山羊抗人PPARγ,即用型 SABC免疫组化试剂盒,DAB显色试剂盒,Annexin V/PI kit,RPMI-1640细胞培养基,胎牛血清,DMSO。
1.2 方法
1.2.1 细胞培养 将 95-D细胞在含 10%胎牛血清、青霉素 100 U/ml的 RPMI-1640培养基中培养,在 37℃、5%CO2饱和湿度孵箱中贴壁培养,用0.25%胰蛋白酶消化传代。
1.2.2 细胞增殖活性检测 采用 MTT法。取对数生长期 95-D细胞并调整至 5×104/ml,接种 96孔板,每孔 150μl,另设空白组。每孔加入 200μl培养液,37℃、5%CO2培养 48 h。TGZ组加入 TGZ溶液 50μl(终浓度 40μmol/L),15-PGJ2组加入 15-PGJ2溶液 50μl(终浓度 20μmol/L),对照组加入DMSO混合溶液 50μl(DMSO∶10%FBSRPMI-1640为 1∶19,下同 ),继续培养 12、24、36 h。每孔加入0.5%MTT溶液 20μl培养 4 h,弃上清。每孔加200μl DMSO,振荡 10 min,使结晶充分溶解。采用酶联免疫检测仪测定各孔 OD值,测定波长490 nm,参考波长 630 nm。细胞增殖抑制率 =(1-实验组OD值 /对照组 OD值)×100%。
1.2.3 细胞凋亡率检测 采用流式细胞仪检测。取对数生长期细胞,分为 TGZ组、15-PGJ2组、对照组,分别加入 500μl的 TGZ溶液、15-PGJ2溶液、DMSO混合溶液,终浓度同上,培养 12 h。用 0.25%胰蛋白酶消化细胞,800 r/min离心 5 min,弃上清。用预冷的 PBS液洗涤 1次,离心弃上清。用已稀释的冰冻 buffer重悬细胞,调细胞浓度为 106个/ml,加 5μl Annexin V和 5μl PI溶液于 490μl的细胞悬液中,轻柔混匀,4℃避光孵育 10 min。凋亡细胞染色呈棕黄色。上机检测细胞凋亡率。
1.2.4 细胞周期检测 采用流式细胞仪检测。分组用药同上,培养 24 h。用 0.25%胰蛋白酶和0.02%EDTA混合液消化细胞,轻轻吹成悬液,调细胞浓度为 1×106/ml。800 r/min离心 5 min,弃上清。后用预冷的 PBS液洗涤 1次,离心去 PBS。加入冰预冷的 70%乙醇固定,4℃ 2 h。离心弃去固定液,PBS重悬 5 min。400目筛网过滤 1次,800 r/min离心 5 min,弃去 PBS。每管加入 1 ml PI染液,4℃冰箱孵育 30 min。离心洗去 PI染液,加 1 ml PBS重悬,上机检测,结果采用 ModFit软件分析。
1.2.5 PPARγ表达检测 采用免疫细胞化学法。取对数生长期细胞,用胰酶消化并吹打成细胞悬液,调整细胞浓度 5×104/ml。接种至含载玻片的 6孔板内,每孔 2 ml,置于 37℃、5%CO2细胞培养箱内48 h。TGZ组、15-PGJ2组、对照组分别加入 250μl的 TGZ溶液、15-PGJ2溶液、DMSO混合溶液,终浓度同上,培养 24 h。采用 ABC法染色,严格按说明书操作,以细胞染成棕黄色为阳性。每组随机选择20个高倍视野,计算阳性细胞占细胞总数的百分比。
1.2.6 统计学方法 采用 SPSS13.0软件分析。细胞增殖抑制率、细胞凋亡率、细胞周期的比较采用SNK-q检验;PPARγ表达水平的比较采用 Kruskal-Wallis检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组细胞增殖抑制率比较 见表1。由表1可见,TGZ、15-PGJ2组作用 12、24、36 h,对 95-D细胞的抑制率依次提高,且两两比较,P均 <0.01。
2.2 各组细胞凋亡率比较 TGZ组细胞凋亡率为26.36%±2.92%,15d-PGJ2组为 38.04% ±3.25%,对照组为 1.41%±0.57%,TGZ组、15-PGJ2组与对照组比较,P均 <0.01,TGZ组和 15-PGJ2组比较,P<0.05。
2.3 细胞周期检测结果比较 见表2。
表1 各组细胞增殖抑制率比较(%,±s)

表1 各组细胞增殖抑制率比较(%,±s)
组别 细胞增殖抑制率12 h 24 h 36 h TGZ组 36.17±1.18 55.48±1.49 93.47±4.30 15-PGJ2组 49.67±1.19 65.29±1.84 97.21±1.41
表2 各组细胞周期检测结果比较(%,±s)
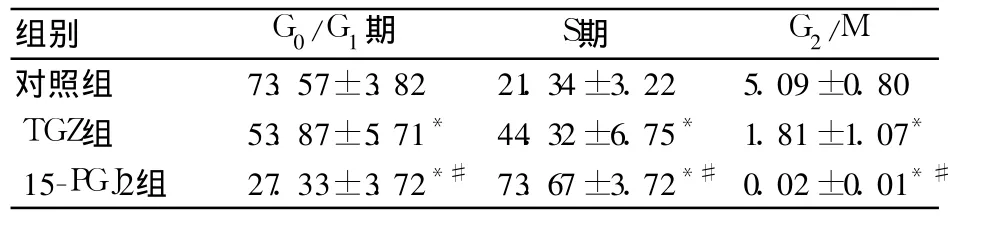
表2 各组细胞周期检测结果比较(%,±s)
注:与对照组比较,*P<0.01与 TGZ组比较,#P<0.01
对照组 73.57±3.82 21.34±3.22 5.09±0.80 TGZ组 53.87±5.71* 44.32±6.75* 1.81±1.07*15-PGJ2组 27.33±3.72*#73.67±3.72*#0.02±0.01*#
2.4 各组 PPARγ表达比较 TGZ组 PPARγ阳性细胞百分比为 58.25%,15-PGJ2为59.80%,对照组为 0.60%。TGZ组和 15-PGJ2组与对照组比较,P均 <0.01。
3 讨论
PPAR是一组核激素受体超家族,包括 PPARα、PPARβ、PPARγ3种亚型,其中 PPARγ与肿瘤发生、发展关系最密切。PPARγ具有 DNA结合区、配体结合区、N-末端 3个结构域,其中 N-末端与细胞分化有关。PPARγ是目前研究最多的一个亚型,根据N-末端不同分为 PPARγ1、2、3亚型。研究表明,PPARγ与调节细胞分化和细胞增殖有关,因此众多研究者探索 PPARγ配体作为肿瘤靶向治疗药物的可能性[1,2]。
本研究选择高转移肺腺癌细胞株 95-D,同时用激活作用较强的 PPARγ合成配体 TGZ和天然配体15-PGJ2激活 PPARγ,观察 PPARγ配体对 95-D细胞的增殖和凋亡作用。在国内外研究中,15-PGJ2浓度多用 10~30μmol/L,TGZ多用 20~50μmol/L。Chacko等[3]认为,15-PGJ2和 TGZ最适浓度分别为 20μmol/L和 40~50μmol/L,最适作用时间为24 h,此时 15-PGJ2和 TGZ对细胞增殖的抑制及细胞凋亡的诱导作用较显著。本研究中 15-PGJ2和TGZ的浓度分别为 20、40μmol/L,结果显示,TGZ和 15-PGJ2对 95-D细胞的抑制率与药物作用时间有关,随作用时间延长,药物对 95-D细胞增殖的抑制作用明显增强。
肿瘤是一类细胞增殖周期紊乱性疾病,即细胞凋亡失控的疾病,细胞周期的调控在肿瘤的发生和治疗中起重要作用。作用 24 h时,TGZ和 15-PGJ2能明显诱导 95-D细胞凋亡。有研究表明,PPARγ激活后可调节 Cyclin D1、Cyclin B1及 cdc2、cdc4、cdc25蛋白表达,从而使细胞停滞在 G1期,S期细胞减少,导致肿瘤细胞发生凋亡和分化[4]。本研究中,PPARγ配体 15-PGJ2和 TGZ作用于 95-D细胞24 h后,S期细胞比例较对照组显著增加,而 G1期细胞比例则减少。PPARγ配体诱导 95-D细胞停滞于 S期,使之无法完成有丝分裂,从而抑制 95-D细胞的增殖活性,促进其发生凋亡。本研究结果与其他研究结论有差异,可能与组织异质性等有关。本研究结果显示,PPARγ配体能显著提高 PPARγ表达,从而进一步发挥 PPARγ调节细胞增殖、分化及诱导细胞凋亡的功能。
综上所述,PPARγ配体能有效激活 PPARγ,提高 PPARγ在肺癌 95-D细胞中的表达,而高表达的PPARγ可能通过各种方式从而调节 95-D细胞分化、增殖,并诱导其凋亡,PPARγ有可能成为肺癌治疗的潜在靶点。
[1]Takahashi N,Okumura T,Motomura W,et al.Activation of PPAR-gamma inhibits cell growth and induces apoptosis in human gastric cancer cells[J].FEBSLett,1999,455(1-2):135-139.
[2]Chinetti G,Griglio S,Antonucci M.Activation of proliferatoractivated receptors alpha and gamma induces apoptosis of human monocytederived macrophages[J].J Biol Chem,1998,273(40):25573-25580.
[3]Chacko BK,Chandler RT,D'Alessandro TL,et al.Anti-inflammatory effects of isoflavones are dependent on flow and human endothelial cell PPAR[J].Nature,2007,137(2):351-356.
[4]马秀梅.胃癌 Skp 2、Heparanase、NF-κB和 PPARγ的表达及 15d-PGJ2和 RNA干扰沉默 PPARγ对胃癌细胞生长的影响及机制[D].河北医科大学,2006.

