微波消融对131 I-chTNT在荷 H22肝癌小鼠体内分布的影响
来庆华,于洪波,孟 辉,丁为民,何克菲,张积仁*
(1南方医科大学附属珠江医院,广州 510282;2山东省肿瘤医院)
肿瘤坏死疗法(TNT)[1]是伴随着单克隆抗体技术发展而产生的一种新的肿瘤靶向治疗方法。131I-肿瘤细胞核人鼠嵌合单克隆抗体(131I-chTNT)能与哺乳动物变性坏死区内的细胞核抗原结合,故扩大肿瘤坏死区能有效增加结合位点,增加药物在肿瘤内的分布。影像引导经皮微波固化治疗技术(PMCT)通过微波消融产生局部高温,使肿瘤组织凝固坏死[2],是诱导、增加肿瘤坏死区的有效方法。2009年 5~11月,我们观察了微波消融对131I-chTNT在小鼠体内分布的影响,旨在为临床应用提供参考。
1 材料与方法
1.1 材料131I-chTNT(规格 1 850 MBq/5 ml,pH 7.2,放射化学纯度 99.6%,抗体特异性结合活性66.4%);昆明小鼠 90只,雌雄不限,5周龄,体质量18~23 g;小鼠肝癌细胞株 H22;FORSEA MTC-3微波消融治疗仪,频率 2 450 MHz,功率输出范围 0~100 W,微波辐射芯线长 0.3 cm,直径 1.2 mm;FT-608γ计数仪;FLA-5100型同位素影像扫描分析仪。
1.2 方法
1.2.1 小鼠 H22肿瘤模型的建立与分组 取小鼠45只,将处于对数生长期的 H22细胞,用 PBS稀释成 2×107/ml,按每只 2×106/0.1 ml接种于小鼠右侧腹股沟皮下。2周左右,肿瘤最大直径达 15 mm时用于实验。治疗前 5 d,在饮水中加入 1%碘化钾溶液,饮用至实验结束,以封闭甲状腺对放射碘的摄取。将荷瘤小鼠随机分为 3组,各 15只。A组采用131I-chTNT瘤内单点注射,18.5 MBq/0.05 ml。B组先采用微波治疗。具体方法:小鼠腹腔内注射10%水合氯醛 0.5 ml/10 g进行麻醉,常规消毒。将组织间肿瘤微波凝固治疗仪直径 1.2 mm电极针,插入小鼠肿瘤,输出功率 30 W,45 s后拔出微波针。1周后于肿瘤微波消融范围中心注射药物,方法、剂量同 A组。C组采用微波联合药物偏心注射治疗,方法同 B组,但在肿瘤微波消融范围以外的肿瘤组织注射药物。
1.2.2 小鼠体内药物分布情况观察 注药后 5 d,每组处死小鼠 10只,取肿瘤、血、心、肝、胃、肝、肾,分别称重。再用 γ计数仪测定放射性计数,并行衰变校正,与总注射剂量对比,计算每克组织的摄取率。
1.2.3 小鼠瘤内药物分布情况观察 注药后 3 d,每组处死小鼠 5只。取小鼠的肿瘤组织和正常的肝脏及肾脏,常规制做病理切片。每个标本做 2个连续切片,切片厚度 5μm,相邻切片分别行放射自显影和常规 HE染色。放射自显影方法:将切片对磷屏曝光 65 h后,用 FLA-5100图像扫描系统进行扫描。扫描参数:IP模式,Laser 635 mm,扫描时间 20 min。观察 HE染色和自显影的切片,比较不同组别之间肿瘤坏死区和放射性分布。自显影图片中黑色部分表示药物分布区域,HE染色中粉红色淡染无细胞结构部分为肿瘤坏死区。
1.2.4 统计学方法 采用 SPSS13.0统计软件。完全随机设计资料用单向方差分析(One-way ANOVO),多组间比较用 LSD法。P≤0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体内药物分布比较 见表1。
表1 各组小鼠体内各组织药物摄取率比较(%ID/g,±s)
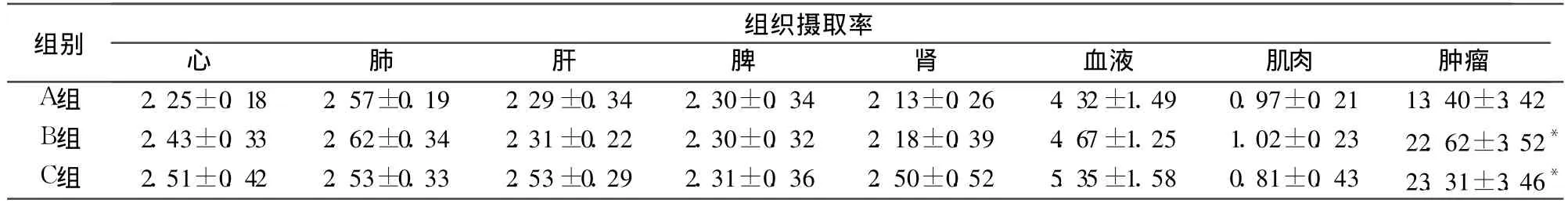
表1 各组小鼠体内各组织药物摄取率比较(%ID/g,±s)
注:与 A组比较,*P<0.05
组别组织摄取率心肺肝脾肾血液 肌肉 肿瘤A组 2.25±0.18 2.57±0.19 2.29±0.34 2.30±0.34 2.13±0.26 4.32±1.49 0.97±0.21 13.40±3.42 B组 2.43±0.33 2.62±0.34 2.31±0.22 2.30±0.32 2.18±0.39 4.67±1.25 1.02±0.23 22.62±3.52*C组 2.51±0.42 2.53±0.33 2.53±0.29 2.31±0.36 2.50±0.52 5.35±1.58 0.81±0.43 23.31±3.46*
2.2 各组小鼠瘤内药物分布比较 放射自显影和HE染色显示,A组肿瘤组织自发坏死少,只占据肿瘤中心的小块区域;药物在瘤内的分布也少,只局限于坏死组织的对应区域。而 B、C组组织坏死区域明显大于 A组,占据肿瘤组织的大块区域,药物在瘤内的分布也多。药物在正常组织如肝脏和肾脏内未见分布。
3 讨论
TNT最早是由美国南加州大学 Epstein教授提出的[1],TNT抗体针对的是变性、坏死的细胞核抗原。恶性肿瘤的快速生长往往使肿瘤组织内部血供不足,血供不足所致的营养不良和缺氧进一步导致肿瘤细胞变性坏死。坏死的细胞越来越多并连接成片,形成肿瘤坏死区,这是恶性肿瘤的典型特征。131I-chTNT是全球第一个被批准用于实体瘤治疗的放射免疫药物。TNT抗体与131I偶联,利用核素的放射性作用杀死肿瘤。然而,肿瘤组织的自发坏死有限,如何增加肿瘤坏死区成为治疗的关键。
目前,已经有学者将 TNT疗法和活性物质、化疗、射频治疗、外照射治疗结合起来,发现联合治疗能显著提高131I-chTNT在肿瘤组织内的分布和疗效[3~7]。PMCT是 2 0世纪 90年代发展起来的一门新技术,可通过微波消融使局部呈高温,从而导致肿瘤组织凝固坏死。本研究将 PMCT和131I-chTNT疗法相结合,荷瘤小鼠的体内分布及放射自显影都提示,微波治疗能显著增加药物在肿瘤组织的浓聚和分布。其原因为微波加热可以直接导致肿瘤组织凝固坏死。变性坏死可导致肿瘤细胞结构、功能发生多种形式的改变,包括细胞膜、核膜的通透性异常升高,膜结构完整性丧失,染色体解聚,双链 DNA解构,暴露出变性降解的单链 DNA复合体等[8,9]。这使大分子的131I-chTNT能够通过变性坏死肿瘤细胞不完整的膜系统进入细胞核,并与靶点 DNA单链复合体结合,最终通过放射性核素131I杀死周围的肿瘤活细胞。本研究还发现,中心注射和偏心注射的药物分布没有明显差别,提示131I-chTNT在微波凝固区同样具有较好的弥散性。同时,也因为药物具有靶向性,只结合于坏死区,不管注射部位在哪里,药物都会趋向于坏死区,注射部位的差别不影响药物的分布。放射自显影和 HE染色切片的对比,进一步验证了131I-chTNT具有很强的特异性,大多集中于肿瘤坏死区,在正常的器官如肝脏和肾脏内未见分布。
综上所述,在注射131I-chTNT前先给予微波治疗,可增加药物在肿瘤组织内的浓聚,微波联合药物中心注射和偏心注射的分布未见明显差异。131I-chTN药物在肿瘤组织分布的增加势会增强药物的疗效,此为临床应用提供了理论依据。
[1]Hornick JL,Sharifi J,Khawli LA,et al.A new chemically modified chimeric TNT-3 monoclonal antibody directed against DNA for the radioimmunotherapy of solid tumors[J].Cancer Biother Radiopharm,1998,13(4):255-268.
[2]彭智勇,时粉周.微波在临床治疗上的应用进展[J].海军医学杂志,2009,30(2):180-183.
[3]Hornick JL,Khawli LA,Hu P,et al.Pretreatment with a monoclonal antibody/interleukin-2 fusion protein directed against DNA enhances the delivery of therapeutic moleculestosolid tumors[J].Clin Cancer Res,1999,5(1):51-60.
[4]Mizokami MM,Hu P,Khawli LA,et al.Chimeric TNT-3 antibody/murine interferon-gammafusion protein for the immunotherapy of solid malignancies[J].Hybrid Hybridomics,2003,22(4):197-207.
[5]Pan H,Han L,Chen W,et al.Targeting to tumor necrotic regions with biotinylated antibody and streptavidin modified liposomes[J].J Control Release,2008,125(3):228-235.
[6]严红霞,伍钢,程晶,等.(131)I-chTNT结合外照射治疗实体瘤的实验研究[J].临床肿瘤学杂志,2007,12(5):325-331.
[7]杜阳峰,罗荣城,李贵平,等.抗乙型肝炎表面抗原 Fab片段联合抗细胞核单抗为载体的肝癌放射免疫治疗实验研究[J].南方医科大学学报,2008,28(3):460-462.
[8]Liang P,Wang Y,Zhang D,et al.Ultrasound guided percutaneous microwave ablation for small renal cancer:initial experience[J].J Urol,2008,180(3):844-848.
[9]项东英,何文,刘会昭,等.微波消融家犬肺组织的实验研究[J].中国介入影像与治疗学,2009,6(05):402-405.

