玉竹提取物 B对人食管癌细胞 Eca-109增殖与凋亡的影响
张 岚,杜亚明,王中彬
(辽宁医学院附属第一医院,辽宁锦州 121001)
玉竹味甘平,性微寒,含有多糖、单糖、生物碱、菸酸等成分,具有扶正固本、养阴润燥之功效。研究发现,玉竹提取物 B(EB-PAOA)具有一定的抗肿瘤作用,但作用机制尚不清楚。2009年 1月 ~2010年1月,我们观察了 EB-PAOA对人食管癌细胞 Eca-109增殖与凋亡的影响,为其临床应用提供理论依据。
1 材料与方法
1.1 材料 Eca-109细胞,EB-PAOA,RPMI-1640培养液,胰蛋白酶,胎牛血清 (FBS),吖啶橙试剂(AO),噻唑蓝(MTT),Annexin V-FITC凋亡检测试剂盒;CO2培养箱,Olympus光学显微镜,COULTEREP ICSXL型流式细胞仪,JEM-1200EX透射电子显微镜和 Olympus荧光显微镜等。
1.2 方法
1.2.1 细胞培养 将 Eca-109细胞置于含 10%FBS的 RPMI-1640完全培养基中,37℃、5%CO2饱和湿度培养箱内培养。隔天以 1∶2比例传代 1次。细胞经胰酶分散传代和收获,取对数生长期细胞进行实验。
1.2.2 EB-PAOA对 Eca-109细胞增殖作用观察采用 MTT法。取 Eca-109细胞,以 1×104/孔接种于 96孔板中,培养 24 h后换液。加入终浓度分别为 100、50、25、12.5 mg/ml的 EB-PAOA,每个浓度每个时点均设 4个复孔,设阴性对照和空白对照。CO2培养箱内继续培养 24、48、72 h,于终止培养前4 h每孔加入 MTT溶液(5 mg/ml,PBS配制)20μl,继续孵育 4 h后,吸弃上清液,加入 100μl DMSO,微孔板震荡器上震荡 10 min,酶标仪570 nm波长处测定各孔吸光度 A值,计算细胞增殖抑制率。细胞增殖抑制率 =1-(实验组 A值/对照组 A值)×100%
1.2.3 EB-PAOA对 Eca-109细胞凋亡作用观察取 Eca-109细胞以 1×106/孔接种于 6孔板中,培养24 h后换液。加入终浓度分别为 100、50、25、12.5 mg/ml的 EB-PAOA,设不加药对照组。CO2培养箱内继续培养 48 h后收获细胞,用新鲜配制的 PBS(pH 7.4)3 ml洗涤 2次,1 000 r/min离心 5 min,吸弃上清,将细胞重悬于 200μl Binding Buffer,加入10μl Annexin V-FITC和 5μl PI,轻轻混匀,避光室温反应 15 min,加入 300μl Binding Buffer,上流式细胞仪检测细胞凋亡率。
1.2.4 统计学方法 采用 SPSS12.0统计软件。数据进行重复测定方差分析、单因素方差分析和多重比较。P≤0.05为差异有统计学意义。
2 结果
2.1 EB-PAOA对 Eca-109细胞增殖的影响 见表1。由表可见,EB-PAOA对 Eca-109细胞增殖有抑制作用,药物浓度增大、作用时间延长,抑制作用越明显,呈剂量、时间依赖性(P均 <0.05)。
表1 EB-PAOA对 Eca-109细胞增殖的影响(%,±s)
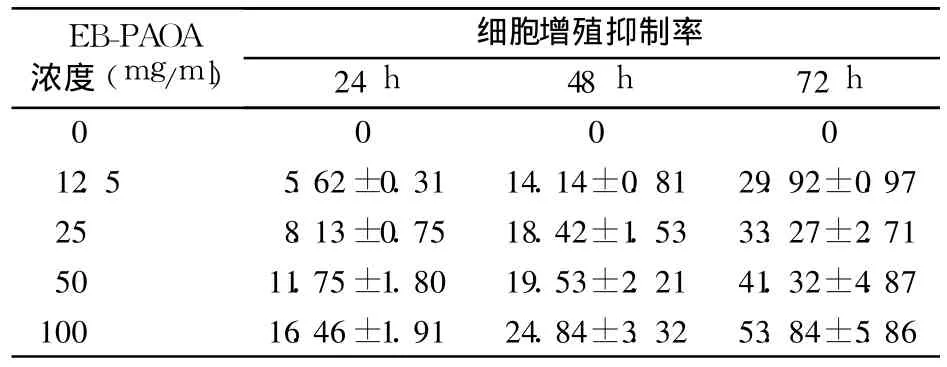
表1 EB-PAOA对 Eca-109细胞增殖的影响(%,±s)
EB-PAOA浓度(mg/ml)细胞增殖抑制率24 h 48 h 72 h 0 0 0 0 12.5 5.62±0.31 14.14±0.81 29.92±0.97 25 8.13±0.75 18.42±1.53 33.27±2.71 50 11.75±1.80 19.53±2.21 41.32±4.87 100 16.46±1.91 24.84±3.32 53.84±5.86
2.2 EB-PAOA对 Eca-109细胞凋亡的影响 EBPAOA与 Eca-109细胞共培养 48 h后,EB-PAOA浓度为 0、12.5、25、50、100 mg/ml时 ,Eca-109细胞凋亡率分别为 0.45%±0.23%、8.54%±1.34%、13.43%±1.95%、29.67%±3.53%、39.69%±6.96%。统计结果显示,随着 EB-PAOA浓度增加,Eca-109细胞凋亡率逐渐增加,呈一定浓度依赖性(P均 <0.05)。
3 讨论
研究发现,食管癌的发生、发展及转移是多基因、多因素共同作用的结果。由于食管癌早期诊断较困难,确诊时 70%~80%的患者已进入临床中晚期,因此化疗是重要的治疗手段。传统抗肿瘤药在杀伤肿瘤细胞的同时也大量破坏机体的正常细胞,临床不良反应大。近年来研究发现,而许多中药都具有诱导肿瘤细胞凋亡作用,如人参皂苷可诱导直肠癌细胞凋亡[4],丹参酮ⅡA可诱导 HL-60细胞凋亡[5]等;并且这种抑制作用对生物体几乎没有毒副作用,所以备受关注。
玉竹,别名铃铛菜、尾参、地管子、甜草根,是百合科黄精属多年生草本植物,因该植物形态似竹、光莹如玉,故名玉竹[6]。玉竹为药食滋补兼用品,明代李时珍在总结玉竹的使用经验时称,“予每用治虚劳寒热及一切不适之症,用代参、芪,不寒不燥,大有殊功”。潘兴瑜等[7]研究发现,EB-PAOA能抑制人 T淋巴细胞白血病细胞株 CEM的增殖,且呈明显的时间、剂量依赖性,但对人的正常淋巴细胞没有影响,认为其抗 CEM作用主要机制之一是诱导 CEM细胞凋亡。李尘远等[8]研究表明,EB-PAOA能促进宫颈癌 Hela细胞由 G0/G1期进入 S期,S期进入G2/M期,并阻滞在 G2/M期,而且随 EB-PAOA剂量加大,这种阻滞现象愈明显。这说明 EB-PAOA能通过干扰肿瘤细胞的有丝分裂,从而降低其增殖能力。研究发现[9],EB-PAOA处理后的足垫荷 S-180肉瘤小鼠产生细胞因子 IL-1、IL-2、TNF-α的能力增强,提示 EB-PAOA有可能通过诱生细胞因子 IL-1、IL-2、TNF-α,提高了小鼠机体的免疫监视功能。本研究结果显示,随着 EB-PAOA浓度增大、作用时间延长,Eca-109细胞的增殖抑制率逐渐增加(P均 <0.05);随着 EB-PAOA浓度增大,细胞凋亡率均逐渐增加(P均 <0.05)。我们认为,EB-PAOA可通过抑制 Eca-109细胞增殖并诱导其凋亡发挥抗肿瘤作用,可能与 EB-PAOA干扰 Eca-109细胞的有丝分裂,从而抑制其增殖,并诱导其凋亡。这可为开发EB-PAOA成为新型抗肿瘤中药提供理论基础,但其确切机制有待于进一步研究。
[1]粟俭.药物诱导的肿瘤细胞凋亡研究进展[J].国外医学:肿瘤学分册,1995,22(1):7-9.
[2]张覃沐.抗肿瘤药物的药理与临床应用[M].郑州:河南医科大学出版社,1999:229.
[3]林厚文,韩公明,谬时萱.中药玉竹有效成份研究[J].药理学报,1997,29(3):215.
[4]邢建华,陈永芹.人参皂苷诱导直肠癌细胞凋亡的临床观察[J].中国中西医结合杂志,2001,21(4):260-261.
[5]黄韧敏,袁淑兰,宋毅,等.丹参酮ⅡA诱导 HL-60细胞凋亡[J].癌症,1998,17(3):164-166.
[6]全国中草药汇编编写组.全国中草药汇编[M].北京:人民卫生出版社,1987:58.
[7]潘兴瑜,张明策,李宏伟.玉竹提取物 B对肿瘤的抑制作用[J].中国免疫学杂志,2000,16(7):460.
[8]李尘远,刘玲,潘兴瑜.玉竹提取物 B对 Hela细胞凋亡的影响[J].锦州医学院学报,2003,24(6):14-16.
[9]李尘远,潘兴瑜,张明策,等.玉竹提取物 B抗肿瘤机制的初步研究[J].中国免疫学杂志,2003,19(4):253-254.

