新疆紫草细胞悬浮培养过程研究
葛 锋,王剑平,王晓东,赵 兵,王玉春
1昆明理工大学生命科学与技术学院,昆明 650224;2中国科学院过程工程研究所生化工程国家重点实验室,北京 100080
新疆紫草(Arnebia euchroma(Royle)Johnst.)为紫草科(Boraginaceae)多年生草本植物,其根药用,有效药用成分是紫草素及其衍生物,这些成分不但具有抗菌、抗炎、抗癌等多种药理作用,而且还作为天然色素广泛用于医药、化妆品和印染工业中[1〛。《中华人民共和国药典》收录的中药紫草中,以新疆紫草品质最佳[2〛,为主要的商品药用紫草。目前,新疆紫草的野生资源破坏严重,自然生态环境恶化,而旺盛的市场需求凸显了供需矛盾。从长远考虑,通过细胞的大规模培养直接生产紫草素来满足药用需求是比较有潜力的途径。
国内外对新疆紫草细胞和组织培养的研究主要集中在愈伤组织的诱导、愈伤组织培养基和培养条件的优化以及各种物理、化学或生物刺激因子对新疆紫草细胞有效次生代谢产物的影响研究等方面[3,4〛。我们已经对新疆紫草愈伤组织的诱导条件[5〛、稀土元素和超声波对新疆紫草细胞生长和药用次生代谢产物积累等进行了研究[6,7〛。植物细胞悬浮培养过程中,营养物质的消耗、细胞的生长和次生代谢产物的积累、细胞的生长速率是植物由摇瓶培养放大到生物反应器培养的关键参数。而生物反应器技术是实现植物细胞大规模培养生产药用次生代谢产物的关键工业化技术。本文对新疆紫草细胞悬浮培养过程进行了研究,为新疆紫草细胞生物反应器的大规模培养提供理论依据。
1 材料与方法
1.1 实验材料
将由外植体诱导得到的新疆紫草愈伤组织[5〛,在液体培养基中进行悬浮培养,得到分散的新疆紫草细胞及聚集体。葡萄糖、硝酸钾和硝酸铵等化学试剂均为分析纯。
1.2 实验方法
2.2.1 新疆紫草细胞悬浮培养方法
前期研究表明[5-7〛,新疆紫草细胞中紫草素的生物合成属非生长偶联型,而且细胞生长和紫草素合成所使用的培养基也不同,因此采用二步培养法,把细胞生长阶段和紫草素合成阶段分开单独进行研究。新疆紫草细胞生长的悬浮培养采用 N6培养基[7〛,接种量为 2%;紫草素合成的悬浮培养采用M 10培养基[7〛,接种量为 7.5%。所有实验均在装有 40m L液体培养基的 100mL三角瓶中进行。N6培养基中添加 1mg/L KT。培养温度为(25±1)℃,摇床转速 120 r/min,暗培养。细胞生长的培养周期为 21 d;紫草素生物合成的培养周期为 16 d。
1.2.2 细胞干重测定方法
取新疆紫草细胞悬浮培养液,用滤纸过滤,将细胞置于烘箱中,55℃烘约 24 h至恒重,称得其干重即为生物量(g/L)。
1.2.3 紫草素含量测定方法
紫草素在 520 nm处有最大吸收峰。由此可进行标准曲线的绘制,曲线方程为:
C=187.85 OD520nm-2.09,r=0.9995
其中,C为紫草素石油醚溶液中的紫草素浓度(mg/L),OD520nm为该测定溶液的吸光度值。
取新疆紫草细胞培养液,3500 r/min离心 20 min,回收的沉淀物为鲜细胞。将鲜细胞转移至三角瓶中,加入一定量的石油醚(沸点 30~60℃),三角瓶放入超声场中进行细胞破碎,然后在室温下振荡(110 r/min)提取 24 h,提取液用于测定细胞中的紫草素含量(%)[6〛。
紫草素产量(g/L)=紫草素含量(%)×细胞干重(g/L)
1.2.4 培养液电导率、pH值的测定
将过滤后的细胞培养液用 DDS-11A型电导率仪测定电导率。pH测定采用 Beckman pH meter。
1.2.5 培养液中 NO-3、NH+4、PO3-4、可溶性糖含量的测定
NO-3含量采用苯酚二磺酸法测定[8〛,NH+4含量采用靛定酚蓝比色法测定[8〛,PO3-4含量采用钼酸盐-钒酸盐试剂测定[8〛,可溶性糖含量采用苯酚-硫酸法测定[9〛。
2 结果与讨论
2.1 新疆紫草细胞悬浮培养时细胞生长和紫草素合成过程
由于新疆紫草细胞的生长和紫草素的合成属于非生长耦联型,而且细胞生长阶段和紫草素合成阶段所用培养基成分差异较大,为此,我们把这两个阶段分开单独进行实验,以便探究有关细胞生长和紫草素合成的一些基本情况。
当接种量为 2%时,新疆紫草细胞悬浮培的 0~3 d为细胞生长的延滞期,此阶段细胞主要进行初级代谢活动,同时适应新的培养环境,为即将到来的细胞分裂旺盛期做物质上的准备。第 3 d后,细胞生长进入指数生长期,这个时期细胞分裂速度快,生长活跃,细胞的鲜重和干重都显著增加,培养到第15 d时,培养体系获得最大生物量为 12.2 g DW/L。随后生长曲线很快进入衰亡期,细胞逐渐褐化、死亡。
由于紫草素合成的培养基 M10不适合细胞的生长,所以当接种量为 7.5%时,在整个紫草素合成阶段,细胞的生物量只有 1倍左右的增长。但是M10培养基非常适合紫草素的合成,从接种当天开始,细胞就开始迅速合成紫草素,基本上没有延滞期。紫草素含量迅速增长阶段一直持续到第 12 d,此时获得了最高的紫草素含量 2.13%和紫草素产量 243.1mg/L,其中紫草素产量比接种时增长达12.2倍。12 d以后,细胞开始衰亡。
2.2 新疆紫草细胞悬浮培养生长阶段 pH值和电导率的变化
新疆紫草悬浮培养细胞生长阶段 pH值和电导率的变化如图 1所示。由图可知,在新疆紫草悬浮培养的整个过程中,pH值的变化不大,大致在 5.2~5.8之间小幅波动,培养后期的 pH值比培养初期略微偏高;培养液的电导率与细胞生物量呈负相关,随着生物量的增加,培养液的电导率降低。出现这种现象的原因是细胞在生长过程中要吸收大量的无机导电离子作为营养物质,导致培养液电导率下降,培养到第 15 d时,细胞的生物量达到最大,培养液中的营养物质被最大限度的吸收,导电离子浓度最低,因此表现出电导率下降到最小值,随后,细胞进入衰亡期,部分种龄大的细胞出现褐化、死亡,衰亡的细胞中释放出了部分导电离子,使得培养液电导率出现小幅增长。
图 2为悬浮培养细胞生长过程中第 5~13 d期间,生物量增长和培养液电导率降低的关系。第 5~13 d为细胞的指数生长期,细胞生长和增殖处于旺盛期,考察此阶段细胞生物量和电导率的相关性相对整个培养周期而言最具代表性。回归分析获得指数生长期生物量和电导率的关系式为:C=4525-76.72Y,r=0.999,其中,C为电导率(us/cm),Y为生物量(g.DW/L)。由于电导率的测量比较容易,方便、快捷,因此,利用电导率和生物量之间的良好的线性相关可以迅速地通过培养液电导率的测定来分析细胞的生长情况,这种间接测定细胞生物量的方法用在生物反应器的大规模培养过程中具有较高的实际应用价值。


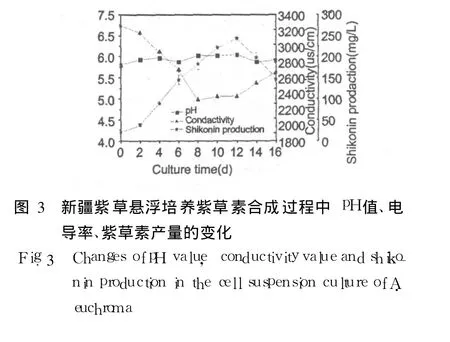
2.3 新疆紫草细胞紫草素合成阶段 pH值和电导率的变化
由图 3可知,在新疆紫草悬浮培养的整个过程中,pH值的变化不大,大致在 5.8附近小幅波动;培养液的电导率与紫草素合成量成负相关。培养过程中的 8~12 d,电导率无明显变化,而紫草素的合成迅速增加,并在第 12 d达到最大值。出现这种现象的原因可能是在紫草素的生成是细胞一系列生理生化反应的结果,这其中必然伴随有培养液中无机离子的消耗,使得培养液电导率下降;同时当培养时间超过第 8 d时,虽然整个培养体系的紫草素合成量是增加的,但少量种龄较大的细胞开始出现裂解,一些导电离子从细胞中释放出来,导致培养液的电导率增加。上面两个对于电导率变化相反的作用过程达到动态平衡时,培养液中的电导率值将近似保持恒定。新疆紫草细胞在生长培养基中进行悬浮培养时没有出现一个电导率相对恒定的时间进程(图1),而在紫草素合成过程中却有一个电导率变化的平台期,这可能是因为在细胞生长培养基中(N6培养基),细胞生长旺盛,良好的生长环境使得细胞发生程序性凋亡的时间后延,大部分细胞集中在指数生长期结束的时候出现裂解、死亡,整个细胞生长周期的进程比较一致,因此没有电导率恒定期;而在紫草素合成培养基中(M10培养基),培养条件适合紫草素的合成,不利于细胞的生长,培养一段时间后,少部分细胞就出现了群体性死亡,直接导致电导率变化平台期的出现。
2.4 新疆紫草细胞生长过程中硝酸盐和可溶性糖的消耗情况
新疆紫草细胞悬浮培养生长阶段硝酸盐和可溶性糖的消耗情况如图 4所示。新疆紫草细胞生长培养基的碳源为蔗糖,氮源为硝酸盐和氨盐,其它的营养物质还有钾盐、钠盐、钙盐、硫酸盐和磷酸盐等。在培养过程中,蔗糖分解为葡萄糖和果糖,果糖再转变为葡萄糖,然后葡萄糖被植物细胞所利用。葡萄糖进入植物细胞后,一部分组成细胞的结构物质,一部分通过呼吸作用为细胞的生命活动提供能源。培养过程中 NO-3和蔗糖的初始浓度分别为 1737 mg/L和 30 g/L。在 0~15 d,NO-3和蔗糖被细胞逐渐吸收利用,浓度快速下降,第15 d时,NO-3和蔗糖浓度同时达到最小值,NO-3浓度为 457mg/L,被消耗掉约 73%;蔗糖浓度为 12.6 mg/L,被消耗掉 58%,此时与细胞的最大生物量相对应。NO-3是细胞生长培养基中的主要氮源供应物质,因此它的消耗情况直接体现了细胞的生长情况。

2.5 新疆紫草细胞生长过程中铵盐和磷酸盐的消耗情况

新疆紫草细胞悬浮培养生长阶段铵盐和磷酸盐的消耗情况如图 5所示。初始 NH+4和 PO3-4的浓度分别为 126和 279 mg/L。磷酸盐消耗速度很快,第 9 d时,磷酸盐已被消耗约 79%;到 15 d时,磷酸盐的浓度达到最低值,仅为 32.4mg/L,消耗 88%。磷酸盐的快速吸收可能与细胞生长、分裂时需大量合成核酸物质有关。铵盐的吸收主要与细胞内的蛋白质合成有关,其消耗速度先慢后快,从 0~6 d,仅消耗 11%,在第 15 d,浓度出现最小值 19.1 mg/L,消耗掉约 85%。
2.6 新疆紫草细胞生长过程中的生长速率和比生长速率

细胞生长过程中细胞的生长速率 γY=dY/dt≈△Y/△t,比生长速率 μ=dY/dt◦ 1/Y≈△Y/△t◦1/Y。其中 Y表示细胞浓度(g/L),t表示培养时间(d)。由图 6可知,在细胞生长的延滞期(0~3 d),细胞的生长速率和比生长速率较低;到了指数生长期,生长速率和比生长速率迅速增加,其中在第 13 d,生长速率达到最大值 1.2 g/(L◦d),在第 7 d比生长速率达到最大值 0.33/d。指数生长期过后,细胞迅速进入衰亡期,生长速率和比生长速率呈现负增长。
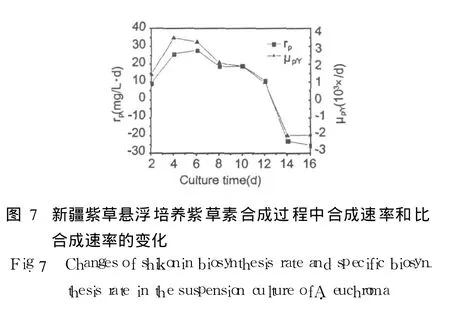
2.7 新疆紫草紫草素合成过程中的合成速率和比合成速率
紫草素合成阶段紫草素合成速率为 γp,比合成速率 μp/Y=γp/Y。新疆紫草细胞悬浮培养过程中紫草素合成速率和比合成速率的变化如图 7所示。由 2.1可知紫草素的合成过程几乎没有延滞期,细胞接种后,很快进入合成旺盛期,这种现象在图 7中的表现就是培养过程前半段紫草素合成速率和比合成速率在高位徘徊,最大值分别出现在第 6 d(28 mg/(L◦ d))和第 4 d(3.49×10-3/d)。培养到 10 d以后,γp和 μp/Y出现大幅度下滑。由于新疆紫草细胞紫草素的合成属于非生长耦联型,紫草素合成阶段使用的培养基并不适合细胞的生长,细胞生物量只有小幅增长,因此在图 7中,紫草素的合成速率与紫草素的比合成速率相比更能代表培养体系中紫草素的合成规律。
2.8 细胞收率系数

构成植物细胞的主要物质元素为 C、H、O、N、P,细胞培养过程中 C源、N源和 P源转化为细胞物质的转化率相当重要。图 8表明了细胞生长阶段各主要无机元素的浓度与细胞生物量的相关性。从中可以看出硝酸盐、铵盐、可溶性糖与细胞生物量有着良好的线性关系,线性回归方程的斜率即为基于底物消耗的细胞收率系数。基于硝酸盐的细胞收率系数Yx/n=8.64 g/g;基于铵盐的细胞收率系数 Yx/a=104.3 g/g;基于可溶性糖的细胞收率系数 Yx/s=0.68 g/g。
磷酸盐与细胞生物量线性相关性不好,这可能是因为磷酸盐在细胞代谢过程中主要用来合成遗传物质,而遗传物质的合成常常早于细胞干物质的积累过程。从图 8可以看出磷酸盐大量消耗的阶段,细胞的生物量增加缓慢;而细胞生物量迅速增加的阶段,磷酸盐消耗速度明显变缓。
3 结论
通过对新疆紫草细胞悬浮培养过程中生物量、紫草素含量和底物浓度随时间变化的分析,可以得出细胞悬浮培养的基本情况。新疆紫草细胞的生长和紫草素的合成属于非生长偶联型,新疆紫草细胞悬浮培养的生长阶段约为 21 d,其中 0~3 d为细胞生长的延滞期,3~15 d为细胞的指数生长期,15 d后进入衰亡期;紫草素合成阶段约为 16 d,接种后细胞就开始迅速合成紫草素,一直持续到 12 d,随后进入平衡期和衰亡期。
新疆紫草细胞生长阶段培养液的电导率与生物量呈负相关,随着生物量的增加,培养液的电导率降低;当细胞进入衰亡期,生物量下降时,电导率增加。由于电导率的测量比较容易,方便、快捷,因此,利用电导率和生物量的这种相关性可以迅速地通过培养液电导率的测定来预测培养体系中生物量的变化情况。
培养过程中磷酸盐消耗最快,硝酸盐、铵盐和可溶性糖的消耗与生物量的变化具有很好的线性关系,从而获得了基于硝酸盐、铵盐和可溶性糖的细胞收率系数。
1 Huang ZS(黄志纾),Zhang M(张敏),Ma L(马林),et al.A survey of chemical and pharmacologic studies on Zicao.Nat Prod Res Dev(天然产物研究与开发),2004,12:73-82.
2 Ge F(葛锋),Wang XD(王晓东),Wang YC(王玉春).Advances in studies onmedicinal Radix Arnebiae Seu Lithospermi.Chin Tradit Herb Drugs(中草药),2003,34(9):5-8.
3 Ji QL(计巧灵),Wang WG(王卫国).Asexual propagation of Arnebia euchroma Johnston and exploration of hereditary stability in regenerated plantlets.Plant Phys Commun(植物生理学通讯),2001,37:499-502.
4 Ye HC(叶和春),Yin ZH(尹作鸿),Li GF(李国凤),et al.Effects of physical and chemical factors on callus growth and shikonin derivative formation in the callus cultures of Arnebia euchroma.Acta Botanica Sinica(植物学报),1991,33:927-931.
5 Ge F(葛锋),Wang XD(王晓东),Wang YC(王玉春).Studies on highly efficient induction of callus from Arnebia euchroma and rapid proliferation of callus.Chin Pharm J(中国药学杂志),2004,39:735-737.
6 Ge F(葛锋),Chen CY(陈朝银),Wang XD(王晓东),et a l.Effects of u ltrasonicwave on cellgrowth and shikonin biosynthesis in suspension culture of Arnebia euchroma.Chin J Process Eng(过程工程学报),2008,8:115-119.
7 Ge F,Wang XD,Zhao B,eta l.Effects of rare earth elements on the grow th of Arnebia euchroma cells and the biosynthesis of shikonin.Plant Grow th Regulation,2006,48:283-290.
8 Chen SA(陈书安).Process regulation in Crocus sativas L.cell and tissue culture.Beijing:Instituteof Process Engineering,CAS(中国科学院过程工程研究所),PhD.2004.
9 Zhang WJ(张惟杰).Biochemical Research Technique of Com plex Am ylose(复合多糖生化研究技术).Shanghai:Shanghai Scientific and Technical Publishers,1995.

