粤蓝链霉菌代谢产物的抗菌抗肿瘤活性及相关基因的初步研究
邓名荣,郭 俊,朱红惠*
1华南理工大学生物科学与工程学院,广州 510006;2广东省微生物研究所广东省菌种保藏与应用重点实验室广东省微生物应用新技术公共实验室,广州 510070
链霉菌(Streptomycete)能产生抗菌、抗肿瘤、抗虫、免疫抑制等广泛生理活性的代谢产物,是生物活性物质的主要产生菌[1]。链霉菌产生的许多活性代谢产物是通过聚酮合酶(polyketide synthases,PKSs)途径和非核糖体多肽合成酶(nonribosomal peptide synthetases,NRPSs)途径产生的[2]。虽然随着已知活性物质的不断增加,发现新的活性物质变得越来越困难[3-5],但是包括链霉菌在内的微生物仍然是新活性物质的主要来源[6]。在实际研究中,微生物的不同种甚至是同种不同株之间所产生的天然产物都有很大不同,商业上重要的未知天然产物的发现,往往是在筛选过程中获得了新的微生物菌株。“新菌株(Novel Strains)→新天然产物(Novel Natural Products)→商业上的成功(Commercial Success)”的筛选模式已被广泛接受[7]。本实验室分离到一株链霉菌新种,能大量产生罕见的水溶性紫罗兰蓝色素,该菌命名为粤蓝链霉菌(Streptomyces vietnamensis)[8]。本文报道了该菌代谢产物的抗菌活性及抗肿瘤活性,并对该菌的 PKS和 NRPS相关基因进行了初步分析。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞
粤蓝链霉菌 GIMV4.0001T,克隆宿主菌大肠杆菌(Escherichia coli)JM109;抗菌活性测试菌株:金黄色葡萄球菌(Staphylococcusaureus)ATCC6538、苏云金杆菌(Bacillus thuringiensis)AS1.16、枯草芽孢杆菌(B.subtilis)ATCC6633、藤黄微球菌(Micrococcus luteus)AS1.634、大肠杆菌 ATCC8739、猪霍乱沙门氏菌(Salmonella choleraesuis)ATCC13312、铜绿假单胞(Pseudomonasaeruginosa)ATCC9027、甘蓝黑腐病菌(Xanthomonas campestris pv.campestris)、白色念珠菌(Candida albicans)ATCC10231;抗肿瘤活性测试细胞:人宫颈癌 HeLa细胞系,均由广东省微生物菌种保藏中心提供。
1.1.2 培养基
1.1.3 试剂与仪器
薄层层析(TLC)硅胶 GF254购自青岛海洋化工厂,乙酸乙酯等化学试剂均为分析纯(广东光华化学厂有限公司),萃取物在 Buchi R200旋转蒸发仪上浓缩;抗肿瘤试验光吸收值在 LAMBDA E型酶标仪上测定;Taq酶、pMD18-T、内切酶等购自宝生物工程(大连)有限公司;凝胶回收试剂盒购自上海生工生物工程技术服务有限公司;PCR在 eppendorf Mastercycler 5333型 PCR仪上进行。引物合成、测序(ABI 3730)均由上海英骏生物技术有限公司完成。
1.2 方法
1.2.1 发酵和提取
培养 36 h的种子液按5%接种于高氏合成一号液体培养基中,28℃,180 r/min,振动培养 7 d,共发酵 2 L,发酵液经离心 (6000 g、20min)、过滤,使菌液分离。发酵上清液用乙酸乙酯萃取四次,50℃旋转浓缩成粗提物,得率约为 1 g/L。
1.2.2 抗菌活性测定
采用琼脂糖扩散法。冷却至 45℃的培养基,加入终浓度约 0.5~3×106cfu/mL的菌体,混匀、倒板,每皿 20 m L,制成含菌平板。培养基凝固后,打孔器打孔(φ5 mm),在孔内加入待测样品,20μL/孔,在各菌的最适生长温度培养 24 h,测定抑菌圈的直径。同时以 100、50μg/mL氨苄青霉素为对照。
1.2.3 TLC-生物显影
取乙酸乙酯粗提物溶解在适量甲醇中,毛细管上样,在氯仿/甲醇(8:1)中展开,展层完毕的 TLC板,与含有金黄色葡萄球菌(约 2×106cfu/mL)的NA平板接触一段时间后,移除 TLC板,含菌平板于37℃培养 24 h,进行生物自显影。
Step1:提供12个警告界面I1、I2, …I12,由核电专家分别给12个警告界面按照上述7个评价因素进行评价得分,得到专家评判矩阵A。
1.2.4 抗肿瘤活性测定
采用 MTT法。癌细胞胰酶消化后,配制成 5×104个细胞/mL的细胞悬液,在 96孔板中,每孔加入 200μL细胞悬液,空白对照组加入培养液,置5%CO2、37℃的培养箱中培养 24 h,加入不同浓度(0、50、100、200、400 μg/mL)的乙酸乙酯粗提物,以10mg/mL 5-氟尿嘧啶为阳性对照,每孔加入样品 10 μL,每个样品 5个重复,培养 44 h后加入 5 mg/mL的 MTT溶液 20μL,继续培养 4 h后,吸去培养液,每孔加入二甲基亚砜(DMSO)150μL,150 r/m in振荡 30min,在酶标仪上测定其 OD490值(以空白对照组调零)。细胞生长抑制率 =(1-实验组/细胞对照组)×100%。
1.2.5 PKS/NRPS基因的克隆及分析
粤蓝链霉菌基因组 DNA的提取参照文献[9]。根据文献[10,11]及自行设计引物,扩增 I型和Ⅱ型PKS基因及 NRPS基因(表 1)。PCR反应体系:10×PCR Buffer(含 20 mmol/L MgCl2)2 μL、dNTPs(10mmol/L each)0.4μL、上下游引物(10 mmol/L)各 1μL、Taq酶(5 U/μL)0.4 μL/DNA模板 1μL,加 ddH2O至20μL,体系中含有 6%的 DMSO。循环参数:95℃2.5min;94℃35 s,56℃50 s,72℃2 min(ⅡPF6/Ⅱ PR6、A 3F/A7R引物对为 1 min),30个循环;72℃延伸 10min。PCR产物经琼脂糖凝胶电泳检测回收后,按通用方法[12]克隆到 pMD18-T载体上,重组质粒经 EcoRⅠ/HindⅢ酶切验证后送上海英骏生物技术有限公司测序。利用 Vector NTI Suite 8分析获得的 DNA序列,同时在 GenBank中进行 BLAST分析,并利用 MEGA 3.1对Ⅱ型 PKS基因进行进化树分析。

表 1 用于 PKS/NRPS基因扩增的引物列表Table 1 Primer pairs for amplifying PKS/NRPS genes
2 结果和分析
2.1 抗菌活性
对所试金黄色葡萄球菌、苏云金杆菌、枯草芽孢杆菌、藤黄微球菌,乙酸乙酯粗提物在 0.1 mg/mL的低浓度下均有明显的抑菌圈产生,表明其对革兰氏阳性细菌有较强的广谱抑制作用;高浓度下对铜绿假单胞有抑制作用,而低浓度下对甘蓝黑腐病菌也有明显的抑制作用,这表明其对部分革兰氏阴性菌也有不同程度的抑制作用(表 2)。
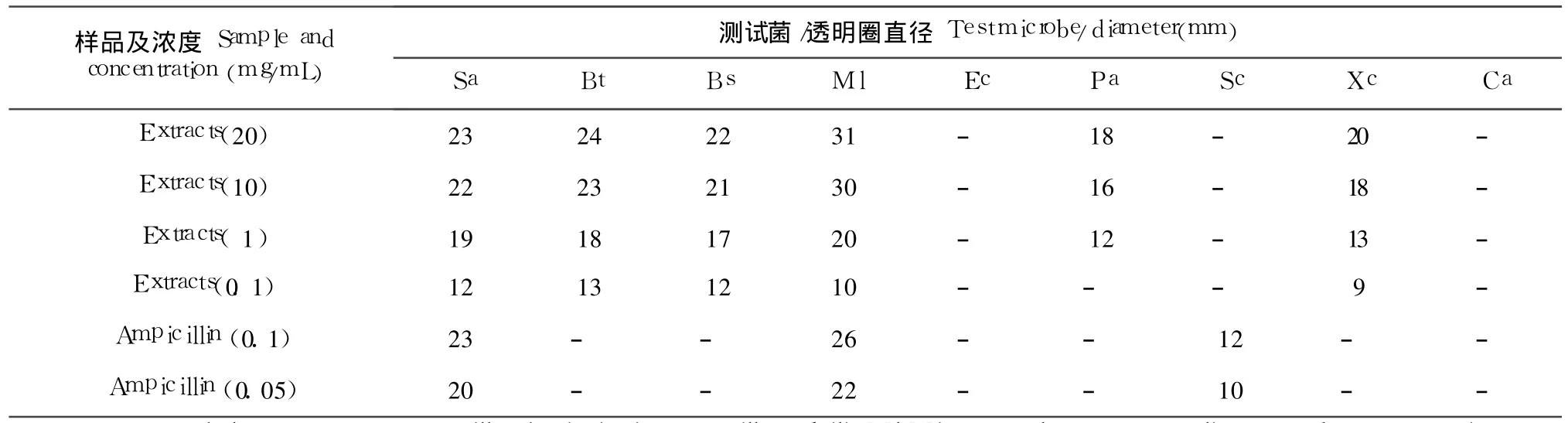
表 2 乙酸乙酯粗提物对测试菌的抑菌圈直径Table 2 Diameters of the inhibition zones of EtOAc extracts against testmicrobes
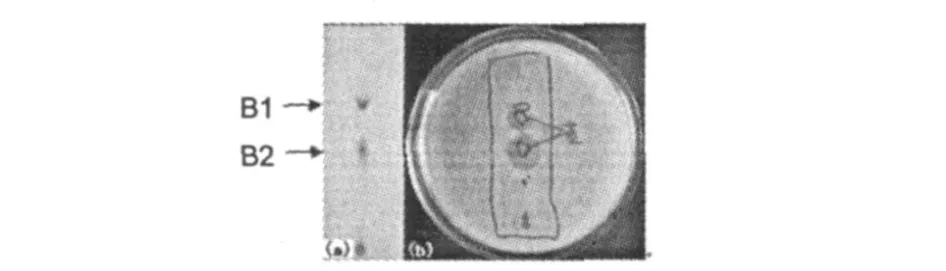
图 1 TLC-生物显影Fig.1 TLC-bioautography
TLC表明,粗提物存在两个主要的蓝色组分B1、B2,Rf值分别为 0.63、0.44;展层后的 TLC薄板与含金黄色葡萄球菌的琼脂接触5 min,平皿培养过夜即可在 B1、B2的相应位置显示出两个抑菌透明区,这表明 B1、B2是两个主要的抗菌活性物质(图1)。当 TLC薄板与琼脂接触时间延长至 30 min,培养后平皿上可出现一个超过平皿面积一半的大抑菌透明区;接触过夜,抑菌透明区即超过平皿面积的3/4(结果未显示),这也表明蓝色组分 B1、B2对金黄色葡萄球菌有较强抑制作用。
2.2 抗肿瘤活性
终浓度为 2.5、5、7.5、10、15、20 μg/mL的乙酸乙酯粗提物在 48 h对 HeLa细胞的生长抑制率分别为 8.2%、23.5%、40.9%、52.7%、81.2%、96.7%,阳性对照 5-氟尿嘧啶(500μg/mL)的抑制率为 60.3%,这显示粤蓝链霉菌产生了具有极强抗肿瘤活性的代谢产物(图 2)。

图 2 乙酸乙酯粗提物对HeLa细胞的抑制作用Fig.2 Inhibtion effect of EtOAc extracts against HeLa cells
2.3 PKS/NRPS基因的克隆及分析
引物 K1F/M 6R可扩增 PKSI的酮酰合酶(ketosynthase)及甲基丙二酰 CoA转移酶(methylmalonyl-CoA transferase)两个功能域的部分基因序列。电泳检测显示,PCR产物在 1297 bp处有一主条带,与预期大小相符(图 3)。测序结果表明,该扩增片段(ks1)是典型的 PKSI基因序列 (登录号:FJ908088);BLAST分析发现,其编码的氨基酸序列与金链菌素 (Aureothin)、Kijanimicin、氯丝菌素(Chlorothricin)、杀念菌素(Candicidin)、南昌霉素(Nanchangmycin)等的 PKS相应区段有较高的同源率(表 3),提示该 PKS可能负责具有重要生物活性的大环内酯类抗生素的生物合成。
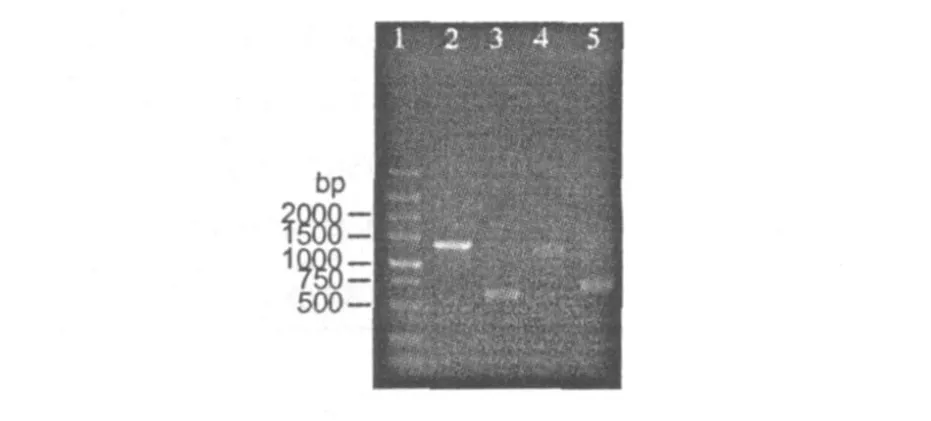
图 3 PKS/NRPS基因 PCR电泳检测Fig.3 Gelelectrophoresis of PCR products of PKS/NRPSgenes 1.DL5000;2.ks1;3.ks2;4.ks3;5.nrps
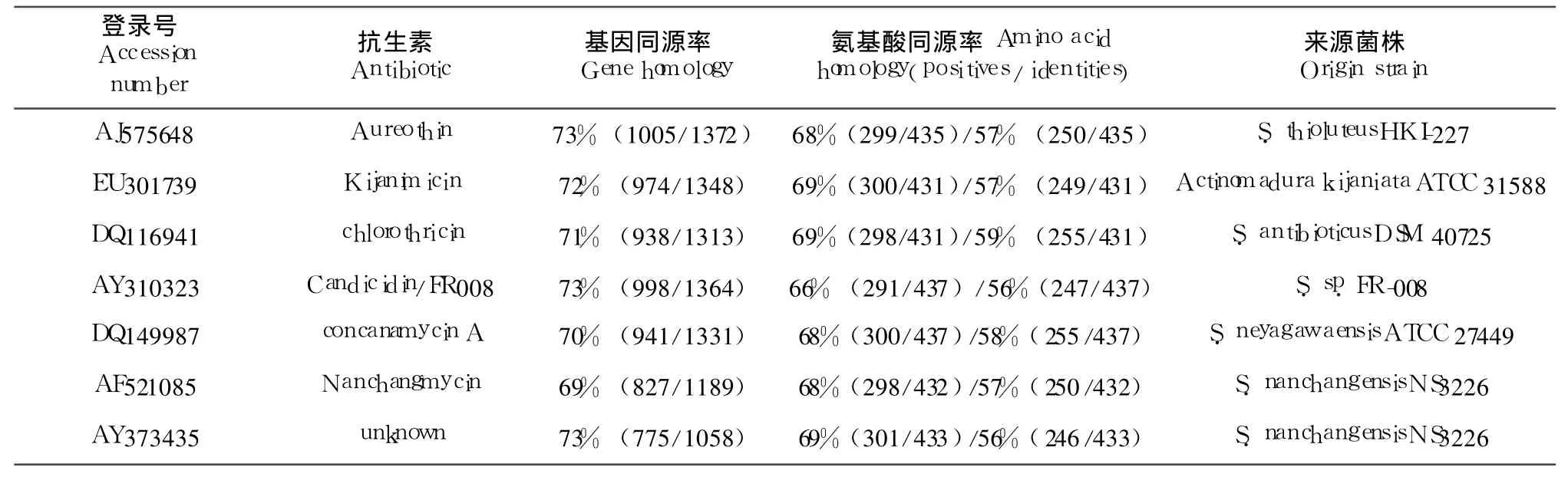
表 3 粤蓝链霉菌PKSI与其它 PKSI的同源性比较Table 3 Homology alignment of the amp lified PKSI fragmentwith PKSI from other sources
引物ⅡPF6/ⅡPR6扩增的目标区域是 PKSⅡ酮酰合酶 α链 (KSα)羧基端基因序列,PCR产物电泳检测显示,在预期片段大小处有一主条带(图 3),测序结果表明,该扩增片段(ks2)613 bp(登录号:EU709745),其编码氨基酸序列与深蓝链霉菌(S.cyaneus(S.curacoi))(X62518)、郝氏链霉菌(S.halstedii)(L05390)、天蓝色链霉菌(S.coelicolor)A3(2)(X55942)孢子色素 PKS相应区域的同源率分别为 92%、91%、89%;在基于氨基酸序列的进化树中,其与合成孢子色素的 PKS聚为一枝(图 4a),推测该 PKS基因簇负责粤蓝链霉菌孢子色素的合成。
KSa34F/ⅡPR6扩增的是 PKSⅡ基因簇中几乎全长的 KSα基因序列,电泳检测显示,PCR产物存在目标条带(图 3),测序结果表明,该扩增片段(ks3)长 1188 bp(登录号:FJ908089),其编码氨基酸序列与醌那霉素(Kinamycin)(AY228175)、杰多霉素(Jadomycin)(DS570913)KSα有 94%的同源率。进化树分析,其与角环类抗生素 PKS聚为一枝(图 4b)。由于 PKSⅡ是迭代型(iterative)的,酮酰合酶参与了聚酮基本骨架合成的全过程,因此,可推测该序列所在基因簇可能负责角环类抗生素的生物合成。
引物 A3F/A7R扩增的目的片段是 NRPS腺苷酰化(adenylation,A)功能域的部分基因序列,PCR产物电泳检测显示,在约 650 bp处存在一条主带(图 3),测序结果表明,该扩增片段(nrps)638bp(登录号:FJ908087);BLAST分析,序列仅与天蓝色链霉菌 A3(2)(AL939113)、阿维链霉菌(S.avermitilis)MA-4680(BA000030)、灰色链霉菌灰亚种(S.griseus subsp.griseus)NBRC13350(AP009493)三个基因组测序的长链脂酰辅酶 A合成酶(long-chain acyl coA synthetase)基因有 90%~91%的同源率,这提示所获得的序列并不是来自负责合成非核糖体多肽(NRP)的基因簇。

图 4 基于PKSⅡ基因扩增区域编码氨基酸序列的进化树分析Fig.4 Phylogenetic analysis based on the amino acid sequences of PCR-amplified regions of the PKSⅡgenes
3 讨论
链霉菌是所有已知生物中产生次级代谢产物最为丰富的属种之一。这些次级代谢产物化学结构多样,不仅对产生菌本身有着重要的意义,而且对其它生物也具有广泛的生理活性,也正因为如此,才使得链霉菌在现代医药中占有重要的地位。经过几十年的筛选,发现新活性物质的几率越来越低,筛选获得新的菌种资源已成为关键因素。另一方面,链霉菌遗传学的发展使得各种活性物质的产生机制被不断阐明,PKS和 NRPS是活性物质产生的两条主要途径,目前已有数以百计的抗生素生物合成基因簇被克隆,基于此的组合生物合成(Combinatorial Biosynthesis)的兴起,为新生物活性物质的获得开辟了新途径。
本研究对新近报道物种——粤蓝链霉菌的次级代谢产物的生物活性进行了研究,发现乙酸乙酯粗提物对革兰氏阳性细菌有较强的广谱抗菌活性,对部分革兰氏阴性菌也有不同程度的抑制作用,两个蓝色组分 B1、B2是主要的抗菌活性成分;粗提物对HeLa肿瘤细胞也有很强的抑制作用;同时对 PKS/NRPS相关基因进行了初步分析,获得 PKS/NRPS基因相关序列 4条,其中 ks1、ks3与已知的负责重要抗生素生物合成的 PKS基因序列有较高的同源性,提示这两条序列所代表的 PKS基因簇有可能是粤蓝链霉菌产生次级代谢产物的重要途径,这些新基因的发现也为组合生物合成提供了更多的基因资源。
在链霉菌中,有一些种能产生蓝色素。早期的链霉菌分类系统甚至以蓝色素作为分类的一个主要依据,将产蓝色素的种归为蓝色类群(cyaneus group)。对初步纯化的蓝色组分 B1、B2进行1H、13C NMR分析,初步判断可能为芳香聚酮类化合物,二者的谱峰非常相似,提示二者的主成份是同系物(数据未显示)。在已知的蓝色素中,粤蓝链霉菌产生的蓝色素与天蓝色链霉菌产生的芳香聚酮类抗生素放线紫红素(actinorhodin)[13]最为相似,都具有抗菌活性,能遇酸变红、遇碱变蓝,但二者在色调上并不相同(紫罗兰:天蓝色),将乙酸乙酯粗提物进行LC/ESI-MS分析,未发现含有与放线紫红素或其已知同系物相同分子量的组分;利用放线紫红素 PKS基因的特异性引物也不能扩增出目标基因(数据未显示),这些结果提示,粤蓝链霉菌产生的蓝色素不同于放线紫红素,其活性物质有可能是新的物质。目前进一步的分离纯化和结构鉴定正在进行中。
1 Bëhal V.Bioactive p roducts from Streptomyces.Adv ApplMicrobiol,2000,47:113-56.
2 Donadio S,Monciardini P,Sosio M.Polyketide synthases and nonribosomal peptide synthetases:the emerging view from bacterial genomics.Nat Prod Rep,2007,24:1073-1109.
3 Barrett CT,Barrett JF.Antibacterials:are the new entries enough to deal with the emerging resistance problems?Curr Opin Biotechnol,2003,14:621-626.
4 Overbye KM,Barrett JF.Antibiotics:where did we go wrong.Drug Discov Today,2005,10:45-52.
5 Peláez F.The historical delivery of antibiotics from microbial natural products—can history repeat.Biochem Pharmacol,2006,71:981-990.
6 Luzhetskyy A,Pelzer S,Bechthold A.The future of natural p roducts as a source of new antibiotics.Curr Opin Invest Drugs,2007,8:608-613.
7 Bull AT,Stach JE,Ward A,etal.Marine actinobacteria:perspectives,challenges,future directions.Anton Leeuw Int JG,2005,87(3):65-79.
8 Zhu HH,Guo J,Yao Q,et al.Streptomyces vietnamensis sp.nov.,a novel streptomycete with violet-blue diffusible pigment isolated from Vietnam.Int JSyst EvolMicrobiol,2007,57:1770-1774.
9 Kieser T,Bibb MJ,Buttner MJ,et a l.Practical Streptomyces Genetics.Norwich:The John Innes Foundation,2000.
10 Ayuso-Sacido A,Genilloud O.New PCR p rimers for the screening of NRPS and PKS-Isystems in actinomycetes:Detection and distribution of these biosynthetic gene sequences inmajor taxonomic groups.Microb Ecol,2005,49:10-24.
11 Metsa-Ketela M,Salo V,Halo L,etal.An efficient approach for screening m inimal PKS genes from Streptomyces.FEMS Microbiol Lett,1999,180:1-6.
12 Sambrook J,Fritsch EF,Maniatis T.MolecularCloning:A Laboratory Manual,2nd ed.New York:Cold Spring Harbor Laboratory Press,1989.
13 Bystrykh LV,Fernandez-Moreno MA,Herrema JK,et al.Production of actinorhodin related blue pigments by Streptomyces coelicolor A(3)2.JBacteriol,1996,178:2238-2244.

