高速逆流色谱法分离纯化青皮中六种多甲氧基黄酮
于 波 ,彭爱一 ,齐 鑫 ,曲学伟 ,李 慧 ,杨 红
辽宁师范大学生命科学学院,大连 116029
高速逆流色谱(High-Speed Counter-Current Chromatography,HSCCC)是利用溶质在两种互不相溶的溶剂系统中分配系数的不同,从而进行分离的色谱方法。由于不使用固体支持介质,避免了因与固体填料发生不可逆吸附造成的样品损失,使样品得以全部回收,具有分离容量大、高效、快速的特点,广泛应用于生物,化学,食品工业等领域。由于该技术具有高承载量,高分离度的特点,适于有效的分离纯化传统中药当中的活性成分[1-3]。
青皮 (Pericarpium citri Reticulatae Viride),为芸香科植物橘(Citrus reticulata Blanco)及其栽培变种的干燥幼果或未成熟果实果皮。是《中国药典》记载的最为常用的传统中药植物之一,中医用煎剂内服治疗胸肋胀痛、胃部痞满、疝气、食积、乳肿、乳核等症。青皮中主要含有黄酮、挥发油和少量氨基酸成分,其中黄酮类化合物含量较高。PMFs作为青皮中的抗癌活性成分,对多种癌细胞有较强的抑制作用。最近发现橘皮素具有保护细胞抵抗内质网应激和细胞毒素[4],抑制神经母细胞瘤增殖[5]等作用。本实验针对青皮中的黄酮类成分,利用 HSCCC从青皮粗提物中分离纯化到六种具有生物活性的 PMFs,其化学结构见图 1。

图 1 6种多甲氧基黄酮类化合物的化学结构Fig.1 Chemical structures of 6 polymethoxyflavone compounds
1 仪器与材料
TBE-300高速逆流色谱仪(上海同田生化技术有限公司),包括 TBP-50A泵,TBD-23UV紫外检测器(254 nm),N2000双通道色谱工作站;waters2695高效液相色谱仪(美国 waters公司),二级管阵列PDA检测器(型号 waters2996,检测波长范围 190 nm~800 nm);Quattro Micro质谱仪 (美国 waters公司);500兆赫超导核磁共振仪(Nuclear Magnetic Resonance,NMR)(AVANCE500 Hz型,瑞士 Bruker公司)。石油醚(60~90℃)、乙酸乙酯、甲醇等均为分析纯(天津市科密欧化学试剂有限公司),95%乙醇(盘锦天源药业有限公司),无水乙醇(北京化工厂),水为自制三蒸水及娃哈哈纯净水;HPLC所用的甲醇、乙腈均为色谱纯试剂(Honeywell)、冰乙酸(天津市凯信化学工业有限公司),D101大孔树脂(天津市大钧科技开发有限公司)。
药材购自于吉林省仙草医药药材有限公司,经辽宁中医药大学药学院王冰教授鉴定为青皮(Pericarpium citriReticulatae Viride)。
2 实验方法
2.1 黄酮的提取和富集
青皮样品干燥后经粉碎机粉碎,过 100目筛,得到青皮粉末 100 g。提取方法为:加 800mL 95%乙醇,回流提取 2次,每次 6 h。过滤,合并滤液,减压回收乙醇,得浸膏 24 g。将浸膏用 50倍体积的氯仿 -甲醇-水(2∶1∶1)体系萃取 ,静置 1 h后分离下相,减压回收下相,浓缩至浸膏。加适量水混悬后,过装有 D101大孔吸附树脂的层析柱(40 cm ×3.0 cm i.d.),静止吸附 1 h后,依次用水、75%甲醇和95%甲醇洗脱,接收 95%甲醇洗脱物,减压浓缩至浸膏后真空干燥(60℃),得棕黄色粉末 3.93 g,放入 4℃冰箱保存。
2.2 两相溶剂体系及样品溶液的制备
本实验中 HSCCC溶剂系统为正己烷∶乙酸乙酯∶甲醇∶水 (4∶6∶4∶6,V/V),按比例将四种溶剂加入分液漏斗中,振荡使溶液充分混合,室温下静置过夜,使用前分得上相(固定相)和下相(流动相),超声脱气 30 min以备用。称取 270 mg青皮粗提物,溶于 18m L下相中,得 15 mg/mL样品溶液。
2.3 HSCCC的分离制备过程
将已超声脱气后的上相(固定相),以 20 mL/min的速度泵入 HSCCC分离管中,待上相充满整个管路(约 12 min),设定分离管顺时针旋转,缓慢调节主机转数至 800 r/min,同时以 2 mL/min流速注入下相,两相达到平衡后由进样阀注入 18 mL样品溶液,同时采集数据,通过紫外检测器(254 nm)检测流出物,按照色谱峰接收目标馏分。
2.4 HPLC分析条件
色谱柱:XTerra MS C18柱(2.1×150 mm,5 μm)。流动相 A:乙腈,B:0.2%乙酸;梯度程序:0~25min,流动相 A由 10%升至 90%,流速 0.2mL/min;柱温箱温度 35℃;检测波长范围:200~600 nm。
3 结果与讨论
3.1 样品前处理方法的选择
由于黄酮类化合物易溶解于甲醇、氯仿、乙酸乙酯等有机溶剂,微溶于水、乙醚,且青皮 95%乙醇提取物中含有亲水性黄酮苷以及氨基酸类成分,以 3和 5的含量(面积归一化法)为例只占总提取物17.07%和 12.61%。若采用有机溶剂逐级萃取方法来处理该样品,体系的样品溶解量小,水相体积过大,有机相萃取次数增多。采用氯仿-甲醇-水体系萃取,使粗提物以溶液状态在上、下相间达到分配平衡:极性成分分布于上相(水相),弱极性成分分布于下相(氯仿相)。在此基础上通过大孔树脂梯度洗脱,收集 95%甲醇洗脱液,经 HPLC测定二者含量提升至 35.96%和 34.06%(图 3)。因此该方法具有萃取体系小,分配时间短且分配完全,简化中间过程等优点,有利于提高 HSCCC的分离纯化效率。
3.2 HSCCC分离条件的选择
现有文献多数报道使用 HSCCC分离黄酮苷的方法,而能够高效分离制备多甲氧基黄酮的方法较少,体系主要为氯仿-甲醇-水,石油醚-乙酸乙酯-甲醇-水,正己烷 -乙酸乙酯-甲醇 -水 。已有文献报道使用石油醚∶乙酸乙酯 ∶甲醇 ∶水 (2∶4∶3∶3)可分离青皮中橙皮苷 、橘皮素 、5-羟基-6,7,8,3′,4′-五甲氧基黄酮。但对于使用 HSCCC同时分离六种 PMFs的方法尚无报道。本实验选择正己烷/水为主溶剂,分别通过调节溶剂体系在不同体积的配比,考察了青皮中各组分的分配系数,筛选出了对于本实验中青皮粗提物的各组分整体分离效果较好、固定相保留率较高的体系。实验结果见表 1。

表 1 青皮粗提物中六种化合物在不同比例的溶剂体系中的分配系数Table 1 Partition coefficients of six compounds of Pericarpium citriReticulatae Viride crude extracts in different p roportion solvent systems
从表 1中可以看出当溶剂体系为正己烷-乙酸乙酯-甲醇 -水 (3∶6∶3∶6)和 (2∶6∶2∶6)时,各组分的分配系数普遍较大,因此体系极性偏强不适合该粗提物的分离纯化。而当体系为正己烷-乙酸乙酯-甲醇 -水 (5∶5∶5∶5)时各组分的分配系数都较小 ,这样分配系数小的组分就容易与无保留的杂质相混淆并且出峰过快影响分离度;因此得出较适合的体系为正己烷 -乙酸乙酯-甲醇 -水 (4∶5∶4∶5)和 (4∶6∶4∶6),在其他实验参数均相同的条件下,分别应用两体系对青皮粗提物进行分离纯化,结果证明正己烷-乙酸乙酯-甲醇 -水 (4∶6∶4∶6)在总的分离时间 ,以及对化合物 1~6分离纯化等方面都优于正己烷-乙酸乙酯 -甲醇-水(4∶5∶4∶5),对于化合物 6采用回收分离管中溶液,甲醇重结晶的方法纯化。因此本实验最终选用正己烷-乙酸乙酯 -甲醇-水(4∶6∶4∶6)作为分离纯化的溶剂体系。
本实验还对样品的一次进样量进行了优化,考察了进样浓度分别为 8、15、25 mg/mL时,对青皮粗提物分离的影响。当进样浓度为 25mg/m L时,样品的分离度较差,化合物 1、2不能有效分离。而当进样量为 8mg/mL和 15 mg/mL时,样品都有较好的分离度,且无明显差别,因此本实验选择的进样浓度为 15mg/m L。
3.3 HSCCC分离制备的结果
将“2.2”节得到的青皮样品溶液按照“2.3”节所述步骤进行分离,固定相保留率为 50%,分离时间为 460min,根据 HSCCC图(图 2)手动分段收集,得到组分 1~5。将 5种组分减压浓缩干燥,称得质量分别为 3.5 mg、13.9 mg、51.3mg、9.5 mg、44.7 mg,组分 6经重结晶后得 11.2mg。

图 2 青皮粗提取的高速逆流色谱图Fig.2 HSCCC chromatogram of the crude extract For peaks 1-6,see Fig 1.
3.4 HPLC检测分析
采用“2.4”节的条件,对青皮样品及组分 1~6分别进行 HPLC检测(图 3,4),面积归一化法测定六种化合物的纯度为:97.8%、98.4%、100%、97.6%、99%、98.1%。此结果表明,利用高速逆流色谱对青皮中的活性化合物进行大量分离制备的方法高效可行。

图 3 青皮粗提物的HPLC图Fig.3 H igh performance liquid chromatography of Pericarpium citri Reticulatae Viride crude extracts Peaks 1-6,see Fig 1.
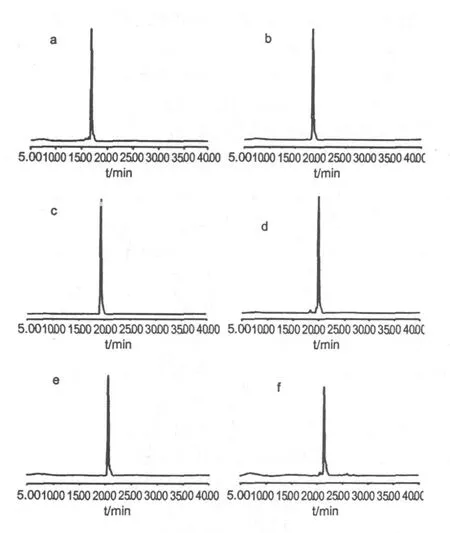
图 4 从图 2中分离得到的五种化合物的HPLC图Fig.4 H igh performance liquid chromatography of five compounds(1、2、3、4、5)isolated by HSCCC.High performance liquid chromatography of recrystallized compound 6
3.5 结构鉴定
化合物 1 黄色针状结晶(甲醇),mp.178~179℃,ESI-MSm/z:373[M+H]+。1H NMR(500 MHz,CDCl3)δ:7.44(1H,dd,J=8.9,2.1 Hz,H-6′),7.23(1H,d,J=2.1Hz,H-2′),6.92(1H,d,J=8.8Hz,H-5′),6.74(1H,s,H-8),6.55(1H,s,H-3),3.98(3H,s,OCH3),3.95(3H,s,OCH3),3.92(3H,s,OCH3),3.90(3H,s,OCH3),3.88(3H,s,OCH3)。1H NMR数据与文献[6]基本一致,故鉴定化合物 1为 5,6,7,3′,4′-五 甲氧 基 黄酮,即甜橙素(Sinensetin)。
化合物 2 黄色粉末(甲醇),mp.216~217℃,ESI-MSm/z:343[M+H]+。1H NMR(500 MHz,CDCl3)δ:7.89(2H,d,J=8.9 Hz,H-2′,6′),7.02(2H,d,J=8.9 Hz,H-3′,5′),6.60(1H,s,H-3),6.44(1H,s,H-6),4.00(3H,s,OCH3),3.98(3H,s,OCH3),3.96(3H,s,OCH3),3.88(3H,s,OCH3);13C NMR(125 MHz,CDCl3):162.2(C-2),107.1(C-3),177.8(C-4),152.0(C-5),92.8(C-6),156.5(C-7),130.9(C-8),156.3(C-9),109.2(C-10),124.0(C-1′),127.7(C-2′),114.5(C-3′),160.7(C-4′),114.5(C-5′),127.7(C-6′),61.6(OCH3),56.7(OCH3),56.3(OCH3),55.5(OCH3)。NMR数据与文献[6]一致,故鉴定此化合物 2为 5,7,8,4′-四甲氧基黄酮。
化合物 3 黄色针状结晶(甲醇),mp.136~137℃,盐酸-镁粉反应呈橙红色。ESI-MSm/z:403[M+H]+。1H NMR(500 MHz,CDCl3)δ:6.62(1H,s,H-3),7.42(1H,d,J=2.1 Hz,H-2′),7.00(1H,d,J=8.5 Hz,H-5′),7.57(1H,dd,J=8.5,2.1 Hz,H-6′),3.97(3H,s,OCH3),3.98(3H,s,OCH3),4.03(3H,s,OCH3),4.10(3H,s,OCH3),3.96(3H,s,OCH3),3.95(3H,s,OCH3);13C NMR(125 MHz,CDCl3)δ:161.1(C-2),106.9(C-3),177.3(C-4),144.2(C-5),149.4(C-6),138.1(C-7),148.5(C-8),147.8(C-9),108.7(C-10),124.1(C-1′),111.3(C-2′),152.0(C-3′),151.5(C-4′),114.9(C-5′),119.7(C-6′),62.3(OCH3),62.0(OCH3),61.8(OCH33),61.7(OCH3),56.1(OCH3),56.0(OCH3).1H NMR、13C NMR数据与文献[7]报道一致,故鉴定为 5,6,7,8,3′,4′-六甲氧基黄酮 ,即川陈皮素(Nobiletin)。
化合物 4 黄色针晶(乙酸乙酯),mp.125~127 ℃,ESI-MSm/z:433[M+H]+。1H NMR(500 MHz,CDCl3)δ:7.81(1H,d,J=1.9 Hz,H-2′),7.01(1H,d,J=8.6 Hz,H-5′),7.84(1H,dd,J=8.6,2.0 Hz,H-6′),4.10(3H,s,OCH3),4.01(3H,s,OCH3),3.98(3H,s,OCH3),3.97(3H,s,OCH3),3.97(3H,s,OCH3),3.95(3H,s,OCH3),3.89(3H,s,OCH3);13C NMR(125 MHz,CDCl3):151.1(C-2),143.9(C-3),173.9(C-4),146.8(C-5),140.8(C-6),151.3(C-7),137.9(C-8),148.2(C-9),115.1(C-10),123.5(C-1′),111.1(C-2′),148.9(C-3′),153.1(C-4′),111.2(C-5′),122.0(C-6′),62.3(OCH3),61.9(OCH3),61.8(0CH3),61.7(0CH3),59.9(0CH3),56.0(OCH3),56.0(OCH3)。 NMR数据与文献[8]一致,故鉴定此化合物 4为 3,5,6,7,8,3′,4′-七甲 氧基 黄 酮 (3,5,6,7,8,3′,4′-Heptame-thoxyflavone)。
化合物 5 黄色针晶(甲醇),mp.49~51℃,ESI-MSm/z:373[M+H]+。1H NMR(500 MHz,CDCl3)δ:6.60(1H,s,H-3),7.88(2H,m,H-2′,6′),7.03(2H,m,H-3′,5′),3.95(3H,s,OCH3),3.95(3H,s,OCH3),4.02(3H,s,OCH3),4.10(3H,s,OCH3);13C NMR(125 MHz,CDCl3)δ:62.3(C-2),106.8(C-3),177.3(C-4),147.8(C-5),144.1(C-6),151.4(C-7),138.1(C-8),148.4(C-9),106.8(C-10),123.9(C-1′),127.7(C-2′),114.6(C-3′),161.2(C-4′),114.5(C-5′),127.7(C-6′),62.3(OCH3),62.0(OCH3),61.8(OCH3),61.7(OCH3),55.5(OCH3)。以上 NMR数据与文献[6]报道一致,故鉴定为 5,6,7,8,4′-五甲氧基黄酮,即橘皮素(Tangeretin)。
化合物 6 黄色针晶(乙酸乙酯),mp.144~145℃,ESI-MSm/z:388[M]+。1H NMR(500MHz,CDCl3)δ:7.59(1H,dd,J=8.5,2.1 Hz,H-6′),7.43(1H,d,J=2.1 Hz,H-2′),7.01(1H,d,J=8.5 Hz,H-5′),6.61(1H,s,H-3),4.11(3H,s,OCH3),3.99(3H,s,OCH3),3.98(3H,s,OCH3),3.97(3H,s,OCH3),3.96(3H,s,OCH3),12.54(1H,s,5-OH);13C NMR(125MHz,CDCl3):164.0(C-2),104.0(C-3),183.0(C-4),145.8(C-5),136.7(C-6),152.6(C-7),133.0(C-8),149.5(C-9),107.1(C-10),123.8(C-1′),108.9(C-2′),149.5(C-3′),153.0(C-4′),111.4(C-5′),120.2(C-6′),62.1(OCH3),61.7(OCH3),61.1(OCH3),56.2(OCH3),56.1(OCH3)。NMR数据与文献[9]一致,故鉴定此化合物 6为 5-羟基 -6,7,8,3′,4′,-五甲氧基黄酮,即 5-去甲川陈皮素(5-O-DesmethylNobiletin)。
4 结论
本文首次研究了使用高速逆流色谱分离制备青皮中六种黄酮类成分的方法,分离产物经 HPLC,MS,NMR分析,结果证明该方法成功获得高纯度,高质量的多甲氧基黄酮类化合物。与常规反复过硅胶柱的方法相比,该方法具有快速,高效,节省溶剂等优点。 3,5,6,7,8,3′,4′-七甲氧基黄酮具有较强的抑制癌细胞增殖,并能促使癌细胞向正常细胞转变,有较高的药用价值。川陈皮素和橘皮素是我国药典规定的青皮中的标志性成分,得到的高纯度样品可以作为标准品用于分析测试或药理与毒理试验,该方法也为分离相似化合物提供技术参考。
1 Chen LJ,Song H,Lan XQ,et al.Comparison of high speed countercurrent chromatography instruments for the separation of the extracts of the seeds of Oroxylum indicum.J Chromatogr A,2005,1063:241.
2 Chen L,Han YS,Yang FQ,et al.H igh-speed counter-current chromatography separation and purification of resveratrol and piceid from Polygonum cuspidatum.J Chromatogr A,2001,907:343.
3 Wang QE,Lee FSC,Wang XR.Isolation and purification of inflacoumarin A and licochalcone A from licorice by highspeed counter-current chromatography.J Chromatogr A,2004,1048:51.
4 Takano K,Tabata Y,Kitao Y,et a l.Methoxyflavones p rotect cells againstendop lasm ic reticulum stress and neurotoxin.Am JPhysiol Cell Physiol,2007,292:C353-61.
5 Akao Y,Itoh T,Ohguchi K,et a l.Interactive effects of polymethoxy flavones from Citrus on cell growth inhibition in human neuroblastoma SH-SY5Y cells.Bioorg Med Chem,2008,16:2803-2810.
6 Jie C,Antonio MM,WilburWW.Two new polymethoxylated flavones,a class of compounds with potential anticancer activity,isolated from cold pressed dancy tangerine peel oil solids.Agric Food Chem,1997,45:364.
7 Wang TZ(王天志),Li T(李涛).Study on the chem ical constituents of Pleurospermum hookeri var.thomsonii.Nat Prod Res Dev(天然产物研究与开发),1998,10(4):19-24.
8 Sunil K Talapatra,Swapan KMukhopadhyay,Anup Bhattacharya,et al.Methoxylated flavones of fortunella japonica.Phytochem istry,1975,14:309.
9 Wang JZ(王建忠),Wang FP(王锋鹏).Two flavones from the leaves of Rabdosia coetsa.West China JPharm Sci(华西药学杂志),1999,14(2):73.

