非酒精性脂肪性肝病和代谢综合征的临床特征比较及危险因素探讨*
张利莉 袁 莉 李 琴 汪 英
华中科技大学同济医学院附属协和医院内分泌科,武汉 430022
随着人们生活方式及饮食习惯的西化,肥胖在我国呈流行之势,一项全国性调查研究显示,超重人群在我国达30%以上[1]。肥胖相关疾病如代谢综合征(metabolic syndrome,MS)、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)等在我国居民中的发病率亦显著升高[1-2]。MS及NAFLD常紧密相随,MS及NAFLD患者的糖尿病、心血管病的发生以及心血管病的死亡、全因死亡的危险性显著增加[3-6]。但NAFLD及MS在代谢特点上有无差异,抑或NAFLD只是作为MS的一个表现形式尚无明确报道。本研究通过进行NAFLD合并MS、单纯MS、单纯NAFLD的临床特征及代谢特点的比较,进一步探讨NAFLD及MS的危险因素,为防治MS及NAFLD等心血管病高危因素提供科学依据。
1 对象与方法
1.1 研究对象
以2008年3月到7月在武汉市协和医院进行健康体检者(均为武汉市长居人口)为研究对象,抽取其中有完整人体测量和实验室资料的个体共1 107人,男 785人,女 322 人,分为 4 组,即单纯MS组(MS组)111人,单纯NAFLD组(NAFLD组)117人,MS合并NAFLD组(MN组)147人,无MS及NAFLD组(对照组)732人。
1.2 方法
采用病例对照研究方法。①使用统一设计的流行病调查表,均由经统一培训的医务人员进行询问,填写被调查者的病史、运动等相关情况。②由专人测身高、体重、腰围、臀围、血压和心率等,其中腰围、臀围各测2次取平均值,血压测3次取平均值。生化指标:取隔夜空腹 12 h静脉血测空腹血糖,血TC、TG、HDL-C、LDL-C及肝肾功能在本院标准化生化实验室自动生化分析仪测定。③代谢综合征诊断标准:采用2005年国际糖尿病联盟(IDF)建议的代谢综合征诊断标准[7]。腹型肥胖(腰围男≥90 cm,女≥80 cm)同时伴以下4项中任意2项异常者:血压≥130/85 mmHg(1 mmHg=0.133 kPa),或接受降压药治疗者;空腹TG(TG)≥1.7 mmol/L;空腹 HDL-C(HDL-C)男 <1.0 mmol/L,女 <1.3 mmol/L;空腹血糖≥5.6 mmol/L或已诊断糖尿病接受降糖药物治疗者。④肝脏B超检查由同一位高年资专职B超医师进行,出具统一报告。根据2006年中华医学会肝脏病学分会《非酒精性脂肪性肝病诊疗指南》[8]的临床诊断标准诊断非酒精性脂肪性肝病。
1.3 统计学处理
采用SPSS 12.0统计软件作以下分析:①以均数和标准差表示连续性变量,百分位数表示分类变量;②对于正态分布资料,多组间差异采用单因素方差分析比较,SNK法比较两两差异;非正态分布资料,采用非参数统计分析比较组间差异;一般病史中计数资料采用χ2检验;用logistic回归分析MS、NAFLD及MN的危险因素,比较各危险因素的相对重要性。所有分析均以 P<0.05为差异有统计学意义。
2 结果
2.1 各组一般病史资料比较
各组年龄及男女比例差异均无统计学意义,MS、NAFLD及MN 3组中高血压、糖尿病、高血脂病的患病率及服用阿司匹林的人数比例均高于对照组,差异有统计学意义(P<0.05或P<0.01)。MS组及MN组高血压病和糖尿病患病率高于NAFLD组,差异有统计学意义(P<0.01),而NAFLD组及MN组有高血脂病史者所占比例高于MS组,差异有统计学意义(P<0.05或P<0.01)。见表1。

表1 各组一般病史资料比较Table 1 Comparison of general history of different g roups
2.2 各组人体测量指标及血清学指标的比较
MS、NAFLD及 MN 3组与对照组相比,舒张压 、BMI、腰围(WC)、腰臀比(WH R)、空腹血糖 、糖化血红蛋白 、TC、TG 、LDL-C 、ALT 及 γ-谷氨酰转肽酶(GGT)均增高,HDL-C降低,差异均具有统计学意义(P<0.05或P<0.01)。MS组血压、腰围、腰臀比及TG均显著高于NAFLD组(P<0.05或 P<0.01),而两组间 BMI、空腹血糖 、糖化血红蛋白、TC 、HDL-C 、LDL-C 、ALT 及GGT差异均无统计学意义。MN组BMI、TC及TG均显著高于MS组(P<0.05或 P<0.01),血压、BMI、腰围、腰臀比、空腹血糖、糖化血红蛋白、TG均显著高于NAFLD组(P<0.05或 P<0.01),而 MS、NAFLD 及 MN 3组间 HDL-C、LDL-C、ALT及GGT差异无统计学意义。见表2。
表2 各组人体测量指标及血清学指标的比较(±s)Table 2 Demographic and laboratory findings between different groups

表2 各组人体测量指标及血清学指标的比较(±s)Table 2 Demographic and laboratory findings between different groups
*P<0.05 **P<0.01 vs control g roup;△P<0.05 △△P<0.01 vs MS g roup;#P<0.05 ##P<0.01 vs N AFLD g roup
Parameters Control group MS g roup NAFLD group MN group SBP(mmHg) 125.09±18.02 140.30±17.82** 127.77±18.02△△ 136.35±14.74**##DBP(mmHg) 78.66±9.83 85.29±11.47** 82.16±8.46**△ 86.67±9.92**##BMI 22.77±2.50 26.07±2.62** 25.70±2.36** 27.19±2.48**△△##WC(cm) 79.08±7.99 91.57±6.23** 88.31±7.05**△△ 93.12±6.59**##WHR 0.86±0.06 0.93±0.05** 0.91±0.05**△ 0.94±0.05**##FBG(mmol/L) 4.93±0.92 5.45±1.29** 5.13±0.89** 5.68±1.43**##HbA1c(%) 5.69±0.63 6.03±0.65* 6.01±0.89** 6.32±0.90**#TC(mmol/L) 4.91±0.91 5.15±0.97* 5.20±0.84** 5.38±0.93**△TG(mmol/L) 1.45±1.02 2.41±1.48** 2.21±1.72**△ 3.00±2.55**△##HDL-C(mmol/L) 1.34±0.22 1.22±0.22** 1.24±0.19** 1.18±0.18**LDL-C(mmol/L) 2.77±0.74 2.94±0.80* 2.97±0.68** 3.04±0.88**ALT(U/L) 20.58±11.07 28.55±16.98** 29.91±16.07** 30.86±16.74**GGT(U/L) 26.27±23.35 44.95±49.51** 39.13±34.24** 37.55±25.68**
2.3 MS、NAFLD及MN的 logistic回归分析
以MS、NAFLD及 MN 为因变量,以 BMI、腰围、收缩压、舒张压、空腹血糖、TC、TG 、HDL-C、LDL-C、ALT、GGT为自变量进行多因素logistic回归分析,并调整家族史(高血压、糖尿病)等混杂因素,结果见表3,腰围和ALT为3组共同的独立危险因素,而BMI为NAFLD及MN的共同独立危险因素,收缩压、空腹血糖及LDL-C为MS及MN的共同独立危险因素。标准OR值提示,TG为人群同时患MS及NAFLD(即MN)的最强危险因素。
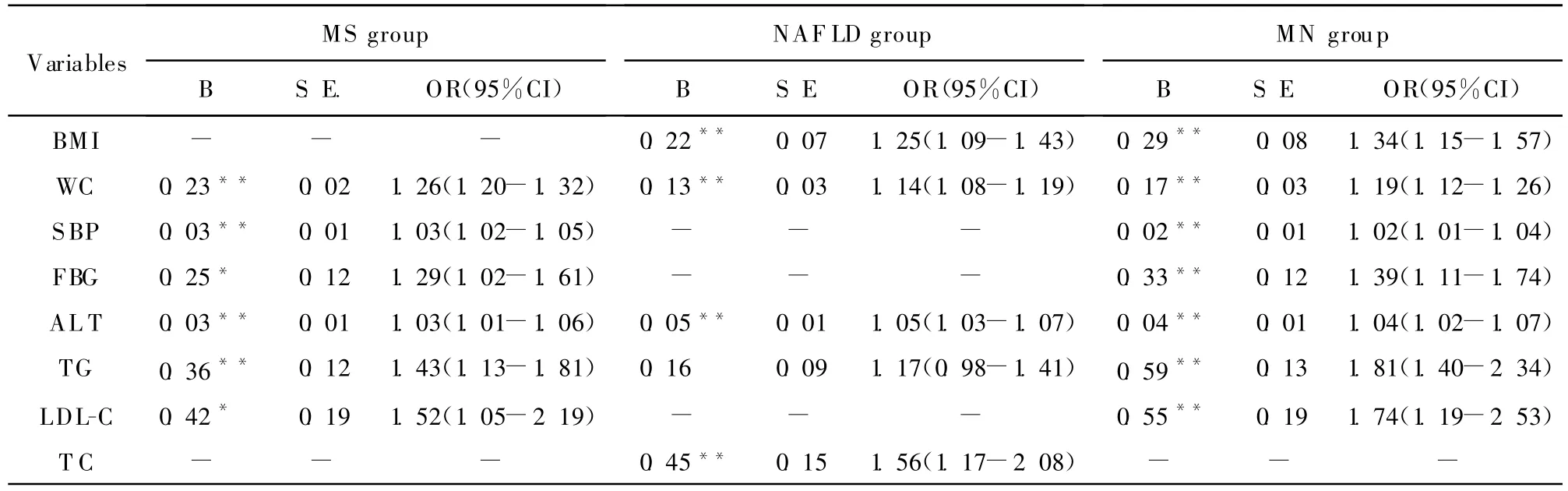
表3 MS、NAF LD及MN的logistic回归分析Table 3 Logistic regression analysis in MS,NAFLD and MN groups
3 讨论
本研究提示,伴有MS的NAFLD者患高血压、糖尿病的比例显著高于单纯NAFLD者,而伴有NAFLD的MS患者有高血脂病史的比例显著高于单纯MS,但无论是MS还是NAFLD抑或两者合并存在的人群中高血压病、糖尿病、高血脂病的患病率均显著高于一般人群,因血黏度增高而需服用阿司匹林的人群比例亦明显高于对照组。这些结果均与现有文献报道的MS、NAFLD是心脑血管病的独立危险因素相一致,而同时合并MS和NAFLD时,患者代谢指标异常程度较单纯某一个疾病时更严重,患高血压、糖尿病的风险均增加,以后患冠心病、脑卒中等心脑血管疾病的风险亦大大增加。
本研究MS及MN组中血压、血糖、TG均较对照组显著升高,而HDL-C显著降低,如果说这些结果主要是因为MS本身定义即来源于这些指标的升高或降低,那么在NAFLD组中,除了收缩压与对照组相比差异无统计学意义外,余舒张压、BMI、腰围、空腹血糖 、TC、TG、HDL-C 、LDL-C 、ALT 、GGT 与对照组相比差异均具有统计学意义,而且这些指标的改变方向均与MS及MN组相一致,但是BMI、空腹血糖、TC、HDL-C、LDL-C、ALT 、GGT 在 MS与NAFLD两组间却无明显差异。这些表象的背后隐藏着哪些共同的机制?有着相似临床特点的MS及NAFLD孰因孰果?同源抑或等危?众多研究认为,胰岛素抵抗(insulin resistance,IR)[9]是 MS发生的中心环节。IR状态下,靶器官对胰岛素敏感性下降,导致继发性高胰岛素血症,组织利用葡萄糖障碍,血糖升高;高胰岛素血症通过致内皮功能紊乱、水钠潴留等导致血压升高;同时IR损伤肝脂质代谢,引起血脂紊乱,导致MS的发生发展。而血游离脂肪酸(FFA)增高,FFA向肝脏转运增加,肝脏TG合成增加,脂肪沉积,肝细胞活力不足,致肝胰岛素抵抗,肝脂肪变性等,因此目前认为 IR亦是NAFLD的首发原因。我们的基础研究亦证实IR与NAFLD的密切关联[10]。由此可见,IR在MS及NAFLD的发生发展过程中均起着极其重要的作用。那么,我们是否可以认为无论是MS还是NAFLD都只是IR的不同表现形式?而隐藏在IR背后更深层次的机制还有待于更进一步的研究,以求在更早阶段干预这些心脑血管危险因素。
Logistic回归分析提示,TC是NAFLD的独立危险因素且OR值高于其他危险因素,而TC与动脉粥样硬化关系密切,这与文献报道NAFLD者肝脏组织学活检的严重程度与颈动脉内膜中层厚度密切相关相一致[11]。NAFLD合并MS存在时血压、血糖、BMI及TG等指标均较单纯NAFLD显著升高,其中TG为人群同时患NAFLD及MS(即MN)的最强危险因素。腰围和ALT为MS、NAFLD及MN 3组共同的独立危险因素。这些均警示我们,这些无临床不适的肥胖、血脂异常预示着以后患NAFLD及MS的危险性显著增加,健康的饮食习惯及适当的有氧运动有益于防治这些与代谢相关的疾病,故有必要对广大群众进行健康教育指导,提高普通人群对这些疾病的认识,积极对抗这些心脑血管疾病的危险因素。
总之,虽然NAFLD与MS孰因孰果或者二者都是某些机制如IR引起代谢异常的不同表现形式尚不清楚,但是二者发病过程中相互作用、相互加重,严重威胁到人群健康是值得重视的。合理控制饮食,加强锻炼,建立健康的生活方式,定期监测并纠正异常的血压、血糖、血脂都是防治 MS及NAFLD的有效措施。
[1] Gu D,Reynolds K,Wu X,et al.Prevalence of the metabolic syndrome and overweight among adults in China[J].Lancet,2005,365(9468):1398-1405.
[2] Williams R.Global challenges in liver disease[J].Hepatology,2006,44(3):521-526.
[3] Hanson R L,Imperatore G,Bennett P H,et al.Components of the“metabolic syndrome” and incidence of ty pe 2 diabetes[J].Diabetes,2002,51(10):3120-3127.
[4] Fraser A,Harris R,Sattar N,et al.Alanine aminotransferase,gamma glutamyltransferase and incident diabetes:The British Women's Heart and Health Study and meta-analysis[J].Diabetes Care,2009,32(4):741-750.
[5] Malik S,Wong N D,Franklin S S,et al.Impact of the metabolic syndrome on mortality from coronary heart disease,cardiovascular disease,and all causes in United States adults[J].Circulation,2004,110(10):1245-1250.
[6] T argher G,A rcaro G.Non-alcoholic fatty liver disease and increased risk of cardiovascular disease[J].Atherosclerosis,2007,191(2):235-240.
[7] Alberti K G,Zimmet P,Shaw J.The metabolic syndrome—a new worldwide definition[J].Lancet,2005,366(9491):1059-1062.
[8] 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志,2006,14(3):161-163.
[9] Ye J H,Li F P,Li F,et al.Relationship between serum IL-18 levels and insulin resistance in patients with metabolic syndrome[J].J Huazhong Univ Sci Technol[Med Sci],2007,36(1):105-107.
[10] 陈樱花,袁莉,陈媛媛,等.阻断肾素血管紧张素系统对长期高脂喂养大鼠肝脂肪变性的影响[J].中华内科杂志,2008,47(3):197-201.
[11] Targher G,Bertolini L,Padovani R,et al.Relations between carotid artery wall thickness and liver histology in subjects with nonalcoholic fatty liver disease[J].Diabetes Care,2006,29(6):1325-1330.

