6种他汀类药物的电喷雾离子阱质谱分析
王 杨,高丽英,吴艳平,孙 璐
(沈阳药科大学,辽宁沈阳 110016)
6种他汀类药物的电喷雾离子阱质谱分析
王 杨,高丽英,吴艳平,孙 璐
(沈阳药科大学,辽宁沈阳 110016)
采用电喷雾离子阱多级质谱技术对6种他汀类药物进行系统研究,总结了该类化合物的电喷雾质谱断裂规律。根据主要药效基团存在形式的不同,分两类解析。第一类:辛伐他汀和洛伐他汀在正离子模式下发生β,δ-二羟基戊内酯开环断裂,生成中性丢失 H2O、CO、CH3COOH的碎片离子;第二类:普伐他汀和阿托伐他汀在负离子模式下产生脱去104 u(3-羟基-1,4-丁內酯和 H2)和160 u(3,5-二羟基-1,7-庚内酯)的碎片离子;氟伐他汀和瑞舒伐他汀在负离子模式下产生脱去62 u(CO2和 H2O)的碎片离子,对该二级碎片离子进行三级全扫描质谱分析,产生脱去42 u(CH2=C=O)和96 u(环已烯-3-酮)的碎片离子。这些质谱特征有助于他汀类药物的结构分析和鉴定。
他汀类药物;多级质谱分析;断裂规律
他汀类降脂药为细胞内胆固醇合成限速酶,即3-羟基-3-甲基戊二酰辅酶A(HM G-CoA)还原酶抑制剂,是目前临床上应用最广泛的一类降脂药物,常用的有辛伐他汀、洛伐他汀、普伐他汀、阿托伐他汀和氟伐他汀。瑞舒伐他汀是2002年在欧洲获得上市批准的最新他汀类药物,临床研究表明,瑞舒伐他汀为最强效的降脂药物。他汀类药物的结构由两部分组成:一部分为脱氢萘环和芳杂环等疏水性刚性平面结构;另一部分为由乙基或乙烯基相连的β,δ-二羟基戊酸(内酯)结构,其中β,δ-二羟基戊酸是发挥活性的必需基团,根据存在形式分为两类,第一类为以非活性内酯环形式存在的前体药物,它们在体内代谢成相应的β,δ-二羟基戊酸代谢物才能发挥药理活性,包括辛伐他汀和洛伐他汀;第二类为直接以具有活性的开放酸盐形式存在的药物,包括普伐他汀、阿托伐他汀、氟伐他汀和瑞舒伐他汀等[1-4]。
电喷雾离子阱质谱法在化合物结构分析方面有着广泛的应用。已有文献[5]报道了辛伐他汀、洛伐他汀的质谱裂解行为,关于其他4种他汀类药物的质谱断裂行为尚未见报道。本研究采用电喷雾离子阱质谱法对6种他汀类药物进行多级质谱分析,解析碎片离子结构,总结质谱断裂规律,为同类化合物的结构分析和鉴定提供理论依据。
1 试验部分
1.1 主要仪器及实验条件
A gilent 1100 SL型液相色谱-质谱联用仪:美国Agilent公司产品;M ass Frontier 3.0质谱解析软件:美国 Highchem公司产品。
质量扫描范围:m/z50~1 500;雾化气压力(N2):103 k Pa;干燥气(N2)流速:5 L ·m in-1;干燥气温度:325℃;毛细管电压:3.5 kV;碰撞气:He;注射泵进样流速:5μL ·min-1。样品溶于甲醇(色谱纯),过0.45μm滤膜。
1.2 样品
辛伐他汀和洛伐他汀:由沈阳华泰药物研究有限公司提供;普伐他汀、阿托伐他汀、氟伐他汀和瑞舒伐他汀:购自沈阳药大药房。6种药物的结构示于图1。
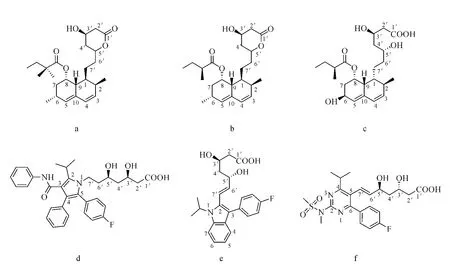
图1 辛伐他汀(a)、洛伐他汀(b)、普伐他汀(c)、阿托伐他汀(d)、氟伐他汀(e)和瑞舒伐他汀(f)的结构式Fig.1 The structures of simvastatin(a),lovastatin(b),pravastatin(c),atorvastatin(d),fluvastatin(e)and rosuvastatin(f)
2 结果与讨论
采用电喷雾离子化方式对6种他汀类药物进行质谱分析。根据结构将其分为两类:第一类为含有β,δ-二羟基戊内酯基团的辛伐他汀和洛伐他汀,在正离子检测方式下响应较好,而在负离子检测方式下无响应,因此选择正离子检测方式进行多级质谱分析。第二类为以开放酸盐形式存在的普伐他汀、阿托伐他汀、氟伐他汀和瑞舒伐他汀,在溶液中很容易解离为酸根离子,在负离子检测方式下灵敏度较高,得到准分子离子峰[M-H]-;在正离子检测方式下普伐他汀得到加合离子峰[M+Na]+,未检测到准分子离子峰[M+H]+,而阿托伐他汀、氟伐他汀和瑞舒伐他汀能检测到准分子离子峰[M+H]+和加合离子峰[M+Na]+,但它们的[M+H]+峰响应值仅为负离子检测方式下准分子离子峰[M-H]-的1/10,因此选择负离子检测方式对这4种药物进行多级质谱分析。
2.1 第一类药物的质谱分析

图2 辛伐他汀 m/z 419[M+H]+的二级质谱图Fig.2 MS2 spectrum of[M+H]+ion at m/z 419 of simvastatin
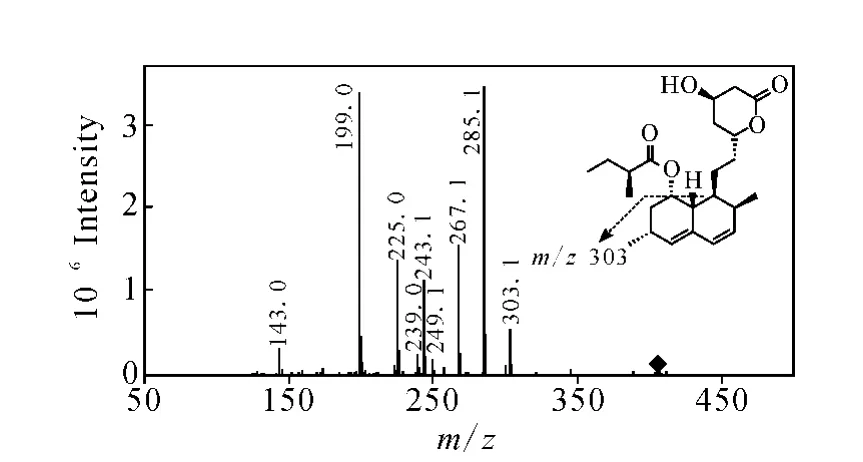
图3 洛伐他汀 m/z 405[M+H]+的二级质谱图Fig.3 MS2 spectrum of[M+H]+ion at m/z 405 of lovastatin
辛伐他汀和洛伐他汀结构相近,差别仅在于去氢萘环上C-8位取代基不同,是相差1个亚甲基的同系物。在一级全扫描质谱中可以检测到响应较高的准分子离子峰[M+H]+和加合离子峰[M+Na]+,且后者的响应强度大于前者,这与结构中含有的酯键官能团易与钠离子形成加合离子有关。对辛伐他汀和洛伐他汀进行一级全扫描质谱分析,检测到准分子离子峰[M+H]+m/z419和m/z405,对它们进行二级全扫描质谱分析,二者产生的碎片离子类型相同,分别为m/z303、285、267、249、243、239、225、199,且各碎片离子的丰度基本相同,说明二者裂解方式一致,示于图2和图3。辛伐他汀与洛伐他汀均生成m/z303的碎片离子,说明m/z303是二者结构中相同的部分,脱去的碎片应为它们结构中不同的部分。结合Mass Frontier 3.0软件分析,推测m/z303是脱去C-8位取代基后生成的碎片离子,断裂方式为C-8位取代基的氧原子质子化后,电荷诱导C—O单键断裂脱去C-8位取代基。对辛伐他汀和洛伐他汀二级质谱中产生的碎片离子m/z303进行三级全扫描质谱分析,得到的主要碎片离子有m/z285、267、249、243、239、225、199,与辛伐他汀和洛伐他汀的准分子离子m/z419和m/z405二级质谱中的碎片离子基本相同,推测二级质谱中的这些碎片离子是由m/z303进一步断裂产生,示于图4。在m/z303的三级质谱中,产物离子m/z285与前体离子m/z303相比减少了18 u,结合Mass Frontier 3.0软件分析,推测是内酯环上3’位羟基与4’位 H脱去一分子 H2O形成的碎片离子。产物离子m/z243与前体离子m/z303相比减少了60 u,推测为内酯环的氧原子质子化诱导5’位C—O键断裂,同时发生麦式重排,脱去一分子CH3COOH而生成[5]。对二级质谱中产生的m/z285碎片离子进行三级全扫描质谱分析,得到的碎片离子主要有m/z267、249、239、225,推测二级质谱中的碎片离子可以由m/z285进一步断裂生成,示于图5。产物离子m/z267与前体离子m/z285相比减少了18 u,推测有两种脱水方式:1)内酯环的氧原子质子化诱导酯键断裂;2)羰基氧原子质子化后与3’位 H脱水。由1)能进一步推断出碎片离子m/z239、225,由2)能进一步推断出碎片离子m/z239、249。对二级质谱中产生的碎片离子m/z267进行三级全扫描质谱分析,得到的碎片离子主要有m/z249、239、225,且碎片离子的丰度高 ,示于图 6。因此推测1)为前体离子m/z285裂解生成产物离子m/z267的主要途径,同时这种方式与文献[5]中环酯的优势裂解方式一致。产物离子m/z249与前体离子m/z267相比减少了18 u,推测为脱去一分子H2O形成的碎片离子。产物离子m/z239与前体离子m/z267相比减少了28 u,推测为脱去一分子CO形成的碎片离子。对二级质谱中产生的m/z243碎片离子进行三级全扫描质谱分析,得到的碎片离子主要是m/z225和m/z199,推测二级质谱中的碎片离子可以由m/z243进一步断裂产生。由于m/z267和m/z243的三级质谱中均能产生m/z225,推测该碎片离子有两种结构,分别为前体离子m/z267脱去CH2=C=O或前体离子m/z243脱去一分子 H2O生成,示于图7。产物离子m/z199与前体离子m/z243相比减少了44 u,推测是发生烯丙基裂解脱去 CH3CHO形成的碎片离子[6-7]。辛伐他汀和洛伐他汀可能的裂解途径示于图8。

图4 辛伐他汀和洛伐他汀二级碎片离子m/z 303的三级质谱图Fig.4 MS3 spectrum of the fragment ions at m/z 303 ion of simvastatin and lovastatin
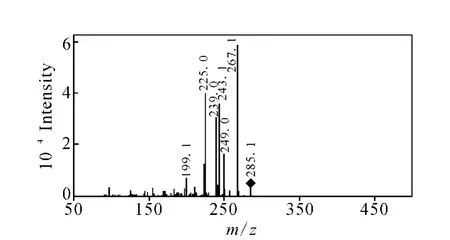
图5 辛伐他汀和洛伐他汀二级碎片离子m/z 285的三级质谱图Fig.5 MS3 spectrum of the fragment ions at m/z 285 of simvastatin and lovastatin

图6 辛伐他汀和洛伐他汀二级碎片离子m/z 267的三级质谱图Fig.6 MS3 spectrum of the fragmen t ions at m/z 267 of simvastatin and lovastatin
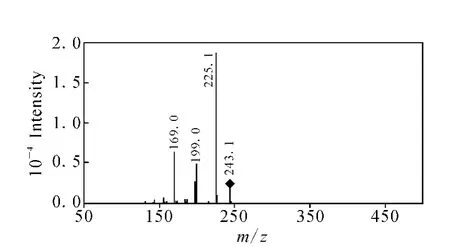
图7 辛伐他汀和洛伐他汀二级碎片离子m/z 243的三级质谱图Fig.7 MS3 spectrum of the fragment ions at m/z 243 of simvastatin and lovastatin
2.2 第二类药物的质谱分析
普伐他汀、阿托伐他汀、氟伐他汀和瑞舒伐他汀均具有β,δ-二羟基戊酸结构:普伐他汀和阿托伐他汀是由乙基相连,氟伐他汀和瑞舒伐他汀是由乙烯基相连,普伐他汀、阿托伐他汀与氟伐他汀、瑞舒伐他汀的质谱断裂行为有差异。
2.2.1 普伐他汀的质谱分析 对普伐他汀在负离子模式下进行一级全扫描质谱分析,检测到准分子离子峰[M-H]-m/z423。对准分子离子m/z423进行二级全扫描质谱分析,得到主要的碎片离子为m/z321和m/z303,其中产物离子m/z321与前体离子m/z423相比减少了102 u,推测为脱去C-8位的酯基取代基形成的碎片离子,示于图9。产物离子m/z303与前体离子m/z423相比减少了120 u,推测是脱去C-8位的酯基取代基和一分子 H2O形成的碎片离子。虽然普伐他汀结构中有多个羟基,但由于6位OH和7位H脱去一分子 H2O后能形成一个稳定的共轭体系,推测其为主要脱水方式。对二级质谱中产生的m/z303碎片离子进行三级全扫描质谱分析,得到的主要碎片离子有m/z285、199、143,示于图 10。产物离子m/z285 与前体离子m/z303相比减少了18 u,推测是脱去一分子 H2O形成的碎片离子。产物离子m/z199与前体离子m/z303相比减少了104 u,推测是5’位发生α-羟基异裂,脱去3-羟基-1,4-丁內酯和H2生成。产物离子m/z143与前体离子m/z303相比减少了160 u,推测为脱去3,5-二羟基-1,7-庚内酯形成的碎片离子。

图8 辛伐他汀和洛伐他汀可能的裂解途径Fig.8 The proposed fragmentation pathways of simvastatin and lovastatin
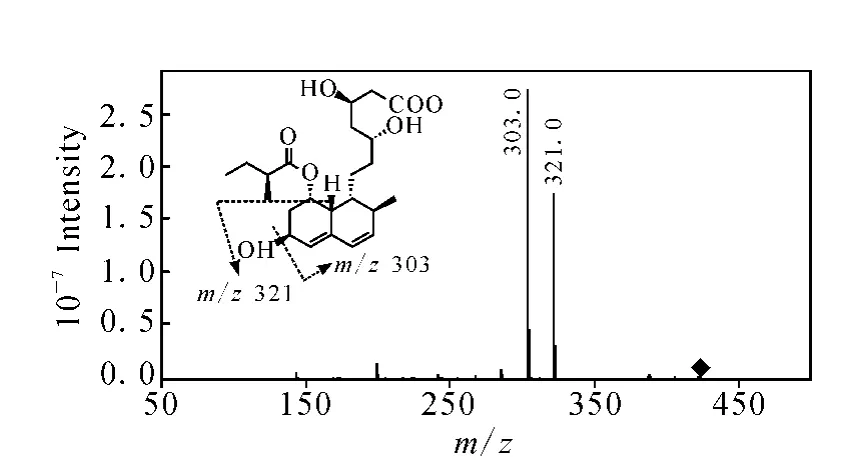
图9 普伐他汀 m/z 423[M-H]-的二级质谱图Fig.9 MS2 spectrum of[M-H]-ion at m/z 423 of pravastatin

图10 普伐他汀二级碎片离子m/z 303的三级质谱图Fig.10 MS3 spectrum of the fragment ion at m/z 303 of pravastatin
2.2.2 阿托伐他汀的质谱分析 对阿托伐他汀在负离子模式下进行一级全扫描质谱分析,检测到准分子离子峰[M-H]-m/z557。对准分子离子m/z557进行二级全扫描质谱分析,检测到主要的碎片离子为m/z521、479、453、397,示于图11。产物离子m/z521与前体离子m/z557相比减少了36 u,推测为β,δ-二羟基戊酸侧链中2个羟基脱水形成的碎片离子。产物离子m/z453与前体离子m/z557相比减少了104 u,结合Mass Frontier 3.0软件分析,推测断裂方式与普伐他汀二级碎片离子m/z303生成碎片离子m/z199的断裂方式相同。产物离子m/z397与前体离子m/z557相比减少了160 u,推测为脱去3,5-二羟基-1,7-庚内酯形成的碎片离子,此种断裂方式与普伐他汀二级碎片离子m/z303生成m/z143的断裂方式相同。

图11 阿托伐他汀m/z 557[M-H]-的二级质谱图Fig.11 MS2 spectrum of[M-H]-ion at m/z 557 of atorvastatin
2.2.3 氟伐他汀的质谱分析 对氟伐他汀在负离子模式下进行一级全扫描质谱分析,得到准分子离子峰[M-H]-m/z410。对氟伐他汀准分子离子m/z410进行二级全扫描质谱分析,示于图12,得到的碎片离子为m/z348和m/z322。产物离子m/z348与前体离子m/z410相比减少了62 u,结合Mass Frontier 3.0软件分析,推测是脱去一分子CO2,同时5’位羟基与4’位H脱水生成。产物离子m/z322与前体离子m/z410相比减少了88 u,推测是3’位发生电荷诱导的α-OH异裂脱去一分子 CO2和CH2=CH-OH生成[8]。对二级质谱中产生的m/z348碎片离子进行三级全扫描质谱分析,得到的主要碎片离子是m/z328、306、252、210,示于图13。产物离子m/z328与前体离子m/z348相比减少了20 u,推测为脱去一分子HF形成的碎片离子。产物离子m/z306与前体离子m/z348相比减少了42 u,推测断裂途径有两种:1)吲哚环的N-C单键断裂,脱去CH2=CHCH3;2)共轭烯键转移,发生烯醇式互变,电荷诱导羰基发生α-裂解脱去CH2=C=O[7]。产物离子m/z252与前体离子m/z348相比减少了96 u,推测为脱去环已烯-3-酮得到的碎片离子。产物离子m/z210与前体离子m/z348相比减少了138 u,推测为吲哚环C-N单键断裂脱去42 u(CH2=CH-CH3),同时脱去96 u(环已烯-3-酮)形成的碎片离子。氟伐他汀m/z306和m/z252可能的裂解途径示于图14。
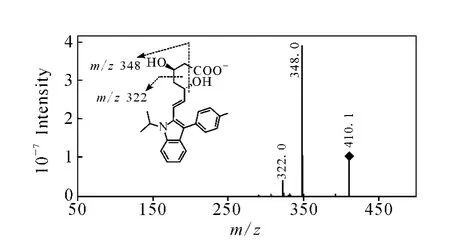
图12 氟伐他汀 m/z 410[M-H]-的二级质谱图Fig.12 MS2 spectrum of[M-H]-ion m/z 410 of fluvastatin

图13 氟伐他汀二级碎片离子m/z 348的三级质谱图Fig.13 MS3 spectrum of the fragment ion at m/z 348 of fluvastatin
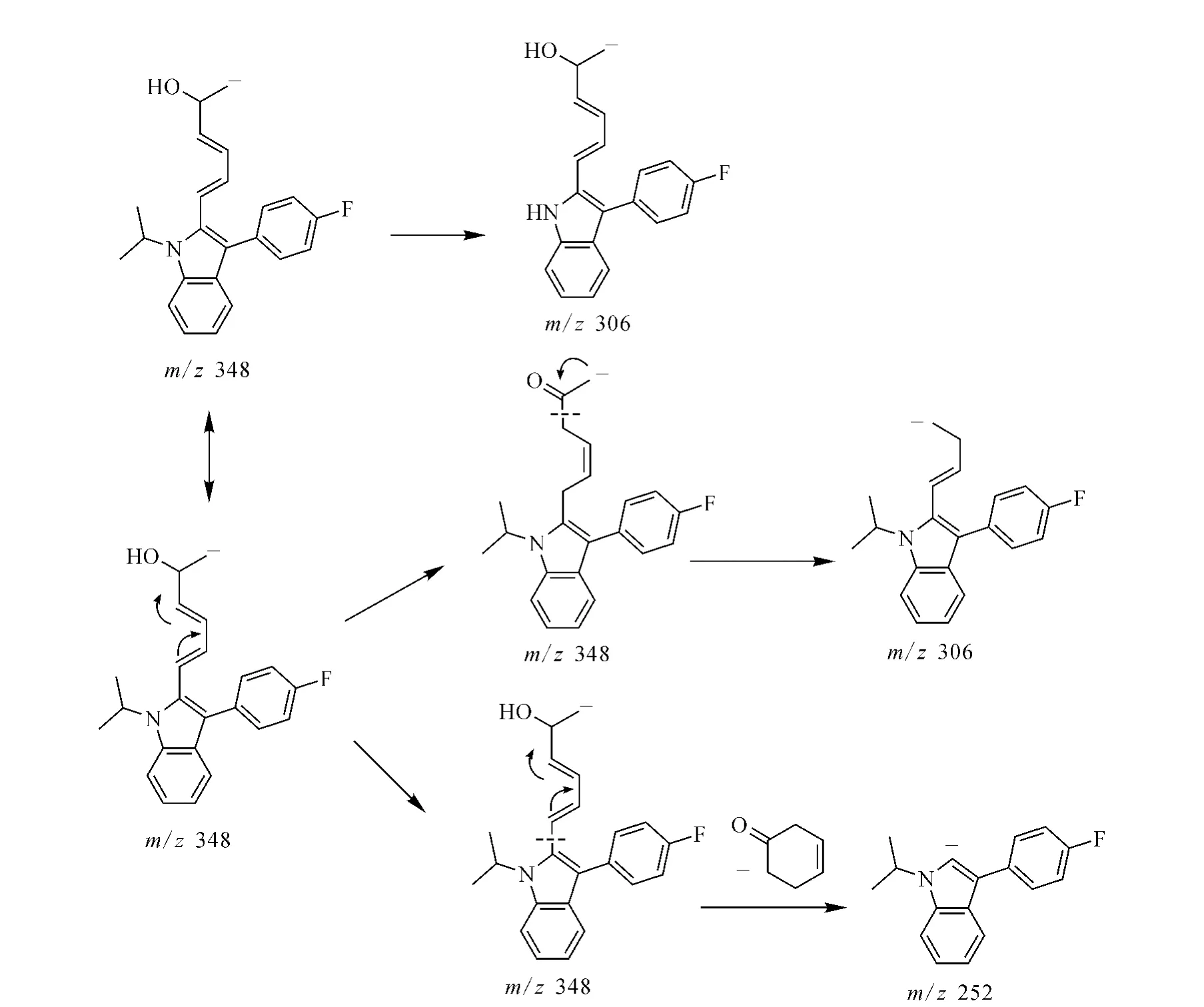
图14 氟伐他汀m/z 306和m/z 252可能的裂解途径Fig.14 The proposed fragmentation pathways of m/z 306 and m/z 252 ions of fluvastatin
2.2.4 瑞舒伐他汀的质谱分析 对瑞舒伐他汀在负离子模式下进行一级全扫描质谱分析,检测到准分子离子峰[M-H]-m/z480。对准分子离子m/z480进行二级全扫描质谱分析,得到主要的碎片离子为m/z418,示于图15。产物离子m/z418与前体离子m/z480相比减少了62 u,结合M ass Frontier 3.0软件分析,推测为脱去一分子CO2和一分子 H2O得到的碎片离子,此种断裂方式与氟伐他汀准分子离子m/z410断裂生成二级碎片离子m/z348相同。对二级质谱中产生的m/z418碎片离子进行三级全扫描质谱分析,检测到主要的碎片离子为m/z398、376、340、322,示于图 16。其中前体离子m/z418断裂生成产物离子m/z398、322的方式与氟伐他汀前体离子m/z348生成产物离子m/z328、252相同,即分别脱去一分子 HF和环已烯-3-酮(96 u)。产物离子m/z376与前体离子m/z418相比减少了42 u,推测与氟伐他汀前体离子m/z348生成产物离子m/z306的断裂方式2)相同。产物离子m/z340与前体离子m/z418相比减少了78 u,推测是甲基磺酰胺的N-S键断裂脱去SO2CH2生成。
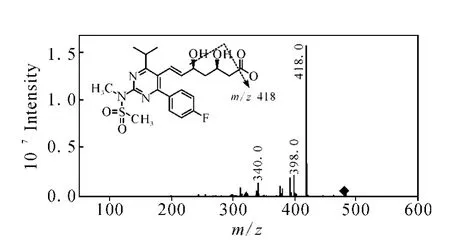
图15 瑞舒伐他汀 m/z 480[M-H]-二级质谱图Fig.15 MS2 spectrum of[M-H]-ion at m/z 480 of rosuvastatin
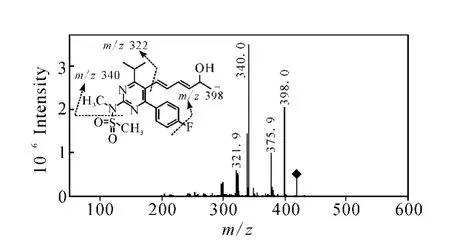
图16 瑞舒伐他汀二级碎片离子m/z 418的三级质谱图Fig.16 MS3 spectrum of the fragmen t ion at m/z 418 of rosuvastatin
3 结论
对辛伐他汀、洛伐他汀、普伐他汀、阿托伐他汀、氟伐他汀和瑞舒伐他汀6种降脂药物进行电喷雾多级质谱分析,根据主要药效基团的存在形式不同分两类解析。第一类以非活性内酯环形式存在的辛伐他汀和洛伐他汀在正离子检测方式下发生电荷诱导β,δ-二羟基戊内酯开环断裂,通过麦式重排生成中性丢失60 u(CH3COOH)的碎片离子;同时产生中性丢失18 u(H2O)、28 u(CO)的碎片离子。第二类药物中具有由乙基连接的β,δ-二羟基戊酸侧链的普伐他汀和阿托伐他汀在负离子检测方式下发生α-羟基异裂,产生脱去104 u(3-羟基-1,4-丁內酯和 H2)和脱去160 u(3,5-二羟基-1,7-庚内酯)的碎片离子;具有由乙烯基连接的β,δ-二羟基戊酸侧链的氟伐他汀和瑞舒伐他汀,生成丢失62 u(CO2和H2O)的碎片离子,对该二级碎片离子进行三级全扫描质谱分析,得到通过共轭烯键转移发生酮式-烯醇式互变,电荷诱导羰基发生α-裂解生成脱去42 u(CH2=C=O)的碎片离子;产生脱去96 u(环已烯-3-酮)、20 u(HF)的碎片离子。这些质谱特征有助于他汀类药物的结构分析和鉴定。
[1]谭志荣,张 利,周宏灏.生物样品中他汀类降脂药检测方法的研究进展[J].中国新药杂志,2007,16(12):917-921.
[2]封宇飞,雷 静,吕俊玲,等.新型降脂药-罗伐他汀[J].中国临床药理学杂志,2004,20(3):234-236.
[3]N IROGIR,MUD IGONDA K,KAND IKERE V.Chromatography mass spectrometry methods for the quantitation of statins in biological samples[J].Journal of Pharmaceutical and Biomedical A-nalysis,2007,44:379-387.
[4]董亚琳,董卫华.他汀类药物的研究进展[J].中国新药杂志,2003,12(3):175-178.
[5]DONOVAN T,BRODBEL T J.Characterization of the dissociation behavio r of gas-phase p rotonated and methylated lactones[J].American Society for Mass Spectrometry,1992,3:47-59.
[6]WANG H,WU Y,ZHAO Z.Fragmentation study of simvastatin and lovastatin using electrosp ray ionization tandem mass spectrometry[J].Journal of Mass Spectrometry,2001,36:58-70.
[7]黄珺珺,黄碧云,季 红,等.莫那可林J的电喷雾质谱裂解规律研究(MS1~MS6)[J].质谱学报,2009,30(3):154-159.
[8]W HEELAN P,ZIRROLL IJ A,MURPHY R C.Negative ion electrosp ray tandem mass spectrometric structural characterization of Leuko triene B4(L TB4)and L TB4-derived metabolites[J].American Society for Mass Spectrometry,1996,7:129-139.
Analysis of Six Statins by Electrospray Ion Trap Mass Spectrometry
WANG Yang,GAO Li-ying,WU Yan-ping,SUN Lu
(Shenying Pharm aceutica l University,Shenyang 110016,China)
To investigate the fragmentation mechanism of statins,six statins w ere studied by electrosp ray ionization-ion trap mass spectrometry(ESI-M Sn).Based on the form sof the main pharmacophore,the samples were analyzed into two groups.The first group,including simvastatin and lovastatin,which were detected in positive ion mode.It is indicated that most fragments are produced after neutral loss processes such as elimination of 18 u(H2O),28 u(CO)and 60 u(CH3COOH)follow ing the ring opening of the lactone.The second goup including pravastatin,atorvastatin,fluvastatin and rosuvastatin were invesgated in negative ionmode.It isobserved that the main fragmentsare derived from neutral losses of 104 u(3-hydroxy-1,4-butyrolactone and H2)and 160 u(3,5-dihydroxy-1,7-hep talactone)of pravastatin and ato rvastatin.While losses of 62 u(CO2and H2O)of fluvastatin and rosuvastatin are detected.And further losses of 42 u(CH2=C=O)and 96 u(cyclohexen-3-one)are observed in M S3.These characteristics can be used for future structural analysis and identification in studies of statins and analogue compounds.
statins;multi-stage mass spectrometry analysis;fragmentation rules
孙 璐(1974~),女(汉族),辽宁人,博士,副教授,从事药物代谢和药物动力学研究。E-mail:lisunlu@126.com
O 657.63
A
1004-2997(2010)06-0368-08
2009-12-27;
2010-02-04
王 杨(1984~),女(满族),内蒙古人,硕士研究生,分析化学专业。E-mail:jerrismile@163.com

