HPLC-MS/MS法分析大鼠体内淫羊藿素葡糖醛酸结合物
刘海培,孟繁华,郭继芬,司端运,朱晓薇,赵毅民
(1.军事医学科学院毒物药物研究所,北京 100850;2.天津中医药大学,天津 300193;3.天津药物研究院,天津 300193)
HPLC-MS/MS法分析大鼠体内淫羊藿素葡糖醛酸结合物
刘海培1,2,孟繁华1,郭继芬1,司端运3,朱晓薇2,赵毅民1
(1.军事医学科学院毒物药物研究所,北京 100850;2.天津中医药大学,天津 300193;3.天津药物研究院,天津 300193)
应用高效液相色谱-串联质谱(HPLC-MS/MS)法鉴别大鼠血浆及尿粪中淫羊藿素葡糖醛酸结合物。生物样品经固相萃取法处理后,以V(乙腈)∶V(水)∶V(乙酸)=45∶55∶1.5为流动相,通过Dikma C18柱分离,采用电喷雾离子四极杆串联质谱在负离子检测方式下进行一级和二级全扫描质谱分析。通过提高离子源内的DP电压,使待测物发生源内裂解产生碎片离子,再对产生的碎片离子进行子离子扫描,可获得相当于三级质谱分析的结果。根据待测物的色谱和质谱信息,发现淫羊藿素在大鼠体内可代谢为1种双葡糖醛酸结合物M 1和2种单葡糖醛酸结合物M 2、M 3。大鼠灌胃给予淫羊藿素后,在血浆和尿样中可检测到M 1、M 2和M 3,在粪便中仅检测到M 2和M 3。
高效液相色谱-串联质谱(HPLC-M S/M S);淫羊藿素;葡糖醛酸结合物;代谢产物
淫羊藿素(icaritin,ICT)为来源于小檗科(Berberidaceae)淫羊藿属(Epimedium)植物的一种黄酮类成分,也可由淫羊藿苷经纤维素酶水解得到,能明显降低黑色素的浓度[1],且具有促进MCF27细胞和T47D细胞增殖的雌激素样作用[2],其结构示于图1。为了了解淫羊藿素的体内过程,我们已建立了 HPLC-MS/M S法[3]测定血浆样品中淫羊藿素的浓度,并将此方法应用到药代动力学研究中。灌胃给予大鼠80 mg·kg-1淫羊藿素后,血浆中结合型淫羊藿素的Cmax和AUC0-∞分别约为原形的44倍和23倍,提示淫羊藿素在大鼠体内主要以结合物形式存在。在上述研究的基础上,本工作采用高效液相色谱-串联质谱(HPLC-MS/M S)法对淫羊藿素在大鼠血浆、尿、粪中的代谢产物进行分析,发现淫羊藿素在大鼠体内可代谢为1种双葡糖醛酸结合物M 1和2种单葡糖醛酸结合物M 2、M 3。

图1 淫羊藿素的结构Fig.1 Structure of icaritin
1 实验部分
1.1 仪器
API3000液相色谱-串联质谱仪:美国 AB公司产品,配有 Turbo Ionsp ray离子化源;Agilent 1100四元梯度泵和自动进样器:美国安捷伦公司产品。
1.2 试剂和材料
淫羊藿素对照品(99.9%):由天津药物研究院提供;抗坏血酸(分析纯):购自北京化学试剂公司;乙腈(色谱纯):购自美国 Sigma公司;乙酸(色谱纯):购自美国 Tedia公司;甲醇(色谱纯):购自美国Fisher公司;Bakerbond固相萃取柱(C18,100 mg/1 mL):购自美国Baker公司。
1.3 试验条件
1.3.1 色谱条件 Dikma C18柱(200 mm×4.6 mm×5μm):美国 Dikma公司产品;C18保护柱(4 mm×3.0 mm):美国 Phenomenx公司产品;流动相为V(乙腈)∶V(水)∶V(乙酸)=45∶55∶1.5;流速 0.6 mL ·min-1;进样量 50 μL;柱温25 ℃。
1.3.2 质谱条件 电喷雾离子源,负离子检测,喷射电压-4 000 V,源温度400℃,雾化气为6 unit,卷帘气为11 unit,碰撞气为7 unit,采用一级和二级全扫描质谱法分析。
1.4 样品处理
取200μL生物样品(血、尿、粪),50μL 2.5 g·L-1抗坏血酸溶液和100μL磷酸二氢铵缓冲溶液(p H 3.99),加入200μL纯净水,涡流3 min,离心 10 min(9 500 r·min-1),取上清液至已活化好的 SPE C18柱,先用2×1 m L水冲洗,再用2×1 m L甲醇洗脱,将甲醇洗脱液于40℃下空气吹干。残余物用150μL流动相溶解后,吸取50μL进行 HPLC-M S/M S分析。
2 结果与讨论
负离子检测模式下,在大鼠灌胃给药后的血样和尿样一级全扫描色谱图上均可检测到1个准分子离子m/z737(M 1)和2个准分子离子m/z561(M 2和M 3)的色谱峰。在粪样的一级色谱图上检测到2个准分子离子m/z561(M 2和M 3)的色谱峰。M 1的相对分子质量比原形药物多2×176 u,M 2和M 3的相对分子质量比原形药物均多 176 u。色谱保留时间顺序为tR(M 1)<tR(M 2)<tR(M 3)<tR(icaritin)。初步推测 M 1为淫羊藿素的双葡糖醛酸结合物,M 2和M 3为淫羊藿素的单葡糖醛酸结合物。
对m/z737(M 1)和m/z561(M 2和 M 3)继续进行二级质谱分析,相应的二级全扫描色谱图和质谱图示于图2和图3。在M 1的二级质谱图中,有基峰为m/z737脱去一分子葡糖醛酸(176 u)后的m/z561,还有脱去二分子葡糖醛酸后的m/z385,以及葡糖醛酸离子m/z175和m/z113。m/z385与淫羊藿素在负离子模式下的准分子离子相同。有文献[4-5]报道,在负离子模式下,碎片离子m/z175和其脱去一分子水和一分子二氧化碳后的m/z113可以作为确定药物葡糖醛酸结合物的直接证据,据此推定M 1为淫羊藿素的双葡糖醛酸结合物。在M 2和M 3的二级质谱图中,基峰均为m/z561脱去一分子葡糖醛酸后的m/z385,另外还均有m/z175和m/z113离子,因此推定M 2和M 3为淫羊藿素的单葡糖醛酸结合物。
为进一步证明M 1、M 2和M 3的二级质谱中所产生的碎片离子m/z385为原形药物淫羊藿素的碎片离子,还需对其进行下一级质谱分析。但由于三重四极杆质谱仪只能进行二级质谱分析,因此通过将离子源内的DP电压由70 V提高到160 V,使M 1、M 2和M 3在离子源内裂解产生m/z385碎片,然后使m/z385在第2个四极杆(即碰撞室)中发生碰撞诱导裂解,获得相当于三级质谱分析的结果。在淫羊藿素对照品的二级质谱图中发现,淫羊藿素脱去B环3’位甲基后的m/z370、脱去C环8位2-羟基-2-甲基丙基后的m/z311、脱去B环3’位甲基和C环8位2-羟基-2-甲基丙基后的m/z297等碎片离子。将M 1、M 2和M 3的三级质谱图与淫羊藿素对照品的二级质谱图进行比较,发现它们具有相同的质谱裂解特征,示于图4,因此进一步证明了M 1、M 2和M 3是淫羊藿素的葡糖醛酸结合物。M 2和M 3具有相同的相对分子质量和质谱裂解碎片,但色谱保留时间不同,说明M 2和M 3为同分异构体。

图2 灌胃给予大鼠淫羊藿素后尿样中M 1、M 2和M 3的二级全扫描色谱图a.空白尿样;b.灌胃给予80 mg·kg-1淫羊藿素后的大鼠尿样Fig.2 Product ion scan chromatograms spectra of M 1,M 2 and M 3 in rat urine after oral administration a.blank urine sample;b.urine sample obtained after oral administration of 80 mg·kg-1 icaritin
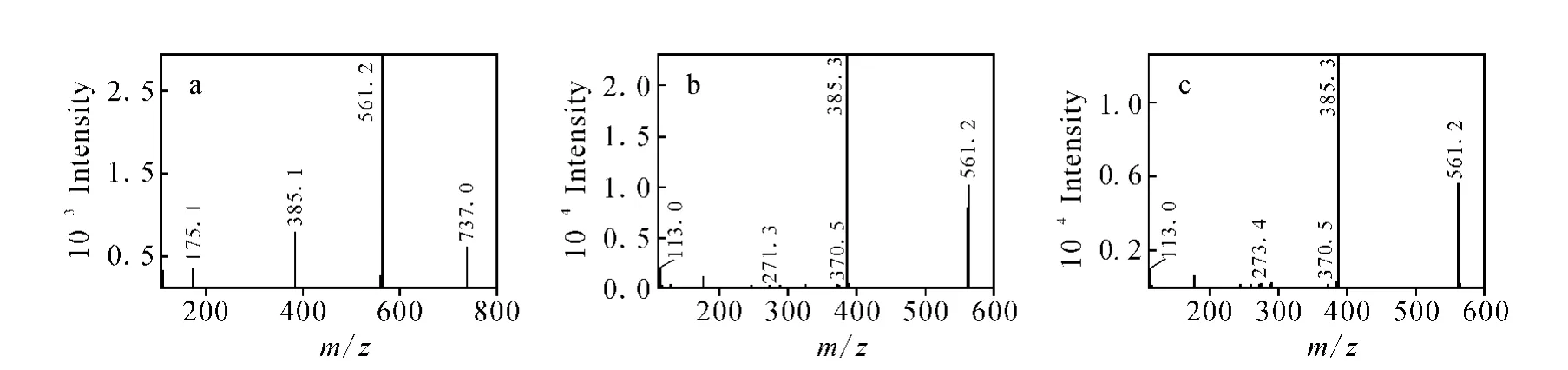
图3 M 1、M 2和M 3的二级全扫描质谱图Fig.3 Product ion scan spectra of M 1,M 2 and M 3

图4 淫羊藿素的二级质谱图及代谢物的三级质谱图a.淫羊藿素的二级质谱图;b.M 1的三级质谱图;c.M 2和M 3的三级质谱图Fig.4 product ion scan spectra of icaritin and full scan MS3 spectra of con jugates a.product ion scan spectrum of icaritin;b.MS3 spectrum of M 1;c.MS3 spectrum of M 2 and M 3
鉴于不易得到葡糖醛酸结合物对照品,我们只能依靠质谱信息对M 1、M 2和M 3的化学结构进行推测。淫羊藿素结构中含有4个羟基,其中包括3个酚羟基(黄酮母核的 3,5,7位)和1个醇羟基。据文献[6]报道,酚羟基较醇羟基的反应活性强,而黄酮类化合物的酚羟基反应顺序通常为7位>3位>5位。因此推测M 1为淫羊藿素的3,7位羟基与葡糖醛酸结合而成的代谢产物;M 2和M 3为淫羊藿素的3,7位羟基分别与葡糖醛酸结合而成的代谢产物,但具体结合位点还有待进一步研究。
[1]PARK J S,PARK H Y,RHO H,et al.Statistically designed enzymatic hydrolysis for op timized production of icariside IIas a novel melanogenesis inhibito r[J].J Microbiol Biotechnol,2008,18(1):110-117.
[2]叶海涌,刘 健,楼宜嘉.淫羊藿苷衍生物的制备及其雌激素样作用研究[J].浙江大学学报,2005,34(2):131-136.
[3]刘海培,孟繁华,郭继芬,等.高效液相色谱-串联质谱法测定大鼠血浆中淫羊藿素[J].药学学报,2009,44(10):1 140-1 144.
[4]王 玲,王英武,陈 刚,等.电喷雾-串联四极杆-飞行时间质谱法测定药物的葡萄糖醛酸结合物[J].质谱学报,2002,23(2):93-95.
[5]邢 杰,陈笑艳,张淑秋,等.液相色谱-电喷雾离子阱质谱法分析大鼠尿样中的黄芩苷及其异构体[J].质谱学报,2004,25(3):129-133.
[6]MOHAM ED B,STÉPHANE L,AZIZ A,et al.Hemisynthesis of all the O-monomethylated analogues of quercetin including the major metabolites,through selective p rotection of phenolic functions[J].Tetrahedron 2002,58:10 001-10 009.
Analysis of Glucuronide Conjugates of Icaritin in Rat by LC-MS/MS
L IU Hai-pei1,2,M ENG Fan-hua1,GUO Ji-fen1,SIDuan-yun3,ZHU Xiao-wei2,ZHAO Yi-m in1
(1.Institute of Pharmacology and Toxicology,Academy of Military Sciences,Beijing 100850,China;2.Tianjin University of Traditiona l Chinese Medicine,Tianjin 300193,China;3.Tianjin Institute of Pharmaceutical Research,Tianjin 300193,China)
The glucuronide conjugates of icaritin in rat plasma,urine and feces were analyzed by high performance liquid chromatography-tandem mass spectrometry(HPLC-M S/MS).Samples were extracted using C18solid-phase extraction cartridges,and then separated on a Dikma C18column.Themobile phase was consisted ofV(acetonitrile)∶V(water)∶V(acetic acid)=45∶55∶1.5.Electrosp ray ionization(ESI)source was app lied.Full scan and second stagemass scan were performed in the negative ion mode.According to the chromatography and MS data,a di-glucuronide conjugate(M 1)and two mon-glucuronide conjugates(M 2 and M 3)of icaritin are identified in rat.M 1,M 2 and M 3 can be detected in plasma and urine,while M 2 and M 3 can be found in feces after oral administration of icaritin to rat.
high performance liquid chromatographic-tandem mass spectrometry(HPLCM S/M S);icaritin;glucuronide conjugate;metabolite
郭继芬,女(汉族),内蒙林西人,副研究员,药物分析专业。E-mail:guojifen@sohu.com
O 657.63
A
1004-2997(2010)06-0376-04
2009-12-31;
2010-06-13
国家自然科学基金(81001468)资助
刘海培(1983~),女(汉族),河北衡水人,硕士研究生,药物分析专业。E-mail:liuhaipei2007@163.com

