液相色谱-质谱联用技术在中药农药残留分析中的应用进展
陈丽娜,宋凤瑞,刘志强
(1.中国科学院长春应用化学研究所,长春质谱中心,吉林长春 130022;2.中国科学院研究生院,北京 100049)
液相色谱-质谱联用技术在中药农药残留分析中的应用进展
陈丽娜1,2,宋凤瑞1,刘志强1
(1.中国科学院长春应用化学研究所,长春质谱中心,吉林长春 130022;2.中国科学院研究生院,北京 100049)
液相色谱-质谱联用(LC-M S/MS)技术在农药残留分析领域的研究已经显示出极大的发展潜力。本文阐述LC-MS/MS法在农残分析中的研究进展,特别强调了该技术在中药农残分析中的应用现状和发展前景。由于样品前处理是农残分析中耗时最多、最易引起误差的关键环节,本文也讨论了最近发展和广泛应用的前处理技术,分析了不同方法的特点,从而为我国中药行业在农药残留方面的监测工作提供参考。
中药材;农药残留;液相色谱-质谱联用(LC-MS/MS);前处理
农药残留是指农药使用后残存于生物体,农副产品和环境中的农药原体、有毒代谢物、降解物和杂质的总称。农药的发明和使用在提高农作物产量的同时,也带来了很多负面作用。
中药由于疗效确切、副作用小,越来越受到人们的青睐。但由于我国在制定植物药农残检验方法和质量标准方面起步较晚,严重制约了对农药残留的有效监控。而许多国家都增加了农残检验项目,特别是欧美发达国家对药用植物的农药残留检验一般是参照食品标准进行的,对中药农药残留限量提出了较高的要求。由于缺少与国际接轨的质量标准,常使得我国在中药材贸易中处于不利地位。因此,建立一种准确、灵敏、可靠的中药农药残留分析方法十分迫切。
目前,我国在中药农残检测方面仍以气相色谱(GC)为主,液相色谱(LC)由于灵敏度低应用相对较少。而在世界范围内,色质联用技术已成为主导检测技术,并实现了一次进样分析上百种农药,极大减少了分析时间,降低了检测费用。GC/M S和LC-M S/M S是两种应用最多的色质联用技术。A lder等[1]对500种农药的 GC/M S和LC-M S/M S数据进行考察,通过比较最低检测限、检测范围和选择性,证明LC-MS/M S比GC/M S具有更好的分析性能和更宽的适用范围。Hiem stra等[2]也证明M S/M S的多反应监测模式(M RM)是抑制基质干扰,显著提高检测器灵敏度和选择性的主要原因。GC虽然也可以与MS/M S联用,但是由于没有合适的软电离源,不能产生足够强度的分子离子峰,应用前景尚不明朗。目前,LC-M S/M S在食品、环境等领域的农残分析中已得到广泛应用[3-7],并有相关综述报道[8-10]。然而,LC-M S/M S法在中药农残分析中的报道却很少[11-12]。
此外,前处理技术落后也是制约中药农残分析方法发展的重要因素。传统的提取、净化方法存在溶剂消耗量大、操作过程繁琐、分析周期长、回收率低等缺点,一些其他领域较为先进的前处理技术不能套用进来。Hajou等[13]以两种AOAC方法为指导,分析中药茴香中有机氯、有机磷、拟除虫菊酯等农药,认为一般的农药多残留前处理方法不能无条件的应用于特定中药,但是两种以上方法可以实现准确定量。然而,这无疑又增加了实验的工作量和成本,与农残分析的发展趋势背道而驰。
本文将论述LC-M S/M S法在农残分析中的优势和不足,综述它在中药农残分析中的应用现状,研究与其联用的样品前处理技术,通过与环境、食品等领域的农残分析做对比,展望LCM S/MS法与各种前处理方法在中药农残分析中的发展趋势和应用前景。
1 前处理方法研究
随着选择性好、分辨率高的检测技术的快速发展,农药多残留检测工作逐渐简化,而前处理过程成为分析方法的关键。对于中药,其成分的特殊性和复杂性对前处理的要求更为严格,因此,建立一种最大限度提取目标物并把干扰降到最低的样品前处理技术是快速、准确的中药农药多残留检测体系成立的前提和保障。近年来,国内外对环境、食品等领域的农药残留前处理技术的研究,特别是对农药多残留分析方法的研究取得了较大的进展[14-49],而这些方法在中药农药残留分析方面的应用还处于探索阶段。
1.1 溶剂提取
溶剂提取(SE)是最常用、最经典的有机物提取方法,具有操作简单、不需要特殊的或昂贵的仪器设备、适应范围广等优点。其原理是根据残留农药与样品组分在不同溶剂中的溶解性差异,通过振荡、捣碎、回流或超声等方式将分析物从样品基质中提取出来。目前多残留分析常用的提取溶剂有乙腈,丙酮,乙酸乙酯等。
乙腈、丙酮是极性溶剂,与水互溶,在提取过程中不会发生相分离,且具有很好的分散性,可以有效的提取极性和非极性农药。但是丙酮在提取农药时会大量提取植物组织中的油脂和色素,使净化过程变得复杂。而乙腈的选择性则较好,它可以显著降低对非极性脂肪、蛋白质、盐、糖等杂质的溶解性,对于酸碱敏感的农药也易于通过调节p H等方法改善回收率[50],此外它与液质具有很好的兼容性,特别适合复杂基质中多种农药的提取,目前已被美国、日本等国家的农残检测标准所采用。乙酸乙酯极性较弱,对于含糖量高的样品较为适合[7]。但用液质分析前需转换溶剂,不但过程繁琐,更会造成大量的农药损失。M atovská等[5]讨论了6种有机溶剂在农药多残留分析中的作用,认为乙腈是多数基质的最佳提取溶剂。特别是随着节能型提取方式和LC-M S/M S检测手段的发展,乙腈的应用将会更为普遍。此外,甲醇[6]、二氯甲烷[51]等也可作为多残留分析的提取溶剂,但是应用范围相对较窄。当单一溶剂不够理想时,也可选用两种或两种以上不同极性的溶剂按一定比例配成混合提取溶剂,以达到预期效果[52]。溶剂提取存在着很多缺点,如操作繁琐、有机溶剂使用量大,既增加成本又易造成污染,给后期处理工作带来很多困难,因此建立溶剂消耗少、操作简单的微型前处理方法势在必行。
1.2 QuEChERS方法
QuEChERS是 Anastassiades等[3]在固相分散提取基础上开发的一种新型前处理方法。它以快速、简便、廉价、有效、耐用、安全的独特优势受到农药残留分析工作者的高度关注,已成为农药多残留快速检测的研究热点。QuEChERS法最初用于蔬菜和水果的预处理[4,14-15],其核心为用与水互溶的乙腈溶剂提取农药,再以氯化钠和具有更强吸水功能的无水硫酸镁诱导相分离,从而使农药进入乙腈层;然后采用PSA(N-丙基乙二胺)和 GCB(石墨化碳)吸附净化,去除脂肪酸、有机酸和色素等杂质。该方法特别适用于多类农药的多残留分析,Lehotay等[4]证实有超过200种农药可用该方法进行处理。同时,对此方法稍作修正,可用于分析果蔬、谷物、牛奶、动物饲料、橄榄油、烟草,甚至动物全血中的药物残留[16,53-60]。Leho tay等[16]用含有0.1%乙酸的乙腈提取,使一些不稳定的问题农药(杀菌丹、灭菌丹、苯氟磺胺、百菌清等)得到了较高的回收率,进一步扩大了QuEChERS法的应用范围。该方法已在世界各国得到广泛应用,2006年欧盟委员会制定了相应的SANCO操作指南。此外,纵观各国对QuECh ERS法的应用研究不难发现,QuEChERS法主要是与 GC/M S、LC-M S/M S结合,对不同基质中农药进行多残留分析,因此,它也将随着 GC/M S、LC/M S及 GC-M S/M S、LC-M S/M S的发展而在更多领域得到广泛应用。
1.3 仪器提取
样品前处理技术的发展趋势倾向于环境有好和节约能源,最佳的前处理方法应能减少操作时间和误差、提高灵敏度,从而实现准确定性定量[61]。因此仪器提取将会成为主要的提取方法。
1.3.1 超临界流体萃取 超临界流体萃取(SFE)以超临界流体为溶剂,利用其特异增加的渗透能力和溶解能力对目标成分进行提取分离,具有萃取过程易于调节、萃取效率高、能耗低、无溶剂残留等优点。最常用的超临界流体是CO2,用于提取非极性和弱极性农药。为了扩大应用范围到中等极性或极性农药,通常需要加入极性调节剂。Aguilera等[17]比较了纯CO2和以甲醇或乙酸乙酯为极性调节剂的CO2萃取食品中多种极性农药的能力,证明极性调节剂可以明显改善此类农药的回收率。此外,不同调节剂的作用也不同。Rissato等[18]以丙酮和乙腈为调节剂,研究了蜂蜜中有机磷、有机氯、氨基甲酸酯和拟除虫菊酯4类农药的SFE提取效率,证明乙腈的作用明显好于丙酮,因此认为极性调节剂的作用不仅在于改变超临界流体的极性,而且在于影响其与样品基质的相互作用。
高选择性是SFE最显著的优点之一,对于低脂肪的水果、蔬菜可直接对提取液进行检测;而对于脂肪含量高或非常复杂的基质则需要额外的净化步骤。通常有萃取后净化[18]和在线净化[19]两种。萃取后净化,即对提取液进行纯化,虽然净化效果好,但会增加提取时间和有机溶剂的用量。目前最为关注的是在线净化,即在提取的同时加入吸附剂进行净化。Aguilera等[19]考察了不同吸附剂在大米提取过程中的净化作用,证明用氨基吸附剂可以得到满意的净化效果。在线净化在选择性提取多种农药残留的过程中有着很好的应用前景,因此对不同吸附剂与基质的相互作用进行研究具有重要的意义。
此外,与SFE联用的检测技术多数为气相色谱结合不同专属性检测器[18-20],SFE-GC/M S的发展极为缓慢[21],SFE-LC/M S的应用则更少[22]。除了与方法自身因素有关外,还由于仪器设备昂贵、接触机会少、经验交流不充分所致。因此超临界流体萃取仪在实验室内的普及是此方法进一步发展的前提。
1.3.2 加速溶剂萃取 加速溶剂萃取(ASE)也称高压液相萃取或快速溶剂萃取,是采用常规溶剂在较高的温度(50~200℃)和压力(6.90×106~1.7×106Pa)下对固体、半固体样品进行萃取的样品前处理技术。其突出的优点是有机溶剂用量少、操作自动化、提取速度快、回收率高等,可用来取代索氏提取等传统的提取方法,已被美国国家环保局选定为环境样品中杀虫剂、除草剂以及多氯联苯、二噁英等污染物检测推荐的标准方法(标准方法编号EPA 3545)。
影响ASE萃取效率的主要因素是温度和压力。高温可以增加溶剂对样品的渗透力,提高萃取效率。高压既能让溶剂在高温下保持液态,又能保证易挥发性物质不挥发,同时高压还有利于溶剂快速充满萃取池,增加对样品组织的穿透能力。另一影响因素是静态提取时间,通常取决于样品的质地。此外,ASE还采用冲洗和氮气吹扫技术减少溶剂损失,通过加入分散剂来扩大提取溶剂与样品的接触面积,减少溶剂使用量。
目前,ASE已经用于各类基质中农药的提取[23-26],与质谱技术的联用更进一步推动了此技术的发展[24-26]。但是,ASE也有不足之处,如提取能力太强而导致共同提取物增加,从而使净化过程变得复杂;提取过程的高温可能导致热不稳定农药降解。总之,对ASE的探索仍然任重而道远。
1.3.3 微波萃取 微波萃取(MAE)是利用微波能强化萃取效率,使残留农药从样品机体中分离出来的技术。自1986年美国科学家 Ganzler等[62]首次用微波提取土壤中有机污染物以来,MAE就受到公众的注意。与其他提取方法相比,微波将能量直接作用于被加热物质,显著地降低了萃取所需的时间,避免了长时间高温引起的物质分解,因此特别适用于处理热敏性组分。同时,它对体系中的不同组分进行选择性加热,成为一种能使目标组分直接从基体中分离的萃取过程。此外,微波还具有萃取效率高、重现性好、快速、节能、污染小等优点,不仅降低了操作费用,而且符合环保要求,是一种全新的“绿色”萃取技术。与ASE和SFE相比,微波又克服了仪器设备复杂、成本高等缺点,因此,微波萃取显示出了良好的发展前景和巨大的应用潜力,现已广泛应用在农残分析、化工、食品、香料、中草药和化妆品等领域[27-30]。此外,与其他技术联用更推动了MAE的进步。Carvalho等[29]成功的将 MAE与 HP-SPM E联用,并结合GC/M S检测分析了沉淀物中多种有机氯类农药。
尽管微波萃取在农残分析中有很多优点,但多数研究仅局限于挥发性和半挥发性农药,而对其他类农药研究较少,特别是在多类多残留分析中几乎没有应用。此外,微波萃取不易自动化,缺少与其他仪器在线联机的可能性,如果能在仪器设计上实现突破,扩大微波萃取的应用范围,则该方法会获得更强大的生命力。
1.4 吸附提取
1.4.1 固相萃取 固相萃取(SPE)是一种用途广泛而且越来越受欢迎的样品前处理技术。其分离机制与液相色谱相同,即利用样品在吸附剂和洗脱溶剂间的作用差异来达到分离的目的。与传统的液液萃取法和层析色谱法相比,SPE具有选择性高、重复性好、操作简便快速、便于前处理自动化等优点,是目前国内外农药残留分析样品前处理的主流技术。
SPE有两种净化模式,其一是保留目标化合物模式,一般包括活化、上样、淋洗、洗脱四步,得到的样品溶液可直接用于检测,目前整个萃取过程可以完全自动化进行。但是在处理混合物时,要求被分离组分对固定相和流动相的作用相近,因此不适合极性范围太宽的多种类农药的净化。其二是杂质被保留在柱上,待测组分通过柱,样品被净化但不能富集,也不能分离保留比待测组分更弱的杂质,即净化不完全,但可通过多种小柱串联增强净化效果,并实现对保留能力范围变化较大的多组分混合物的净化[31]。
无论哪种模式,固定相的选择都是此方法的关键。根据固定相的性质可将萃取方式分为反相 (C18、C8),正相 (Flo risil、氧化铝、HLB、N H2),离子交换(SCX、SAX),混合机制(TPH、TPT)和吸附(GCB)五类。常用的洗脱溶剂有甲醇、乙酸乙酯、丙酮和乙腈等,或者它们不同比例的混合溶液。此外,洗脱流速和洗脱溶剂的p H值也不容忽视[32-33]。
固相萃取技术自开发以来得到飞速发展,相应的仪器设备层出不穷,但是我们必须看到对于理化性质范围很宽的多种组分很难选择合适的固相萃取柱和洗脱溶剂。此外,高空白值、产品性能的波动和处理的样品量有限仍是目前面临的主要问题[34]。
1.4.2 固相微萃取 固相微萃取(SPM E)是基于萃取涂层与样品之间的吸附-解吸平衡而建立起来的集萃取、浓缩、进样于一体的样品制备技术,具有操作简单、方便、样品用量小、无需有机溶剂等优点,因此它一经出现就得到迅速发展。目前已广泛用于气体、液体和固体中的挥发性、半挥发性、难挥发性物质的萃取、富集和分析,并与气相、液相色谱等检测技术实现了联用。
SPM E与 GC联用[35-37]无需接口装置,操作简单,是目前最为成熟的联机技术之一。与HPLC联用需要一个特殊的接口装置,一般采用管内固相微萃取模式(in-tube SPM E),通过溶剂解析作用实现分离。In-tube SPM E具有更大的萃取表面积和更薄的萃取相膜,富集倍数相应提高,并且易于操作自动化,不仅节省时间,而且提高了精密度和准确度[38-39]。SPM E与质谱联用技术[40-43]也正在快速地发展,不但可进行多残留分析,而且很容易降低检测限至μg甚至ng。Sakamoto等[41]采用85μm聚丙烯酸酯萃取头,顶空-固相微萃取 (HS-SPM E)方式,GC/M S方法测定水中158种农药的残留量,最低检出限达0.01μg·L-1。
SPM E技术目前在农药残留分析方面的应用已相当成功,特别是随着联用技术的发展及SPM E技术本身的发展,SPM E将会渗透到分析检测的各个领域。同时,我们可以看到,尽管目前SPM E与质谱结合还没有成为主要的检测手段,但应用前景看好,很有可能成为农残检测领域的重要角色之一。
1.4.3 基质固相分散 基质固相分散(M SPD)是在固相萃取基础上发展起来的一种可同时进行提取和分离的样品前处理技术。其主要区别在于M SPD技术可以直接处理固态、半固态和粘稠样品,而不需转化成溶液。此技术的基本原理是将试样直接与适量吸附剂研磨、混匀制成半固态物质作为填料装柱,然后选择合适的有机溶剂将各种待测物洗脱下来。为了加强净化效果,经M SPD柱的淋洗液可通过 Florisil柱进一步净化,或者在柱底填入Florisil、无水硫酸钠等,最后的流出液可直接进行色谱分析。M SPD用的吸附剂与SPE相同,吸附剂的选择主要依赖于待测组分和样品基质的性质。反相填料C8[43]和C18[63]易破坏细胞膜并将组织分散,特别适合此方法,可应用于有机氯、有机磷、拟除虫菊酯、氨基甲酸酯、吡唑类、甲氧基丙烯酸酯、苯并咪唑类、尿素等的提取。正相吸附剂Florisil[50]、NH2[64]净化效果好,但可能会引起一些农药的分解,应用范围不如反相填料广。此外,一些惰性填料的应用也越来越多[65-67]。洗脱溶剂的种类,洗脱体积,基质性质等都是优化提取条件不可忽视的因素[67]。
不难看出,M SPD特别适合多种类农药的多残留分析,而且样品处理速度快,溶剂与样品使用量少,与灵敏度高、选择性好的 GC/M S和LC-M S/M S检测方法联用已成为必然的发展方向。但是,整个萃取过程仍为人力操作,开发与GC/M S和LC-M S/M S联机操作的M SPD方法是主要的发展趋势。
1.5 凝胶渗透色谱
凝胶渗透色谱(GPC)又称体积排阻色谱,它是按溶质分子大小进行分离的一种前处理技术。对富含油脂、脂肪、蛋白质、色素等杂质的样品进行净化时,GPC是主要的净化手段[44-49]。与其他前处理方法相比,GPC具有自动化程度高、净化速度快、回收率高且稳定等特点。此外,GPC的柱填料与被分离试样没有任何相互作用,不存在不可逆吸附,每个适用于 GPC分离的样品都能完全洗脱,从而使 GPC柱的性能得到长期保持,并能反复使用。但是,此方法仍有很多不足,例如净化不完全,农药和样品基质成分通常会有一部分重叠,即使使用高分辨的凝胶柱也很难达到完全分离。因此,GPC方法通常还需要结合一些额外的处理步骤,常用的有 LLE或SPE[45-48]。此外,溶剂消耗量大,仪器维护费用高也是主要问题。尽管如此,GPC在高脂肪样品农残分析中仍发挥着不可取代的作用。Lesueur等[48]对4种土壤中农残提取净化方法进行比较,证明LLE-GPC法净化所得到的检测限最低,净化效果最好。
与其他前处理方法一样,联机技术是它们发展的共同趋势。GPC与 GC/M S的成功联用,实现了从样品前处理到农药检测的完全自动化,可快速的进行多种农药的定性和定量分析,进一步提高样品处理量和自动化程度[49]。特别是在处理大量样品时,此方法显得更为重要。
2 液相色谱-串联质谱的研究
液相色谱-质谱(LC-M S/MS)联用技术是近20年来分析领域最重要的进展之一,已成功用于分析热不稳定、相对分子质量较大、难以用气相色谱分析的化合物,具有检测灵敏度高、选择性好、定性定量同时进行、结果可靠等优点。
2.1 色谱部分
农药分离常用的色谱柱是反相C18或C8柱,也有少数离子型农药使用离子交换柱或离子对反相色谱柱。由于质谱检测器的特殊性,人们
已把色谱条件考察的焦点从固定相转移到流动相。目前广为接受的流动相是水与甲醇或乙腈的梯度混合溶剂。其中有机相的种类、比例、p H值、缓冲盐的种类及浓度都会影响分析物的离子化效率,从而影响方法的灵敏度。Jansson等[68]证明样品在甲醇中的质谱信号普遍高于乙腈,然而在农药多种类多残留分析中仍多以乙腈为有机相[14-15,54-60]。此外,在流动相中加入适量的挥发性酸或碱(如甲酸、乙酸铵等)可以起到抑制不稳定弱酸或弱碱性农药分解和帮助离子化的作用。
2.2 质谱部分
2.2.1 接口系统 ESI和 APCI是最常用的液质接口系统,关于二者的理论已有很多报道[8-10],ESI主要用于极性和离子型化合物,APCI则适用于中等极性和弱极性化合物,但在农残分析方面二者并没有严格的界线。Thurman等[69]研究了 72种农药的 ESI和 APCI离子化效果,示于图1,并对两种离子源适用农药的极性范围和种类,以及不同农药的正负电离模式做了详细阐述,指出对少量农药进行检测时,二者各具优势,但当农药的种类大于200时,ESI的灵敏度却明显高于 APCI[70]。事实上,ESI与APCI的灵敏度还与仪器的厂家和型号有关,特别是随着近几年质谱仪器的快速发展,很难得出定论。此外,APPI在农残分析领域也开始得到应用,其原理与APCI相似,可以认为是APCI的补充,用于检测非极性和低极性化合物。同时,APPI还降低了基质效应,在农残检测过程中省去了基质校正的步骤,不但简化了实验过程,更进一步扩大了液质联用技术的应用范围[71]。
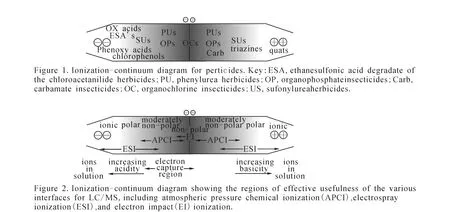
图1 Thurman[71]绘制的离子源与农药性质的关系图Fig.1 Diagram showing the relationship between ionization and pesticide performance designed by Thurman[71]
2.2.2 质量分析器 LC/M S的质量分析器有单四极杆,飞行时间,串联质谱(IT、QQQ、Q IT)和混合质谱(Q TOF)。单四极杆背景噪音大,在农残分析中很少使用。串联质谱的选择反应监测模式(SRM)可以克服这一缺陷,显著提高选择性和灵敏度,因此QQQ成为农药多残留分析中应用最广泛的检测技术。Lehotay等[4]用TQM S同时分析了水果、蔬菜中229种农药,灵敏度达到μg·kg-1水平。Q IT也可以进行SRM模式,但其定量性能颇有争议,Hogenboom等[72]通过比较Q ITM S和 TQM S的一些定量数据,认为 Q ITM S的最低检出限高于TQM S的5~30倍,然而,Evans等[7]却认为二者具有相似的LODs,并都能提供常规检测所需的准确度和灵敏度。Soler等[73]也考查了LCTQ/M S和LC-Q IT/M S在农残分析中的应用特点,认为 TQM S在准确度、线性和重现性方面都好于Q ITM S。但可以确定的是Q ITM S可进行多级串联质谱分析,因此在结构鉴定上比TQMS灵敏。Blasco等[74]用 LC-Q IT/MS3对多种农药进行分析,不但得到了特征裂解途径,而且提供了足够的定量信息,可以进行准确定量。TOF的主要优点是可以在高分辨条件下操作,并且可以进行准确质量测定。准确质量数可给出元素组成,从而提供结构信息,这是四极杆质谱所做不到的。Q TOF结合了两种技术的优点,既可以在串联状态下对子离子提供准确质量测定,又可以作为单独的 TOF质谱仪对前体离子进行准确质量测定[75]。但是它不能完成真实的母离子扫描和中性丢失模式,定量分析的灵敏度比 QQQ低 1个数量级[76]。因此,目前对Q TOF的研究主要集中在分析未知农药。
2.3 LC-MS/MS的局限性
LC-M S/M S作为一种发展中的检测技术也存在一定的局限性。ESI与APCI都不能胜任非极性化合物的离子化,尽管理论上APPI可以用于非极性化合物,但还没有实际例子能证明这一点。此外,LC-M S/M S准确定量至少需要3个特征离子,对于一些只有1个碎片离子的化合物只能不完全定量,如果第2个离子的丰度不够高也会显著降低分析的灵敏度。LC-M S/M S另一个不容忽视的问题是基质效应,即基质干扰物通过增强或抑制分析物离子化效率来影响分析结果。改善色谱分离效果和各种基质净化方法都可以减少但不能完全消除基质效应,校准法是避免或补偿基质效应最有效的方法。其中,同位素内标法是单个农药分析时的最佳选择,但存在内标不易找到和价格昂贵的缺点,且不适合多残留分析。共振峰法是在内标法基础上发展起来的,它也存在局限性,特别是影响同分异构体的鉴定。基质匹配标准曲线法是目前多残留分析中最常用的校准方法,其不足为每种样品都需要各自的空白样品,不能建立通用的基质匹配标准曲线。但是基质效应的问题已经得到广泛重视,M artínez Vidal等[77]找到了一种通用的空白基质,可对多种物质的基质效应进行校准。A lder等[78]开发了一种新型基质效应补偿方法,通过在柱后加入一种监测物质可永久性补偿多残留分析中基质效应,不但改善了回收率,而且显著减少了分析时间。我们相信,随着LC-M S/M S方法的发展和普及,会有更多更有效的方法来克服这种不足。
3 LC-MS/MS在中药农残分析中的研究现状
目前,LC-M S/M S的研究主要集中于多残留分析和一些性质特殊的单个或几个农药的分析,农药种类涉及氨基甲酸酯、有机磷、拟除虫菊酯、苯并咪唑、三唑类等。前处理过程是多残留分析的关键环节,美国食品药品管理局根据样品中脂肪、水和糖的含量进行分类,建立相应的前处理方法。而中药由于其成分复杂,很难找出通用的分类依据。中药净化最常用的方法是吸附柱色谱法,如 Florisil、氧化铝、硅胶等。Florisil是中药净化最好的吸附材料,特别适合从非极性基质中分离极性化合物。一些先进的提取技术在中药中的应用也有报道,但研究不够深入,还没有充分发挥出它们的优势[78-82]。
纵观各国对农残分析的研究不难发现,LCMS/MS在环境污染和食品安全方面发展得最快,特别是近几年,由于对多残留分析的关注和对最大残留限量的严格规定,LC-M S/M S的应用几乎达到了高峰。但是,它在中药农残领域的应用却寥寥无几[11-12],完全没有发挥出其高选择性和高灵敏度的优势,这也是制约中药农残分析发展的主要因素之一。
4 结论与展望
近些年来,农残超标问题屡屡出现,农残分析已成为分析化学家们关注的焦点,而质谱的出现极大地推动了这一问题的解决。LC-M S/M S已经成功应用到环境食品等各个领域,但在中药农残分析中仍面临着巨大的挑战。此外,化学成分复杂、各异,无法建立通用的前处理方法依然是面临的主要问题。充分利用现有技术建立简单,廉价,环保,可靠的分析方法是中药质量监控的首要任务。
同时我们必须看到,LC-M S/M S作为最有潜力的分析技术,仍有很大的发展空间。小型或微型色谱柱的开发、接口技术的改进和完善、M S谱库识别技术的发展以及基质效应的彻底解决都是分析工作者们需要关注的方向。有理由相信,随着液质技术的日益成熟,其必会在中药农残分析中发挥重要的作用。
[1]ALDER L,GREUL ICH K,KEMPE G,et al.Residue analysis of 500 high p rio rity pesticides:Better by GC-MS or LC-MS/MS?[J].Mass Spectrometry Review s,2006,25(6):838-865.
[2]H IEMSTRA M,DEKOK A.Comprehensivemultiresidue method for the target analysis of pesticides in crops using liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2007,1 154(1/2):3-25.
[3]ANASTASSIADESM,L EHOTA Y SJ,et al.Fast and easy multiresidue method emp loying acetonitrile extraction/partitioning and“dispersive solid-phase extraction”for the determination of pesticide residues in p roduce[J].J AOAC Int,2003,83(2):412-431.
[4]LEHOTA Y SJ,KOK A,H IEMSTRA M,et al.Validation of a fast and easy method for the determination of residues from 229 pesticides in fruits and vegetables using gas and liquid chromatography and mass spectrometric detection[J].J AOAC Int,2005,88(2):595-614.
[5]MA TOVSKÁK,LEHOTA Y SJ.Evaluation of common organic solvents for gas chromatographic analysis and stability of multiclass pesticide residues[J].J Chromatogr A,2004,1 040(2):259-272.
[6]GRANBY K,ANDERSEN J H,CHRISTENSEN H B.Analysis of pesticides in fruit,vegetables and cereals using methanolic extraction and detection by liquid chromatography-tandem mass spectrometry[J].Anal Chim Acta,2004,520(1/2):165-176.
[7]EVANS C S,STARTIN J R,GOODALL D M,et al.Op timisation of ion trap parameters for the quantification of chlo rmequat by liquid chromatography/mass spectrometry and the app lication in the analysis of pear extracts[J].Rapid Commun Mass Spectrom,2000,14(2):112-117.
[8]SOLER C,MAÑESJ,PICÓY.The roleof liquid chromatography-mass spectrometry in pesticide residue determination in food[J].Crit Rev Anal Chem,2008,38(2):93-117.
[9]PICÓY,FONT G,RU IZ M J.Control of pesticide residues by liquid chromatography-mass spectrometry to ensure food safety[J].Mass Spectrometry Review s,2006,25(6):917-960.
[10]PICÓY,BLASCO C,FONT G.Environmental and food app lications of LC-tandem mass spectrometry in pesticide-residue analysis:An overview[J].Mass Spectrometry Review s,2004,23(1):45-85.
[11]吴永江,朱 炜,程翼宇.液-质联用法测定铁皮石斛和西洋参及制剂中多菌灵残留[J].分析化学,2006,34(2):235-238.
[12]庞国芳,范春林,梁 萍,等.GB/T 23201—2008桑枝、金银花、枸杞子和荷叶中413种农药及相关化学品残留量的测定液相色谱-串联质谱法[S].北京:中国标准出版社,2009.
[13]HAJOU M K,AFIFIU,BA TTAH H.Comparative determination of multi-pesticide residues in Pimpinella anisum using two different AOAC methods[J].Food Chemistry,2004,88(3):469-478.
[14]L ESU EUR C,KN ITTL P,GARTN ER M,et al.Analysisof 140 pesticides from conventional farming foodstuff samples after extraction with the modified QuECheRS method[J].Food Control,2008,19(9):906-914.
[15]MORENO J L F,FREN ICH A G,BOLAÑOS P P,et al.M ultiresidue method for the analysis of mo re than 140 pesticide residues in fruits and vegetables by gas chromatography coup led to triple quadrupole mass spectrometry[J].J Mass Spectrom,2008,43(9):1 235-1 254.
[16]MA TOVSKÁK,LEHOTA Y SJ.Evaluation of common o rganic solvents for gas chromatographic analysis and stability of multiclass pesticide residues[J].J Chromatogr A,2004,1 040(2):259-272.
[17]AGU ILERA A,BROTONSM,RODRIGUEZM,et al.Supercritical fluid extraction of pesticides from a table-ready food composite of plant origin(Gazpacho)[J].J Agric Food Chem,2003,51(19):5 616-5 621.
[18]RISSA TO SR,GALH IANEM S,KNOLL F R N,et al.Supercitical fluid extraction for pesticide multiresidue analysis in honey:Determination by gas chromatography with electron-cap ture and mass spectrometry detection[J].J Chromatogr A,2004,1 048(2):153-159.
[19]AGU ILERA A,RODRINGUEZ M,BROTONS M,et al.Evaluation of supercritical fluid extraction/aminop ropyl solid-phase“in-line”cleanup for analysis of pesticide residues in rice[J].J Agric Food Chem,2005,53(24):9 374-9 382.
[20]AGU ILERA A,BROTONSM,RODRIGUEZM,et a1.Supercritical fluid extraction of pesticides f rom a table-ready food composite of plant o rigin(Gazpacho)[J].J Agric Food Chem,2003,51(19):5 616-5 621.
[21]LEHOTA Y S J.Determination of pesticide residues in nonfatly food by percritical extraction aqnd gas chromatography mass spectrometry:Collaborative study[J].J AOAC Int,2002,85(5):1 148-1 166.
[22]SEGER C,RÖM PP H,STURM S,et al.Characterization of supercritical fluid extracts of St.John’s Wo rt(H ypericum perforatumL.)by HPLC-MS and GC-MS[J].Eur J Pharm Sci,2004,21(4):453-463.
[23]D IAZ-CRUZ M S,BARCELÓD.Highly selective samp le p reparation and gas chromatographicmass spectrometric analysis of chlo rpyrifos,diazinon and their major metabolites in sludge and sludge-fertilized agricultural soils[J].J Chromatogr A,2006,1 132(1/2):21-27.
[24]GARRIDO FREN ICH A,MARTINE V IDAL J L,CRUZ SICIL IA A D.M ultiresidue analysisof organochlo rine and organophospho rus pesticides in muscle of chicken,pork and lamb by gas chromatography-triple quadrupole mass spctrometry[J].Anal Chim Acta,2006,558(1/2):42-52.
[25]BLASCO C,FON T G,PICÓY.Analysis of pesticides in fruits by p ressurized liquid extraction and liquid chromatography-ion trap-triple stage mass spectrometry[J].J Chromatogr A,2005,1 098(1/2):37-43.
[26]张洪非,胡清源,唐纲岭,等.气相色谱-质谱法分析烟草中有机磷农药残留量及其烟支转移率研究[J].分析试验室,2009,28(2):53-56.
[27]SINGH SB,FOSTER GD,KHAN SU.Determination of thiophanate methyl and carbendazim residues in vegetable samples using microwaveassisted extraction[J].J Chromatogr A,2007,1 148(2):152-157.
[28]BARRIADA-PEREIRA M,GONZÁLEZ-CASTRO M J,MUN IA TEGU I S,et al.Comparison of p ressurized liquid extraction and microwave assisted extraction for the determination of o rganochlorine pesticides in vegetables[J].Talanta,2007,71(3):1 345-1 351.
[29]CARVALHO P N,PEDRO N R,RODRIGUES M,et al.An expeditiousmethod for the determination of organochlorine pesticides residues in estuarine sediments using microwave assisted p reextraction and automated headspace solid-phase microextraction coupled to gas chromatographymass spectrometry[J].Talanta,2008,76(5):1 124-1 129.
[30]PA IGA P,MORA ISS,CORREIA M,et al.Determination of carbmate and urea pesticde residues in fresh vegetables using microwave-assisted extraction and liquid chromatography[J].Int J Environ Anal Chem,2009,89(3):199.
[31]PANG G F,L IU Y M,FAN C L,et al.Simultaneous determination of 405 pesticide residues in grain by accelerated solvent extraction then gas chromatography-mass spectrometry o r liquid chromatography-tandem mass spectrometry[J].Anal Bioanal Chem,2006,384(6):1 366-1 408.
[32]BLASCO C,FONT G,PICÓY.Determination of dithiocarbamates and metabolites in plants by liquid chromatography-mass spectrometry[J].J Chromatogr A,2004,1 028(2):267-276.
[33]HERNÁNDEZ F,POZO O J,SANCHO J V,et al.M ultiresidue liquid chromatography tandem mass spectrometry determination of 52 non gas chromatography-amenable pesticides and metabolites in different food commodities[J].J Chromatogr A,2006,1 109(2):242-252.
[34]LAMBROPOULOU D A,ALBAN IS T A.Methods of samp le p reparation for determination of pesticide residues in food matrices by chromatography-mass spectrometry-based techniques:a review[J].Anal Bioanal Chem,2007,389(6):1 663-1 683.
[35]CORREIA M,DELERUE-MATOS C,ALVESA.M ulti-residue methodology for pesticide screening in wines[J].J Chromatogr A,2000,889(1/2):59-67.
[36]CHA IM K,TAN G H.Validation of a headspace solid-phase microextraction p rocedure with gas chromatography-electron cap ture detection of pesticide residues in fruits and vegetables[J].Food Chem,2009,117(3):561-567.
[37]AMVRAZIE G,TSIROPOULOSN G.Chemometric study and op timization of extraction parameters in single-drop microextraction for the determination of multiclass pesticide residues in grapes and apples by gas chromatography mass spectrometry[J].J Chromatogr A,2009,1 216(45):7 630-7 638.
[38]SANCHEZ-ORTEGA A,SAMPEDRO M C,UNCETA N,et al.Solid-phase microextraction coupled with high performance liquid chromatography using on-line diode-array and electrochemical detection for the determination of fenitrothion and itsmain metabolites in environmental water samples[J].J Chromatogra A,2005,1 094(1/2):70-76.
[39]BAGHERIH,GHANBARNEJAD H,KHAL IL IAN F.Immersed sol-gel based amino-functionalized SPM E fiber and HPLC combined with postcolumn photochemically induced fluo rimetry derivatization and fluo rescence detection of pyrethroid insecticides from water samples[J].J Sep Sci,2009,32(17):2 912-2 918.
[40]SCHEYER A,MORV ILLE S,M IRABEL P,et al.Analysis of trace levels of pesticides in rainwater using SPM E and GC-tandem mass spectrometry[J].Anal Bioanal Chem,2006,384(2):475-487.
[41]SA KAMOTO M,TSUTSU M I.Applicability of head space solid-phase microextraction to the determination of multi-class pesticides in waters[J].J Chromatogr A,2004,1 028(1):63-74.
[42]ZHU F,RUAN W H,HEM H.App lication of solid-phase microextraction for the determination of organophosphorus pesticides in textiles by gas chromatography with mass spectrometry[J].A-nal Chim Acta,2009,650(2):202-206.
[43]VALENZUELA A L,LORENZIN IR,REDONDO M J,et al.Matrix solid-phase dispersion microextraction and determination by high-performance liquid chromatography with UV detection of pesticide residues in citrus fruit[J].J Chromatogr A,1999,839(1/2):101-107.
[44]CORTESJ M,TOLEDANO R M,V ILLÉN J,et al.Analysis of pesticides in nuts by online reversed-phase liquid chromatography-gas chromatography using the through-oven transfer adsorption/deso rp tion interface[J].J Agric Food Chem,2008,56(14):5 544-5 549.
[45]HOH E,LEHOTA Y SJ,M ASTOVSKA K,et al.Evaluation of automated direct samp le introduction with comp rehensive two-dimensional gas chromatography/time-of-flight mass spectrometry for the screening analysis of dioxins in fish oil[J].JChromatogr A,2008,1 201(1):69-77.
[46]HUANG ZQ,L IY J,CHEN B,et al.Simultaneous determination of 102 pesiticide residues in Chinese teas by gas chromatography-mass spectrometry[J].J Chromatogr B,2007,853(1/2):154-162.
[47]ZHANGW G,CHU X G,L IC J.et al.Simultaneous determination of 109 pesticides in unpolished rice by a combination of gel permeation chromatography and Florisil column purification,and gas chromatography/mass spectrometry[J].Rapid Commun M ass Spectrom,2006,20(4):609-617.
[48]LESUEUR C,GARTNER M,M ENTLER A,et al.Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatography-ion trap-mass spectrometry[J].Talanta,2008,75(1):284-293.
[49]MATSUOKA T,AKIYAMA Y,M ITSUHASHIT.Screening method of pesticides in meat using cleanup with GPC and mini-column[J].J Food Hygienic Society,2009,50(2):97-107.
[50]FERRER C,GÓM EZM J,JUAN F,et al.Determination of pesticide residues in olives and olive oil by natrix solid-phase dispersion followed by gas chromatography/mass spectrometry and liquid chromatography/tandem mass spectrometry[J].J Chromatogr A,2005,1 069(2):183-194.
[51]KOLBEN,ANDERSSON J T.Simple and sensitive determination of o-phenylphenol in citrus fruits using gas chromatography with atomic emission o rmass spectrometric detection[J].J Agric Food Chem,2006,54(16):5 736-5 741.
[52]DEGELM ANN P,EGGER S,JÜRL IN G H,et al.Determination of sulfonylurea herbicides in water and food samples using sol-gel glass-based immunoaffinity extraction and liquid chromatography-ultraviolet/diode array detection orliquid chromatography-tandem mass spectrometry[J].J Agric Food Chem,2006,54(6):2 003-2 011.
[53]KINSELLA B,LEHOTA YB SJ,MASTOVSKA K,et al.New method for the analysis of flukicide and other anthelmintic residues in bovine milk and liver using liquid chromatography-tandem mass spectrometry[J].Anal Chim Acta,2009,637(1/2):196-207.
[54]NGU YEN T D,HAN EM,LEE G H,et al.A multi-residuemethod for the determination of 203 pesticides in rice paddies using gas chromatography/mass spectrometry[J].Anal Chim Acta,2008,619(1):67-74.
[55]NGUYEN T D,LEE B S,LEE G H,et al.A multiresidue method for the determination of 109 pesticides in rice using the Quick Easy Cheap Effective Rugged and Safe(QuECh ERS)sample p reparation method and gas chromatography/mass spectrometry with temperature control and vacuum concentration[J].Rapid Commun Mass Spectrom,2007,21(18):3 115-3 122.
[56]LEE JM,PARK JW,JANG G C,et al.Comparative study of pesticide multi-residue extraction in tobacco for gas chromatography-trip quadrupole mass spectrometry[J].J Chromatogr A,2008,1 187(1/2):25-33.
[57]LESUEUR C,GARTNER M,M ENTLER A,et al.Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatography-ion trap-mass spectrometry[J].Talanta,2008,75(1):284-293.
[58]GARCL Á-REYES J F,FERRER C,GÓM EZRAMOSM J,et al.Determination of pesticide residues in olive oil and olives[J].Trends Analy Chem,2007,26(3):239-251.
[59]GEORGA KOPOULOS P,M YLONA A,PANAGIOTIS N.Evaluation of cost-effective methods in the pesticide residue analysis of non-fatty baby foods[J].Food Chemistry,2009,115(3):1 164-1 168.
[60]WALORCZYK S.Development of a multi-residuemethod for the determination of pesticides in cereals and dry animal feed using gas chromatography-tandem quadrupolemass spectrometry:II.Imp rovement and extension to new analytes[J].J Chromatogr A,2008,1 208(1/2):202-214.
[61]RIDGWAY K,LALLJIE SP,SM ITH R M.Sample p reparation techniques for the determination of trace residues and contaminants in food[J].J Chromatogr A,2007,1 153(1/2):36-53.
[62]GANZLER K,SALGÓA,VAL KÓ K.M icrowave extraction:A novel sample p reparation method for chromatography[J].J Chromatogr A,1986,371:299-306.
[63]DAGNAC T,GARCIA-CHAO M,PULLEIRO P,et al.Dispersive solid-phase extraction followed by liqucd chromatography-tandem mass spectrometry for the multi-residue analysis of pesticides in raw bovine milk[J].J Chromatogr A,2009,1 216(18):3 702-3 709.
[64]FERRER C,FERRER I,THURM AN MM,et al.Determination of pesticide residues in olives and olive oil by matrix solid-phase dispersion followed by gas chromatography/mass spectrometry and liquid chromatography/tandem mass spectrometry[J].J chromarogr A,2005,1 069:183-194.
[65]CHU X G,HU X Z,YAO H Y,Determination of 266 pesticide residues in app le juice by matrix solid-phase dispersion and gas chromatographymass selective detection[J].J Chromatogr A,2005,1 063(1/2):201-210.
[66]BOGIALL IS,CURIN IR,NAZZARIM,et al.A simple and rapid assay for analyzing residuesof carbamate insecticides in vegetables and fruits:ho t water extraction followed by liquid chromatography-mass spectrometry[J].J Agric Food Chem,2004,52(4):665-671.
[67]FERNANDEZ-ALVAREZM,LLOMPART M,LAMASJ P,et al.Developmentof amatrix solid-phase dispersion method for the simultaneous determination of pyrethroid and o rganochlo rinated pesticides in cattle feed[J].J Chromatogr A,2009,1 216(14):2 832-2 842.
[68]JANSSON C,PIHLSTROM T,ÖSTERDAHL B G,et al.A new multi-residuemethod for analysis of pesticide residues in fruit and vegetables using liquid chromatography with tandem mass spectrometric detection[J].J Chromatogr A,2004,1 023(11):93-104.
[69]THURMAN EM,FERRER I,BARCELÓD.Choosing between atmospheric p ressure chemical i-onization and electrosp ray ionization interfaces for the HPLC/MS analysis of pesticides[J].Anal Chem,2001,73(22):5 441-5 449.
[70]KLEIN J,ALDER L.App licability of gradient liquid chromatography with tandem mass spectrometry to the simultaneous screening for about 100 pesticides in crops[J].J AOAC Int,2003,86(5):1 015-1 037.
[71]TA KINO M,YAMAGUCH I K,NA KAHARA T.Determination of carbamate pesticide residues in vegetables and fruits by liquid chromatography-atmospheric p ressure pho toionization-mass spectrometry and atmospheric p ressure chemical ionization-mass spectrometry[J].J Agric Food Chem,2004,52(4):727-735.
[72]HOGENBOOM A C,N IESSEN W M A,BRINKMAN U A.Rapid target analysis of microcontaminants in water by on-line single-sho rt-column liquid chromatography combined with atmospheric p ressure chemical ionization ion-trap mass spectrometry[J].J Chromatogr A 1998,794(1/2):201-210.
[73]SOLER C,HAM IL TON B,FUREY A,et al.Op timization of LC-MS/MS using triple quadrupole mass analyzer for the simultaneous analysis of carbosulfan and itsmainmetabolites in o ranges[J].Anal Chim Acta,2006,571(1):1-11.
[74]BLASCO C,FONT G,PICÒY.Analysis of pesticides in fruits by p ressurized liquid extraction and liquid chromatography-ion trap-triple stage mass spectrometry[J].J Chromatogr A,2005,1 098(1):37-43.
[75]帕拉马尼克B N.电喷雾质谱应用技术[M].俞克佳,译.北京:化学工业出版社,2005.
[76]HERNANDEZ F,IBANEZ M,SANCHO J V,et al.Comparison of differentmass spectrometric techniques combined with liquid chromatography for confirmation of pesticides in environmental water based on the use of identification points[J].Anal Chem,2004,76(15):4 349-4 357.
[77]MARTÍNEZ V IDAL J L,GARRIDO FREN ICH A,LÓPEZ LÓPEZ T,et al.Selection of a rep resentativematrix for calibration inmultianalyte determination of pesticides in vegetables by liquid chromatography-electrosp ray tandem mass spectrometry[J].Chromatographia,2005,61(3/4):127-131.
[78]ZU IN V G,YARIWA KE J H,B ICCH IC.Fast supercritical fluid extraction and high-resolution gas chromatography with electron-cap ture and flame photometric detection for multiresidue screening of organochlo rine and organophosphorus pesticides in B razil’s medicinal plants[J].J Chromatogr A,2003,985(1/2):159-166.
[79]CAM PILLO N,PÑALVER R,HERNÁNDEZCÓRDOBA M.Pesticide analysis in herbal infusions by solid-phase microextraction and gas chromatography with atomic emission detection[J].Talanta,2007,71(3):1 417-1 423.
[80]ZHAO C J,HAO G M,L I H X,et al.Decontamination of organochlorine pesticides in Radix Codonopsis by supercritical fluid extractions and determination by gas chromatography[J].Biomed Chromatogr,2006,20(9):857-863.
[81]HWANGB H,LEEM R.Solid-phase microextraction for organochlo rine pesticide residues analysis in Chinese herbal formulations[J].J Chromatogr A,2000,898(2):245-256.
[82]BANERJEE K,OULKAR D P,DASGUPTA S,et al.Validation and uncertainty analysis of a multi-residue method for pesticides in grapes using ethyl acetate extraction and liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2007,1 173(1/2):98-109.
Advances on Traditional Chinese Medicine Application of Liquid Chromatography-Tandem Mass Spectrometry and Correspondingly Sam ple Preparations in Pesticide Residue Analysis
CHEN Li-na1,2,SONG Feng-rui1,L IU Zhi-qiang1
(1.Changchun Institute of A pp lied Chemistry,Chinese Academy of Sciences,Changchun 130022,China;2.Graduate School of Chinese Academy of Sciences,Beijing 100049,China)
The past few years show the considerable potential in the app lication of liquid chromatography-tandem mass spectrometry(LC-M S/M S)to control pesticide residues for insure environment and food safety.This review focuses on the advances of LC-M S/M S analysis of pesticide residues and especially addressed its app lications and p rospect in the traditional Chinese medicine(TCM).Some samp le p reparation techniques which recently developed and extensively used are also surveyed as they are still mandato ry in many app lications for the reason of time consuming and easily errors.Furthermore,emphasis is p laced on the advantages and disadvantages of them in order to p rovide information for pesticide residue control in Chinese medicine production.
Chinese herbalmedicine;pesticide residues;liquid chromatography-tandem mass spectrometry(LC-M S/M S);p reparation
刘志强(1962~),男(汉族),教授,博士生导师,从事天然药物化学与有机质谱学研究。E-mail:liuzq@ciac.jl.cn
O 657.63
A
1004-2997(2010)06-0342-12
2010-10-01;
2010-11-10
国家科技部科技支撑计划项目(2009ZX09308-006),国家科技部创新方法研究专项(2010IM 030400)资助
陈丽娜(1984~),女(汉族),博士研究生,分析化学专业。E-mail:m slab29@ciac.jl.cn

