夯实溶液概念 学会总结酸碱规律
牛桂芬,河南新郑市市直中学高级教师,郑州市骨干教师。多次荣获优秀辅导教师奖及全国化学竞赛园丁奖。编著多本教辅图书。多篇教学论文获省级奖励。
只有牢固掌握基本概念,学会总结知识规律,才能提高创新能力,在第九、十单元的学习中同学们应注意以下几点。
一、理解基本概念的内涵,注意知识间的联系
正确理解有关溶液的概念。生活中我们接触到比较多的溶解例子,如食盐溶于水,蔗糖溶于水,用汽油来溶解油污,用洗洁精洗涤油污盘子等。但只有物质溶解形成均一、稳定的混合物才能称为溶液,即溶液具有均一性、稳定性的特征。可见,食盐水、蔗糖水属于溶液,用洗洁精除油污形成的液体不是溶液而是乳浊液。水或酒精也不是溶液,因它们是纯净物而不是混合物。所以,同学们学习时要弄清概念的内涵,避免误用。
一定温度下,在定量的溶剂中不能继续溶解某种溶质时形成的溶液就是该溶质的饱和溶液,否则就是不饱和溶液。改变温度、定量溶质、定量溶剂三个因素中的一个因素,溶液的状态就会发生改变。
不同物质在相同溶剂中溶解的能力不同,这个“能力”的定量描述就是溶解度。而一定量溶剂里所溶解溶质的多少不同,又会表现出溶液的浓、稀,溶液的浓稀程度有多种表示形式,其中一种就是用溶质的质量分数来表示。所以,不能把概念孤立化,而应掌握其间的联系规律。
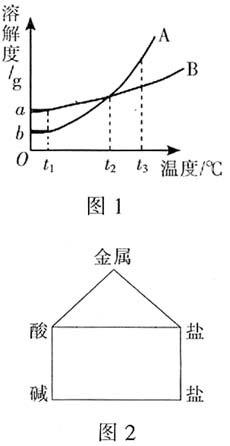
思考一下(2008年河南)图1是A、B两种物质的溶解度曲线。请回答下列问题:(1)t1 ℃时,B物质的溶解度为_____g。(2)将t2 ℃时A、B的饱和溶液分别升温到t3 ℃,A溶液溶质的质量分数_____(填“大于”、“小于”或“等于”)B溶液溶质的质量分数(假设升温过程中水的质量没有变化)。
分析:第(1)小题应填a;第(2)小题填“大于”就错了,表面上是大于,但溶液是由t2 ℃升到t3 ℃,此过程没有改变A、B溶液的组成,故二者的质量分数仍相等。
二、重视探究实验,提高综合能力
同学们要认真学习课堂上老师准备的探究实验,并充分利用身边的物质开展家庭小实验,以提高自己的动手能力及灵活运用知识的创新能力。如:利用蔗糖或食盐的溶解探究饱和溶液与不饱和溶液间的转化条件;利用厨房中的纯碱和柠檬酸混合制汽水;用醋除水壶中的水垢;用洁厕精(含盐酸)验证蛋壳成分含碳酸盐等。
三、学习物质性质,以点带面
第十单元酸碱的性质是中考分量较重的一块,且这部分内容又是一个学习难点,需要掌握两酸、两碱的性质及由此总结出的通性。由常见的盐酸的性质学习总结出酸的通性,就是5条性质规律。碱的学习参照此路径,为4条性质规律。同学们在应用中容易出现性质规律混淆、乱用的情况,出错率较高,可采用列酸、碱、盐图表形式,简化规律。如图2,短线连接表示二者会反应。你能各举一个实例吗?
四、把握计算要求,莫忽视“化学”意义
溶液的计算是中招必考知识点。化学计算不等于纯数学计算,在计算时要依据化学概念,尊重化学事实,明确溶解度的含义,溶液各成分之间量的关系,某溶质的质量分数只在一定范围内有意义。如在20 ℃时,氯化钠的水溶液最大质量分数不超过26.5%,而讨论此温度下更大质量分数的氯化钠溶液是脱离实际的,因此也是没有意义的。
责任编辑/侯秀姣
——饱和溶液与不饱和溶液

