根癌农杆菌介导的胶孢炭疽茵遗传转化体系的建立
李 伟 郑肖兰 贺春萍 吴伟怀 李 锐 郑服丛
摘要:本研究基于农杆菌介导的遗传转化方法,建立了芒果胶孢炭疽菌高效的遗传转化体系,获得一批炭疽菌的T-DNA插入突变体,其目的是为炭疽菌的功能基因组学研究和致病相关基因的克隆奠定基础。结果如下:通过摸索并优化了体系的各项因子,在潮霉素筛选浓度为200 μg/mL,苗液浓度为OD660=0.15条件下,AS为200 μmol/L,选择pH5.5的IM共培养基中转化效果最好;进一步通过对转化子的继代稳定性和PCR检测,结果发现潮霉素抗性稳定遗传和假阳性率低;通过菌落形态观察和产孢能力的测定获得3个菌落形态异常突变体,6个产孢能力下降突变体。
关键词:胶孢炭疽菌;遗传转化;农杆菌介导插入;突变
中图分类号:Q 78
芒果具有“热带果王”之美称,在热带、亚热带地区出口水果中占有重要的地位。芒果胶孢炭疽菌[Colletotrichum hloeosporioides(Penz.)Penz.&sacc.以下简略为CG],是芒果的主要病原菌,引起炭疽病,危害芒果的果实、叶片、花穗等器官。造成落叶、落花、落果、嫩枝枯死以及采后果实腐烂等,导致严重的经济损失,其中以果实危害损失最为严重。炭疽菌不仅潜伏侵染芒果幼果,而且还可以在采后的贮藏、运输过程中,果实后熟时开始发病,造成:赶批烂果。
1材料与方法
1.1材料
1.1.1菌种、质粒及其来源
芒果胶孢炭疽菌(CG):由本实验室分离自湛江,海口和儋州具有典型炭疽病症状的芒果果实病斑。获得的菌株经纯化和单孢分离后保存于PDA斜i面。用于本研究中进行遗传转化试验的是致病力和产孢能力都较强的儋州菌株LCG5。农杆菌菌株:AGL-1(含质粒pBHt2)。
1.1.2主要培养基
PDA培养基、YEP培养基、MM液体培养基、IM液体培养基、MMRK液体培养基。
1.2 CG遗传转化体系的建立
1.2.1供试菌株的筛选
1.2.1.1CG的致病力测定

首先将CG在28℃恒温下培养7 d。接着取新鲜无病菌的芒果,在芒果表面均匀选取5个点,用烧过的针扎出大小一致的伤口,用打孔器打出直径为0.5 cm的菌块,菌面紧贴伤口,无菌水浸泡的湿棉花,覆盖在菌块上保湿。每个菌株作3个重复,3 d后记录发病情况。发病分级标准为0级:刺伤点不发病;1级:刺伤点发病并连成片,病斑直径小于1 cm;2级:病斑直径1~2 cm;3级:病斑直径2~3 cm;4级:病斑直径3~4 cm;5级:病斑直径大于4 cm。
1.2.1.2CG的产孢能力测定
取大小相同(直径为5 mm)、培养时间一致(7 d)的各菌株菌丝块,移于平板上,28℃、黑暗条件下培养7 d。用10 mL灭菌水洗下各培养皿分生孢子,旋涡混匀,定容至相同体积,然后用血球计数板进行孢子计数。每一菌株计3个培养皿,重复2次,取平均值。
1.2.2抑制LCG5的潮霉素最佳浓度的筛选
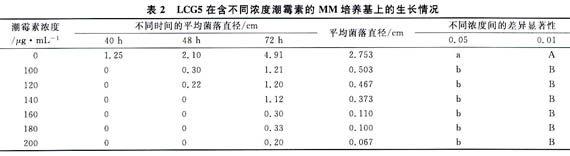
先将培养7 d的LCG5,刮去表面的菌丝,用挑针挑取少量的孢子堆,点接到含潮霉素浓度0、100、120、140、160和200 μg/mL的固体MM平板上。然后置于28℃恒温箱中进行培养,分别于培养后24、44、48、72 h观察记录。
1.2.3最佳共培条件的筛选
1.2.3.1不同pH共培养基IM的准备
用1 mol/L HCl和1 mol/L NaOH调节IM液体和固体培养基,pH计标定培养基的pH为5.0、5.5、6.0,4℃冰箱内保存。
1.2.3.2不同浓度农杆菌的准备
取4℃冰箱内保存的农杆菌,吸取100μL,加到5 mL MMRK选择培养基中,200 r/min,28℃摇菌2 d。将农杆菌培养至OD660为0.75,然后用MMRK液体培养基分别稀释1、5、10、15、20×。接着4 000 r/min离心收集农杆菌,在无菌操作台上倒掉MM,用相同体积的IM液体培养基重悬。
1.2.3.3AS对转化效率的影响

取已活化的农杆菌AGL-15X菌液,4 000 r/min离心5 min,pH5.5的IM液体培养基重悬,重复共培养步骤,设不加AS的为空白对照。
1.3抗性菌株的筛选
1.3.1筛选培养及抗性稳定测定
将于MM固体培养基(潮霉素:200μg/mL)培养的抗性菌落,转接到含有200 μg/mL潮霉素的固体PDA上,并设LCG5作对照,于28℃恒温培养,进行初筛;7 d后,有孢子产生的炭疽菌进行单孢分离。分离的单孢转接到固体PDA(潮霉素:200 μg/mL)上进行二次筛选;没有孢子产生的炭疽菌,在菌落边缘挑取单根菌丝末端进行分离培养,3 d后再次筛选培养。以上步骤中经二次筛选的抗性菌株,转接到含有200 μg/mL潮霉素PDA上重复筛选。
1.3.2TCG(遗传转化体)的PCR检测
1.3.2.1TCG总DNA提取及农杆菌Ti质粒DNA的碱法小量提取
提取步骤参照《植物基因工程原理与技术》。
1.3.2.2转化菌株的PCR检测
引物设计:根据质粒PBHt2中潮霉素磷酸转移酶基因编码区设计了一对引物:Hf:5-TGCGC-CCAAGCTGCATCAT-3;Hr:5-TGAACTCAC-cGCGACGTCTGT-3;PCR反应体系:10×反应缓冲液(不含Mg C12)2.0μL;Mg C12溶液(25 mmol/L)1.2 μL;4×dNTP混合物(每种2.5 mmol/L)1.6 μL;Primer Hf 0.75 μL;Primer Hr 0.75 μL;DNA模板0.5 μL;无菌去离子水12.2 μL;TaqDNA聚合酶1.0 μL;总体积为20.0 μL。电泳检测产物。
1.4 TCG生物学特性比较
主要进行PDA培养基上LCG5与TCG形态对比:将分离培养的TCG,用打孔器打成大小相同的菌块接到PDA固体培养基上,28℃培养,菌丝长满培养皿后观察记录。
2结果与分析
2.1 CG遗传转化体系的建立
2.1.1CG产孢能力及致病力的测定结果
自海口、湛江、儋州3处采集地的CG菌株产生分生孢子能力和对芒果果实致病力的测定结果如表1所示:湛江2号和儋州2号菌株产生分生孢子能力最强,但其对芒果果实的致病力均居于中、下水平。考虑到本研究试图要建立的突变体库最终是为了进行cG的致病机制分析,本研究选用致病力最强、产孢能力中等的儋州第5号菌株,既保证了转化
体系的成功建立,又方便对突变体库的致病和产孢相关突变体的筛选。为了叙述方便,将此菌株用代号LCG5代表。
2.1.2抑制LCG5的潮霉素的最佳浓度筛选结果
LCG5在含不同浓度潮霉素的MM培养基上的菌落生长情况归纳于表2。表2的结果表明,LCG5接种到MM培养基上,在24 h之内,生长情况看不出明显的差异;在40 h后观察,能看到对照孢子萌发并形成1~2 cm大小的菌落,120、140 μg/mL浓度开始有扩展,其他的浓度下并没有明显变化;在48 h后再观察,120、140 μg/mL处理下菌落孢子有明显萌发,可看出菌落扩展,160 μg/mL浓度下的炭疽菌菌落开始扩展;在72 h后再观察,可以看出,对照已经连接成片,100、120、140、160、180 μg/mL5个潮霉素浓度梯度下的炭疽菌都有不同程度的扩展,200 μg/mL稍有扩展,但不是很明显,220 μg/mL的潮霉素浓度F,基本上没什么变化。因此,结果认为潮霉素浓度200μg/mL为最佳的筛选浓度。
2.1.3共培养方法的筛选结果
2.1.3.1不同农杆菌和共培养基的酸碱度对转化效率影响的测定结果
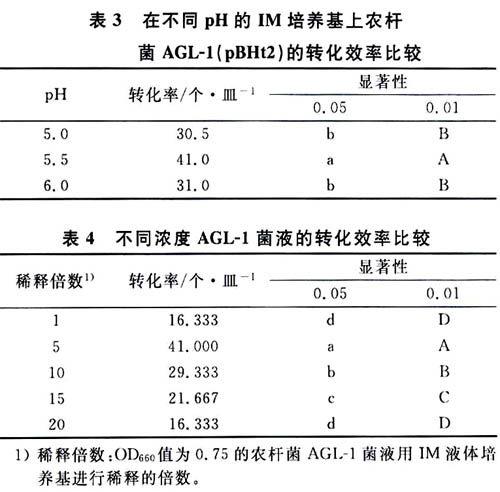
表3是使用不同酸碱度的IM培养基上农杆菌AGL-1的转化效率数据。培养基的酸碱度对转化效率有显著的影响,进行SAS分析,发现pH5.5时转化最好。
2.1.3.2农杆菌AGL-1菌液不同浓度对转化效率的影响测定结果
表4为使用农杆菌AGL-1不同浓度的菌液得到的转化效率数据。OD660= 0.75菌液梯度稀释作转化试验,使用稀释5×的菌液得到的转化效率最高,与其他浓度之间的差异达到极显著。稀释10、15×的其次,1、20×最低。
2.1.3.3AS对转化效率的影响
用IM作共培培养基(pH5.5),MM作筛选培养基,AS浓度设定为:200和0 μmol/L,在相同的试验条件下进行遗传转化试验,潮霉素的筛选浓度为200 μg/mL,结果显示没有加AS的处理基本上没有抗潮霉素的菌落出现,而含有AS的处理转化效率平均达到38个抗潮霉素菌落/皿。
2.2对LCG5的遗传转化和转化体的鉴定结果
2.2.1TCG对潮霉素抗性的稳定性检测
含潮霉素200 μg/mL的PDA上,接种48 h后CG与TCG的菌落生长情况:TCG在筛选培养基上扩展2 cm左右,LCG5被潮霉素抑制。潮霉素浓度保持不变继续在PDA筛选培养基上继代培养共5代。结果显示:TCG对潮霉素的抗性稳定遗传。
2.2.2PCR检测
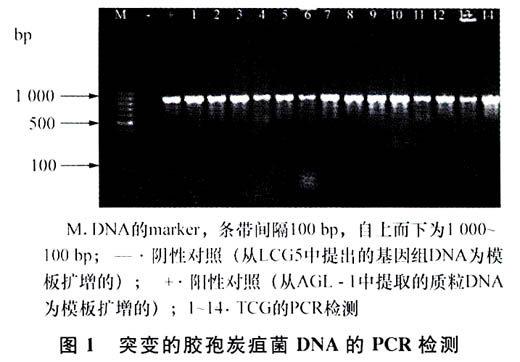
随机选取的LCG5及13个TCG,提取DNA与从农杆菌AGL-1及EHAl05提取的质粒DNA进行PCR扩增,结果显示13个抗性菌株扩增出与阳性带大小一致的约800 bp的条带,证明潮霉素磷酸转移酶基因已整合到LCG5转化子的基因组中(图1)。
2.3 LCG5的大规模转化和转化体的生物学特性
2.3.1LCG5优化后的转化体系
综合上述LCG5的遗传转化各个参数研究结果,总结出LCG5的遗传转化操作程序如下:
1)无菌牙签挑取农杆菌AGL-1单菌落,接种于Ⅵ1P液体培养基(卡那霉素:50μg/mL;利福平:25 μg/mL),200 r/min振荡培养,28℃过夜培养至对数期。在加有YEP固体平板培养基(卡那霉素:50 μg/mL;利福平:25 μg/mL)上画线,28℃培养2~3 d。
2)无菌牙签挑取农杆菌AGL-1单菌落,接种于MMRK液体培养基,28℃、200 r/min振荡过夜培养,稀释测定OD660=0.15。
3)取OD660=0.15的LCG5菌液5 mL,4 000 r/min离心5 min,倒去上清,5 mL pH5.5 IM液体培养基重悬,每管加入200 μmol/mL的AS(乙酰丁香酮)0.5 μL,28℃下,200 r/min摇6 h。
4)摇6 h后的农杆菌溶液,与浓度为3×105个孢子/mL的CG菌液等体积混合,摇匀。
5)硝酸纤维滤膜紧贴在IM固体培养基上,每皿取400 μL混合液均匀涂抹到硝酸纤维滤膜上,于无菌操作台上晾干,封口,在28℃恒温下培养48 h。
6)无菌牙签挑取已萌发的孢子,点接在MM固体培养基(潮霉素:200 μg/mL;链霉素:100 μg/mL;头孢霉素:100 μg/mL)上。一个皿中不同位置大约点接100个点。
7)在光照条件下28℃恒温培养48 h,挑生长良好的菌落转接在PDA固体培养基(潮霉素:200 μg/mL;链霉素:100 μg/mL;头孢霉素:100 μg/mL)上作进一步筛选。
8)对抗性菌株单孢分离,在PDA固体培养基(潮霉素:200 μg/mL)上继代筛选,并作保存。
按照优化后的操作程序,对LCG5进行大规模遗传转化,平均转化效率达到38个转化体/皿,相当于每1×105个LCG5分生孢子得到38个转化体。从所得的突变体中,随机选出100个经单孢分离并继代筛选表明抗性稳定,又经PCR检测,证实这些转化体确实在基因组中已经插入了抗潮霉素基因。
2.3.2TCG的生物学特性观察

从上述遗传转化体中挑选出11个PCR检测均为阳性,但在表型上与LCG5有明显差异的转化体,进行培养和观察、记录各种表型特征(表5)。
菌丝颜色改变:LCG5是白色菌丝,部分突变体菌丝颜色改变为灰色,如TCG3、TCG7、TCG8、TCG9;产孢能力改变:有些突变体产孢量明显降低,如TCG5、TCG6、TCG7、YCG8、TCG9、TCG10、TCG11;菌落形态改变:部分菌落出现扇变,如TCG5、TCG6、突变型11。
3讨论
3.1关于CG的遗传转化体系
本研究通过农杆菌介导转化胶孢炭疽菌的条件探索和对比,获得CG遗传转化的AS浓度、农杆菌浓度、CG分生孢子浓度、共培养的质粒、转化培养基和农杆菌等最佳的参数,最后组建成高效的CG遗传转化体系。经实际应用证实,用该体系进行芒果炭疽病菌菌株LCG5的遗传转化效率较高,操作也比较方便。该转化体系的建立,为CG功能基因组学,尤其是致病性的功能基因组学研究奠定良好的技术基础。关于炭疽菌有关种的遗传转化,国外已经有些报道。如Groot等已经成功地利用农杆菌转化Colletotrichum hloeosporioides,Epetein等利用限制酶介导整合(REMI)插入诱变技术,实现对C.gra-minicola的遗传转化。但迄今为止,国内还没有关
于芒果炭疽菌的遗传转化体系的研究报道。
根据以往的经验,在进行真菌的遗传转化中,目的真菌的野生菌株的选择直接影响转化效率。而且,同一种真菌的不同菌株,对作为筛选的潮霉素的敏感性可能存在很大差异。本研究基于筛选致病相关突变体的考虑,在CG野生菌株的选择上,综合考虑致病力、产孢能力和对潮霉素敏感程度,通过对比筛选,从来自我国芒果种植区的14个菌株中选出分生孢子产生能力中等、致病力强、对潮霉素敏感的LCG5菌株作为转化的野生菌株。既保证了转化体系的成功建立,又方便对突变体库的致病和产孢相关突变体的筛选。
本研究结果表明,潮霉素在MM培养基、PDA培养基上虽然可以抑制LCG5的生长,可以作为遗传转化的选择标记,但是CG在平板培养基上对潮霉素有较高的耐受性,抑制浓度比较高,必须达到200 μg/mL才能达到较好的抑菌效果。因此利用价格昂贵的潮霉素进行CG的遗传转化筛选突变体,其成本比较高。这个问题在丝状真菌的遗传转化中普遍存在。但是,就CG而言,应该有一些解决的办法,比如,可以通过大规模的CG菌株筛选,从中寻找对潮霉素更加敏感的菌株,用于遗传转化。又如,据有关文献报道,BAR(一种价格便宜的除草剂)已经被成功地作为选择标记用于稻瘟菌遗传转化上,苯菌灵(一种价格低廉的杀菌剂)也被成功地作为选择标记用于遗传转化上。可否将其移用于CG的遗传转化,值得进一步探索。
农杆菌菌液浓度的差异也是影响转化效率的一个很重要的因素。表面上看,菌液浓度越大,转化的机会应该越大,所以转化率应该高些,但事实并非如此。其原因可能是因为菌液浓度过大造成共培养后杀除农杆菌比较困难、农杆菌与CG抢占营养而造成CG形成菌落受到阻碍的缘故。
在共培养的培养基酸碱度筛选中,作者发现,微酸条件下(pH5.5)CG的转化效率最高,即抗性菌率最高。其原因可能是微酸性条件有利于激活农杆菌的侵染毒性、促进CG菌丝生长。
通过对比试验,发现添加200 μmol/L的乙酰丁香酮,确实可以大大提高CG的转化效率,而且用乙酰丁香酮对农杆菌进行预处理,遗传转化效率更高。
3.2关于LCG5的突变体
利用上述转化体系进行大规模的LCG5转化操作。在所得的突变体中,随机选出100个进行系统分析,获得了TCGll个菌落形态改变的突变体,其中6个为产孢量减少突变体,3个为菌落形态的突变体。这些突变体的获得,为研究胶孢炭疽菌形态发育、致病关键阶段的相关基因克隆和分子调控机制研究奠定了基础,最终为揭示胶孢炭疽菌与芒果相互作用的分子机制,为最终培育持久抗病品种和制定胶孢炭疽菌引起的病害的持久治理措施和策略奠定了基础。
3.3有待进一步研究的问题
由于时间关系,本研究还没来得及对获得的遗传转化体进行southern检测,不知道插入拷贝数,有待补充。另外,本研究获得的突变体比较少,为了使插入突变覆盖CG的整个基因组的每个基因,必须大规模筛选CG突变体。再者,本研究虽然优化了农杆菌介导胶孢炭疽菌的转化条件,但总的转化效率还不够理想,如何进一步提高转化效率成为一个迫切需要解决的问题。

