多毛番茄冷诱导转录因子CBF1转化番茄的研究
王沛文+朱文哲+刘阳+李景富+陈宏宇+陈秀玲+王傲雪


摘要:番茄在气温低于12 ℃时即不能正常开花结实,因此番茄生产受到了很大限制。多毛番茄是一种野生番茄,具有耐低温甚至抗冻的特性,短暂遭受0 ℃的低温,仍能正常开花结实。构建了多毛番茄冷诱导转录因子CBF1的植物表达载体,并通过农杆菌介导法转入番茄中,获得8株转基因阳性植株。转基因植株经冷诱导处理后,丙二醛(MDA)含量和超氧自由基( O-2 · )含量均低于非转基因对照,而超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、脯氨酸(Pro)含量、过氧化氢酶(CAT)活性、抗坏血酸过氧化物酶(ASA)活性和苯丙氨酸解氨酶(PAL)活性则高于非转基因对照,表明转多毛番茄CBF1基因(ShCBF1)可以提高番茄的抗冷性。
关键词:多毛番茄;CBF1转录因子;耐冷性;番茄;遗传转化
中图分类号:S641.201 文献标志码: A
文章编号:1002-1302(2015)04-0030-06
收稿日期:2014-05-23
基金项目:国家自然科学基金青年项目(编号:31301780);教育部科学技术研究重点项目(编号:211043);黑龙江省博士后基金(编号:LBH-Z12044);黑龙江省高校寒地蔬菜生物学重点实验室开放课题基金(编号:CVB2012-005)。
作者简介:王沛文(1990—),男,内蒙古人,硕士,从事蔬菜分子生物学方面的研究。E-mail:1009934259@qq.com。
通信作者:王傲雪,博士,教授,从事植物分子生物学方面研究。E-mail:wangaoxue@yahoo. com。
番茄是一种重要的蔬菜作物,在世界各地均有栽培,但在生产过程中,经常遭受低温冷害,因而降低了经济效益,影响番茄生产。而多毛番茄是一种野生番茄,属番茄属[1],相关研究表明,它具有耐低温甚至抗冻的特性[2]。多毛番茄叶片表面有厚密的绒毛,而普通番茄不具备此特点,推测多毛番茄表面的绒毛可能在一定程度上提高了其耐冷能力[3]。然而多毛番茄只有作父本和栽培番茄杂交才能坐果,而且果实结籽率低,转育杂交困难[4],限制了其作为育种材料的应用。多毛番茄的高耐冷性不仅与膜脂相变程度小、膜结构的调整能快速适应低温、代谢调整等一些生理生化变化有关[5],同时也受CBF1基因的诱导[6]。
CBF(CRT/DRE binding factor)基因是一种抗冷(冻)转录因子,CBF基因首先在拟南芥中被克隆出来[7]。该基因通过调动一系列的冷害相关(COR)基因完成植株的抗冷机制[8]。对多毛番茄而言,它的CBF1基因与普通番茄的CBF1基因同源性很高,但是普通番茄为冷敏植物,不具备耐冷性,多毛番茄耐冷性却很强。推其原因,可能是多毛番茄CBF1基因下游的耐冷相关基因的分布和普通番茄不同,导致多毛番茄CBF1基因对下游基因的调控作用强于普通番茄。
在拟南芥中过量表达CBF1基因,植株的抗寒能力明显提高,不仅能提高COR蛋白的含量,而且大幅提高可溶性糖和脯氨酸含量[9-11]。Hsieh等将拟南芥的CBF1基因转入番茄后,使番茄植株的CAT活性增强、脯氨酸含量增加,在干旱条件下比野生番茄植株表现更强的抗旱能力[12]。本研究从具有强抗冷性的野生番茄中克隆得到的CBF1转录因子通过农杆菌介导法转入到番茄中,并探讨了转基因植株的抗冷性及生理生化变化,获得了抗寒力增强的番茄新材料。
1 材料与方法
1.1 材料
1.1.1 植物材料 多毛番茄LA1033来自番茄遗传资源中心(tomato genetic resource center,TGRC),普通番茄Micro-Tom由东北农业大学番茄课题组提供。
1.1.2 菌株和质粒 PMD18-T载体购自TaKaRa公司(大连)。植物表达载体p(h+p)由东北农业大学生物工程实验室馈赠,大肠杆菌DH5α和农杆菌EHA105由东北农业大学番茄课题组提供。
1.1.3 主要试剂 各种限制性内切酶购于大连TaKaRa公司,T4连接酶、氨苄青霉素(Amp)、卡那霉素(Km)购自 Promega 公司;质粒提取试剂盒和胶回收试剂盒购自上海生工生物工程技术服务有限公司,其他试剂均国产分析纯试剂。
番茄再生体系利用现有的成熟体系,具体如表1所示。
1.2 试验方法
1.2.1 引物及PCR反应条件 根据笔者所在实验室已经克隆的多毛番茄LA1033的CBF1基因序列(GenBank 登录号GU129699)设计特异引物,在引物两端添加适当的酶切位点,便于载体构建。引物设计应用primer 5.0软件进行,合成由上海生物工程有限公司完成。ShCBF1up为5′-GT GGATCCACCATGAATATCTTCGAAACC-3′(斜体为BamHⅠ酶切位点),ShCBF1down为5′-GCGGTACCTTAGATGGAATAATTCC-3′(斜体为KpnⅠ酶切位点)。
表1 番茄Micro-Tom的再生体系
培养基 成分
无菌苗培养基A O+15 g/L蔗糖+7 g/L琼脂(pH=5.8)
预培养培养基B O+30 g/L蔗糖+8 g/L琼脂+1.0 mg/L BAP+1.0 mg/L NAA(pH=5.8)
共培养培养基C O+30 g/L蔗糖+8 g/L琼脂+1.0 mg/L BAP+1.0 mg/L NAA(pH=5.8)
芽诱导培养基D O+30 g/L蔗糖+7 g/L琼脂+2 mg/L Zeatin*+500 mg/L Cef+50 mg/L Km(pH=5.8)
芽伸长培养基E O+15 g/L蔗糖+7 g/L琼脂+1.0 mg/L Zeatin+500 mg/L Cef+50 mg/L Km+1.0 mg/L GA(pH=5.8)
生根培养基 F O+15 g/L蔗糖+8 g/L琼脂+2.0 mg/L IBA+500 mg/L Cef+50 mg/L Km+1.0 mg/L GA(pH=5.8)
注:*前2周用2 mg/L Zeatin,以后Zeatin的浓度减半;O为4.3 g/L MS。
以多毛番茄LA1033叶片总RNA逆转录得到的cDNA第一链为模版,引物ShCBF1up和ShCBF1down进行PCR扩增,PCR体系为20 μL:含有2 μL 10×Taq buffer,1.6 μL Mg2+(25 mmol/L),0.4 μL dNTP (10 mmol/L),上下游引物各1 μL (10 μmol/L),0.2 μL Taq DNA聚合酶(5 U/μL),1 μL模板cDNA,12.8 μL ddH2O。反应条件:95 ℃ 3 min;94 ℃ 30 s,55℃ 30 s,72 ℃ 90 s,35次循环;最后72 ℃,保温10 min,反应产物利用1%琼脂糖凝胶电泳进行检测。
1.2.2 ShCBF1表达载体的构建 将PCR扩增得到的ShCBF1经胶回收纯化后与PMD18-T载体(TaKaRa公司)连接,利用热激法转化大肠杆菌,涂板后37 ℃倒置培养过夜,挑取白斑进行PCR初筛和质粒酶切鉴定,得到含有ShCBF1基因的阳性克隆。将鉴定为阳性克隆的转化子(PMD-1033CBF1)送至北京六合华大基因科技股份有限公司进行测序,以验证目标基因的准确性。
ShCBF1植物表达载体基于载体p(h+p)进行构建,首先合成接头adapter1(5′-CGTACGTGAGCT- 3′)和adapter2(5′-CATGGCATGCAC 3′),adapter1和adapter2在65 ℃下孵育10 min后,可形成1个两端分别是KpnⅠ和SacⅠ酶切位点的黏性末端的接头。该接头在T4连接酶的作用下与其他片段进行连接反应。利用KpnⅠ和BamHⅠ双酶切PMD-1033CBF1质粒,得到ShCBF1基因。用SacⅠ和BamHⅠ双酶切质粒p(h+p),回收10 kb左右的载体片段。将目的基因、载体片段及合成好的接头用T4连接酶进行连接、转化大肠杆菌DH5α,将转化细胞涂布于含有Km抗性的LB培养基平板上进行培养,挑取单菌落进行PCR初步检测,并做好标记。然后在PCR成功的单菌落处再挑1次摇菌,提取质粒DNA,用SacⅠ和BamHⅠ双酶切质粒。鉴定重组体中ShCBF1基因片段插入的正确性,将得到的重组质粒命名为pCAMhp1033CBF1。冻融法将质粒pCAMhp1033CBF1导入农杆菌菌株EHA105中,PCR检测后待用。
1.2.3 农杆菌介导番茄的遗传转化 无菌苗获得:将番茄品种Micro-Tom的种子经挑选后,用70%无水乙醇浸泡30 s,然后用10%次氯酸钠(NaClO)消毒15 min,其间不断摇动,再用无菌水清洗3~4次后,接种于1/2MS培养基上,每瓶15~20粒,置于(26±2) ℃(16 h光照,8 h黑暗)培养,光照度 1 600~1 800 lx。待子叶展开时,在无菌条件下切下子叶放在B培养基中预培养24 h,即可用于农杆菌侵染。
农杆菌的培养:挑取YEP平板上的单菌落,接种于10 mL含相应抗生素的YEP液体培养基中,28 ℃、200 r/min振荡培养48 h,菌液长至D600 nm=0.5左右时,按1 ∶ 10的比例稀释菌液,再摇菌进行二次活化,摇约8~10 h至菌液D600 nm=0.5左右时,将菌液转入离心管,然后4 ℃、4 000 r/min离心 10 min,收集细菌细胞,用2%MSO液体培养基悬浮沉淀至D600 nm=05,该菌液作为转化用菌液,对番茄叶片外植体进行侵染。
侵染和共培养:将外植体放入已用2%MSO液体培养基悬浮好的菌液侵染预培养24 h的子叶20 min,其间轻轻摇动,浸染完之后将番茄叶盘背面向上放入共培养培养基C中共培养48 h。
外植体的筛选:外植体筛选利用卡那霉素,筛选压力为50 mg/L,设对照为未经农杆菌侵染的子叶外植体放置到D培养基中,这些子叶应该被卡那霉素杀死。已侵染的并共培养48 h的外植体也转移置D培养基中培养2周。
外植体的继代:每隔2周将D培养基中的外植体继代1次,在此期间叶原基大概在2周内就形成了,将形成叶原基的外植体切成小块转移到E培养基中,每隔2周或间隔更短时间继代1次。经过2~3周E培养基的继代和筛选。3种类型的继代外植体被区分出来并分别转入不同的培养基:具有1 cm长的形状良好的芽的外植体转移置E培养基中;致密的、绿色的外植体(有或没有绿色的原基和小的不定芽)转到含1 mg/L玉米素的D培养基;黑色或棕色的外植体已被卡那杀死,组织疏松的白色的外植体没有分生能力,这2种外植体都应丢弃。
生根培养和驯化移栽:当芽长置2~4 cm时切离外植体,转到生根培养基F中。植株长到5 cm可驯化移栽到土中。将转基因植株从三角瓶中取出,用自来水洗掉植株根部的琼脂,然后移栽到装有湿润土壤的营养钵中。再把营养钵放在浅盘中用自来水充分浸透营养钵中的土壤。将浅盘用透明的塑料膜罩上,以保证较高的湿度。5~7 d后撤掉塑料膜,施水肥,植株长置10 cm定植到温室。
1.2.4 转化植株的PCR检测 CTAB法提取转化获得的番茄幼苗的基因组DNA,根据NptⅡ序列设计引物NptⅡup 5′-ACTGGGCACAACAGACAA-3′和NptⅡdown 5′-CCGTAAAGCACGAGGAA-3′。以基因组DNA模板、NptⅡ上下游引物进行PCR扩增,以未转基因的番茄植株为阴性对照,质粒为阳性对照。
1.2.5 转基因植株的耐低温性检测 低温对植物造成的影响主要是对植物细胞的生理生化特性产生影响,比如细胞的膜脂过氧化作用、细胞抗氧化酶系统以及细胞的脂类物质发生变化等。为了初步检测转基因植株的耐低温性,选取阳性的转ShCBF1植株和对照植株的幼苗,置于人工气候室内培养,22~25 ℃、光照16 h/d,在6张真叶时用于低温胁迫处理。将转基因植株株系TS-1、TS-2植株和对照植株(CK)在5 ℃条件下处理,分别在处理后0、24、36、48、96、144 h取样,测定并分析转基因植株与对照植株间的丙二醛(MDA)含量、超氧自由基( O-2 · )含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、脯氨酸(Pro)含量和过氧化氢酶(CAT)活性、抗坏血酸过氧化物酶(ASA)活性和苯丙氨酸解氨酶(PAL)活性等各项指标。测定方法参照朱文哲等的方法(2011),同时比较转基因与为转基因植株的形态特征。
2 结果与分析
2.1 多毛番茄CBF1基因的pCAMhp1033载体构建
用KpnⅠ和BamHⅠ双酶切质粒PMD-1033CBF1,回收700 bp左右的1033CBF1基因片段,同时,用SacⅠ和BamHⅠ双酶切质粒p(h+p),回收10 kb左右的载体片段(图1)。将这2个片段与已连接好的KpnⅠ、SacⅠ接头一起用T4连接酶连接并转化。
经PCR鉴定和酶切鉴定,均得到预期目的片段,证明植物表达载体pCAMhp1033CBF1构建成功(图2)。
2.2 植物表达载体pCAMhp1033转化农杆菌
采用冻融法将已构建好的植物表达载体pCAMhp1033导入根癌农杆菌EHA105感受态细胞,涂布在含有Rif和Km的YEP固体平板培养基上,28 ℃恒温培养48 h后长出菌落,随机挑取菌落进行ShCBF1基因的PCR扩增,电泳结果可以看出,转化的菌落可扩增出约700 bp左右特异的目的基因片段(图3),表明得到了完整的Ti质粒表达载体系统。因为直接提取农杆菌质粒进行酶切鉴定比较困难,所以,将提取的PCR检测具有目的条带的农杆菌质粒转化入大肠杆菌,再提取大肠杆菌质粒进行酶切鉴定,如图4所示,表明pCAMhp1033已成功转入农杆菌菌株EHA105。
2.3 番茄的遗传转化
通过对番茄子叶进行遗传转化,最终得到抗性植株13株,番茄品种Micro-Tom的遗传转化过程见图5。
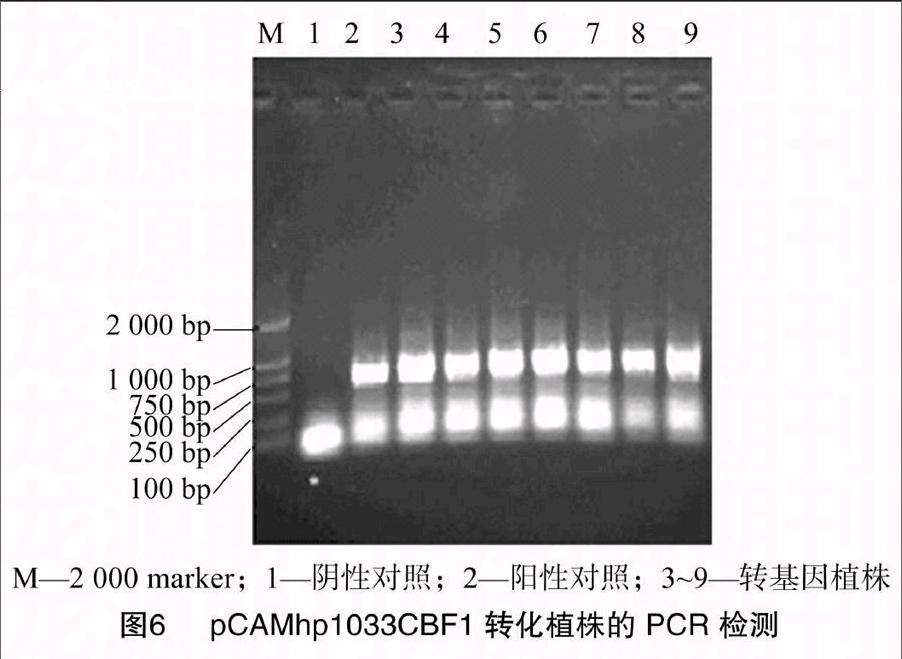
2.4 再生植株的PCR检测
利用NptⅡ序列对转基因植株进行PCR检测,以质粒为阳性对照,以未转基因植株为阴性对照,扩增结果如图6所示。抗性植株有13株,8株表现为阳性。这初步说明1033CBF1目的基因整合到Micro-Tom的番茄基因组中。
2.5 转基因植株的耐低温性检测
2.5.1 低温胁迫对转化植株的MDA和 O-2 · 含量的影响 在非低温胁迫条件下,转基因植株与对照植株之间的MDA、
O2-含量无明显差异。随着5 ℃低温胁迫时间延长,转基因植株和对照植株的MDA、 O-2 · 含量逐渐升高,而对照植株比转基因植株升高趋势快且显著高于转基因植株,转基因株系TS-1和TS-2之间差异不明显,由此可见转基因植株的细胞膜伤害程度比非转基因植株轻(图7-A、图7-B)。
2.5.2 低温胁迫对转化植株的SOD和POD活性的影响 随着5 ℃低温胁迫时间的延长,转基因植株与对照植株的SOD活性在72 h时出现了一个峰值,在0~72 h之间呈上升趋势,之后下降。而POD活性均呈上升趋势,转基因株系 TS-1 和TS-2之间无明显差异,且显著高于对照植株(图 7-C、图7-D)。
2.5.3 低温胁迫对转化植株的脯氨酸(Pro)含量和CAT活性的影响 在非低温胁迫条件下,转基因植株与对照植株之间的脯氨酸含量无明显差异。随着5 ℃低温胁迫时间的延
长,转基因植株和对照植株的脯氨酸含量均表现为上升趋势,转基因株系TS-1和TS-2之间差异不明显,但明显高于对照(图 7-E)。由于研究表明脯氨酸含量与植物抗寒性有很大相关性,说明转基因植株的耐冷性更强。随着5 ℃低温胁迫时间延长,转基因株系TS-1和TS-2的CAT活性呈上升趋势,而对照植株则呈下降趋势(图7-F)。
2.5.4 低温胁迫对转化植株的ASA和PAL活性的影响 在非低温胁迫条件下,转基因植株与对照植株之间的ASA和PAL活性无明显差异。随着5 ℃低温胁迫时间延长,转基因植株和对照植株的ASA、PAL活性逐渐下降,转基因株系TS-1和TS-2之间差异不明显,但明显高于对照(图7-G、图7-H)。
2.5.5 转基因植株的形态观察 低温胁迫后,转基因植株生长未受影响,而非转基因植株生长受到一定抑制,转基因植株比非转基因植株高,叶色浓绿,而非转基因植株的叶色要明显比转基因植株的浅,呈现淡绿色,且有一定程度的萎蔫(图8)。
3 结论与讨论
番茄是一种极具营养价值和经济价值的世界性蔬菜作物[13],而冷(冻)害常会严重影响其产量。低温胁迫严重影响着植物的生长发育,番茄在温度低于12 ℃时就不能正常开花结果和生长发育[14],在0~12 ℃之间,植株表现出冷害,损伤程度受到低温胁迫时间的影响。多毛番茄是一种野生番茄,具有耐低温甚至抗冻的特性。本研究成功构建了多毛番茄的冷诱导转录因子CBF1的植物表达载体,并通过农杆菌介导法获得了番茄的转ShCBF1植株,丰富了抗寒番茄转基因新种质。
ROS( O-2 · 、H2O2、·OH)是植物体有氧代谢不可避免的产物,会引发生物膜的不饱和脂肪酸发生膜脂过氧化反应,并由此产生对细胞有毒性的脂质过氧化物,在低温胁迫时,植物体自由基增加,使质膜过氧化作用加强,导致膜的损伤和破坏。本研究中转基因植株经冷诱导处理后,丙二醛(MDA)含量和超氧自由基( O-2 · )含量均低于非转基因对照,证明了转ShCBF1基因植株对低温胁迫的耐受性增强,增加了自身的抗寒性。
低温胁迫下,转基因株系中超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、脯氨酸(Pro)含量、过氧化氢酶
(CAT)活性、 抗坏血酸过氧化物酶(ASA)活性和苯丙氨酸解
氨酶(PAL)活性则高于非转基因对照。SOD主要的功能是清除 O-2 · ,产生H2O2[15-17]。而CAT能够在低温胁迫过程中清除SOD产生的H2O2[18],维持体内活性氧代谢平衡,保护膜结构,从而使植物能在一定程度上忍耐、减缓或抵抗低温胁迫。低温胁迫时间的延长诱导POD酶活性的增强,从而抵御低温下氧自由基的伤害。适当的维持体内膜保护酶活性和 O-2 · 含量的平衡关系。由于冷诱导基因CBF1主要受冷诱导表达,因此,在冷胁迫下植株内SOD活性增减可能是CBF1基因在低温逆境诱导下超量表达,在一定程度上使得其自身有效清除体内超氧离子的能力增强。
此外,在低温胁迫条件下,自由基的不断积累会破坏ASA和PAL对活性氧的毒害防御作用。而转基因植株可能其本身耐冷基因CBF1受冷诱导后超量表达,增强了其耐冷机能。使转基因植株的ASA和PAL活性显著高于对照植株。冷胁迫后生理生化指标的测定和植株形态观察充分表明了转ShCBF1基因可以提高番茄的抗冷性。
参考文献:
[1]Dolstra O,Venema J H,Groot P J,et al. Low-temperature-related growth and photosynthetic performance of alloplasmic tomato (Lycopersicon esculentum Mill.) with chloroplasts from L. hirsutum Humb.&Bonpl.[J]. Euphytica,2002,124(3):407-421.
[2]Patterson B D,Smillie R M. Chilling resistance in Lycopersicon hirsutum Humb.& Bonpl,a wild tomato with a wide altitudinal distribution[J]. Plant Physiology,1978,5:609-617.
[3]Foolad M R,Lin G Y. Genetic analysis of cold tolerance during vegetative growth in tomato,Lycopersicon esculentum Mill.[J]. Euphytica,2001,122:105-111.
[4]褚亚峰,李文丽,王 富. 多毛番茄主要生物学特性研究[J]. 中国农学通报,2012,28(16):161-164.
[5]朱文哲,李景富,王傲雪. 低温胁迫对多毛番茄幼苗生理生化特性的影响[J]. 东北农业大学学报,2011,42(4):57-61.
[6]Li Z J,Zhang L L,Li J F,et al. Isolation and functional characterization of the ShCBF1 gene encoding a CRT/DRE-binding factor from the wild tomato species Solanum habrochaites[J]. Plant Physiology and Biochemistry,2014,74:294-303.
[7]Stockinger E J,Gilmour S J,Thomashow M F. Arabidopsis thaliana CBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE,a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J]. Proc Natl Acad Sci USA,1997,94:1035-1040.
[8]Thomashow M F. Plant cold acclimation:freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:571-599.
[9]Gilmour S J,Sebolt A M,Everard J D,et al. Overexpression of the Arabidopsis CBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation[J]. Plant Physiology,2000,124:1854-1865.
[10]Jaglo-Ottosen K R,Gilmour S J,Zarka D G,et al. Arabidopsis CBF1 overexpression induces COR genes and enhances freezing tolerance[J]. Science,1998,280:104-106.
[11]Zhang L L,Li Z J,Li J F,et al. Ectopic overexpression of SsCBF1,a CRT/DRE-binding factor from the nightshade plant Solanum lycopersicoides,confers freezing and salt tolerance in transgenic Arabidopsis[J]. PLoS One,2013,8(6):e61310.
[12]Hsieh T H,Lee J T,Charng Y Y,et al. Tomato plants ectopically expressing Arabidopsis CBF1 show enhanced resistance to water deficit stress[J]. Plant Physiology,2002,130:618-626.
[13]张治平,於丙军,汪良驹,等. 低温下ALA对番茄光合色素和抗氧化酶活性的影响[J]. 江苏农业学报,2014,30(1):222-224.
[14]Hu W H,Zhou Y D,Du Y S,et al. Differential response of photosynthesis in greenhouse and field ecotypes of tomato to long-term chilling under low light[J]. Journal of Plant Physiology,2006,163:1238-1246.
[15]陈 倩,陶功胜,谢寅峰,等. 高氯酸钾胁迫对水稻幼苗光合作用及保护酶活性的影响[J]. 江苏农业学报,2013,29(4):715-721.
[16]Bowler C,van Montagu M,Inzé D. Superoxide dismutase and stress tolerance[J]. Annu Rev Plant Physiol Plant Mol Biol,1992,43:83-116.
[17]赵秋月,张广臣.番茄对碱性盐胁迫的响应机制[J].江苏农业科学,2014,42(8):139-142.
[18]Miyake C,Asada K. Ferredoxin-dependent photoreduction of monodehydroascorbate radicals in spinach thylakoids[J]. Plant Cell Physiol,1994,35:539-549.

