GALNT4介导的TYRO3糖基化对子宫内膜癌的恶性生物学行为的影响
【摘 要】目的:探讨多肽GalNAc转移酶4(GalNAc transferases,GALNT4)通过介导蛋白酪氨酸激酶受体(protein tyrosine kinase receptor,TYRO3)糖基化影响子宫内膜癌(endometrial carcinoma,ECa)的恶性生物学行为的分子机制。方法:研究人群包括从106例ECa患者中收集的福尔马林固定石蜡包埋的ECa组织样本制作组织微阵列。分析GALNT4表达与患者诊断时的年龄、疾病阶段、淋巴血管侵犯、生存结局的关系。人ECa细胞系Ishikawa和RL95-2转染GALNT4-特异性siRNA或GALNT4质粒以敲低或上调GALNT4表达。采用si-TYRO3处理GALNT4过表达的Ishikawa细胞。通过Transwell实验测量了细胞的迁移、侵袭能力。将GALNT4过表达或敲低的Ishikawa细胞注射到NOD/SCID小鼠脾脏中以诱导肝转移,分析肝转移病灶数量。结果:ECa组织中GALNT4的表达较正常组织增加(P<0.05)。GALNT4低表达组和GALNT4高表达组在年龄、组织学类型、国际妇产联盟(International Federation of Gynecology and Obstetrics,FIGO)分期存在差异(P<0.05)。GALNT4表达水平与OS呈负相关,HR为2.610(95%CI=1.094~6.226)(P<0.05)。GALNT4高表达组的总生存期低于GALNT4低表达组(P<0.05)。与Vector组相比,GALNT4组Ishikawa和RL95-2细胞迁移和侵袭细胞数增加(P<0.05)。与si-NC组相比,si-GALNT4#1、si-GALNT4#2组Ishikawa和RL95-2细胞的迁移、侵袭细胞数降低(P<0.05)。与Vector组相比,GALNT4组Ishikawa细胞肝转移病灶数量增加(P<0.05)。相反,与si-NC组相比,si-GALNT4#1、si-GALNT4#2组Ishikawa细胞肝转移病灶数量减少(P<0.05)。与GALNT4+ si-NC组相比,GALNT4+si-TYRO3组Ishikawa细胞的迁移、侵袭细胞数降低(P<0.05)。结论:GALNT4在ECa组织中过表达,并与不良预后相关。机制研究显示,GALNT4促进ECa细胞迁移、侵袭的行为部分是通过修饰TYRO3的O-糖基化和蛋白稳定性实现。
【关键词】多肽GalNAc转移酶4;蛋白酪氨酸激酶;子宫内膜癌;糖基化
【中图分类号】R737.33【文献标志码】A【收稿日期】2024-01-08
基金项目:湖北省自然科学基金青年资助项目(编号:2022CFB991)。
Impact of TYRO3 glycosylation mediated by GalNAc transferase 4 on the malignant biological behavior of endometrial carcinoma
Zhu Yilin,Gao Xuemei,Meng Hongjuan,Liu Yan
(Department of Obstetrics and Gynecology,Wuhan Hospital of Integrated Traditional Chinese and Western Medicine)
【Abstract】Objective:To investigate the molecular mechanism of action of the polypeptide GalNAc transferase 4(GALNT4) on the malignant biological behavior of endometrial carcinoma (ECa) by mediating the glycosylation of receptor tyrosine kinase TYRO3. Methods:Formalin-fixed paraffin-embedded ECa tissue samples were collected from 106 ECa patients to prepare tissue microarrays. The association of the expression of GALNT4 with the age at diagnosis,disease stage,lymphovascular invasion,and survival outcome was analyzed. Human ECa cell lines Ishikawa and RL95-2 were transfected with GALNT4-specific siRNA or GALNT4 plasmid to knockdown or upregulate the expression of GALNT4,and Ishikawa cells with GALNT4 overexpression were treated with si-TYRO3. Transwell assay was used to assess the migration and invasion abilities of cells. Ishikawa cells with GALNT4 overexpression or knock? down were injected into the spleen of NOD/SCID mice to induce liver metastasis,and the number of liver metastatic lesions was ana? lyzed. Results:The expression level of GALNT4 in ECa tissue was significantly higher than that in normal tissue(P<0.05). There were significant differences in age,histological type,and FIGO stage between the low-expression GALNT4 group and the high-expression GALNT4 group(P<0.05). The expression level of GALNT4 was negatively correlated with overall survival(hazard ratio=2.610,95%CI= 1.094-6.226,P<0.05). The high-expression GALNT4 group had a significantly shorter overall survival time than the low-expression GALNT4 group(P<0.05). Compared with the Vector group,the GALNT4 group had significant increases in the migration and invasion of Ishikawa and RL95-2 cells(P<0.05). Compared with the si-NC group,the si-GALNT4#1 and si-GALNT4#2 groups had significant reductions in the migration and invasion of Ishikawa and RL95-2 cells(P<0.05). Compared with the Vector group,the GALNT4 group had a significant increase in the number of liver metastatic le? sions due to Ishikawa cells(P<0.05),and on the contrary,compared with the si-NC group,the si-GALNT4#1 and si-GALNT4#2 groups had a significant reduction in the number of liver metastatic lesions(P<0.05). Compared with the GALNT4+si-NC group,the GALNT4+si-TYRO3 group had a significant reduction in the migration and invasion of Ishikawa cells (P<0.05). Conclusion:GALNT4 is overexpressed in ECa tissue and is associated with poor prognosis. The mechanism study shows that GALNT4 promotes the migration and invasion of ECa cells partly by modifying the O-glycosylation and protein stability of TYRO3.
【Key words】polypeptide GalNAc transferase 4;protein tyrosine kinase;endometrial carcinoma;glycosylation
子宫内膜癌(endometrial carcinoma,ECa)是最常见的妇科恶性肿瘤,在发展中国家的发病率和病死率均有所增加[1]。一些ECa患者可以通过手术完全治愈,但晚期ECa患者的预后总是很差,需要更有效的临床治疗策略[2]。因此,迫切需要找到新的诊断标记和确定治疗靶点来改善ECa的治疗。糖基化改变影响许多细胞特性,包括细胞增殖、凋亡、分化、黏附、迁移、侵袭和免疫反应[3]。哺乳动物细胞中蛋白质糖基化的两种主要形式是N-连接和O-连接。其中,最丰富的O-糖基化类型是N-乙酰氨基半乳糖(N-acetylgalactosamine,GalNAc)型O-糖基化,由GalNAc转移到丝氨酸(S)或苏氨酸(T)残基的羟基以形成Tn抗原(GalNAc-α-S/T)介导[4]。GalNAc型O-糖基化反应由一大家族的多肽Gal? NAc转移酶(GalNAc transferases,GALNTs)催化,该家族由20个成员组成,即GALNT1-20[5]。GALNT酶以时空依赖的方式在各种组织中差异表达[6]。许多报告已经证明了GalNAc型O-聚糖和GALNT基因的生物功能和在癌症中的重要性[7]。其中,GALNT4已被报道为乳腺癌的诊断标志物,并可能通过调节纤联蛋白的O-糖基化来调节乳腺癌的肿瘤发生[8]。GALNT4调节死亡受体O-糖基化并控制肿瘤细胞对促凋亡配体Apo2L/TRAIL的敏感性[9]。然而,目前关于GALNT4在ECa中的生物学功能仍不清楚。课题组前期通过GEPIA在线数据库分析显示GALNT4在ECa中的表达明显增加,并且其表达与患者预后密切相关。因此,本研究在前期发现的基础上进一步通过病理分析和体外实验探索GALNT4介导的糖基化修饰在ECa恶性生物学行为中的分子机制。
1 材料与方法
1.1 材料
研究人群包括从106例ECa患者中收集的福尔马林固定石蜡包埋的ECa组织样本制作组织微阵列,分布为30个国际妇产联盟(International Federation of Gynecology and Obstetrics,FIGO)1~2级(低级别)子宫内膜样癌(low grade endometrioid carcinoma,LEMC)(28.3%)、28个FIGO 3级(高级别)子宫内膜样癌(high grade endometrioid carcinoma, HEMC)(26.4%)、31个浆液性癌(serous cancers,SC)(29.2%)和17个透明细胞癌(clear cell carcinoma,CCC)(16%)。2例妇科病理学家对所有病理切片进行了复查,并确认了初步诊断和组织学分级。记录每个样本的患者诊断时的年龄、疾病阶段、是否存在淋巴血管侵犯、生存结局。这项研究得到了本中心伦理委员会的批准(审批号:2021006),并获得患者的知情同意。
1.2 方法
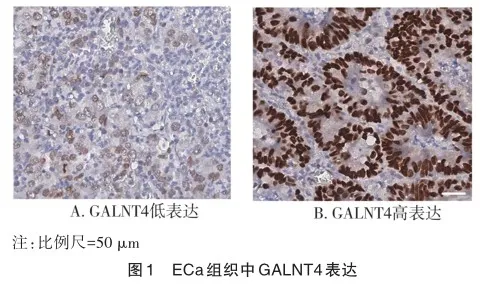
1.2.1 TMA与免疫组织化学染色 使用Leica Bond RX自动化系统(德国Leica Biosystems公司)对载玻片进行染色。用Dewax Solution(德国Leica公司)在自动化系统上对载玻片进行脱蜡2次,每次15 min,然后在100%-85%-75%乙醇中再水合,并在室温下在3% H2O2中浸泡10 min。抗原在97 ℃的柠檬酸缓冲液中提取30 min,并用封闭缓冲液(上海碧云天公司)封闭1 h。将小鼠抗人GALNT4多克隆抗体(美国Invi? trogen公司)用Dako抗体稀释剂(美国Carpenteria公司)以1∶200的稀释比稀释,并与抗原孵育15 min。使用MaxVisionⅡ试剂盒进行第二抗体孵育(美国MXB公司)。用苏木精复染裁片,脱水并盖玻片。使用Leica Bond Polymer Refined检测系统进行评估。通过将阳性染色细胞的百分比乘以核染色强度来计算H-score(范围:0~300)。强度被量化为0(无染色)、1+(弱染色)、2+(中度染色)和3+(强染色),频率被量化为细胞表现出染色的百分比。然后,根据每个强度级别的染色细胞的百分比来计算H-scores=1×(%细胞染色强度为1+)+2×(%细胞染色强度为2+)+3×(%细胞染色强度为3+)。染色代表图见图1。
1.2.2 细胞培养 人ECa细胞系Ishikawa和RL95-2购自美国典型培养物保藏中心。将细胞培养在含有10%胎牛血清、100 U/mL青霉素和100 g/mL链霉素的DMEM培养基(美国Gibco公司)中。
1.2.3 转染与质粒构建 对于瞬时敲除,使用2种独立的GALNT4-特异性siRNA、蛋白酪氨酸激酶受体(protein tyro? sine kinase receptor,TYRO3)-特异性siRNA(美国Invitrogen公司)和非靶向siRNA(美国Invitrogen公司)(最终浓度为10 nmol/L)转染Ishikawa和RL95-2细胞48 h。针对GALNT4的siRNA为si-GALNT4#1:5’-CAGCAGGGAACUAAGCCUC GACA-3’和si-GALNT4#2:5’-UGUCGAGUUAGUUCCCUGC UG-3’。抗TYRO3的siRNA为si-TYRO3:5’-GAGCGGGAA UUUGGAGAACA-3’。非靶向siRNA(si-NC)为5’-CACACCU GCCAUGUCGACUGGUUU-3’。使用慢病毒感染系统在ECa细胞中过表达GALNT4。从用20 μg GALNT4/TRIPdU3 IRES-GFP(GALNT4)或TRIPdU3 IRES-GFP空质粒(15 μg psPAX2和6 μg VSVG,Vector)转染Ishikawa和RL95-2细胞。转染后48 h,通过蛋白质印迹分析证实了GALNT4的过表达。
1.2.4 蛋白质印迹分析、凝集素下拉测定和蛋白质降解分析 将处理的细胞在RIPA裂解缓冲液(上海碧云天公司)中制备匀浆,随后使用BCA蛋白质测定试剂盒测定蛋白质浓度(上海碧云天公司)。蛋白质在8%SDS/PAGE凝胶上分离,并转移到PVDF膜上。用5%牛血清白蛋白(BSA;美国Bio-Rad公司)封闭1 h,将膜与一级抗体在4 ℃过夜。抗GAPDH的抗体购自美国Santa Cruz Biotechnology公司。抗GALNT4、TYRO3的抗体购自美国Cell Signaling Technology公司。然后将膜与辣根过氧化物酶缀合的第二抗体孵育,并使用ECL试剂(美国GE Healthcare Life Sciences公司)检测蛋白质。通过凝集素下拉分析O-聚糖的变化。将300 μg总细胞裂解物与Vicia Vilosa凝集素(VVA)琼脂糖珠(美国Vector Laboratories公司)在4 ℃孵育过夜。用PBS洗涤后,对被拉下的蛋白质进行蛋白质印迹分析。为了分析蛋白酶体依赖性降解,用2 mmol/L苄基-a-GalNAc(美国Sigma公司)处理细胞24 h。收集总细胞裂解物,使用蛋白质印迹分析检测TYRO3和负载对照GAPDH。
1.2.5 Transwell检测细胞迁移、侵袭能力 将处理的细胞(2×104个/孔)接种在无Matrigel基质或预涂有100 μL 1 μg/μL Matrigel基质(美国BD Biosciences公司)的Transwell室(美国Corning公司)中用于迁移、侵袭测定。分别将无血清培养基和完全培养基添加到上室和下室。孵育24 h后,迁移、侵袭的细胞用4%多聚甲醛固定,1%结晶紫染色,显微镜下拍照。
1.2.6 实验动物模型 SPF级5周龄雌性非肥胖糖尿病/严重联合免疫缺陷(NOD/SCID)小鼠购自上海斯莱克实验动物有限责任公司。所有小鼠饲养在无病原体环境下。将小鼠分为5组,每组6只:Vector组、GALNT4组、si-NC组、siGALNT4#1组、si-GALNT4#2组。将经转染处理的Ishikawa细胞(2×106)注射到小鼠的脾脏中。在6周时处死小鼠,测量肝脏中的转移性肿瘤,并通过免疫组化分析转移病灶中GALNT4表达情况。
1.3 统计学方法
使用SPSS 22.0和GraphPad Prism 9进行统计分析。计量资料用均数±标准差(x±s)表示,比较采用独立样本t检验;计数资料用例数(百分比)表示,采用卡方检验,单因素方差分析比较多个实验组之间的差异。使用Kaplan-Meier方法绘制生存曲线,通过时间-事件数据的对数秩检验比较总生存率。独立样本t检验和单因素方差分析用于分析体外和体内实验的组间差异。检验水准α=0.05。
2 结 果
2.1 GALNT4在ECa组织中的表达情况及其与临床特征的关系
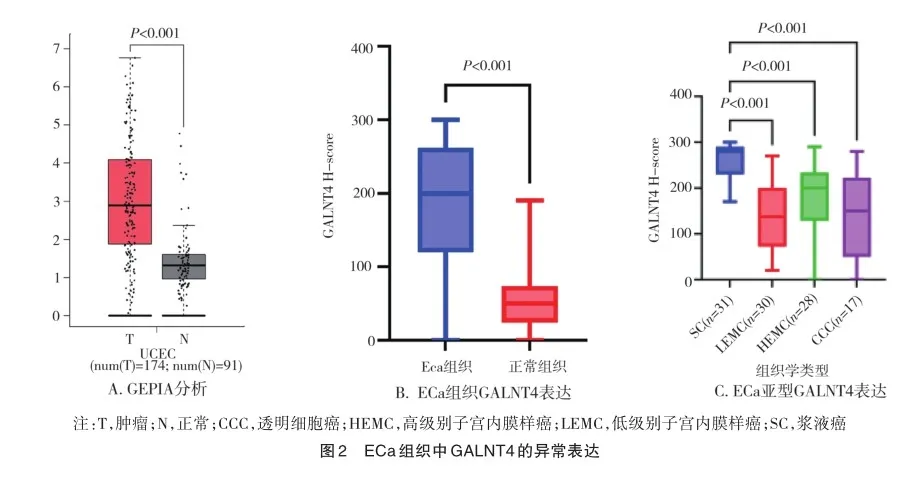
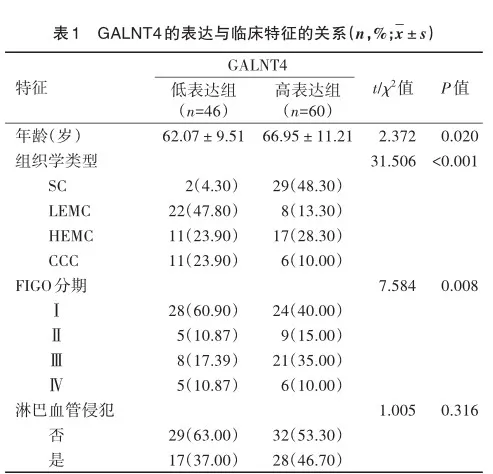
基于GEPIA在线数据库和临床样本分析显示,ECa肿瘤组织中GALNT4的表达较正常组织增加(t=2.445,P=0.015,t=22.462,P<0.001)(图2A、B)。在临床样本中,通过免疫组织化学分析GALNT4在不同ECa组织学类型中的表达情况,SC中GALNT4的表达高于HEMC、CCC和LEMC(F=20.220,P<0.001)(图2C)。根据GALNT4表达水平的中位数,将患者分为低表达组(n=46)和高表达组(n=60)。GALNT4低表达组和GALNT4高表达组在年龄、组织学类型、FIGO分期差异有统计学意义(t=2.372,P=0.020;F=31.506,P<0.001;F= 7.584,P=0.008)(表1)。
2.2 GALNT4蛋白表达与不良疾病结局相关
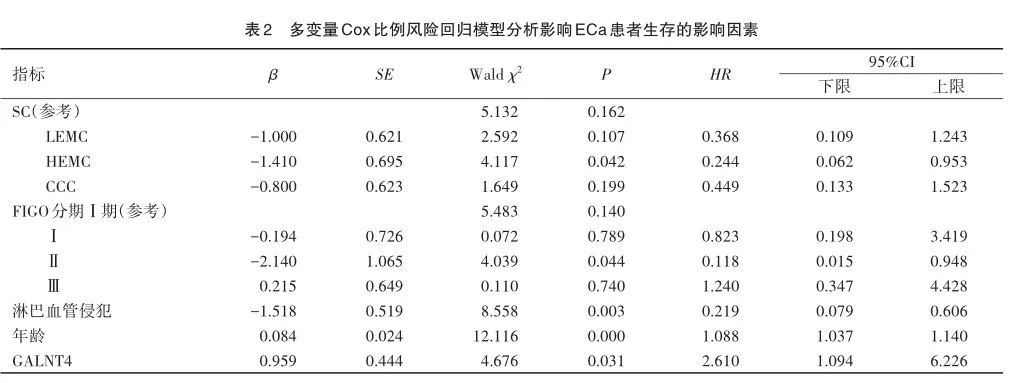
晚期癌症的中位疾病生存期为48.5个月。由于有限的临床随访,无法估计患者的早期疾病生存率。通过调整诊断时的年龄、组织学亚型、FIGO分期和淋巴血管侵犯进行反向剔除,GALNT4表达水平与OS呈负相关,HR为2.610(95%CI= 1.094~6.226)(P<0.05)(表2)。Kaplan-Meier曲线分析显示,GALNT4高表达组的总生存期低于GALNT4低表达组差异有统计学意义(P<0.05)(图3)。

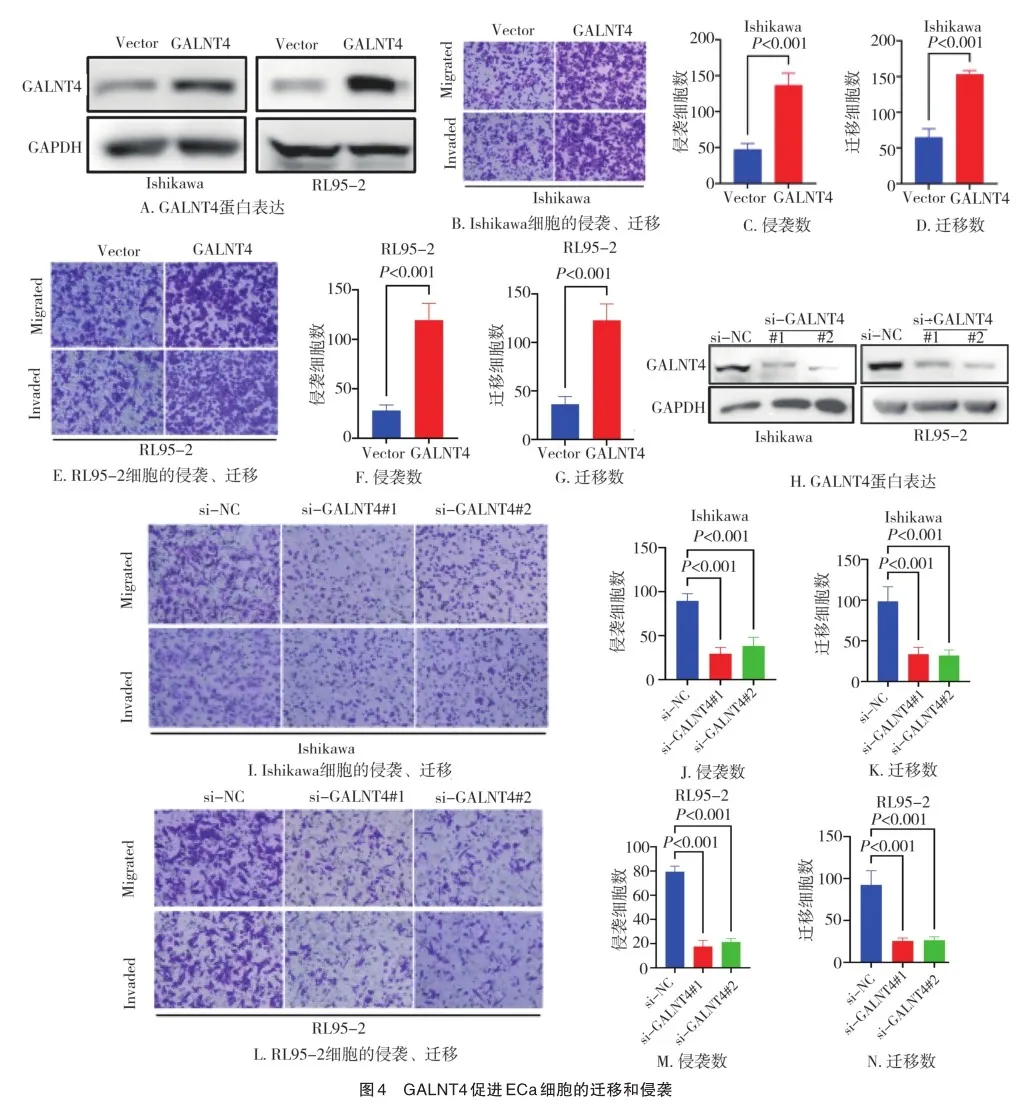
2.3 GALNT4过表达促进ECa细胞的迁移和侵袭
因为转移是癌症死亡的关键决定因素,因此我们集中研究GALNT4对ECa细胞迁移和侵袭的影响。蛋白质印迹分析证实在GALNT4质粒转染的Ishikawa和RL95-2细胞中GALNT4过表达(图4A)。与Vector组相比,GALNT4组Ishikawa和RL95-2细胞迁移和侵袭细胞数增加(P<0.05)(图4B~G)。在Ishikawa和RL95-2细胞中用不同的siRNAs敲低GALNT4(图4H)。与si-NC组相比,si-GALNT4#1、siGALNT4#2组Ishikawa和RL95-2细胞的迁移、侵袭细胞数显著降低(P<0.05)(图4I~N)。这些结果表明GALNT4表达的沉默足以抑制ECa细胞(包括Ishikawa、RL95-2)的迁移和侵袭。
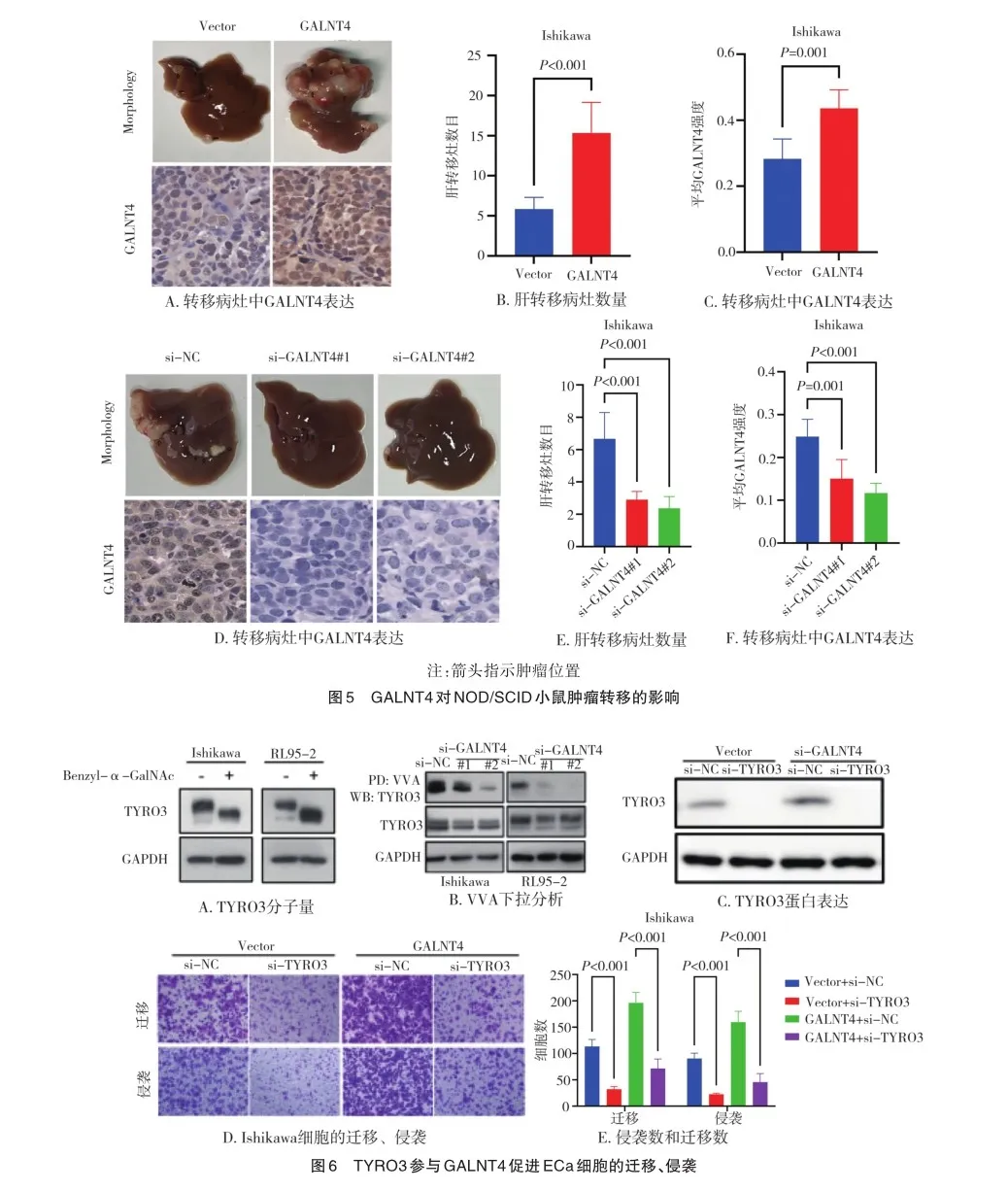
2.4 GALNT4对NOD/SCID小鼠肿瘤转移的影响
为了研究GALNT4过表达对体内肿瘤转移的影响,将GALNT4过表达或敲低的Ishikawa细胞注射到NOD/SCID小鼠脾脏中以诱导肝转移。结果显示,与Vector组相比,GALNT4组Ishikawa细胞肝转移病灶数量明显增加(P< 0.05),并且转移病灶中GALNT4染色强度明显增加(P< 0.05)(图5A~C)。相反,与si-NC组相比,si-GALNT4#1、siGALNT4#2组Ishikawa细胞肝转移病灶数量明显减少,差异有统计学意义(P<0.05),并且转移病灶中GALNT4染色强度降低,差异有统计学意义(P<0.05)(图5D~F)。
2.5 TYRO3参与GALNT4促进ECa细胞的迁移、侵袭
已知纤连蛋白由大量修饰的GalNAc型O-聚糖组成。为了证明携带O-聚糖的TYRO3是否被GalNAc型O-聚糖修饰,用苄基-α-GalNAc处理ECa细胞以抑制O-聚糖延伸。结果显示苄基-α-GalNAc降低了RL95-2和Ishikawa细胞中TYRO3的分子量(图6A),表明TYRO3携带O-聚糖。为了证明GALNT4可以在TYRO3上添加O-聚糖,本研究进行了长柔毛野豌豆外源凝集素(VVA)下拉试验。已知VVA特异性识别丝氨酸或苏氨酸残基上的GalNAc,结果显示Ishikawa和RL95-2细胞中GALNT4敲除明显降低了TYRO3上的GalNAc(图6B),表明GALNT4可以在TYRO3上产生O-聚糖,并调节ECa细胞中TYRO3蛋白的水平。
在用或不用TYRO3siRNAs处理的GALNT4过表达的Ishikawa细胞中进行了Transwell实验。结果显示,与GALNT4+si-NC组相比,GALNT4+si-TYRO3组Ishikawa细胞的迁移、侵袭细胞数明显降低,差异有统计学意义(P< 0.05)(图6C~E)。
3 讨 论
GalNAc型O-糖基化和GALNT基因家族的20个成员在调节细胞行为中起着至关重要的作用。先前的研究表明,GALNT4在多种恶性肿瘤中上调,包括肝细胞癌、乳腺癌和膀胱癌,并且与肿瘤进展密切相关[10-11]。然而,GALNT4在ECa中的功能和详细的分子机制仍然是未知的。在目前的研究中,本研究证实GALNT4表达在ECa中普遍上调,并且与患者的年龄、组织学类型、FIGO分期密切相关。此外,GALNT4高表达对ECa患者预后产生不利影响,表明GALNT4可能介导ECa的恶性生物学行为。在体外实验中,GALNT4过表达促进ECa细胞迁移和侵袭,在体内促进肝脏转移。相反,沉默GALNT4抑制了这些恶性行为。在机制方面,本研究证明了TYRO3是GALNT4的一种新的蛋白底物,GALNT4主要通过蛋白酶体依赖途径调节TYRO3降解。此外,GALNT4介导的ECa细胞的迁移、侵袭几乎被TYRO3的siRNAs阻断,表明TYRO3是GALNT4介导的迁移、侵袭的关键决定因素。这项研究为GALNT4-TYRO3轴在ECa进展的发病机制中的作用提供了新的见解。
TAM(TYRO3、AXL和MERTK)家族受体酪氨酸激酶(TAM family of receptor tyrosine kinases,RTKs)在多种癌症中异常表达,并且基于其在癌症细胞和促肿瘤免疫细胞中的不同功能,已被确定为有前景的治疗靶点[12]。其中,TYRO3表达与多种实体癌的转移风险增加和低存活率相关,包括乳腺癌、非小细胞肺腺癌、卵巢癌、透明细胞肾癌和胰腺癌[13-14]。在ECa中,TYRO3被认为是ECa生存率差和对抗EGFR治疗耐药的预测因子[15]。此外,TYRO3也在成纤维细胞、血管细胞和几种免疫细胞中表达并发挥关键作用[16-17]。因此,TYRO3是癌症治疗的新兴目标。与以前的报道一致,本研究通过遗传学方法抑制TYRO3的表达显著逆转GALNT4过表达介导的ECa细胞的迁移、侵袭。因此,本研究提出GALNT4介导的ECa迁移、侵袭至少部分是通过激活TYRO3实现。此外,由于RTKs中TYRO3、AXL和MERTK的结构相似,因此AXL、MERTK可能也有助于GALNT4介导的迁移、侵袭。虽然GALNT4如何调节AXL和MERTK的详细机制仍有待进一步研究,但有理由预计所有TAM受体具有相似的功能,并可能参与GALNT4介导的迁移、侵袭行为。它们对细胞迁移、侵袭性的相对贡献可能取决于它们在ECa细胞中的表达水平。
据报道,GALNT亚型对具有GalNAc的肽和糖肽表现出不同的受体底物特异性,即:肽上GalNAc部分的序列组成决定了由单个GALNTs起始的O-糖苷键[18]。本研究发现,GALNT4介导的O-糖基化通过蛋白酶体降解途径调节TYRO3蛋白的稳定性。据报道,全长TYRO3(TYRO3-FL)的蛋白酶体依赖性降解与TYRO3细胞内结构域的产生相结合,TYRO3-ICD可以调节癌症相关基因的表达,并被认为是TYRO3的配体非依赖性功能之一[19]。由于本研究不能在ECa细胞中检测到足够量的磷酸TYRO3表达,无法解答GALNT4是否可以调节TYRO3的配体依赖性激活。此外,本研究发现用苄基-α-GalNAc抑制O-糖基化导致TYRO3的分子量降低,并且GALNT4的敲低降低了TYRO3的总水平,而TYRO3的分子量没有明显变化。原因可能是TYRO3上有多个O-糖基化位点,但GALNT4仅在这些位点的一部分上启动O-糖基化。因此,很有可能其他GALNT酶也能糖基化ECa细胞中的TYRO3。这些发现为GalNAc型O-糖基化在TAM受体生物学中的意义提供了新的见解,对了解癌症、心血管、自身免疫和神经元疾病的病理机制非常重要。
总之,本研究证明了GALNT4在ECa组织中过表达,并与不良预后相关。机制研究显示,GALNT4促进ECa细胞迁移、侵袭的行为部分是通过修饰TYRO3的O-糖基化和蛋白稳定性实现。这项研究强调了GalNAc型O-糖基化在TAM受体中的功能意义。
参 考 文 献
[1] Crosbie EJ,Kitson SJ,McAlpine JN,et al. Endometrial cancer[J]. Lancet,2022,399(10333):1412-1428.
[2] Wang T,Jiang RA,Yao YS,et al. Endometrial cytology in diagno? sis of endometrial cancer:a systematic review and meta-analysis of diag? nostic accuracy[J]. J Clin Med,2023,12(6):2358.
[3] Lin SS,Cao Y,Zhu K,et al. Identification of a novel prognostic sig? nature based on N-linked glycosylation and its correlation with immuno? therapy response in hepatocellular carcinoma[J]. J Hepatocell Carci? noma,2023,10:1749-1765.
[4] Sanz-Martinez I,Pereira S,Merino P,et al. Molecular recognition of GalNAc in mucin-type O-glycosylation[J]. Acc Chem Res,2023,56(5):548-560.
[5] Wandall HH,Nielsen MAI,King-Smith S,et al. Global functions of O-glycosylation:promises and challenges in O-glycobiology[J]. FEBS J,2021,288(24):7183-7212.
[6] Thompson N,Wakarchuk W. O-glycosylation and its role in thera? peutic proteins[J]. Biosci Rep,2022,42(10):BSR20220094.
[7] Beaman EM,Carter DRF,Brooks SA. GALNTs:master regulators of metastasis-associated epithelial-mesenchymal transition (EMT)?[J]. Glycobiology,2022,32(7):556-579.
[8] Berkel C,Cacan. The expression of O-linked glycosyltransferase GALNT7 in breast cancer is dependent on estrogen-,progesterone-,and HER2-receptor status,with prognostic implications[J]. Glycoconj J,2023,40(6):631-644.
[9] Gao Y,Luan X,Melamed J,et al. Role of glycans on key cell sur? face receptors that regulate cell proliferation and cell death[J]. Cells,2021,10(5):1252.
[10] Yu SA,Sun L,Peng L,et al. BarH-like homeobox 2 suppresses cell proliferation,invasion,and angiogenesis in hepatocellular carci? noma by activating N-acetylgalactosaminyltransferase 4[J]. Mol Biotech? nol,2023:2456-2558.
[11] Liang DY,Gao Q,Meng ZX,et al. Glycosylation in breast cancer progression and mammary development:molecular connections and ma? lignant transformations[J]. Life Sci,2023,326:121781.
[12] DeRyckere D,Huelse JM,Earp HS,et al. TAM family kinases as therapeutic targets at the interface of cancer and immunity[J]. Nat Rev Clin Oncol,2023,20(11):755-779.
[13] Hsu PL,Chien CW,Tang YA,et al. Targeting BRD3 eradicates nuclear TYRO3- induced colorectal cancer metastasis[J]. Sci Adv,2023,9(15):eade3422.
[14] Park M,Kuen DS,Park J,et al. TYRO3 blockade enhances antiPD-1 therapy response by modulating expression of CCN1 in tumor mi? croenvironment[J]. J Immunother Cancer,2023,11(1):e006084.
[15] Akin DF,?zkan D. Molecular profiling of TAM tyrosine kinase re? ceptors and ligands in endometrial carcinoma:an in silico-study[J]. J Obstet Gynecol,2023,62(2):311-324.
[16] Lin JZ,Lin N. Three oxidative stress-related genes that associate endometrial immune cells are considered as potential biomarkers for the prediction of unexplained recurrent implantation failure[J]. Front Immu? nol,2022,13:902268.
[17] Daly RJ,Scott AM,Klein O,et al. Enhancing therapeutic anticancer responses by combining immune checkpoint and tyrosine kinase inhibition[J]. Mol Cancer,2022,21(1):189.
[18] Ballard CJ,Paserba MR,Paul Daniel EJ,et al. Polypeptide Nacetylgalactosaminyltransferase(GalNAc-T) isozyme surface charge governs charge substrate preferences to modulate mucin type Oglycosylation[J]. Glycobiology,2023,33(10):817-836.
[19] Mikolajczyk A,Mitula F,Popiel D,et al. Two-front war on cancer-targeting TAM receptors in solid tumour therapy[J]. Cancers,2022,14(10):2488.
(责任编辑:周一青)
本文引用格式:
朱一麟,高雪梅,孟红娟,等. GALNT4介导的TYRO3糖基化对子宫内膜癌的恶性生物学行为的影响[J]. 重庆医科大学学报,2025,50(2):217-223.

