基于UHPLC-QTOF-MS探讨高原鼠兔棕色脂肪低氧环境代谢分子机制
【摘 要】目的:基于超高效液相色谱—四极杆飞行时间质谱联用(ultra high performance liquid chromatography quadrupole timeof-flight mass spectrometry,UHPLC-QTOF-MS)研究不同海拔下高原鼠兔棕色脂肪组织(brown adipose tissue,BAT)中的内源性差异代谢物及代谢通路,探讨BAT适应高原极端环境的代谢分子机制。方法:分别捕捉青海省果洛地区(4 360 m)(MD组)和海北州门源地区(2 900 m)(MY组)高原鼠兔各8只,利用UHPLC-QTOF-MS检测2组高原鼠兔BAT样本代谢产物,采用Simca软件对BAT代谢轮廓特征进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal projec? tions to latent structures- discriminant analysis,OPLS-DA),结合t检验、火山图分析差异代谢物,并对差异代谢物进行KEGG代谢通路分析,构建气泡图。结果:PCA和OPLS-DA模式结果显示,2组BAT代谢组均表现出明显聚类型分布,这些代谢物参与体内糖代谢、脂代谢、氨基酸代谢、核苷酸代谢、胆汁酸代谢等多种生命活动。其中,葡萄糖-6-磷酸、胆酸、ADP-核糖、腺苷、脱氧胞苷、L-苯丙氨酸等代谢物水平在MD组高原鼠兔BAT中明显上调(P<0.05);去甲肾上腺素、硬脂酸、尿素、鸟氨酸、丙硫氧嘧啶等代谢物水平明显下调(P<0.05)。富集通路分析发现BAT代谢与苯丙氨酸、磷酸戊糖途径、酪氨酸、色氨酸等代谢通路相关。结论:高原极端环境影响机体的能量相关代谢通路有效激活BAT非颤抖产热,促进机体脂肪组织分化与白色脂肪褐变,增加BAT比重,以此适应高原极端环境。
【关键词】超高效液相色谱—四极杆飞行时间质谱联用技术;高原低氧;高原鼠兔;棕色脂肪组织;代谢组学
【中图分类号】R339.5【文献标志码】A【收稿日期】2023-09-22
基金项目:青海省“昆仑英才”行动计划资助项目(编号:K9924072);青海省科技厅基础研究计划资助项目(编号:2023-ZJ-773)。
Molecular mechanism of brown adipose tissue metabolism in the hypoxic environment in plateau pikas: a study based on ultra-performance liquid chromatography-quadruple time-of-flight mass spectrometry
Xue Hua1,He Yuxin1,Guo Zixu1,Lin Kaige1,Bai Zhenzhong2,Cao Xuefeng2
(1. Qinghai University School of Medicine;2. Research Center for High Altitude Medicine,Qinghai University)
【Abstract】Objective:To investigate the differentially expressed endogenous metabolites and metabolic pathways in the brown adipose tissue(BAT) of plateau pikas at different altitudes based on ultra-performance liquid chromatography-quadruple time-of-flight mass spectrometry(UHPLC-QTOF-MS),as well as the metabolic molecular mechanism for BAT to adapt to extreme high-altitude environ? ments. Methods:Eight pikas captured from Guoluo area(4 360 m) of Qinghai Province in China were established as MD group,and eight pikas captured from Menyuan area(2 900 m) of Haibei Prefecture were established as MY group. UHPLC-QTOF-MS was used to analyze the metabolites in BAT samples of the two groups,and Simca software was used to perform the principal component analysis(PCA) and the orthogonal partial least squares-discriminant analysis(OPLS-DA) of the metabolic profile features of BAT. The t-test,volcanic map analysis,and KEGG metabolic pathway analysis were performed for differentially expressed metabolites,and a bubble map was constructed. Results:PCA and OPLS-DA showed that the BAT metabolomics in both groups showed significant clustering dis? tribution,and these metabolites were involved in various life activities such as glucose metabolism,lipid metabolism,amino acid me? tabolism,nucleotide metabolism,and bile acid metabolism in the body. Among these metabolites,glucose 6-phosphate,cholic acid,ADP ribose,adenosine,deoxycytidine,and L-phenylalanine were significantly upregulated in the BAT of the MD group(P<0.05),while norepinephrine,stearic acid,urea,ornithine,and propylthio? uracil were significantly downregulated(P<0.05). The pathway en? richment analysis showed that BAT metabolism was associated with the metabolic pathways of phenylalanine,phosphopentose,tyrosine,and tryptophan. Conclusion:Extreme high-altitude environment ef? fectively activates non-shivering heat production in BAT by affect?ing the energy-related metabolic pathways in the body,promotes adipose tissue differentiation and white adipose browning,and in? creases the proportion of BAT,thereby helping to adapt to the extreme high-altitude environment.
【Key words】ultra-performance liquid chromatography-quadruple time-of-flight mass spectrometry;high altitude hypoxia;plateau pi? kas;brown adipose tissue;metabolomics
高原鼠兔长期生存于低氧、高寒、强紫外线极端高原环境下,经过长期进化演进,被认为是研究高原土著动物适应高原环境理想模式动物。当前对高原土著动物的高原适应性研究,已成为高原医学研究的热点。文献研究表明,高海拔地区动物白色脂肪(white adipose tissue,WAT)与棕色脂肪组织(brown adipose tissue,BAT)会随季节、气温的改变而出现适应性变化[1],包括驱动非战栗产热[2-3]、棕色脂肪适应性分布[4]、白色脂肪褐变[5]等。
为研究高原鼠兔BAT适应高原极端环境的分子机制,运用超高效液相色谱—四极杆飞行时间质谱联用技术(ultra high performance liquid tandem chromatography quadrupole time of flight mass spec? trometry,UHPLC-QTOFMS)代谢组学方法对不同海拔的高原鼠兔BAT中代谢物水平进行分析。在这项研究中,极端环境下的BAT代谢展现出与糖代谢、脂代谢、核苷酸代谢、胆汁酸代谢、氨基酸代谢等多种代谢途径的重要联系。
1 材料与方法

1.1 实验动物
本课题研究对象为海拔4 360 m青藏高原果洛地区鼠兔样本8只(MD组,3个月龄左右,雌雄各半)与海拔2 900 m海北州门源地区鼠兔样本8只(MY组,3个月龄左右,雌雄各半)。本次研究中的2组鼠兔的生存环境在海拔、氧含量、环境温度及草场条件(表1)、2组一般生理生化指标检测结果(表2)。采取样本立即-80 ℃保存,直至实验检测。本研究符合本单位伦理委员会所制定的伦理学标准。
1.2 主要仪器及试剂
1.2.1 实验试剂 LC-MS级甲醇、LC-MS级乙腈、LC-MS级乙酸铵、LC-MS级氨水购自CNW Technologies,纯度≥98%内标:L-2-氯苯丙氨酸。
1.2.2 实验仪器 1 290 UHPLC超高效液相(Agilent),Triple TOF 6 600高分辨质谱(AB Sciex),Heraeus Fresco17离心机(Thermo Fisher Scientific),BSA124S-CW天平(Sartorius),JXFSTPRP-24研磨仪(上海净信科技有限公司),明澈D24 UV纯水仪(Merck Millipore),PS-60AL超声仪(深圳市雷德邦电子有限公司),ACQUITY UPLC BEH Amide 1.7 μm 2.1×100 mm色谱柱(Waters)。
1.3 实验方法
1.3.1 代谢物提取 称取30 mg样本,加入600 μL含有内标的提取液,内标浓度2 μg/mL),涡旋混匀30 s;加入瓷珠,用45 Hz研磨仪处理4 min,后超声处理5 min(冰水浴);重复以上步骤2~3次;在-20 ℃静置1 h;将样品在4 ℃,12 000 r/min下离心15 min;取500 μL上清至EP管中;真空浓缩干燥提取;随后向干燥后的代谢物加入60 μL 提取液,复溶;涡旋30 s,继续超声处理10 min(冰水浴);将样本在4 ℃,12 000 r/min下离心15 min;取30 μL上清至2 mL进样瓶中,每个样本各取10 μL混合成QC样本,再取60 μL上机检测。
1.3.2 上机检测 使用UHPLC系、UPLC BEH酰胺柱和Triple TOF 6600进行LC-MS/MS分析。流动相由25 mmol/L NH4Ac和25 mmol/L NH4OH(pH=9.75)的水溶液(A)和乙腈(B)组成,洗脱梯度为0 min和95%B;0.5 min,95%硼;7 min,65%硼;8 min,40%B;9 min,40%B;9.1 min,95%硼;12 min,95%B,以0.5 mL/min递送,进样体积1.5 μL。在每个循环中,选择强度大于100的12个前体离子以30 V的碰撞能量进行碎裂。ESI源条件设置如下:离子源气体1为60 Psi,离子源气体2为60 Psy,幕帘气体为35 Psi,源温度为600 ℃,离子注入电压波动分别为5 000 V或-4 000 V。
1.3.3 质量控制 QC样本TIC出峰保留时间和峰面积重叠很好,说明仪器稳定性很好;内标L-2-氯苯丙氨酸在样品中的保留时间和峰面积具有良好稳定性,说明仪器数据采集具有较好稳定性;空白样品中无显著峰检出,说明物质残留控制得很好,不存在样品间的交叉污染。QC样本相关系数绝对值>0.99,具有强相关性。所有QC样本在PCA-X一维分布图中分布于2STD之内,QC样本中内标的相应差异≤20%,说明本次实验数据质量较高。
1.3.4 差异代谢物筛选及鉴别 在获得数据后,对其进行多元变量模式识别分析,包括t检验、PCA、OPLS-DA、差异代谢物筛选及鉴别的统计方法对结果进行分析,过滤掉代谢物中与分类变量不相关的正交变量,并对非正交变量和正交变量分别分析,从而获取更加可靠的代谢物的组间差异与实验组的相关程度信息。本次筛选使用的卡值标准为t检验(student’s t-test)的P<0.05,同时OPLS-DA模型第一主成分的变量投影重要度(variable importance in the projection,VIP)>1。
1.4 统计学方法
使用R4.2.1版本和自建二级质谱数据库对峰进行物质鉴定。计量资料采用均数±标准差(x±s)表示,比较采用t检验。检验水准α=0.05。
2 结 果

2.1 模式识别判别分析
在对比不同组别样本的聚类和分离时采用PCA分析。在PCA得分图中,QC样本分布较为聚集,证明本次实验仪器分析系统稳定性较好,结果可靠,样本的生物学差异可以准确被实验所得的代谢谱差异所反映。MD组和MY组OPLS-DA模型分离合理(R2X=0.292,R2Y=0.972,Q2=0.718)。OPLS-DA的VIP>1和Student’s t检验的P<0.05,证明MD组和MY组相比代谢物发生显著变化,见图1。通过与pubmed数据库的对比,筛选出19个代谢物,并初步将其作为研究高原鼠兔BAT适应高原环境的代谢机制潜在靶点(表3)。
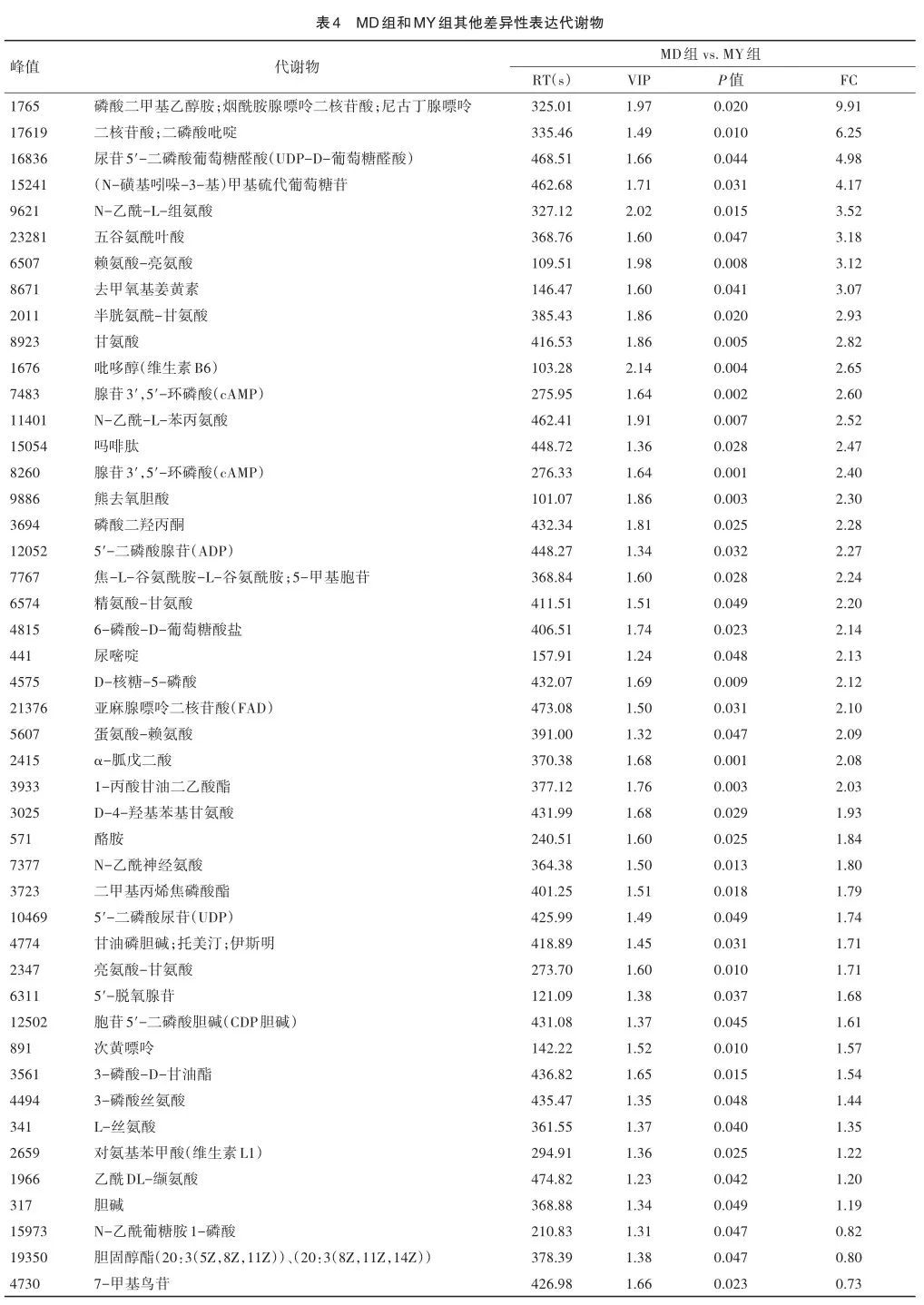
2.2 PCA3D得分图
PCA3D得分图能够更好得观察样本的聚集、离散程度,样本点的位置越相近,则表明两者之间的代谢差异越小。PCA3D得分图显示MD组与MY组样本点部分交叉,但并不重叠,在得分图中的位置明显分离,证明2组的代谢模式存在差异。此外,QC样本分布较为聚集,再次证明本次实验仪器分析系统稳定性较好,结果可靠,见图2。
2.3 差异代谢物结果
将MD组与MY组的差异代谢物进行比较,结果如表3所示。MD组糖代谢的相关物质如葡萄糖-6-磷酸显著上调; MD组动物体内有关核苷酸代谢的物质如ADP-核糖、腺苷、脱氧胞苷等上调趋势明显,而丙硫氧嘧啶与其他核苷酸趋势相反;与胆汁代谢相关物质如胆酸亦呈上调趋势。然而BAT中与脂质代谢相关的脂肪酸水平却明显下调,如甘油三酯、硬脂酸等脂类物质。氨基酸代谢的代谢物水平并非呈统一的上调或下调趋势,氨基酸如苯丙氨酸、酪氨酸和色氨酸等呈上调趋势,鸟氨酸与尿素呈下调趋势。2组鼠兔BAT中的激素水平也有较大差异,MD组BAT中去甲肾上腺素较MY组下调。
此外,MD组和MY组其他差异性表达代谢物机制尚未明确,但有较高VIP值,如表4所示。
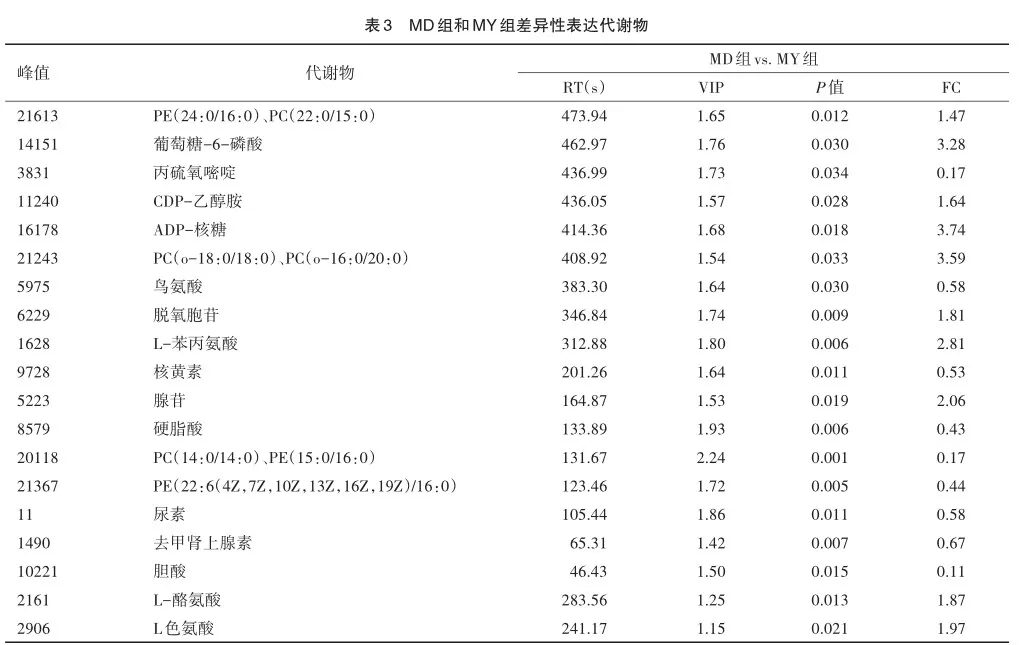
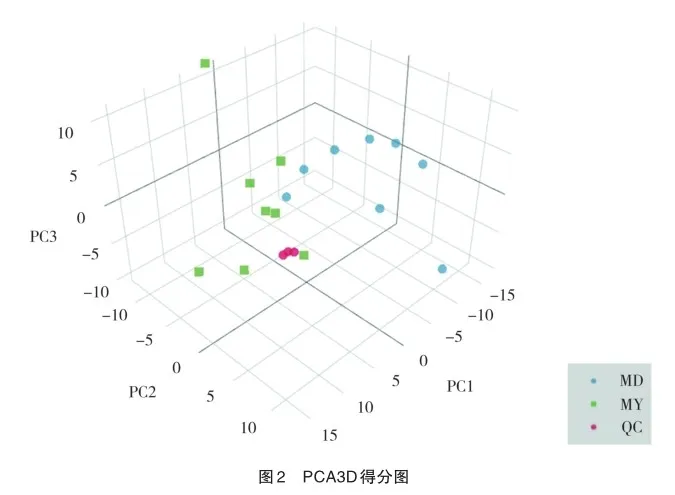
2.4 差异代谢物的火山图
将筛选差异代谢物的结果以火山图的形式进行可视化。MD组对MY组的结果如图所示。火山图中每个点代表一个代谢物,横坐标代表该组对比各物质的倍数变化(取以2为底的对数),纵坐标表示t检验的P值(取以10为底对数的负数),散点大小代表OPLS-DA模型的VIP值,散点越大VIP值越大。散点颜色代表最终的筛选结果,明显上调的代谢物以红色表示,明显下调的代谢物以蓝色表示,非明显差异的代谢物为灰色,见图3。
2.5 差异代谢物的代谢通路分析
取得差异代谢物的匹配信息后,将对应物种Rattus nor? vegicus的通路数据库相应代谢通路予以分析。结果以气泡图展示。结果显示富集的差异代谢通路以苯丙氨酸、酪氨酸和色氨酸生物合成通路影响因子最明显,磷酸戊糖途径、甘氨酸、丝氨酸和苏氨酸代谢通路富集程度最明显。其他差异代谢通路包括维生素B6代谢通路、甲烷代谢通路和苯丙氨酸代谢通路也有变化,见图4。
各通路所含差异代谢物如下:苯丙氨酸、酪氨酸和色氨酸生物合成通路为苯丙氨酸;磷酸戊糖途径通路为脱氧核糖;D-核糖-5-磷酸;D-红细胞4-磷酸;6-磷酸葡萄糖酸;甘氨酸、丝氨酸和苏氨酸代谢通路为L-丝氨酸;胆碱;甜菜碱;维生素B6代谢通路为吡哆醇。甲烷代谢通路:L-丝氨酸。
3 讨 论
高原鼠兔主要栖息在青藏高原的高寒草甸生态系统,严酷的高海拔环境,动物不仅面临低温,还受到低氧的长期胁迫,使其成为研究高原土著动物对极端环境适应的理想动物模型。根据非靶标代谢组学的结果可知,生存于不同海拔的鼠兔 BAT中代谢物水平差异较大,而其中部分代谢物的作用已有文献记载。
脂肪酸作为BAT适应性产热的“燃料”,受到高原低氧高寒等极端环境的剧烈影响。已有研究证明,冷暴露会引发脂质代谢系统性变化,从而增加脂肪酸向BAT输送能量[6-7]。此外,冷暴露可诱导BAT产热基因表达,解偶联蛋白1(UCP1)和过氧化物酶体增殖受体γ辅激活因子α(PGC1α)蛋白水平升高,诱导BAT参与甘油三酯和甘油磷酯代谢[8]。本研究还发现MD组BAT中硬脂酸水平下调,硬脂酸为不饱和脂肪酸,能通过下调成脂转录因子抑制脂肪细胞分化[9],在寒冷条件时下调硬脂酸水平可促进脂肪细胞分化,BAT占比升高,增加机体产热。
糖类在生命活动中的主要作用是提供能量。MD组动物葡萄糖-6-磷酸水平高于MY组。研究发现,相较于WAT而言,BAT中含有丰富糖原和较低的葡萄糖含量[10],表明BAT可快速合成糖原,且糖原可驱动棕色脂肪细胞分化过程中脂滴的生成[11]。这种在BAT和WAT中的糖量差异提示葡萄糖可能参与到BAT的产热活动中去。动物实验表明,在饥饿条件下,BAT糖原可以影响体内营养感应,使小鼠的G-6-P水平增加[12]。此外,1项有关小鼠冷暴露的实验发现,短期冷暴露能增加糖酵解途径中的代谢产物以及某些氨基酸含量,且BAT糖酵解途径代谢产物和乳酸水平明显高于WAT[13-14]。BAT中糖酵解和脂肪酸的β-氧化是积极的生物途径,有助于通过冷暴露激活产热,从而促进UCP1表达产生热量。
在本研究中,BAT展现出与核苷酸代谢的紧密关系。MD组ADP-核糖、腺苷、脱氧胞苷、黄嘌呤、次黄嘌呤水平均高于MY组。通过现有文献进行分析,发现嘌呤、嘧啶、腺苷等物质能有效调节脂肪细胞的分化[15]。如5-氮-2-脱氧胞苷被证明可以上调BAT特异性蛋白表达,阻碍与微小RNA的DNA甲基化来改变表观遗传学修饰,从而调节WAT发生褐变[16]。腺苷能够通过激活腺苷受体A激活BAT和WAT脂肪细胞分解和产热程序,并能够促进WAT褐色化[17]。有专家推测ADP-核糖与白色、棕色和米色脂肪细胞的分化有重要联系[18],但目前并无确切证据。除此之外,PTU在MD组BAT中的表达明显下调。PTU是甲状腺激素(thyroid hormone,TH)抑制剂,TH对动物的体温维持有重要作用。在寒冷状态下,TH通过多途径刺激BAT产热,且促进WAT发生褐变[19-20]。在强烈冷刺激的持续作用下,机体下调PTU水平,解除了对TH的抑制,使动物体温在寒冷条件下得以维持。
在差异代谢物的代谢通路分析中,苯丙氨酸、酪氨酸和色氨酸等氨基酸合成通路的影响因子最大。有文献报道,冷暴露可影响BAT中的氨基酸代谢[21-22]。在BAT中含量较高的代谢物中,大部分富集到磷酸戊糖途径、甘氨酸、丝氨酸和苏氨酸代谢通路。其与核苷酸类物质的作用相似,氨基酸类物质同样对脂肪细胞的分化起重要作用。在寒冷应激时,酪氨酸合成通路激活,该蛋白质通过合成儿茶酚胺类物质,促进体内分解代谢,并通过TH的PPARγ信号通路调节UCP1的合成,促进脂肪褐变,消耗体内储存的TG加强产热[23]。苯丙氨酸调节线粒体生成等方面来调节脂肪分化。而丝氨酸和苏氨酸可能通过丝苏氨酸蛋白激酶通路促进脂肪动员,可能与寒冷条件下增加产热有关[24]。
研究结果显示,高海拔环境下,BAT中的激素水平也发生了巨大变化。去甲肾上腺素(norepi? nephrine,NE)是下丘脑调节体温的主要递质,能有效诱导非颤抖性产热能力。NE可激活BAT细胞内的β-肾上腺素受体,促进脂肪酸的释放,进而激活UCP1,从而提高机体体温;另一方面,高表达NE促进BAT细胞的增殖和分化,诱导WAT褐色化[25]。NE受体可上调产热基因程序的表达,NE被证明是BAT生成的关键促进剂[26]。理论上NE在MD组BAT中应为上调,但事实并非如此,初步推测其原因可能与递质耗竭有关。
此外,其他差异性表达的代谢物如磷酸二甲基乙醇胺、亚麻腺嘌呤二核苷酸(flaxseed adenine dinucleotide,FAD)、对氨基苯甲酸等代谢物水平变化机制还不明确,但它们都有较高的VIP值,进一步的研究可能需要关注这些代谢物的功能,排除假阳性的可能。
综上所述,生存于不同海拔的鼠兔BAT代谢物有巨大差异,高寒低氧环境通过影响机体的糖、脂、核苷酸、氨基酸代谢促进BAT分解脂肪和产热能力,同时上调促脂肪生成基因、促脂肪分化代谢物,增加BAT占比,为产热提供更多“动力”和“燃料”。BAT适应性改变使动物能在高原极端环境下能量代谢保持平衡。本研究还发现,某些代谢物水平在短期冷暴露和长期冷暴露环境下的变化不同,其原因和机制需要进一步探讨。
参考文献
[1] Song AY,Dai WT,Jang MJ,et al. Low- and high-thermogenic brown adipocyte subpopulations coexist in murine adipose tissue[J]. J Clin Invest,2020,130(1):247-257.
[2] Reinisch I,Schreiber R,Prokesch A. Regulation of thermogenic adipocytes during fasting and cold[J]. Mol Cell Endocrinol,2020,512:110869.
[3] Watanabe M,Yamamoto T,Mori C,et al. Cold-induced changes in gene expression in brown adipose tissue:implications for the activation of thermogenesis[J]. Biol Pharm Bull,2008,31(5):775-784.
[4] 李欣慧,白振忠,韩士瑞. 高原环境对高原鼠兔脂肪分布的影响[J]. 临床医药文献电子杂志,2015,2(25):5191-5192. Li XH,Bai ZZ,Han SR. Effect of plateau environment on fat distribu? tion of plateau pika[J]. J Clin Med Lit,2015,2(25):5191-5192.
[5] Xu ZY,You WJ,Zhou YB,et al. Cold-induced lipid dynamics and transcriptional programs in white adipose tissue[J]. BMC Biol,2019,17(1):74.
[6] Heeren J,Scheja L. Brown adipose tissue and lipid metabolism[J]. Curr Opin Lipidol,2018,29(3):180-185.
[7] Hiroshima Y,Yamamoto T,Watanabe M,et al. Effects of cold ex? posure on metabolites in brown adipose tissue of rats[J]. Mol Genet Metab Rep,2018,15:36-42.
[8] Liu X,Tang J,Zhang RN,et al. Cold exposure induces lipid dynamics and thermogenesis in brown adipose tissue of goats[J]. BMC Genomics,2022,23(1):528.
[9] Li YR,Rong YH,Bao LS,et al. Suppression of adipocyte differen? tiation and lipid accumulation by stearidonic acid(SDA) in 3T3-L1 cells[J]. Lipids Health Dis,2017,16(1):181.
[10] 宋懿朋,李 宁,薛海斯,等. 棕色脂肪组织和白色脂肪组织的代谢组学研究[J]. 波谱学杂志,2016,33(2):208-223. Song YP,Li N,Xue HS,et al. Metabonomics analysis of brown adipose and white adipose tissues[J]. Chin J Magn Reson,2016,33(2):208-223.
[11] Volke L,Krause K. Effect of thyroid hormones on adipose tissue flexibility[J]. Eur Thyroid J,2021,10(1):1-9.
[12] Carmean CM,Huang YH,Brady MJ. Glycogen repletion in brown adipose tissue upon refeeding is primarily driven by phosphorylationindependent mechanisms[J]. PLoS One,2016,11(5):e0156148.
[13] Okamatsu-Ogura Y,Kuroda M,Tsutsumi R,et al. UCP1-depen? dent and UCP1-independent metabolic changes induced by acute cold exposure in brown adipose tissue of mice[J]. Metabolism,2020,113:154396.
[14] Park G,Haley JA,Le J,et al. Quantitative analysis of metabolic fluxes in brown fat and skeletal muscle during thermogenesis[J]. Nat Metab,2023,5(7):1204-1220.
[15] Hou DM,Jia T,Li Q,et al. Metabonomics of white adipose tissue and brown adipose tissue in Tupaia belangeri during cold acclimation[J]. Comp Biochem Physiol Part D Genomics Proteomics,2021,38:100823.
[16] Liang J,Jia Y,Yu HX,et al. 5-aza-2’-deoxycytidine regulates white adipocyte browning by modulating miRNA-133a/Prdm16[J]. Me? tabolites,2022,12(11):1131.
[17] Wu ZF,Rao SJ,Li JY,et al. Dietary adenosine 5’-monophos? phate supplementation increases food intake and remodels energy expen? diture in mice[J]. Food Nutr Res,2022,66:7680.
[18] Szántó M,Bai P. The role of ADP-ribose metabolism in metabolic regulation,adipose tissue differentiation,and metabolism[J]. Genes Dev,2020,34(5/6):321-340.
[19] Castillo-Campos A,Gutiérrez-Mata A,Charli JL,et al. Chronic stress inhibits hypothalamus-pituitary-thyroid axis and brown adipose tissue responses to acute cold exposure in male rats[J]. J Endocrinol In? vest,2021,44(4):713-723.
[20] Yau WW,Yen PM. Thermogenesis in adipose tissue activated by thyroid hormone[J]. Int J Mol Sci,2020,21(8):3020.
[21] Verkerke ARP,Wang D,Yoshida N,et al.BCAA-nitrogen flux in brown fat controls metabolic health independent of thermogenesis[J]. Cell,2024,187(10):2359-2374.
[22] Gong LQ,Zhao SY,Chu X,et al. Assessment of cold exposureinduced metabolic changes in mice using untargeted metabolomics[J]. Front Mol Biosci,2023,10:1228771.
[23] 刘鼎鑫,孟凡舜,李仕韦,等. 冷暴露下酪氨酸联合半胱氨酸对小鼠脂质代谢的影响[J]. 黑龙江八一农垦大学学报,2022,34(4):31-36. Liu DX,Meng FS,Li SW,el al. The effect of tyrosine combined with cys? teine on lipid metabolism in mice under cold exposure[J]. Journal of Hei? longjiang Bayi Agricultural and Reclamation University,2022,34(4):31-36.
[24] 任美玲,王 萍. 中药调控棕色脂肪组织解偶联蛋白1表达的机制研究概述[J]. 环球中医药,2022,15(9):1722-1728. Ren ML,Wang P. Review on the mechanism of Chinese medicinals regulating the expression of brown adipose tissue uncoupling protein 1[J]. Glob Tradit Chin Med,2022,15(9):1722-1728.
[25] Li L,Li BG,Li M,et al. Switching on the furnace:regulation of heat production in brown adipose tissue[J]. Mol Aspects Med,2019,68:60-73.
[26] Tao XX,Du RL,Guo SM,et al. PGE2-EP3 axis promotes brown adipose tissue formation through stabilization of WTAP RNA methyl? transferase[J]. EMBO J,2022,41(16):e110439.
(责任编辑:周一青)
本文引用格式:
薛 华,何雨昕,郭子旭,等. 基于UHPLC-QTOF-MS探讨高原鼠兔棕色脂肪低氧环境代谢分子机制[J]. 重庆医科大学学报,2025,50(2):267-274.

