4辛基-衣康酸通过Nrf2/ARE通路抑制氧化应激减轻高脂饮食诱导的早期肾损伤
【摘 要】目的:研究4辛基-衣康酸(4-octyl itaconate,4-OI)通过核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)通路减轻高脂饮食(high fat diet,HFD)诱导的早期肾脏损伤的效应及机制。方法:将小鼠随机分为对照组、HFD组、4-OI组3组;HFD组和4-OI组接受HFD喂养12周,4-OI组自HFD喂养第9周起接受4-OI干预。检测糖耐量及尿白蛋白肌酐比值(urinary albumin/creatinine ratio,UACR);苏木精伊红(hematoxylineosin,HE)染色和高碘酸-希夫(periodic acid-Schiff,PAS)染色观察肾皮质病理变化;酶联免疫吸附测定法(enzyme-linked im? mune sorbent assay,ELISA)检测血脂和肾皮质氧化应激相关指标;检测肾小管损伤标志物及肾皮质Nrf2/ARE通路相关分子的表达水平。结果:4-OI干预可减轻高脂饮食导致的肾近曲小管刷状缘断裂和上皮细胞脱落,降低肾皮质肾小管损伤标志物肾损伤分子1(kidney injury molecule 1,KIM-1)、中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin protein,NGAL)表达和尿液上清液中的UACR含量(P=0.001、P=0.002、P=0.000),减轻肾皮质氧化应激,如还原型谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)的回升和丙二醛(malondialdehyde,MDA)的回降(P=0.040、P= 0.000、P=0.001),增加Nrf2以及Nrf2/ARE通路相关分子血红素加氧酶-1(heme oxygenase 1,HO-1)、NAD(P)H脱氢酶(醌)1(NAD(P)H dehydrogenase[quinone]1,NQO1)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)蛋白表达水平(P=0.003、P= 0.000、P=0.001、P=0.000)和mRNA表达水平(P=0.000、P=0.009、P=0.000、P=0.000)。结论:4-OI可能通过激活Nrf2/ARE通路降低肾脏氧化应激水平,从而改善HFD导致的早期肾损伤。
【关键词】肾损伤;肾小管;高脂饮食;4辛基-衣康酸;氧化应激
【中图分类号】R151.1【文献标志码】A【收稿日期】2024-05-11
基金项目:重庆医科大学未来医学青年创新团队资助项目(编号:W0085)。
Effect of 4-octyl itaconate in attenuating early renal injury induced by high-fat diet through inhibiting oxidative stress via the nuclear factor erythroid 2-related factor 2/antioxidant response element pathway
Wang Luning,Wan Jindong,Chen Jiayao,Lin Xiaoqian,Yang Jian
(Department of Clinical Nutrition,The Third Affiliated Hospital of Chongqing Medical University)
【Abstract】Objective:To investigate the effect and mechanism of 4-octyl itaconate(4-OI) in alleviating early renal injury induced by high-fat diet(HFD) via the nuclear factor erythroid 2-related factor 2(Nrf2)/antioxidant response element(ARE) pathway. Methods:Mice were randomly divided into control group,HFD group,and 4-OI group. The mice in the HFD group and the 4-OI group were given HFD feeding for 12 weeks,and those in the 4-OI group were given 4-OI intervention since week 9 of HFD feeding. Glucose toler? ance and urinary albumin-to-creatinine ratio(UACR) were measured;HE staining and periodic acid-Schiff staining were used to observe the pathological changes of renal cortex;ELISA was used to measure blood lipids and renal cortical oxidative stress-related indicators;the expression levels of renal tubular injury markers and the molecules involved in the Nrf2/ARE pathway in renal cortex were measured. Results:This study showed that 4-OI intervention significantly alleviated the brush border fracture and epithelial cell shedding of renal proximal convoluted tubules and reduced the expression levels of the renal tubular injury markers kidney injury molecule-1 and neutrophil gelatinase-associated lipocalin in renal cortex and the content of UACR in urine supernatant(P=0.001,0.002,and 0.000),and it also reduced renal cortical oxidative stress,including the increases in glutathione and superoxide dismutase(SOD) and the reduction in malondialdehyde(P=0.040,0.000,and 0.001). 4-OI intervention increased the protein and mRNA expression levels of Nrf2 and the Nrf2/ARE pathway-related molecules heme oxygenase-1,NAD(P)H dehydrogenase[quinone]1,and superoxide dismutase 1(protein expression:P=0.003,0.000,0.001,and 0.000; mRNA expression:P=0.000,0.009,0.000,and 0.000). Conclusion:4-OI may reduce the level of renal oxidative stress by activating the Nrf2/ARE pathway,thereby improving early renal injury caused by HFD.
【Key words】kidney injury;renal tubule;high-fat diet;4 octyl-itaconic acid;oxidative stress
在全球肥胖流行的时代,长期高脂饮食(high fat diet,HFD)已被公认为是慢性肾脏病(chronic kidney disease,CKD)的主要和独立的危险因素[1]。由于早期CKD尚未出现肾小球损伤,而是表现为肾小管尤其是近端小管损伤[2],因此,大多数早期CKD患者的肾脏微结构病变程度尚低,且具有较强可逆性。如果处于该阶段的患者及时接受有效治疗,则可减少甚至避免肾脏结构和功能持续受损以及发展为终末期肾病的可能性[3]。所以,探索HFD导致的早期肾损伤的有效防治具有重要研究价值。
衣康酸是一种内源性代谢物,已被证明具有强大的抗炎和抗氧化作用[4]。然而,衣康酸由于其亲水性结构而不能很好穿透细胞膜,因此其应用受到限制。4辛基-衣康酸(4-octyl itaconate,4-OI)是衣康酸的衍生物,比衣康酸具有更好的脂溶性,因而更容易穿透细胞膜进而降解为衣康酸发挥生物学作用[5]。近年来,4-OI在肾脏疾病中的保护作用受到关注,比如4-OI干预可以减轻缺血再灌注造成的急性肾损伤,抑制CKD发展过程中出现的肾脏纤维化[4,6]。然而,4-OI是否对HFD诱导的早期肾损伤具有保护作用尚不清楚。因此,本研究对4-OI对HFD诱导的早期肾损伤的作用及其机制进行了研究,这为进一步探索4-OI在肾脏,尤其是近端小管的作用提供了理论基础。
1 材料与方法
1.1 实验材料
1.1.1 药物与配置 将(2-羟丙基)-β-环糊精(上海康朗生物科技有限公司,98%纯度)溶于双蒸水,制成40%环糊精溶液。将4-OI(上海Med Chem Express公司,98%纯度,10 mmol/L)溶于40%环糊精溶液中,制成4-OI溶液。
1.1.2 实验动物 C57BL/6J小鼠(年龄6~8周龄)购自北京维通利华实验动物技术有限公司。
1.1.3 主要试剂与实验设备 主要试剂:高脂饲料[成分为维持饲料33.6%、猪油26%,蔗糖8%、酪蛋白13.5%、全脂奶粉10.8%、磷酸氢钙2%、碳酸钙1.2%、微晶纤维素1.9%、混合微量元素(维生素、矿物质)3%]购自重庆腾鑫生物技术有限公司。血糖仪和血糖试纸购自上海罗氏诊断产品有限公司。甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、游离脂肪(free fatty acids,FFA)、白蛋白、肌酐、还原型谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒均购自南京建成生物工程研究所。HiFi Script cDNA合成试剂盒购自上海碧云天生物技术股份有限公司。肾损伤分子1(kidney injury molecule 1,KIM-1)、中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin protein,NGAL)、核因子E2相关因子2(nuclear factorerythroid 2-related factor 2,Nrf2)、血红素加氧酶-1(heme oxygenase 1,HO-1)、NAD(P)H脱氢酶(醌)1(NAD(P)H dehy? drogenase[quinone]1,NQO1)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)引物均购自上海生工生物工程股份有限公司。Nrf2、HO-1、NQO1、SOD1抗体均购自武汉三鹰技术有限公司。主要仪器:全波长多功能酶标仪和Bio-Rad CFX connect定量聚合酶链式反应(polymerase chain reaction,PCR)仪购自美国Bio-Rad Laboratories公司;研究级全玻片扫描系统VS200购自日本奥林巴斯株式会社;Odyssey双色红外激光成像系统购自美国LI-COR公司。
1.2 实验方法
1.2.1 动物造模 所有小鼠均被饲养在有12 h光/暗循环和22 ℃温度环境内,可自由饮食。将小鼠随机分为3组,分别为对照组、HFD组、4-OI组。对照组小鼠正常饲养12周,HFD组和4-OI组小鼠正常饮水和高脂饲料饲养12周;自第9周开始,正常组和HFD组小鼠隔天腹腔注射40%环糊精溶液,4-OI组小鼠隔天腹腔注射50 mg/kg 4-OI溶液至造模结束。
1.2.2 尿液收集 小鼠禁食不禁水24 h,期间收集尿液。尿液静止4 h后离心取上清,获得尿液上清液。
1.2.3 经腹腔注射葡萄糖耐量检测(intraperitoneal glucose tolerance test,ipGTT)小鼠禁食不禁水过夜,腹腔注射50% D-葡萄糖溶液。使用血糖仪通过尾部出血测量0、30、60、90、120 min时的血糖水平。
1.2.4 标本取材 小鼠一次性腹腔注射10%水合氯醛,待小鼠充分麻醉后取血液和双侧肾脏,颈椎脱位法处死小鼠。血液静止4 h后离心取上清,获得血清。肾脏取单侧放入4%多聚甲醛进行固定。
1.2.5 血清TG、TC、FFA测定 血清中的TG、TC、FFA含量通过商业试剂盒和全波长多功能酶标仪进行测量。
1.2.6 肾组织形态学观察 将多聚甲醛固定的小鼠肾脏包埋在石蜡中后,切成4 μm切片,并对组织进行苏木精伊红(hematoxylin-eosin,HE)染色和高碘酸-希夫(periodic acidSchiff,PAS)染色。用全玻片扫描系统扫描完成染色的切片得到图像。
1.2.7 实时定量聚合酶链式反应(quantitative real-time poly? merase chain reaction,qRT-PCR)检测 使用trizo试剂提取肾皮质RNA,并使用HiFi Script cDNA合成试剂盒进行逆转录。qRT-PCR在Bio-Rad CFX connect定量PCR仪上进行。循环程序是10 min 95 ℃,15 s 95 ℃和1 min 60 ℃循环40次。
1.2.8 尿液上清液尿白蛋白肌酐比值(urinary albumin/cre? atinine ratio,UACR)测定 尿液上清液中的白蛋白和肌酐含量通过商业试剂盒和全波长多功能酶标仪进行测量。通过肌酐含量标化白蛋白含量得到UACR值。
1.2.9 肾皮质GSH、MDA、SOD测定 肾皮质中GSH、MDA、SOD含量通过商业试剂盒和全波长多功能酶标仪进行测量。1.2.10 蛋白质印迹检测 在裂解缓冲液中匀浆肾皮质组织,并使用二奎林甲酸检测法(aicinchoninic acid assay,BCA)蛋白检测试剂盒测量蛋白质浓度。然后对蛋白样本进行电泳,并转移到聚偏二氟乙烯膜中。室温下将膜浸泡在5%脱脂奶粉中封闭90 min。将膜浸泡在相应一抗中,并在4 ℃下孵育过夜。室温下浸泡二抗中90 min,并使用Odyssey双色红外激光成像系统对膜进行扫描得到图像。
1.3 统计学方法
采用SPSS 20.0统计软件进行统计学处理。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,2组间比较采用t检验。检验水准α=0.05。
2 结 果
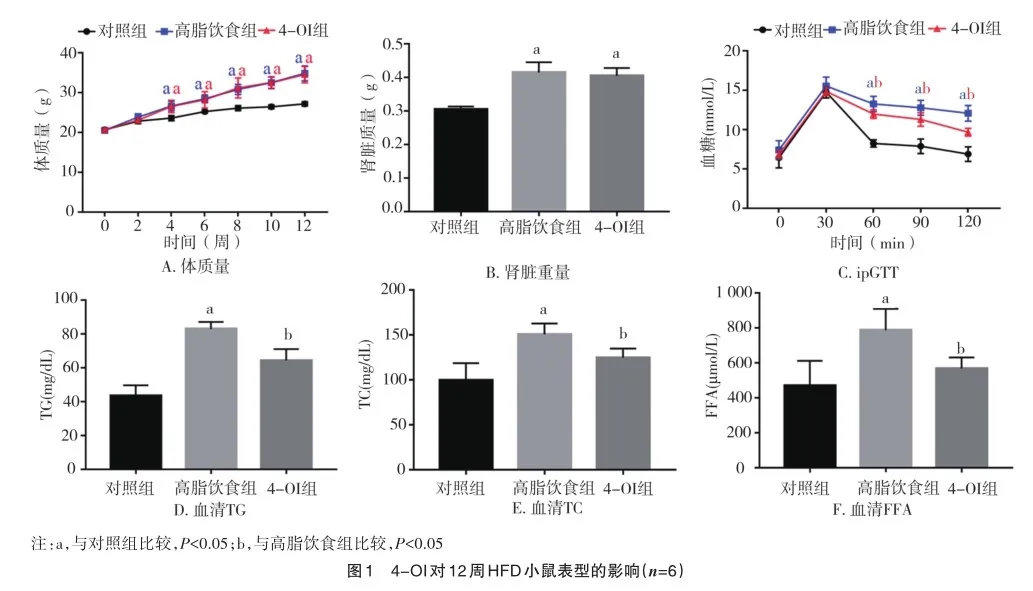
2.1 4-OI对12周HFD小鼠表型的影响
与对照组小鼠相比,12周HFD干预显著增加了小鼠体质量和肾脏重量(t=8.519、q=11.797;P=0.000、P=0.000),而HFD组小鼠与4-OI干预后的小鼠在体质量和肾脏重量上均没有差异(t=0.710、q=1.044;P=0.494、P=0.745)(图1A、B)。ipGTT显示,HFD组小鼠较对照组小鼠表现为显著的葡萄糖不耐受(t=9.315,P=0.000),4-OI组小鼠葡萄糖不耐受较HFD组小鼠减轻(t=5.292,P=0.000)(图1C)。与对照组小鼠相比,HFD组小鼠血清TG、TC、FFA明显升高(q=3.306、q= 8.729、q=6.791;P=0.000、P=0.001、P=0.001),该现象在4-OI干预后改善(q=7.943、q=4.427、q=4.665;P=0.000、P=0.018、P=0.013)(图1D、E、F)。
2.2 4-OI减轻HFD导致的肾小管损伤
为了进一步明确4-OI对HFD导致肾脏损伤的可能保护作用,本研究对动物肾皮质进行了HE染色和PAS染色,结果均显示HFD组小鼠出现了明显肾小管损伤。在肾小管区域尤其是近端小管部位,出现严重的刷状缘断裂和上皮细胞脱落,4-OI干预减轻了刷状缘断裂和上皮细胞脱落。肾小球大小和肾小球系膜基质在3组之间则没有明显差异(图2A、B)。肾小管损伤标志物KIM-1和NGAL的mRNA表达在HFD干预12周后的小鼠肾皮质中明显上升(q=32.376、q= 14.147;P=0.000、P=0.000),该变化可被4-OI作用所减轻(q=21.106,q=5.940;P=0.001、P=0.002)(图2C、D)。同时,HFD干预12周后,小鼠UACR明显增加(q=25.748,P= 0.000),其在4-OI干预后也得到一定改善(q=14.366,P= 0.000)(图2E)。上述提示4-OI作用后可以减轻HFD导致的肾小管损伤。
2.3 4-OI通过降低氧化应激减轻HFD诱导的肾小管损伤
氧化应激在HFD诱导的肾小管损伤扮演了重要角色,GSH和MDA在维持氧化和还原平衡中起着关键作用[7]。小鼠在HFD干预12周后,肾皮质中GSH水平较对照小鼠明显降低(q=10.233,P=0.001),MDA水平则较对照小鼠明显升高(q=12.618,P=0.000)。4-OI作用HFD小鼠后,动物肾皮质GSH水平回升(q=3.839,P=0.040),MDA水平则明显回降(q= 7.732,P=0.000)(图3A、B)。同时,SOD是关键抗氧化物酶之一[8]。经检测发现,HFD组小鼠肾皮质SOD水平明显低于对照组(q=16.007,P=0.000),4-OI作用后则明显恢复(q= 7.957,P=0.001)(图3C)。上述结果提示4-OI可能通过降低氧化应激水平进而减轻HFD诱导的肾小管损伤。
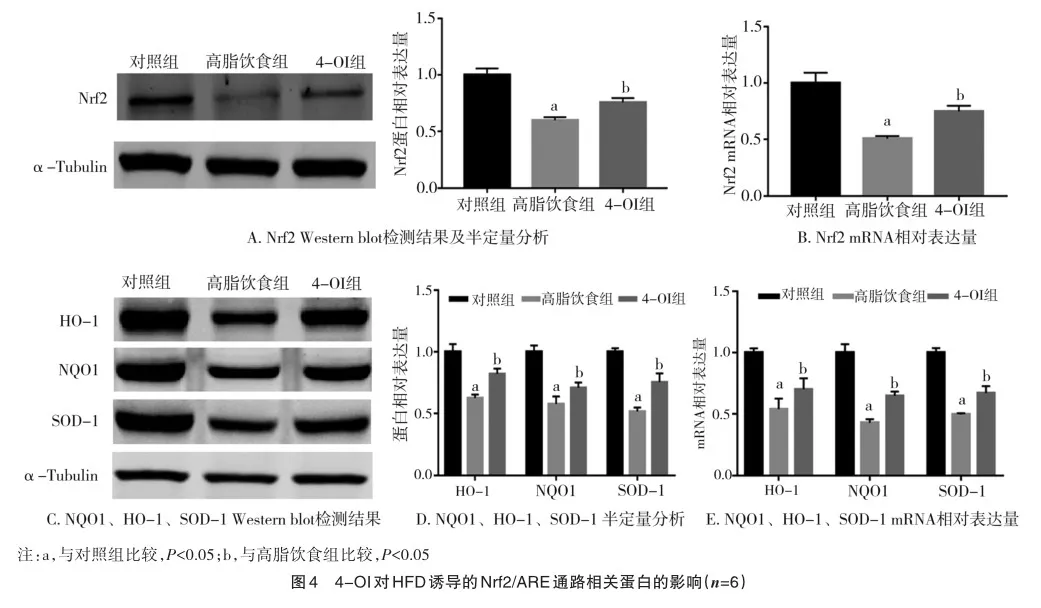
2.4 4-OI通过Nrf2/ARE通路减轻HFD诱导的肾皮质氧化应激
与对照组相比,HFD干预小鼠肾皮质Nrf2蛋白和转录水平均明显降低(q=23.305、q=19.803;P=0.000、P=0.000),其在4-OI组小鼠肾皮质中则明显回升(q=9.196、q=9.707;P= 0.003、P=0.000)(图4A、B)。既往研究证实HO-1、NQO1和SOD-1作为机体内重要抗氧化酶,能被Nrf2/抗氧化反应元件(antioxidant response element,ARE)通路激活,从而发挥作用[9]。HFD干预小鼠肾皮质中HO-1、NQO1和SOD-1蛋白表达量均明显降低(t=27.451、t=13.262、t=12.761;P=0.001、P= 0.000、P=0.000),其可被4-OI干预所逆转(t=9.503、t=7.476、t=4.311;P=0.000、P=0.001、P=0.000)(图4C、D)。类似地,4-OI组小鼠肾皮质HO-1、NQO1和SOD-1的mRNA表达也较HFD组明显回升(t=11.602、t=7.552、t=3.223;P=0.009、P= 0.000、P=0.000)(图4E)。这提示4-OI可能通过Nrf2/ARE通路减轻HFD诱导的肾皮质氧化应激。

3 讨 论
随着全球肥胖患病率的迅速增加,HFD相关肾脏疾病正在成为CKD的重要原因,如果在早期没有接受有效治疗,大多数CKD患者的肾脏将会不断受损,最后约有三分之一患者会发展为终末期肾病[10]。因此,为HFD导致的早期CKD患者提供治疗方法相关思路有着重要意义。现有研究证实4-OI对缺血再灌注造成的急性肾损伤和CKD发展过程中出现的肾脏纤维化具有抑制作用,从而保护肾脏[4-6,11]。同时,4-OI还能够有效调节HFD诱导的肥胖小鼠的葡萄糖稳态和促进非酒精性脂肪性肝病的肝细胞脂质代谢[12-13]。然而,4-OI是否对HFD诱导的早期肾损伤具有保护作用尚不清楚。本研究结果表明,4-OI干预可显著减轻HFD造成的肾脏近曲小管刷状缘断裂和上皮细胞脱落,降低肾皮质中肾小管损伤标志物KIM-1和NGAL表达,以及减少尿液中UACR的含量,表明4-OI能够改善HFD导致的早期肾损伤。
肾脏是所有器官中耗氧率最高的器官之一。虽然肾脏仅占总重量0.5%,但它约占人体总耗氧量的7%[8]。此外,肾脏的线粒体密度仅次于心肌[14]。因此,肾脏和活性氧(reactive oxygen species,ROS)之间的关系是不可忽视的。肾脏ROS的产生和消除在正常生理条件下保持微妙平衡,多种抗氧化物能够有效清除多余ROS[15]。然而,发生CKD时,肾脏消除过剩ROS的能力受到损害,ROS的过量产生及累积会破坏体内氧化还原平衡,引发氧化应激反应[16]。研究发现,肥胖患者和HFD实验动物的肾脏中均出现了高水平氧化应激,并对肾小管上皮细胞造成损害[17-18]。本研究结果显示,4-OI干预可显著抑制HFD造成的肾皮质MDA水平的上升及GSH和SOD水平的下降,提示4-OI能够改善HFD导致的肾脏氧化应激,并可能以此保护肾小管损伤。
Nrf2是1个由7个高度保守的结构域(Neh1~7)构成的转录因子蛋白对维持细胞稳态至关重要[19]。16个核苷酸构成的ARE是许多抗氧化、细胞保护和解毒基因的调控元件[20]。当暴露于在抗氧化剂作用下时,Nrf2从细胞质转移到细胞核。在细胞核中,Nrf2通过ARE介导抗氧化酶的转录激活,如HO-1、NQO1、SOD、谷胱甘肽S -转移酶等[21]。Nrf2/ARE通路不仅具有根除细胞氧化损伤的强大能力,同时也是细胞防御由ROS引起的氧化应激关键调节通路[22]。既往研究表明双脱甲氧基姜黄素和海蜇皮胶原蛋白肽可以通过激活Nrf2/ARE通路减轻HFD小鼠肾脏的氧化应激,并以此改善肾损伤[23]。因此,Nrf2/ARE通路可能是抑制HFD造成的肾脏氧化应激并以此降低肾损伤水平的有效通路。本研究结果显示,4-OI干预可以显著上调肾皮质Nrf2表达以及Nrf2/ARE通路下游的HO-1、NQO1和SOD-1等的表达水平,提示4-OI可能通过激活Nrf2/ARE通路,进而改善HFD导致的肾脏氧化应激。
综上所述,本研究结果表明4-OI可能通过激活Nrf2/ARE通路降低肾脏氧化应激水平,从而改善HFD导致的早期肾损伤。这为治疗HFD导致的早期CKD提供了新的思路。
参 考 文 献
[1] Sun Y,Ge X,Li X,et al. High-fat diet promotes renal injury by in? ducing oxidative stress and mitochondrial dysfunction[J]. Cell Death Dis,2020,11(10):914.
[2] Culver SA,Akhtar S,Rountree-Jablin C,et al. Knockout of neph? ron ATP6AP2 impairs proximal tubule function and prevents high-fat diet-induced obesity in male mice[J]. Endocrinology,2021,162(12):bqab200.
[3] Lu QY,Yang LJ,Xiao JJ,et al. Empagliflozin attenuates the renal tubular ferroptosis in diabetic kidney disease through AMPK/NRF2 pathway[J]. Free Radic Biol Med,2023,195:89-102.
[4] Tian F,Wang Z,He JQ,et al. 4-Octyl itaconate protects against re? nal fibrosis via inhibiting TGF-β/Smad pathway,autophagy and reduc? ing generation of reactive oxygen species[J]. Eur J Pharmacol,2020,873:172989.
[5] Xu LJ,Cai J,Li CR,et al. 4-Octyl itaconate attenuates LPSinduced acute kidney injury by activating Nrf2 and inhibiting STAT3 signaling[J]. Mol Med,2023,29(1):58.
[6] Li XK,Yang HJ,Du SH,et al. 4-Octyl itaconate alleviates renal ischemia reperfusion injury by ameliorating endoplasmic reticulum stress via Nrf2 pathway[J]. Exp Biol Med,2023,248(23):2408-2420.
[7] Wang Y,Quan F,Cao QH,et al. Quercetin alleviates acute kidney injury by inhibiting ferroptosis[J]. J Adv Res,2021,28:231-243.
[8] Kishi S,Nagasu H,Kidokoro K,et al. Oxidative stress and the role of redox signalling in chronic kidney disease[J]. Nat Rev Nephrol,2024,20(2):101-119.
[9] Magesh S,Chen Y,Hu LQ. Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents[J]. Med Res Rev,2012,32(4):687-726.
[10] Xing L,Wu SY,Shi Y,et al. Chronic constant light exposure ag? gravates high fat diet-induced renal injury in rats[J]. Front Endocrinol,2022,13:900392.
[11] Ke QQ,Shi CF,Lv YH,et al. SGLT2 inhibitor counteracts NLRP3 inflammasome via tubular metabolite itaconate in fibrosis kidney[J]. FASEB J,2022,36(1):e22078.
[12] Frieler RA,Vigil TM,Song JR,et al. Aconitate decarboxylase 1 regulates glucose homeostasis and obesity in mice[J]. Obesity,2022,30(9):1818-1830.
[13] Weiss JM,Palmieri EM,Gonzalez-Cotto M,et al. Itaconic acid underpins hepatocyte lipid metabolism in non-alcoholic fatty liver dis? ease in male mice[J]. Nat Metab,2023,5(6):981-995.
[14] Forbes JM,Thorburn DR. Mitochondrial dysfunction in diabetic kidney disease[J]. Nat Rev Nephrol,2018,14(5):291-312.
[15] Coussens LM,Werb Z. Inflammation and cancer[J]. Nature,2002,420:860-867.
[16] Rimessi A,Previati M,Nigro F,et al. Mitochondrial reactive oxy? gen species and inflammation:molecular mechanisms,diseases and promising therapies[J]. Int J Biochem Cell Biol,2016,81(Pt B):281-293.
[17] Cheng K,Song ZH,Chen YN,et al. Resveratrol protects against renal damage via attenuation of inflammation and oxidative stress in high-fat-diet-induced obese mice[J]. Inflammation,2019,42(3):937-945.
[18] Liu BC,Tang TT,Lv LL,et al. Renal tubule injury:a driving force toward chronic kidney disease[J]. Kidney Int,2018,93(3):568-579.
[19] Tkachev VO,Menshchikova EB,Zenkov NK. Mechanism of the Nrf2/Keap1/ARE signaling system[J]. Biochemistry,2011,76(4):407-422.
[20] Lee JM,Johnson JA. An important role of Nrf2-ARE pathway in the cellular defense mechanism[J]. BMB Rep,2004,37(2):139-143.
[21] Cui WP,Bai Y,Luo P,et al. Preventive and therapeutic effects of MG132 by activating Nrf2-ARE signaling pathway on oxidative stressinduced cardiovascular and renal injury[J]. Oxid Med Cell Longev,2013,2013:306073.
[22] Abed DA,Goldstein M,Albanyan H,et al. Discovery of direct in? hibitors of Keap1-Nrf2 protein-protein interaction as potential thera? peutic and preventive agents[J]. Acta Pharm Sin B,2015,5(4):285-299.
[23] Miao BT,Zheng JW,Zheng GP,et al. Using collagen peptides from the skin of monkfish(Lophius litulon) to ameliorate kidney damage in high-fat diet fed mice by regulating the Nrf2 pathway and NLRP3 sig? naling[J]. Front Nutr,2022,9:798708.
(责任编辑:李青颖)
本文引用格式:
王泸宁,万进东,陈佳瑶,等. 4辛基-衣康酸通过Nrf2/ARE通路抑制氧化应激减轻高脂饮食诱导的早期肾损伤[J]. 重庆医科大学学报,2025,50(2):254-259.

