陆地棉GhUGP1基因的克隆与表达分析






摘 要 为进一步了解UGPase在棉花中的作用,根据全基因组测序结果,筛选且克隆了在陆地棉纤维发育过程中的关键基因 GhUGP1。利用生物信息学方法对其核苷酸和氨基酸序列进行分析,通过同源重组技术,将 GhUGP1基因的编码序列构建到原核表达载体pMAL-C4x上,通过IPTG诱导蛋白表达来确定IPTG诱导蛋白的最佳条件,最后利用Western Blot鉴定重组蛋白。结果显示, GhUGP1(XP_040931642.1)全长序列 "6 572 bp,编码区1 404 bp,编码467个氨基酸,预测分子质量约为51.493 ku,等电点为5.86。氨基酸序列比对分析发现在陆地棉、亚洲棉、木槿等不同物种间UGP序列的相似率为90.63%。进化树分析结果显示GhUGP1蛋白与亚洲棉UGP蛋白亲缘关系最近,同源性最高并在一个分支上。亚细胞定位结果显示该蛋白为核膜共定位。蛋白诱导时由于IPTG浓度梯度结果差别不明显,选择IPTG终浓度为0.3 mmol/L,而温度梯度和时间梯度结果差异明显,确定最佳诱导温度为28 ℃,最佳诱导时间为6 h,蛋白溶解及纯化的温度和时间为28 ℃诱导6 h。Western Blot结果表明重组蛋白的大小正确,最终成功获得了大小为95.9 ku的pMAL-C4x-GhUGP1重组蛋白,为后期对 GhUGP1功能深度解析提供帮助。
关键词 陆地棉; GhUGP1基因;克隆;序列分析;原核表达
棉花(Gossypium spp)是不可或缺的经济作物,棉花纤维在已知的天然纤维中纯度最高,在全球纺织业中具有重要价值,为人类提供了巨大的利益,是全球重要的原材料[1]。虽然国内棉花总产较高,但是纤维品质较差,因此改善纤维品质成为棉花育种的重点。纤维品质包括纤维长度、强度、马克隆值等。其中纤维强度主要由细胞壁强度决定,植物细胞壁包含纤维素、半纤维素和果胶三大类多糖,以及酚类化合物和细胞壁蛋白。果胶可连接纤维素、非纤维素和其他基质,因此其对改良棉花纤维品质具有重要作用[2]。在果胶合成的三条途径中,UDP-葡萄糖途径备受关注。尿苷二磷酸葡萄糖焦磷酸化酶基因(UGP)对于多糖生物合成来说十分关键[3],并且对植物生长发育也起到重要作用[4]。其中,尿苷二磷酸葡萄糖焦磷酸化酶(UGPase)在植物各个组织和器官中均有存在,并且UGPase与糖代谢密切相关[5]。在糖代谢的途径中,UGPase可逆催化尿苷三磷酸(UTP)和葡萄糖-1-磷酸(Glucose1-phosphate)反应生成尿苷二磷酸葡萄糖(UDPG)和焦磷酸(PPi),这是一个可逆反应,反应公式为Glucose-1-phosphate+UTPPPi+UDPG[6]。其中UDPG可作为胞外信号分子来影响植物生长[7],也是形成纤维素、半纤维素等重要细胞壁聚合物的前体[8]。UGPase最先于1953年在酵母细胞中被发现[9-10]。研究发现UGPase可分为两类,分别是UGPase-A和UGPase-B,且各自结构差异明显没有同源性[11]。UGPase在自然界中分布较广,目前已在部分动物[12]、植物[13-15]及微生物[16]中发现并研究,但对于植物来说只有被子植物中含有UGPase[17]。在棉花中UGP基因参与纤维素及糖类化合物的合成,并可能在棉花纤维发育中起重要作用[18-19]。
本研究通过对陆地棉转录数据分析并用qRT-PCR进行验证,筛选到陆地棉纤维发育过程中的关键基因 GhUGP1,对其进行生物信息学分析并构建原核表达载体,通过设置异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)浓度、时间及温度梯度发现利用IPTG诱导蛋白的最佳条件,成功在体外表达,为后续深入研究蛋白互作,UGP基因功能及创制纤维品质优良的种质材料奠定基础。
1 材料与方法
1.1 试验材料
高保真酶TransStart FastPfu DNA Polymerase(含2.5 mmol/L dNTPs)、TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix购自北京全式金生物公司;DNA Marker(D2000)、快速质粒小提试剂盒(DP105)、(DP441)RNAprep Pure多糖多酚植物总RNA提取试剂盒、大肠杆菌DH5α和BL21DE3)均购自天根生化科技(北京)有限公司;GatewayTMBP ClonaseTMII 酶混合物和GatewayTMLR ClonaseTM酶混合物购自赛默飞世尔科技(中国)有限公司;IPTG、4×蛋白上样缓冲液(含巯基还原剂)、苯甲基磺酰氟(phenylmethylsulfonyl fluorid,PMSF)、30%制胶液(29∶1)购自北京索莱宝科技有限公司;MBPSep Dextrin Agarose Resin 6FF(MBP标签蛋白高度交联纯化树脂)购自翌圣生物科技(上海)股份有限公司Tween 20/吐温20(Reagent grade)购自碧云天生物;pDONORZeo(Zeo+)和pMAL-C4x(Amp+)载体由新疆农业科学院核技术生物技术研究所作物分子植物育种课题保存;SL0911农杆菌侵染液(烟草专用)购自北京酷来搏科技有限公司;其他试剂均为化学分析纯。
1.2 试验方法
1.2.1 GhUGP1基因荧光定量验证 对棉花开花后0、5、10、15、20、25 d时期的纤维进行取样,利用天根DP441试剂盒提取样品的RNA,用全式金试剂盒进行RNA反转录,获得cDNA,用15 g/L琼脂糖检测条带。利用Snap Gene软件设计 GhUGP1基因(Ghir_A08G004240.1)的qRT-PCR引物。使用全式金qPCR SuperMix试剂盒进行qRT-PCR,仪器LightCycler 480 Instrument II,反应体系和仪器程序参照说明书。内参基因为GhUBQ7(该基因在棉花各组织,细胞中稳定表达,且不受外源或内源因素的影响)[20], "3个重复,运用2-△△Ct法计算。
1.2.2 GhUGP1基因序列的获得及原核表达载体构建 根据棉花全基因组测序结果以TM-1 cDNA克隆 GhUGP1基因并将其连接到pMAL-C4x(MBP)载体上。根据 GhUGP1基因(Ghir_A08G004240.1)的CDS序列设计并合成添加BP接头引物进行扩增(表1),扩增体系为50 μL:cDNA 3 μL、正向引物1 μL、反向引物1 μL、dNTPS(2.5 mmol/L)10 μL、PCR Stimulant(5×)0.5 μL、5×Fly Buffer 10 μL、Trans Start Fast Pfu Fly Buffer 1 μL、ddH2O 23.5 μL。PCR扩增程序:预变性98 ℃ 5 min,以下程序32个循环(变性98 ℃ 5 min、退火55 ℃ 30 s、延伸72 ℃" "90 s),最终延伸72 ℃ 5 min。用15 g/L琼脂糖电泳检测PCR产物。
利用Gateway克隆技术构建载体,利用BP反应将目的片段连入中间载体pDONOR/Zeo,反应体系为:1.5 μL ddH2O、1 μL" pDONER/Zeo(Zeo+)、2 μL PCR产物、0.5 μL Gateway BP Clonase。25 ℃放置4 h转化至DH5α,涂于含博来霉素(Zeo)抗性的培养皿。挑取单克隆检测完毕后将阳性菌液送去上海生工生物技术有限公司(http://www.sangon.com /sangon)测序。测序正确后提取质粒。
利用LR反应构建超表达载体及原核表达载体,反应体系为:1.5 μL ddH2O、1 μL pGWB405(Spe+)/pMAL-C4x(Amp+)、1 μL pDONER/Zeo-GhUGP1质粒、0.5 μL Gateway LR Clonase。室温放置4 h,转入DH5α,涂于含氨苄青霉素(Amp)抗性的培养皿,挑取单克隆检测,提取质粒后将质粒转入BL21感受态,挑取单克隆阳检,选择阳检正确的菌液,保菌并进行后续 "试验。
1.3 GhUGP1基因的序列分析
通过多种在线工具对 GhUGP1的序列进行分析。利用Expasy在线工具查找蛋白的分子质量和等电点。利用NCBI中的ORF" finder预测开放阅读框架。利用NCBI中的Blast对其蛋白序列进行同源性分析、DNAMAN对多重序列进行比对。利用MEGA" 7.0内置的ClustalW程序进行多序列比对后构建系统发生树。bootstrap值设置为5 000、p-distance模型采用邻近法(Neighbor-Joining,NJ)构建GhUGP1蛋白与其他物种蛋白的系统进化树。
1.4 亚细胞定位分析
利用Gateway技术将 GhUGP1的编码区构建到表达载体中形成融合质粒 pGWB405-GhUGP1,将测序正确的质粒利用电转法转入农杆菌GV3101,阳检后选择正确的菌液保菌, "-80 ℃保存。取2 mL活化后的农杆菌菌液进行离心收菌,使用烟草侵染液重悬菌体,并调节重悬液的OD600值为0.7~0.8,避光静置2~3 h后用注射器注射侵染生长5~8周的健康幼嫩的烟草叶片,每株烟草注射2~3个叶片,使菌液在烟草叶片内部扩散,将侵染后的烟草植株标记并在黑暗条件下放置48 h后使用激光共聚焦显微镜检测荧光信号表达情况。
1.5 目的蛋白的诱导及可溶性分析
将转化BL21感受态后阳检正确且活化的大肠杆菌菌液按1∶50的比例加入含有Amp抗性的LB液体培养基中37 ℃培养至OD600为0.6~0.8时,取5 mL菌液分装于5个试管内,再分别加入IPTG使其终浓度达到0.1、0.3、0.5、0.7及0.9 mmol/L即可,4 ℃、8 000 r/min离心10 min,弃上清,向沉淀中加入50 μL的1×磷酸缓冲盐溶液(phosphate buffered saline,PBS)重悬菌体,再加入等量的4×蛋白上样缓冲液,沸水浴10 min,在冰上冷却后取15 μL进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测,根据试验结果确定IPTG的最佳 "浓度。
根据上述的试验结果再分别设置时间梯度(0、2、4、6、8 h)和温度梯度(18 ℃、28 ℃、37 ℃)培养结束后分别收集菌液。将收集的菌液4 ℃、 "8 000 r/min离心10 min,倒掉上清,于沉淀中加入50 μL的1×PBS溶液使其重悬,再加入50 μL 4×蛋白上样缓冲液,沸水浴10 min,在冰上冷却后取20 μL进行SDS-PAGE检测,根据试验结果确定IPTG诱导的最佳时间及温度。
在重组蛋白pMAL-C4x-GhUGP1成功诱导表达后,再根据摸索出的最佳诱导表达的条件。对目的蛋白进行可溶性分析。诱导表达结束后取600 mL菌液4 ℃、8 000 r/min离心10 min,向沉淀菌体中加入20 mL 1×PBS溶液重悬,采用超声破碎,频率60 kHz,超声处理30 s,每次间隔 "3~5 s,持续6~10 min。4 ℃、8 000 r/min离心10 min,于上清沉淀中分别加入4×蛋白上样缓冲液,取20 μL进行SDS-PAGE检测,分析蛋白的可溶性。
1.6 目的蛋白的纯化
pMAL-C4x-GhUGP1重组蛋白纯化:将10 mL破碎后的菌液4 ℃、12 000 r/min离心10 min,取上清微滤处理并加入裂解液与2 mL 静置后的MBPSep Dextrin Agarose Resin 6FF(MBP标签蛋白高度交联纯化树脂)混匀,4 ℃摇晃1 h使蛋白与树脂充分结合,过柱收集流出液;用 "5 mL洗脱缓冲液(1 mol/L Tris-Cl" pH=8.0, "10 mmol/L还原型谷胱甘肽)收集洗脱液,用于SDS-PAGE检测。
1.7 Western Blot检测重组蛋白
将目的蛋白和纯化蛋白经过处理后,进行SDS-PAGE检测。结束后将蛋白胶放入提前预冷好的转膜液中浸泡5~10 min,利用Bio-Rad半干转膜仪将浸泡好的蛋白胶转到PVDF膜上,20 V恒压转膜1 h即可。转膜结束后将膜夹出,正面朝下放入10 mL含有5%脱脂奶粉的1×PBS溶液常温摇晃封闭1 h,封闭结束后按照1∶8 000的比例加入一抗,常温孵育3 h或者4 ℃摇晃过夜。用PBST溶液将膜漂洗3遍,每遍5 min。然后将膜放入5~10 mL 1×PBS溶液中,按 "1∶10 000的比例添加二抗,常温孵育3 h,用PBST溶液将膜漂洗3~5遍,每遍5~10 min。然后在漂洗干净的PVDF膜上加入Western发光检测液A、B。用保鲜膜封好于暗匣内放置 "10~30 min,结束后用蒸馏水轻轻冲洗,待膜晾干后进行观察。
2 结果与分析
2.1 GhUGP1基因荧光定量验证
通过qRT-PCR对 GhUGP1在棉纤维不同发育时期的表达模式分析发现(图1),该基因在棉花纤维发育期的表达量逐渐上升,在花后20 d时表达量最高,说明其可能参与棉花纤维的发育并在纤维发育伸长时起到重要作用。
2.2 pMAL-C4x-GhUGP1原核表达载体的构建
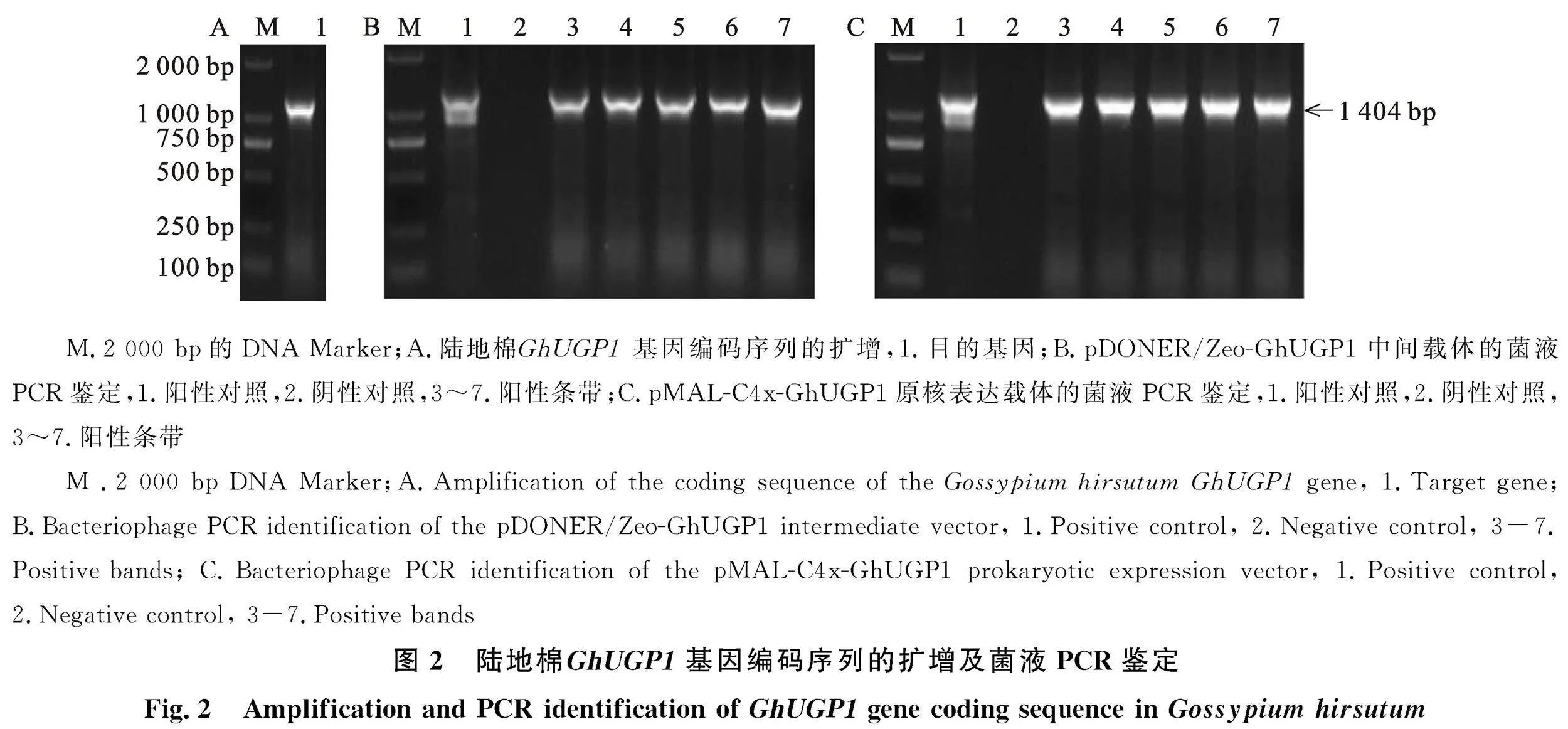
以陆地棉cDNA为模板,BP-GhUGP1-F和BP-GhUGP1-R为引物,扩增获得1000bp至2 000 bp之间的目的条带(图2-A),与 GhUGP1基因片段大小基本相符。回收PCR产物进行BP反应,后将连接产物转化到DH5ɑ感受态细胞中,涂布于含有Zeo抗性的固体培养基中,经阳检测序后获得1 404 bp的片段(图2-B),表明pDONER/Zeo-GhUGP1入门载体构建成功。提取BP质粒后进行LR反应,阳检后将正确的质粒转化到BL21感受态细胞中,涂布于含有Amp抗性的固体培养基中,经阳检测序后获得1 404 bp的片段(图2-C),表明pMAL-C4x-GhUGP1原核表达载体构建成功。
2.3 GhUGP1基因的序列分析
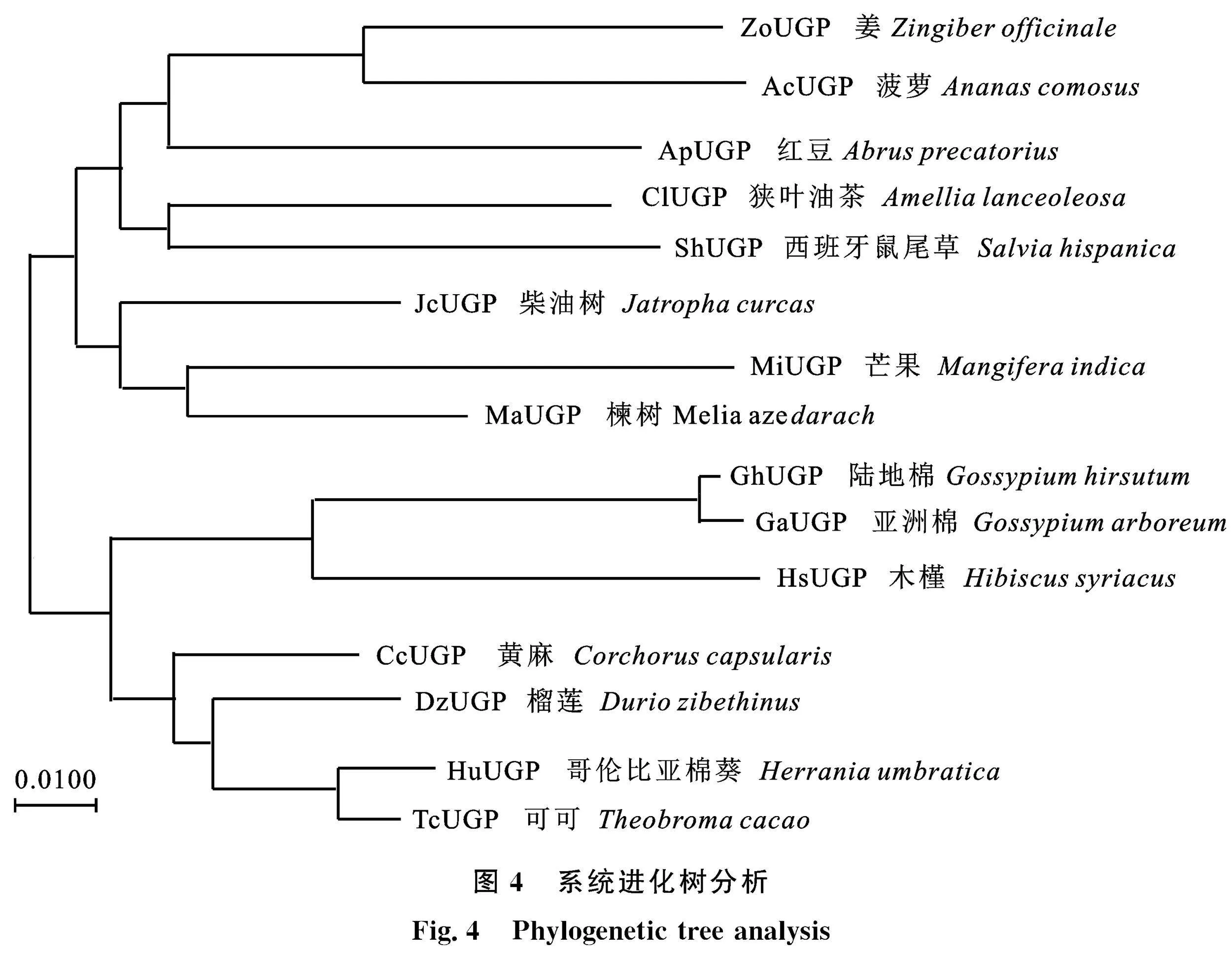
经NCBI网站的ORF finder程序预测发现,这条序列含有完整的阅读框, GhUGP1全长序列6 572 bp,编码区长1 404 bp,编码467个氨基酸,预测分子质量约为51.493 ku,等电点为5.86。将 GhUGP1基因的氨基酸序列与其他植物的UGP1蛋白序列进行了氨基酸序列比对分析,结果如图3所示,整体相似性较高,为93.61%,说明UGP1在这些植物中较保守。
经NCBI网站的BLAST程序获得多个物种与GhUGP1的同源蛋白。使用MEGA" 7.0软件的NJ法构建系统进化树(图4)。结果显示,陆地棉GhUGP1蛋白与亚洲棉(Gossypium arboreum)UGP亲缘关系最近,与木槿(Hibiscus syriacus)亲缘关系较近,可能是因为陆地棉、亚洲棉及木槿同为被子植物门锦葵科,因此它们之间的亲缘关系相比其他物种较近。
2.4 GhUGP1基因的亚细胞定位分析
为进一步研究 GhUGP1的亚细胞定位情况构建了 GhUGP1与GFP的融合载体,转化农杆菌阳检后,侵染烟草叶片,观察 GhUGP1在烟草叶片中的荧光信号,共聚焦荧光显微镜检测显示, GhUGP1在细胞核和细胞膜上都有荧光信号,表明 GhUGP1基因所编码的蛋白质共定位于细胞膜和细胞核上(图5)。
2.5 IPTG诱导蛋白的最佳条件
为了确定IPTG的最佳诱导浓度,在转化了pMAL-C4x-GhUGP1,且OD600为0.6~0.8的菌液中分别用不同IPTG终浓度(0、0.1、0.3、0.5、0.7及0.9 mmol/L)进行37 ℃诱导3 h,结果显示,目的条带的大小约为95.9 ku(图6-A),与预测结果相符,表明GhUGP1在大肠杆菌中成功表达,且根据条带的清晰度确定IPTG的最佳诱导浓度为0.3 mmol/L。
为了确定IPTG的最佳诱导时间,在转化了pMAL-C4x-GhUGP1,且OD600为0.6~0.8的菌液中用相同IPTG终浓度(0.3 mmol/L)分别进行37 ℃诱导0、2、4、6、8 h,结果显示,pMAL-C4x-GhUGP1能在大肠杆菌中成功表达,且在诱导6 h时的条带较清晰(图6-B),因此可以确定IPTG诱导的最佳时间为6 h。
为了确定IPTG的最佳诱导温度,在转化了pMAL-C4x-GhUGP1,且OD600为0.6~0.8的菌液中用相同IPTG终浓度(0.3 mmol/L)分别进行18、28、37 ℃,进行SDS-PAGE分析,结果显示(图6-C),且IPTG诱导的最佳温度为28 ℃。
最终,最佳条件为IPTG的终浓度为0.3 mmol/L,诱导温度为28 ℃,诱导时间为6 h,并用这些结果进行后续的可溶性分析及Western Blot检测。
2.6 蛋白的可溶性分析、纯化及Western Blot检测于28 ℃诱导pMAL-C4x-GhUGP1的表达,将诱导表达后所得的菌液超声破碎后分别取上清和沉淀部分进行SDS-PAGE电泳检测,发现重组蛋白主要存在于沉淀中(图7),但是上清中也有部分蛋白,因此pMAL-C4x-GhUGP1为可溶性蛋白。SDS-PAGE检测发现,重组蛋白pMAL-C4x-GhUGP1被成功洗脱,条带较为单一,表明纯化成功(图7)。将pMAL-C4x-GhUGP1重组蛋白进行Western blotting检测,结果表明,纯化后的GhUGP1重组蛋白,在PVDF膜上约95.9 ku处有一明显条带(图7),与预期结果一致,说明重组蛋白pMAL-C4x-GhUGP1与抗体发生特异性结合。
3 讨" 论
UGPase是植物糖代谢途径中的一个关键酶,主要通过偶联蔗糖磷酸合酶(SPS)和蔗糖合酶(SuSy)来参与植物的糖代谢。蔗糖合酶主要是分解蔗糖形成葡萄糖与果糖[21],而葡萄糖(Glc)又是棉花纤维伸长过程中的所需物质[22],有研究发现蔗糖合酶表达量与纤维起始数目多少和纤维伸长度呈线性关系,在棉花纤维起始和伸长过程中具有重要作用[23]。
Wang等[24]发现在棉花中GhUGP基因的表达量受乙烯诱导的影响,在拟南芥中异源表达后植株的淀粉、可溶性糖及纤维素含量增加。本研究中qRT-PCR结果显示 GhUGP1在棉花纤维发育期的表达量逐渐上升,UGP基因可能参与调节棉花纤维发育,是棉花纤维发育的重要候选基因。Pang等[25]发现UGP1基因的表达量提高后,纤维中寡糖的含量降低,UDPG的合成提高,从而调控细胞壁的合成。还有研究发现UGP基因在植物体内的表达会受外界条件的影响,施加碳源和氮源能有效提高香菇菌丝UGP基因的转录表达水平[26]。佟岩等[27]发现在铁皮石斛中UGP基因的表达量受外界温度的影响。郭鑫[28]发现兴安落叶松中的LgUGPase1和LgUGPase2基因主要参与植物的代谢调控,并对外界环境和植物激素有一定的响应。研究发现低浓度Cd2+促进三角褐指藻生长,并提高三角褐指藻中UGP基因的表达量[29]。张帆等[30]发现在水稻过表达OsUGP后UGPase酶活性,并且胞内多糖含量和胞外多糖含量都上升,表明OsUGP对多糖合成具有正向作用。近年来,研究人员还从党参[31]、落叶松[32]、海带[33]中分离克隆出了UGPase基因。这些结果都为UGP基因家族的研究提供了宝贵的材料。
本研究从陆地棉中克隆出 GhUGP1基因编码区为1 404 bp,编码467个氨基酸,预测分子质量约为51.493 ku,通过UGP氨基酸序列比对及系统进化树分析显示,GhUGP1氨基酸片段与其他植物有较高的同源性(93.61%),表明UGP基因编码区保守性较高,与前人报道的结果类似[34]。qRT-PCR结果显示 GhUGP1可能参与棉花纤维发育,与前人结果一致[35]。将其构建到表达载体pWGB405和pMAL-C4x上,亚细胞定位结果显示该蛋白为核膜共定位,通过蛋白诱导梯度试验确定了当IPTG终浓度为0.3 mmol/L、诱导温度为28 ℃、诱导时间为6 h时重组蛋白可被成功诱导且效果最佳,后获得可溶性的pMAL-C4x-GhUGP1蛋白并进行了纯化,Western Blot试验验证了纯化后蛋白的正确性,所以克隆和鉴定棉花中的UGPase基因对棉花糖代谢途径及纤维发育研究具有重要意义。
棉花作为新疆的重要经济,提高棉花产量,改良棉花纤维品质成为棉花产业可续发展的关键。本研究根据棉花全基因组测序结果克隆出 GhUGP1基因的编码区,并构建出了表达载体,利用IPTG成功诱导pMAL-C4x-GhUGP1重组蛋白。为后续在棉花中研究尿苷二磷酸葡萄糖焦磷酸化酶在纤维发育中的功能及分子机理奠定基础。
参考文献 Reference:
[1] GAO X,GUO H,ZHANG Q,et al.Arbuscular mycorrhizal fungi (AMF) enhanced the growth,yield,fiber quality and phosphorus regulation in upland cotton (Gossypium hirsutum L.)[J].Scientific Reports,2020,10(1):2084.
[2]徐中阳.陆地棉UGP基因家族的鉴定及UGD基因功能的初步分析[D].郑州:郑州大学,2022.
XU ZH Y.Identification of the UGP gene family in upland cotton and preliminary analysis of the function of UGD[D].Zhengzhou :Zhengzhou University,2022.
[3]XU J W,JI S L,LI H J,et al.Increased polysaccharide production and biosynthetic gene expressions in a submerged culture of Ganoderma lucidum by the overexpression of the homologous α-phosphoglucomutase gene.[J].Bioprocess and Biosystems Engineering,2015,38(2):399-405.
[4]肖桂青,卢向阳,张海文.植物尿苷二磷酸糖焦磷酸化酶研究进展[J].分子植物育种,2017,15(3):1149-1155.
XIAO G Q,LU X Y,ZHANG H W.Progress of UDP-sugar-producing pyrophosphorylase in Plants[J].Molecular Plant Breeding,2017,15(3):1149-1155.
[5]KLECZKOWSKI L A.Glucose activation and metabolism through UDP-glucose pyrophosphorylase in plants [J].Phytochemistry, 1994,37(6):1507-1515.
[6]EIMERT K,VILLAND P,KILIAN A,et al.Cloning and characterization of several cDNAs for UDP-glucose pyrophosphorylase from barley (Hordeum vulgare) tissues [J].Gene,1996,170(2):227-232.
[7]JANSE VAN RENSBURG H C,VAN DEN ENDE W.UDP-glucose:a potential signaling molecule in plants? [J].Frontiers in Plant Science ,2018,8:2230.
[8]KLECZKOWSKI L A,DECKER D.Sugar activation for production of nucleotide sugars as substrates for glycosyltransferases in plants [J].Journal of Applied Glycoscience,2015,62(2):25-36.
[9]MUNCH-PETERSEN A,KALCKAR H M,CUTOLO E,et al.Uridyl transferases and the formation of uridine triphosphate:enzymic production of uridine triphosphate:uridine diphosphoglucose pyrophosphorolysis [J].Nature,1953,172(4388):1036-1037.
[10] DARAN J M,DALLIES N,THINES-SEMPOUX D,et al.Genetic and biochemical characterization of the UGP1 gene encoding the UDP-glucose pyrophosphorylase from Saccharomyces cerevisiae [J].European Journal of Biochemistry,1995,233(2):520-530.
[11]KLECZKOWSKI L A,KUNZ S,WILCZYNSKA M.Mechanisms of UDP-glucose synthesis in plants [J].Critical Reviews in Plant Sciences,2010,29(4):191-203.
[12]FVHRING J I,CRAMER J T,SCHNEIDER J,et al.A quaternary mechanism enables the complex biological functions of octameric human UDP-glucose pyrophosphorylase,a key enzyme in cell metabolism [J].Scientific Reports,2015,5(1):9618.
[13]DECKER D,KLECZKOWSKI L A.UDP-sugar producing pyrophosphorylases:distinct and essential enzymes with" "overlapping substrate specificities,providing de novo precursors for glycosylation reactions [J].Frontiers in Plant Science,2019,9:1822.
[14]DECKER D,BERG C,KLECZKOWSKI L A.Identification and characterization of inhibitors of UDP-glucose and UDP-sugar pyrophosphorylases for in vivo studies [J].The Plant Journal,2017,90(6):1093-1107.
[15]贺望兴,杨普香,李延升,等.灵芝尿苷二磷酸葡萄糖焦磷酸化酶基因的电子克隆与生物信息学分析[J].江西农业学报,2019,31 (9):86-94.
HE W X,YANG P X,LI Y SH,et al.Silico" cloning and characterization analysis of UDP glucose pyrophosphorylase gene from Ganoderma lucidum by bioinformatics[J].Acta Agriculturae Jiangxi,2019,31(9):86-94.
[16]MAEDA K,NARIKAWA R,IKEUCHI M.CugP is a novel ubiquitous non-GalU-type bacterial UDP-glucosepyrophosphorylase found in cyanobacteria [J].Journal of Bacteriology,2014,196(13):2348-2354.
[17]白蓓蓓,陈业渊,盖江涛,等.植物UDP-葡萄糖焦磷酸化酶家族基因鉴定及序列进化分析[J].分子植物育种,2019,17(4):1186-1190.
BAI P P,CHEN Y Y,GAI J T,et al.Identification and sequence evolution analysis of plant UDP glucose pyrophosphorylase family genes[J].Molecular Plant Breeding,2019,17(4):1186-1190.
[18]XU Z,HE J,AZHAR M T,et al.UDP-glucose pyrophosphorylase:genome-wide identification,expression and functional analyses in Gossypium hirsutum [J].PeerJ,2022,10:e13460.
[19]陈 琴,李多露,赵杰银,等.陆地棉UDPGP基因家族的鉴定及抗旱性分析[J].棉花学报,2022,34(1):12-22.
CHEN Q,LI D L,ZHAO J Y,et al.Identification and drought resistance analysis of UDPGP family genes in Gossypium hirsutum[J].Cotton Science,2022,34(1):12-22.
[20]张玉芳,赵丽娟,曾幼玲.基因表达研究中内参基因的选择与应用[J].植物生理学报,2014,50(8):1119-1125.
ZHANG Y F,ZHAO L J,ZENG Y L,et al.Selection and application of reference genes for gene expression studies[J].Plant Physiology Journal,2014,50(8):1119-1125.
[21]GEIGENBERGER P,STITT M.Sucrose synthase catalyses a readily reversible reaction in vivo in developing potato tubers and other plant tissues [J].Planta,1993, "189(3):329-339.
[22]罗小英,肖月华,李德谋,等.棉纤维蔗糖合酶基因SS3上游调控序列的克隆及其表达分析[J].中国生物化学与分子生物学报,2005,21(3):334-339.
LUO X Y,XIAO Y H,LI D M,et al.Cloning and analysis of the upstream regulated sequence of a cotton fiber sucrose synthase gene[J].Chinese Journal of Biochemistry and Molecular Biology,2005,21(3):334-339.
[23]RUAN Y L,LLEWELLYN D J,FURBANK R T.Suppression of sucrose synthase gene expression represses cotton fiber cellinitiation,elongation,and seed development [J].The Plant Cell,2003,15(4):952-964.
[24]WANG Q,ZHANG X,LI F,et al.Identification of a UDP-glucose pyrophosphorylase from cotton (Gossypium hirsutum L.) involved in cellulose biosynthesis in Arabidopsis thaliana [J].Plant Cell Reports,2011,30:1303-1312.
[25]PANG C Y,WANG H,PANG Y,et al.Comparative proteomics indicates that biosynthesis of pectic precursors is important for cotton fiber and Arabidopsis root hair elongation [J].Molecular amp; Cellular Proteomics,2010,9(9):2019-2033.
[26]陈小敏,吴海冰,向泉桔,等.香菇UDP-葡萄糖焦磷酸化酶转录水平及酶活性对不同碳氮源的响应特征[J].四川大学学报(自然科学版),2018,55(1):214-220.
CHEN X M,WU H B,XIANG Q" J,et al.Transcriptional expression profiles and enzyme activity of UGP from Letinous edodes under different carbon and nitrogen sources[J].Journal of Sichuan University (Natural Science Edition),2018,55(1):214-220.
[27]佟 岩,黄 荟,王 辉,等.铁皮石斛多糖合成相关基因在不同组织及低温胁迫下的表达分析[J].西部林业科学,2021,50(3):20-27.
TONG Y,HUANG H,WANG H,et al.Expression analysis of polysaccharide synthesis related genes in different tissues and low temperature stress on Dendrobium officinale[J].Journal of West China Forestry Science,2021, "50(3):20-27.
[28]郭 鑫.兴安落叶松尿苷二磷酸葡萄糖焦磷酸化酶促进转基因植物营养生长的分子机理[D].呼和浩特:内蒙古大学,2019.
GUO X.Molecular mechanism of UDP-glucose pyrophosphatase enhancing vegetative growth in transgenic plants[D].Hohhot:Inner Mongolia University,2019.
[29]吴明晗,朱葆华,张瑞豪,等.Cd2+对三角褐指藻生长及尿苷二磷酸葡萄糖焦磷酸化酶基因表达调控的影响[J]. "水生生物学报,2021,45(4):749-755.
WU M H,ZHU B H,ZHANG R H,et al.Effecta of cadmium on the growth and expression of UDP-Glucose pyrophosphorylase gene in Phaeodactylum tricornutum[J].Acta Hydrobiologica Sinica,2021,45(4):749-755.
[30]张 帆,钟 威,穆 虹,等.过量表达OsUgp2基因提高紫芝多糖含量[J].菌物学报,2011,30(3):442-452.
ZHANG F,ZHONG W,MU H,et al.Increasing polysaccharide yield by over-expression of OsUgp2 in Ganoderma sinense[J].Mycosystema,2011,30(3):442-452.
[31]李 晶,郭琼琼,孙海峰,等.党参CpUGPase基因的克隆、序列分析与原核表达[J].中草药,2016,47(21):3876-3883.
LI J,GUO Q Q,SUN H F,et al. Cloning,sequence analysis,and prokaryotic expression of CpUGPase gene in Codonopsis radix[J].Chinese Traditional and Herbal Drugs,2016,47(21):3876-3883.
[32]梅丽丽.兴安落叶松UDP焦磷酸化酶基因启动子的克隆及功能分析[D].呼和浩特:内蒙古农业大学,2018.
MEI L L.Cloningand functional analysia of UDP pyrophosphorylase gene promoter from Larix gmelinii[D].Hohhot:Inner Mongolia Agricultural University,2018.
[33]CHI S,FENG Y J,LIU T.Molecular cloning,characterization,and comparison of UDP-glucose pyrophosphorylase from Gracilaria chouae and Saccharina japonica [J].Journal of Applied Phycology,2016,28:2051-2059.
[34]嵇元烨,吴 梅,吴秋丽,等.金线莲UGPase基因克隆与表达及在多糖合成中的作用[J].中草药,2021,52(12):3671-3678.
JI Y Y,WU M,WU Q L,et al.Cloning and expression of UGPase gene and its role in polysaccharide synthesis of Anoectochilus roxburghii[J].Chinese Traditional and Herbal Drugs,2021,52(12):3671-3678.
[35]张 岚,程 琦,梁士辰,等.棉花UGPase基因鉴定与生物信息学分析[J].棉花学报,2021,33(4):337-346.
ZHANG L,CHENG Q,LIANG SH CH,et al.Identification and bioinformatic analysis of UGPase gene family in cotton[J].Cotton Science,2021,33(4):337-346.
Cloning and Expression Analysis of "GhUGP1 Gene" from Gossypium hirsutum
Abstract This study aimed to understand the role of UGPase in cotton further. GhUGP1, a key gene in fibre development of Gossypium hirsutum, was screened and cloned based on whole genome sequencing results.Bioinformatics was then employed to analyze GhUGP1 nucleotide and amino acid sequences, and its coding sequences were subsequently inserted into a prokaryotic expression vector pMAL-C4x through the homologous recombination technique.IPTG-induced protein expression was used to determine the optimal conditions for IPTG-induced protein.Finally, Western Blot was used to identify the recombinant protein.The results showed that the full-length sequence of "GhUGP1 (XP_040931642.1) is 6 572 bp, with a coding region of 1 404 bp, encoding 467 amino acids, a predicted molecular mass" of about 51.493 ku, and an isoelectric point of 5.86.Amino acid sequence comparison analysis revealed that the similarity rate of UGP sequences among different species, such as Gossypium hirsutum, Gossypium arboreum, and Hibiscus syriacus was 90.63%.The results of evolutionary tree analysis showed that the GhUGP1 protein was closest to the UGP protein from Gossypium arboreum, with the highest homology, and on the same branch.The results of subcellular localization showed that the protein was co-localized at the nuclear membrane.The results of protein induction were not obvious due to the IPTG concentration gradient; thus, we chose the condition that the final concentration of IPTG was 0.3 mmol/L.The results of the temperature gradient and time gradient were obvious: the optimal induction temperature was 28 ℃, the optimal induction time was 6 h, and the temperature and time of protein solubilization and purification were 28 ℃ with induction for 6 h.The Western Blot results showed that the size of the recombinant protein was correct, and finally, the pMAL-C4x-GhUGP1 recombinant protein with a size of 95.9 ku was successfully obtained, which will help to analyze the function of GhUGP1 in depth at a later stage.
Key words Gossypium hirsutum; GhUGP1 gene; Cloning;" Sequence analysis;" Prokaryotic expression

