基于分离培养和高通量测序的芷江白蜡虫病原菌研究









摘 要 为了明晰引起湖南芷江侗族自治县白蜡虫发病的主要原因及病原种类,利用分离培养法和高通量测序技术,对分别从芷江李家界、胡家头、田家溪和杨家村采集的6份罹病白蜡虫样本(5份雄虫、1份雌虫)进行真菌群落组成和多样性分析。结果表明,胡家头、田家溪、杨家村的4份雄虫样本在真菌群落结构上高度相似,其优势病原菌均为渐狭蜡蚧菌(Lecanicillium attenuatum)(丰度达94%以上,分离率28.12%),而采集于李家界的雄虫样本真菌多样性较高,群落结构和组成也明显不同于以上4份雄虫样本(Plt;0.05),主要病原菌为六出花链格孢(Alternaria alstroemeriae)(分离率7.76%)和枝状枝孢菌(Cladosporium cladosporioide)(分离率9.75%)。采集自杨家村的雌虫样本真菌群落结构不同于雄虫,主要病原菌为松针刺盘孢菌(Colletotrichum fioriniae)(分离率18.50%)和一种横断孢属真菌(Strelitziana sp.)(丰度25.77%)。此外,芷江罹病的雌、雄白蜡虫在真菌群落组成上具有显著差异,而雄性白蜡虫的真菌群落结构受立地环境影响较大,种虫来源与白蜡虫发病无明显相关性。
关键词 白蜡虫;分离培养;昆虫病原真菌;群落结构和组成
白蜡虫[Ericerus pela(Chavannes)]隶属于半翅目(Hemiptera)蚧总科(Coccoidea)蜡蚧科(Coccidae),是中国特有的重要资源昆虫。白蜡虫的主要寄主植物是木犀科的女贞树(Ligustrum lucidum Ait)和白蜡树(Fraxinus chinensis Roxb),一龄若虫在寄主植物叶片上活动(定叶),二龄若虫定栖在寄主植物枝干上(定杆),二龄雄若虫定杆后分泌的白蜡具有很高利用价值,被广泛应用于化工、食品、医药、信息技术、化妆品等现代工业,素有“蜡中之王”美誉[1-4]。作为种虫,雌虫可通过有性生殖或孤雌生殖来繁衍后代[5],为白蜡的生产提供种源。
白蜡在中国的生产和利用已有上千年历史,形成了“高山产虫,低山产蜡”的传统生产模式[6],白蜡虫养殖是山区农民致富的主要途径和经济收入的主要来源[7]。但在生产中,白蜡虫易受到寄生蜂、瓢虫及病原微生物等威胁,导致白蜡产业经济效益降低[4,8]。前期研究表明,盘长孢属(Gloeosporium)或刺盘孢属(Colletotrichum)的某种真菌可导致湖南地区白蜡虫雌虫发生褐腐病,而种虫带菌被认为是其主要侵染源[9]。引起白蜡虫雌虫霉病的是湿串孢霉属的一种真菌(Monilochaetes sp.)[10],主要靠雨水、媒介昆虫和风力传播病菌孢子。此外,枝孢属2种真菌(Cladosporium langeronii和C. sphaerospermum)也能引起白蜡虫雌虫发病,可造成雌虫大量死亡,严重影响种虫数量和质量,进而影响白蜡生产[11]。目前,关于白蜡虫雌虫受真菌感染死亡的报道较多,鲜有雄虫被真菌侵染致死的报道。
湖南省芷江县是中国传统的白蜡产区,素有“白蜡之乡”美誉[12]。芷江白蜡已于2020年登记成为全国农产品地理标志。但最近几年,芷江多个地方的白蜡虫爆发病害,引起雌、雄若虫的大量死亡,只有少量可以迁移到枝条上,导致雄虫产蜡量显著减少,雌虫产卵量骤然降低,严重影响了当地种虫的种群繁衍,给养殖户造成严重经济损失。2022年6月底至7月初(白蜡虫定杆期),本文作者通过死亡虫体的初步镜检,发现湖南省芷江县白蜡虫是由真菌侵染致死的,但仅凭镜检结果,无法明确具体的病原种类。因此,本研究利用分离培养法和高通量测序技术,对6份罹病白蜡虫样品进行了真菌群落结构及多样性分析,以期明确芷江罹病白蜡虫的主要病原菌及引起发病的主要因素,为芷江白蜡虫病害防控提供理论基础。
1 材料与方法
1.1 采集地概况
湖南省芷江县(109°17′31″ E~109°54′49″ E,27°04′12″ N~27°38′24″N)地处云贵高原东缘,地形以山地和丘陵为主,呈山间盆地状;海拔300~1 000 m,属亚热带季风性湿润气候,年均气温15.8 ℃~17.3 ℃,年均日照1 527.7 h,年均降雨量1 156.4~1 432.9 mm,年均无霜期279 d[12]。本研究样品采集于芷江县中部芷江镇的4个村落,其中李家界属于中低海拔区,农户较少,人口密度低,周围多山林,植被覆盖率相对较高;胡家头、田家溪、杨家村3个采集地立地条件明显与之不同,属于低海拔区,农户集中、农田较多,人为干扰较大,植被以农田作物为主,植被覆盖率相对 "较低。
1.2 样品采集和处理
2022年6月底至7月初,分别从芷江镇的李家界、胡家头、田家溪、杨家村4个养虫基地采集带有罹病白蜡虫的大叶女贞叶片样本,共采集到6份样本(表1),用无菌自封袋单独装好后低温带回实验室。
从每份样本中随机选取3片叶子,将上面的白蜡虫用无菌解剖刀刮取下来,分别置于1.5 mL的离心管中,每份样本3个重复,共得到18个样品。收集好的白蜡虫立即放于-80 ℃冰箱保存,用于基因组提取和高通量测序;剩下的样本放于4 ℃冰箱保存,用于可培养虫生真菌的分离纯化。
1.3 虫体镜检
分别对叶片上发病的白蜡虫和转移到枝条上产蜡的健康白蜡虫的虫体进行镜检。用无菌刀片刮取白蜡虫的虫体放于载玻片上,以无菌水为浮载剂制作成临时玻片,在普通光学显微镜下 "(Olympus BX53)观察虫体形态、体表及体内虫生真菌的菌丝与孢子形态特征,挑选典型的标本拍照,并对白蜡虫病原真菌进行初步分类鉴定[13]。
1.4 虫生真菌的分离及纯化
从每份样本中随机选取3片叶子,每片叶子挑取10个白蜡虫,分别置于无菌培养皿(6 cm)中,在超净工作台中对虫体进行表面消毒[14],依次用75%酒精浸泡40 s、1.5%次氯酸钠浸泡 "1 min、无菌水冲洗4~5次,然后用灭菌滤纸吸干虫体表面水分,将它们分别放在马铃薯葡萄糖琼脂培养基上[PDA,含硫酸链霉素和卡那霉素 "(50 mg/L)],每皿放5个虫体,置于25 ℃培养箱中培养。待虫体长出菌丝后,用灭菌接种针分别挑取菌落形态不同的菌丝到新的PDA培养基上进行纯化。纯化后的菌株接种到PDA斜面培养基上,置于4 ℃冰箱保存,备用。
1.5 虫生真菌的鉴定
形态学鉴定:首先观察纯化菌株的菌落形态,包括正反面颜色、菌丝质地、是否产生可溶性色素等,定期观察菌丝生长速率并拍摄菌落照片;再利用普通光学显微镜观测菌丝形态、是否产孢、产孢结构、孢子形态和大小等显微结构,并将分离菌株的形态特征与虫体镜检结果进行关联和比对分析,明确不同分离菌株在罹病白蜡虫上的生长 "特征。
分子生物学鉴定:采用CTAB法[15]提取分离菌株的基因组DNA作为模板,以ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为扩增引物,进行分离菌株核糖体内转录间隔区(ITS)基因序列扩增。PCR扩增产物经1%琼脂糖凝胶电泳检测后,送至陕西杨凌天润奥科生物公司进行Sanger测序。对测序所得ITS序列在NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对,并从GenBank中下载同源性较高基因序列,最后使用MEGA11.0基于Neighbor-Joining(NJ)法构建系统进化树,确定分离菌株的分类 "地位。
1.6 虫生真菌群落的高通量测序
1.6.1 DNA提取和PCR扩增 用E.Z.N.A.soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.)提取白蜡虫样品中的真菌基因组DNA,用紫外分光光度计(NanoDrop 2000)和1%琼脂糖凝胶电泳分别检测DNA的纯度和提取质量。检测合格后,利用带Barcode的正向引物ITS1F和反向引物ITS4R进行PCR扩增,反应体系为(20 μL):5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,正向和反向引物(5 μmol/L)各0.8 μL,FastPfu Polymerase 0.4 μL,BSA 0.2 μL,DNA模板 10 ng,ddH2O补充至20 μL。反应条件为:95" ℃预变性3 min;95" ℃变性30 s,55" ℃退火30 s,72" ℃延伸45 s,循环35次;最后72" ℃延伸10 min。每个DNA样品扩增3次,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA试剂盒(AXYGEN公司)切胶回收PCR产物,用Tris-HCl洗脱回收目标DNA片段,2%琼脂糖电泳检测回收质量,用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量。纯化后的PCR产物送往上海美吉生物医药科技有限公司,利用Illumina MiSeq PE300平台(Illumina,San Diego,CA,USA)进行测序。
1.6.2 测序数据分析 根据PE reads之间的 "overlap关系,使用Flash(Version 1.2.11, "http://www.cbcb.umd.edu/software/flash)对测序获得的原始序列(Raw reads)进行拼接[16-17],使用Fastp(Version 0.19.6,https://github.com/OpenGene/fastp)软件对reads的质量和拼接效果进行质控,并去除过滤嵌合体序列[18]。根据序列首尾两端的Barcode和引物序列区分各样本数据,去除Barcode和引物序列后,最终获得有效序列(Effective reads)。使用Uparse(Version11,http://www.drive5.com/uparse/)对全部有效序列进行聚类,将一致性(identity)达到97%以上的序列聚类为OTU[19],计算每个OTU代表性序列在各个样品中的相对丰度(Relative abundance),使用Qiime(Version 1.9.1,http://qiime.org/install/index.html)软件基于真菌ITS Unit数据库(Version 8.0 https://unite.ut.ee/)对OTU分类注释真菌物种信息[20],获得每个OTU在各级分类水平上的信息[21]。使用Mothur(Version 1.30.2,https://www.mothur.org/wiki/Downl)软件[22]、Qiime软件和R语言包(Version 3.3.1)进行α和β多样性分析。使用LefSe(http://huttenhower.sph.harvard. edu/galaxy/root?tool_id=lefse_upload)软件分析不同样本间具有显著性差异的群落或物种[23]。最后基于Funguild数据库(Version 1.0,http://www.funguild.org/),对真菌群落生态和功能信息进行注释[20]。
2 结果与分析
2.1 虫体镜检
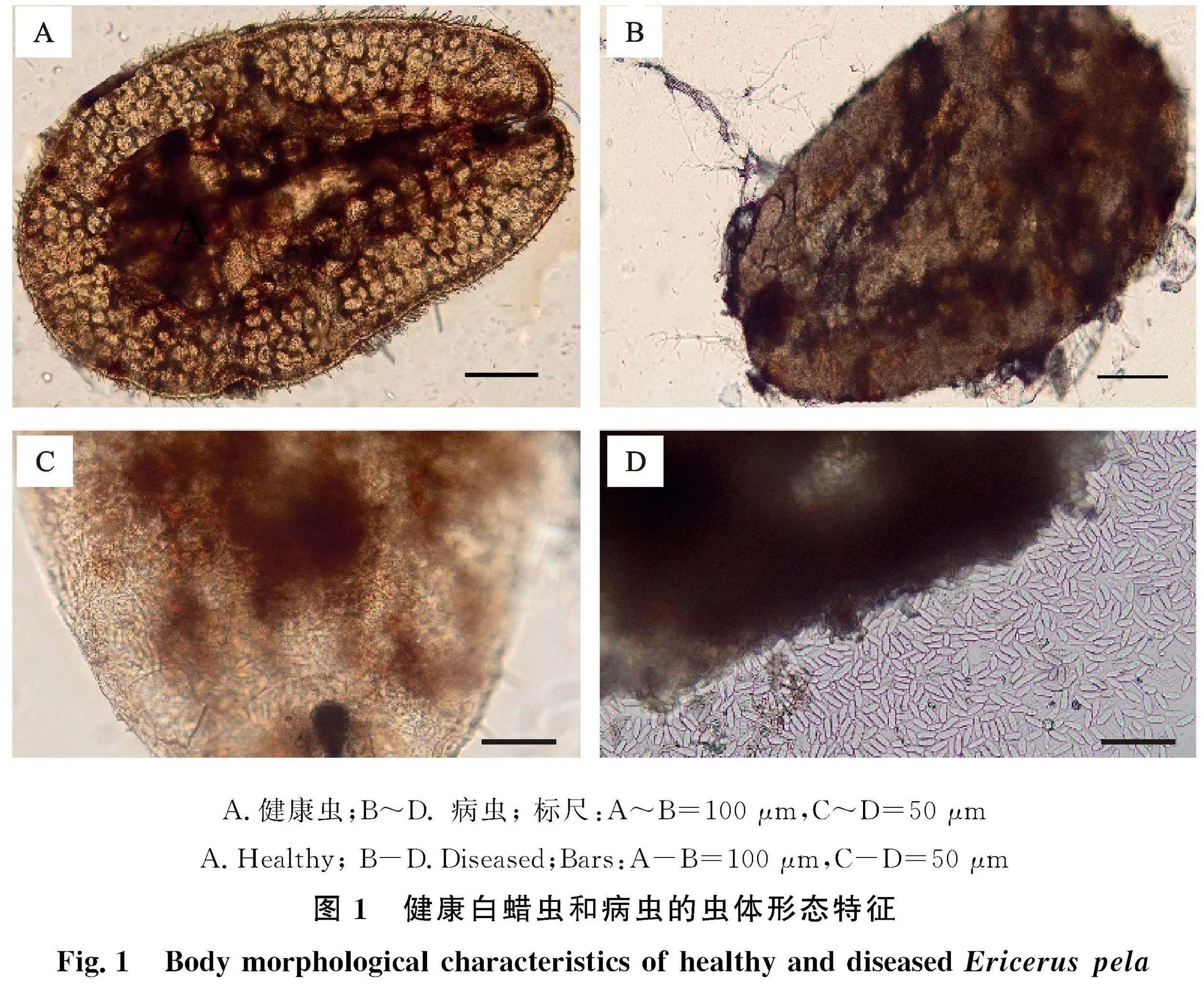
健康虫体的形态结构清晰、完整,没有发现解体或被真菌侵染现象(图1-A)。感病虫体完整,但含有大量菌丝和分生孢子,有些菌丝和分生孢子梗伸出虫体,并在体外产生大量分生孢子(图 "1-B~1-D)。
2.2 虫生真菌分离鉴定
从白蜡虫虫体上观察到的虫生真菌主要有6种,均在分离培养中得到了纯菌株(菌株编号 "ZP1~ZP6)。6种真菌在白蜡虫虫体上的寄生状态及菌落形态和显微特征具体如下。
被菌株ZP1侵染的白蜡虫虫体内布满大量的菌丝,细长的分生孢子梗常从虫体边缘长出,并向外延伸约250 μm(图2-A),大量分生孢子散落在虫体周围(图2-B)。菌株在PDA上培养15 d后可长满6 cm培养皿。菌落白色、致密而厚,背面呈奶油黄色,生长后期菌落中央逐渐增高隆起,形成褶皱;气生菌丝无色,匍匐生长(图2-C);分生孢子梗较长,瓶梗状的产孢细胞基部渐狭,单生、对生或轮生,每轮3~4个;分生孢子单生,圆柱状,两端圆或一端稍尖,大小为(5.33~7.75)μm×(2.07~2.69)μm(图2-D~2-E)。形态特征表明,菌株ZP1为蜡蚧菌属(Lecanicillium) "真菌。
菌株ZP2侵染白蜡虫后,虫体内产生大量分生孢子,较粗短菌丝和分生孢子梗常从虫体边缘伸出(图3-A~3-B)。菌株在PDA培养基中培养10 d可长满6 cm培养皿。菌落呈棕粉红色至白浅灰色,颜色从中央向边缘递减(图3-C),肉眼可观察到菌落中央有大量橘黄色分生孢子堆(图 "3-D)。气生菌丝棉絮状,透明,有隔,具分枝;长椭圆形的分生孢子光滑、无隔膜,基部钝圆或稍尖,大小为(9.28~14.81) μm×(2.34~5.20) μm(图3-E~3-F)。形态特征表明,菌株ZP2为刺盘孢属(Colletotrichum)真菌。
菌株ZP3的分生孢子常与少量蜡丝混合,游离在被侵染的白蜡虫虫体周围(图4-A)。该菌株在PDA上培养7 d可长满6 cm培养皿。菌落近圆形,呈厚实的绒毛状,正面橄榄绿色,背面蓝黑色至黑色,中央稍隆起(图4-B)。分生孢子淡黄褐色,呈倒棒状、梨形或卵形,具有若干隔膜,分隔处平滑或缢缩(图4-C),大小为(24.63~56.16)μm×(6.72~12.25) μm。形态特征表明,菌株ZP3为链格孢属(Alternaria)真菌。
菌株ZP4的菌丝常从被侵染的虫体边缘长出,形成分生孢子梗并产生椭圆形分生孢子(图4-D)。菌株在PDA上培养16 d后可长满6 cm培养皿。菌落正面呈灰橄榄色或土黄色,有皱褶并隐约可见少许轮纹;菌落背面暗绿色,并有裂纹(图4-E)。产孢细胞短甁梗状,分生孢子近纺锤形或椭圆形,大小为(3.80~6.25) μm×(2.24~4.00) μm(图4-F)。形态特征表明,菌株ZP4为枝孢属(Cladosporium)真菌。
菌株ZP5在PDA上培养5 d可长满6 cm培养皿。菌落由中心向外呈橙黄色到白色,随菌丝老化向培养基中释放橙红色水溶性物质(图4-H)。分生孢子常聚集形成大小为(9.94~22.14)μm×(9.15~21.23)μm的黄黑色分生孢子团(图4-I),散落在虫体周围(图4-G)。形态特征表明,菌株ZP4为附球菌属(Epicoccum)真菌。
菌株ZP6在PDA培养基上培养5 d后长满6 cm培养皿。气生菌丝薄绒状,菌落白色,不产生色素(图4-K)。产孢细胞为单瓶梗,产生两种不同类型的分生孢子,小型分生孢子卵圆形,大小为(5.80~11.63)μm×(2.21~4.32)μm;大型分生孢子细长,呈镰刀状,两端略弯曲,顶端稍尖,壁较厚,具4~7个横隔膜(图4-L),大小为 "(17.68~22.64)μm×(3.02~4.07)μm,散落在被侵染的虫体周围(图4-J)。形态特征表明,该菌为镰孢菌属(Fusarium)真菌。
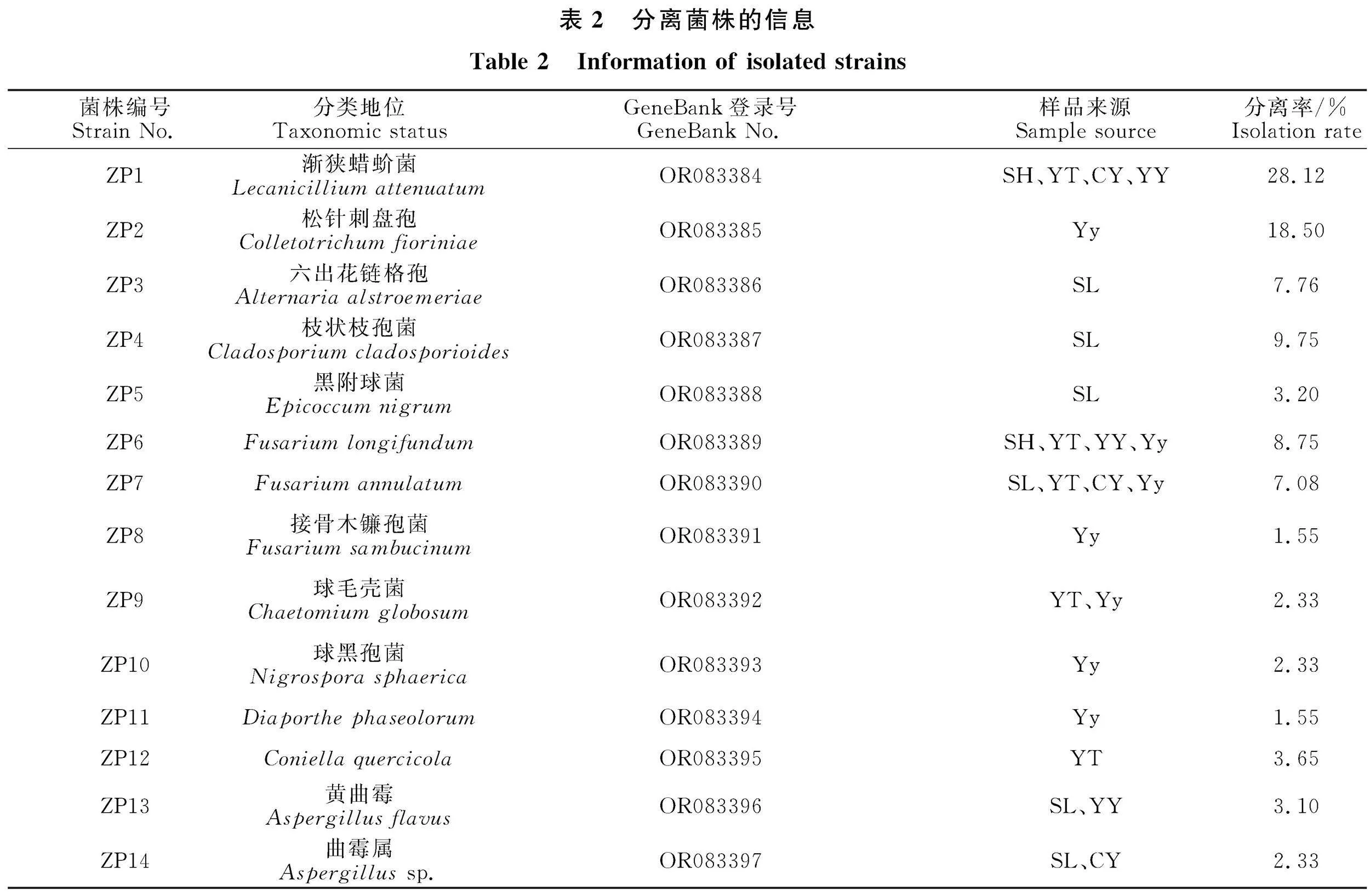
此外,从白蜡虫虫体上共分离到129株真菌,依据形态学特征初步鉴定为14种真菌(包含上述6种)。对这14种真菌的ITS序列进行扩增和测序,所得序列与NCBI数据库比对并提交至GenBank获得菌株登录号,最后构建NJ系统进化树(图5),明确了这14种真菌的分类地位,它们分属于11个属(表2)。菌株ZP1为渐狭蜡蚧菌(Lecanicillium attenuatum),除样本SL和Yy外,其余样本均分离到,其分离率最高;菌株ZP2为松针刺盘孢(Colletotrichum" fioriniae) "(18.50%),只在雌虫样本Yy中分离到六出花链格孢(Alternaria alstroemeriae);菌株ZP3~ZP5分离自雄虫样本SL,分别为六出花链格孢(Alternaria alstroemeriae)(7.76%)、枝状枝孢菌(Cladosporium cladosporioides)(9.75%)和黑附球菌(Epicoccum nigrum)(3.20%);菌株ZP6~ZP8为镰孢菌属真菌,分别为Fusarium longifundum(8.75%)、F. annulatum(7.08%)和接骨木镰孢菌(F.sambucinum)(1.55%),几乎每份样品中均分离得到镰孢菌属真菌;菌株ZP9为球毛壳菌(Chaetomium globosum)(2.33%),分离自样本YT和Yy;菌株ZP10和ZP11分离自雌虫样本Yy,分别为球黑孢菌(Nigrospora sphaerica) "(2.33%)和Diaporthe phaseolorum(1.55%);菌株ZP12-ZP14主要分离自雄虫样本,分别为Coniella quercicola(3.65%)、黄曲霉(Aspergillus flavus)(3.10%)和曲霉属真菌(Aspergillus sp.)(2.33%)。
2.3 高通量测序结果
2.3.1 序列数据统计及α多样性分析 经质控过滤并去除嵌合体后,共获得609 816条优化序列,平均长度为625 bp。每个样品按最小序列数抽平到21 712条序列,在97%的相似性水平下聚类后得到6 691个真菌OTU。基于OTU水平建立Shannon多样性指数稀释曲线,随着测序数量的增加,曲线趋于平坦饱和(图6),表明本次测序数据合理。
α多样性分析表明,雌虫样本Yy的Shannon指数、Chao1指数和ACE指数最高 "(Plt;0.05),Simpson指数最低(Plt;0.05)(表3),说明罹病雌、雄虫体上真菌群落结构差异显著,雌虫虫体上真菌群落的种类多且分布均匀。雄虫样本SL的真菌群落多样性及丰富度仅次于雌虫样本,而其余4份雄虫样品(SH、YT、CY、YY)的Shannon指数、ACE指数及Chao1指数均较低,但Simpson指数均显著高于样本SL和Yy(Plt;0.05),说明这4份样品中真菌群落结构相对简单、物种组成较单一。
2.3.2 β多样性分析 基于OTU水平进行的PCA主成分分析结果表明,PC1与PC2的贡献率分别为39.11%和15.48%(图7),两个水平可解释50%以上的数据差异。样本SH、YT、CY和YY聚类于同一象限,同一样本内的3个样品高度集中,而不同样本间分布距离较近且有重叠,表明这4份样品真菌群落的构成趋于一致;而SL和Yy样本则较为分散,同一样本内的3个样品虽聚类于同一象限但距离较远,均表现出一定的个体独立性。PC1可将雌虫样品Yy与其余5份雄虫样品明显区分开,表明罹病雌、雄白蜡虫在真菌群落结构上存在明显差异;PC2可将SL与其余4份雄虫样品明显区分开。
为进一步揭示不同样本群落结构的相似性或差异关系,在OTU水平上对样本群落距离矩阵进行层级聚类分析(Hierarchical clustering),构建样本层级聚类树。层级聚类结果与PCA分析结果相一致,所有样品主要聚集为2个独立的大分支(图8),雌虫样本Yy为一个分支,雄虫样本为另一个分支,表明雌、雄白蜡虫上真菌群落之间存在较大的差异。在雄虫样本的分支中,SL单独聚类为一小支,其余4份雄虫样本聚集明显,为另一个小分支。
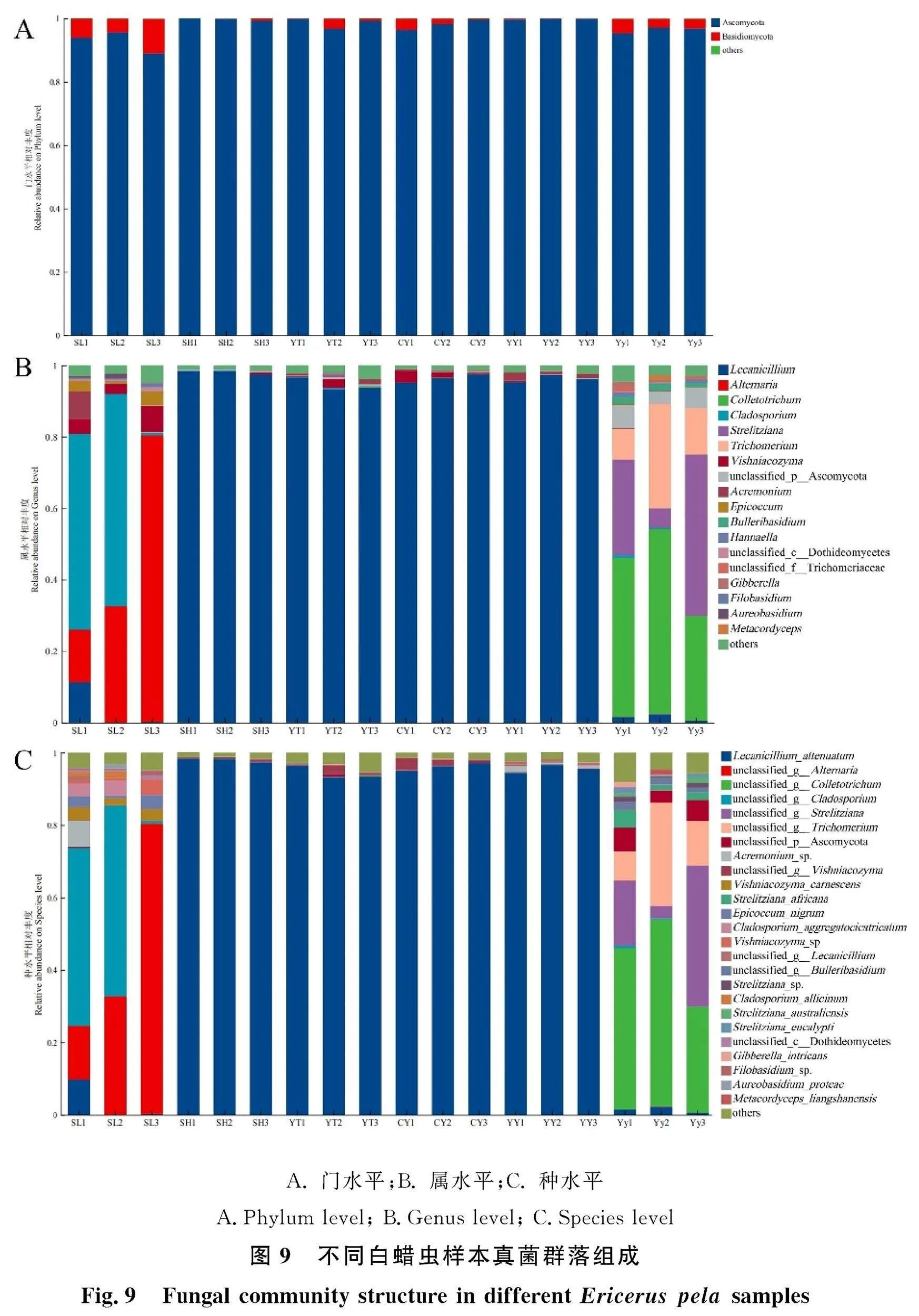
2.3.3 真菌群落组成及差异分析 聚类得到的OTU代表序列与真菌ITS数据库(Unite)比对和物种注释结果表明,6 691个OTU归属于6门30纲72目176科349属599种。在门水平上,所有样本真菌群落的组成结构简单,优势菌门为子囊菌门(Ascomycota),次优势菌门为担子菌门(Basidiomycota)(图9-A)。与其余5份样本相比,样本SL中子囊菌门的相对丰度显著较低,而担子菌门的相对丰度显著较高(Plt;0.05)。
在属水平上,18个样品中丰度最高的前6个属为蜡蚧菌属(65.08%)、链格孢属(7.11%)、刺盘孢属(7.01%)、枝孢属(6.54%)、横断孢属(Strelitziana)(4.31%)和木霉属(Trichoderma)(2.84%)(图9-B)。其中,仅渐狭蜡蚧菌能注释到种水平(图9-C),其他虫生真菌需要结合分离培养结果进一步确定。如前所述,前4个属均有相应的菌种被分离培养出来,而横断孢属和木霉属真菌未被分离培养出来。
6份白蜡虫样本的真菌群落组成和结构不尽相同,且菌种的相对丰度差异较大。样本SL的优势属包括链格孢属(特有属,42.56%)、枝孢属(38.35%)、维希尼克氏酵母属(Vishniacozyma)(4.77%)、蜡蚧菌属(3.82%)和附球菌属(特有属,2.53%);其中,Alternaria alstroemeriae和枝状枝孢菌的分离率较高。雌虫样品Yy的优势属为刺盘孢属(41.91%)、横断孢属(特有属, nbsp;25.77%)和木霉属(特有属,17.00%),而松针刺盘孢是该样本分离培养真菌中的优势种。样本SH、YT、CY和YY在群落结构和组成上高度相似,渐狭蜡蚧菌为绝对优势种,其丰度均在94%以上。
2.3.4 LefSe组间差异显著性分析 多样性分析及群落结构和组成分析均表明,样本SH、YT、CY和YY的菌群结构具有高度一致性,组间物种组成差异性极小。为了寻找不同样本间具有统计学差异的生物标志物(Biomarker),明晰罹病白蜡虫的主要病原菌,将这4份样品合并为一组(命名为“FM”),并利用LefSe分析样本FM、SL及Yy间具有显著性差异的群落或物种(LDA值≥ 4.0)。结果表明,样本SL和Yy中指示类群比较丰富(图10)。在属水平上,样本SL显著富集的类群有链格孢属和枝孢属;Yy则是刺盘孢属、木霉属和横断孢属;FM中起重要作用的真菌类群是粪壳菌纲(Sordariomycetes)肉座菌目(Hypocreales)虫草科(Cordycipitaceae)的蜡蚧菌属,在种水平上对应的是渐狭蜡蚧菌。以上在各组中显著富集的类群可作为各组的生物标志物,即不同样本的优势病原菌。
2.3.5 功能预测 利用Funguild对白蜡虫样本的真菌群落进行功能预测分析,结果表明6份样本的真菌功能类群主要包括腐生营养型(Saprotroph,33.72%)、病理营养型(Pathotroph, "25.98%)、病理-腐生-共生营养型(Pathotroph-Saprotroph-Symbiotroph,16.58%)、病理-共生营养型(Pathotroph-Symbiotroph,9.98%)、共生营养型(Symbiotroph,8.40%)、病理-腐生营养型(Pathotroph-Saprotroph,3.40%)。
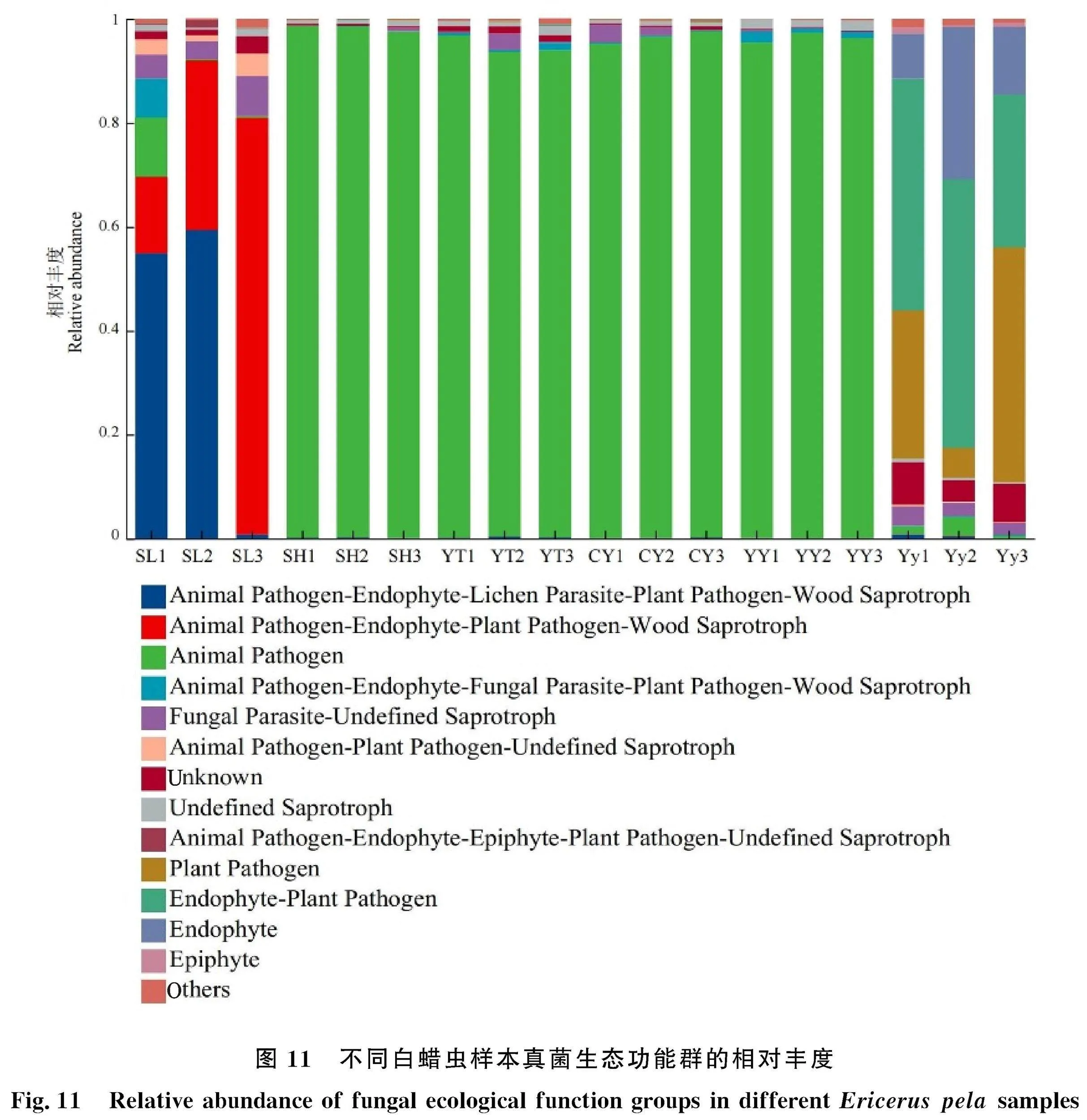
6份样本共得到12个生态功能群,不同样本的主要生态功能群的相对丰度存在显著差异(图11)。样本SL的主要功能群包括:动物病原菌-内生真菌-地衣寄生菌-植物病原菌-木材腐生菌(Animal pathogen-Endophyte-Lichen parasite-Plant pathogen-Wood saprotroph,38.35%)和动物病原菌-内生菌-植物病原菌-木材腐生菌(Animal pathogen-Endophyte-Plant pathogen-Wood saprotroph,42.56%),在属水平上分别对应的是枝孢属和链格孢属。样本SH、YT、CY和YY中动物病原菌(Animal pathogen)的相对丰度达95%以上,为绝对优势功能群,在种水平上对应的是渐狭蜡蚧菌。雌虫样本中的优势功能群包括:内生菌-植物病原菌(Endophyte-Plant pathogen,41.94%)、植物病原菌(Plant pathogen,26.45%)和内生菌(Endophyte,17%),在属水平上对应的分别是刺盘孢属、横断孢属和木 "霉属。
3 讨论与结论
昆虫病原真菌(Entomopathogenic fungi)具有侵染和杀死昆虫的能力[24],自然界病死的昆虫约60%是因感染这些真菌而死亡的[25]。为揭示“白蜡虫之乡”芷江的白蜡虫病原菌,本研究同时采用分离培养法和Illumina Miseq高通量测序技术,对不同种虫来源及立地条件下的6份罹病白蜡虫样本进行了真菌群落结构和多样性研究,共分离培养得到11属14种真菌;通过高通量测序共检测出349属599种真菌,明显高于分离培养得到的菌株,但大部分物种的丰度极低。高通量测序结果与分离培养的结果在优势菌群及多样性分析上基本一致,但高通量测序注释到种水平的菌种仅渐狭蜡蚧菌。几乎每份样品在虫体镜检时均观察到镰孢菌属真菌,其分生孢子大量游离在虫体周围,且镰孢菌的分离率也较高,但高通量测序结果中镰孢菌的丰度极低(0.02%)。镰孢菌在死亡虫体上常以腐生菌的形式生存[26],本研究中观察和分离到的镰孢菌可能是白蜡虫死后在虫体上大量腐生形成的,而测序丰度低可能与镰孢菌凋亡较快、遗传物质严重降解有关[27]。
样本SL的优势菌为链格孢属和枝孢属真菌,功能预测显示它们既是动物病原菌又是植物病原菌。研究表明,动物病原菌可导致植物病害,植物病原菌也能在昆虫、动物和人类等寄主体内定殖,即所谓的“跨界侵染(Cross-kingdom infection)”[28]。白蜡虫整个生活史几乎都是在寄主植物上完成的,这为部分真菌跨界侵染提供了机会,这可能也是样本SL中混合营养型真菌较多的主要原因。部分链格孢属和枝孢属真菌作为动物病原菌,可感染多种昆虫[29-31]。王雪庆等[32]和孙涛等[33]曾从健康雌性白蜡虫成虫及蜡花中检测到丰度较低的链格孢菌和枝孢菌,表明这两种真菌在低丰度时不会导致白蜡虫感病。在满足扩张条件时,枝孢属真菌会产生致病性,造成白蜡虫雌成虫大量死亡[11]。本研究发现样本SL中链格孢属和枝孢属的测序丰度较高,且枝状枝孢菌和六出花链格孢的分离率较高,表明其病原菌应为枝状枝孢菌和六出花链格孢。
样本Yy的优势菌为刺盘孢属(松针刺盘孢)、横断孢属和木霉属真菌。刺盘孢属和横断孢属为植物病原菌,可引起植物炭疽病[34]和煤污病[35]。刺盘孢属真菌也可侵染昆虫,并导致其死亡[36-38]。另外,松针刺盘孢的分生孢子产生的气味对雌果蝇有驱避作用,侵染后能降低果蝇产卵率和若虫存活率[39]。本研究中松针刺盘孢属和横断孢属真菌侵染白蜡虫后,可能同时诱发白蜡虫寄主植物发生病害,降低寄主植物营养成分,进一步加重雌性若虫的大量死亡。木霉属真菌可作为拮抗菌抑制多种病原菌,但样本Yy中木霉属相对丰度远低于横断孢属和刺盘孢属的总丰度,可能对病原菌的拮抗作用较弱,不能有效抑制病原菌的大量生长和繁殖,因而难以阻止白蜡虫真菌性病害的发生。
渐狭蜡蚧菌是重要的昆虫病原真菌[40],其商品化药剂对半翅目、鳞翅目害虫(蚜虫、木虱、烟草粉斑螟等)具有较高致病力[41-45]。此外,蜡蚧菌属真菌也能抑制某些植物病原真菌和寄生菌,从而促进植物生长[46-47]。本研究发现渐狭蜡蚧菌是样本SH、YT、CY、YY中的绝对优势种(优势病原菌),而其余菌群的丰度极低。这可能是渐狭蜡蚧菌抑制了其他病原菌和腐生菌生长,导致物种多样性显著下降。湿度通常是决定昆虫病原菌致病力强弱的关键因素,相关研究表明,渐狭蜡蚧菌对棉蚜虫的致病力会随着湿度的升高而增加[48]。本研究的采样时间为高温多雨的盛夏季节,当时的气候条件利于渐狭蜡蚧菌产生大量孢子并随雨水扩散传播,可能有效增强了渐狭蜡蚧菌的侵染力。这是首次发现渐狭蜡蚧菌侵染可引起雄性白蜡虫大量发病和死亡。
昆虫病原真菌的群落组成和物种丰度会受海拔高度、植被特点、气候变化以及地理位置等各种环境因素的影响[49-50]。本研究发现,立地条件相似但种虫来源不同的4份雄虫样本(SH、YT、CY和YY)在真菌群落结构组成上高度相似;而种虫均源于陕西的雄虫样本SL与SH的立地条件不同,它们的真菌群落组成具有显著性差异。该结果表明,芷江县罹病雄性白蜡虫的真菌群落结构差异主要由环境因子引起,与种虫来源无关。另外,同种源、同立地环境的雄虫样本YY和雌虫样本Yy的真菌群落组成差异较大,表明引起雌、雄虫死亡的病原菌并不相同。本研究揭示了引起该地白蜡虫发病的主要病原菌,为白蜡之乡的白蜡虫病害防控提供了理论基础。
参考文献 Reference:
[1]陈晓鸣,王自力,陈 勇.影响白蜡虫泌蜡主要气候因子及白蜡虫生态适应性分析[J].昆虫学报,2007,50(2):136-143.
CHEN X M,WANG Z L,CHEN Y.The main climate factors affecting wax excretion of Ericerus pela Chavannes (Homopetera:Coccidae) and an analysis of its ecological" "adaptability[J].Acta Entomologica Sinica,2007,50(2):136-143.
[2] YANG P,CHEN X M,LIU W W,et al.Transcriptome" "analysis of sexually dimorphic Chinese white wax scale insects reveals key differences in developmental programs and transcription factor expression[J].Scientific Reports,2015,5:8141.
[3] YU S H,YANG P,SUN T,et al.Identification and evaluation of reference genes in the Chinese white wax scale insect Ericerus"" pela[J].Springer" Plus,2016,5(1):1-8.
[4] 吴 昊,李鸿明,钟芳竹,等.陕西咸阳白蜡虫种群生态学及生产适宜性研究[J].西北林学院学报,2023,38(6):145-152.
WU H,LI H M,ZHONG F ZH,et al. Population ecology and production suitability of Ericerus pela in Xianyang,Shaanxi Province[J].Journal of Northwest Forestry University,2023,38(6):145-152.
[5] 王自力,陈晓鸣,王绍云,等.白蜡虫孤雌生殖的研究[J].林业科学研究,2003,16(4):386-390.
WANG Z L,CHEN X M,WANG SH Y,et al. Study on the parthenogenesis of Ericerus pela (Chavannes)[J]. Forest Research,2003,16(4):386-390.
[6] 陈晓鸣,王自力,陈 勇,等.白蜡虫同地产虫产蜡生产模式构建与分析[J].林业科学,2010,46(12):106-113.
CHEN X M,WANG Z L,CHEN Y,et al.Design and analysis of a system for breeding white wax scale insects and producing insect wax in the same region[J]. Scientia Silvae Sinicae,2010,46(12):106-113.
[7] 史鸿翔,李 斌,陈晓鸣,等.白蜡虫雌虫体表真菌的分离及初步鉴定[J].环境昆虫学报,2023,45(1):211-225.
SHI H X,LI B,CHEN X M,et al.Isolation and preliminary identification of fungi on the body surface of female Ericerus pela[J] .Journal of Environmental Entomology,2023,45(1):211-225.
[8] 张长海,刘化琴.中国白蜡虫及白蜡生产技术[M].北京: "中国林业出版社,1997:94-113.
ZHANG CH H,LIU H Q.Chinese White Wax Scale Insect and Wax Excretion Production Technology[M].Beijing:China Forestry Publishing House,1997:94-113.
[9] 吴光金,万益锋,刘世悌.白蜡虫褐腐病的研究[J].中南林学院学报,1982,2(1):65-72.
WU G J,WAN Y F,LIU SH T.Study on brown rot of Chinese white wax scale insect[J].Journal of Central South University of Forestry amp; Technology,1982,2(1):65-72.
[10] 严善春.资源昆虫学[M].哈尔滨:东北林业大学出版社,2001:233-234.
YAN SH CH.Resource Entomology[M].Harbin:Northeast Forestry University Press,2001:233-234.
[11] SUN T,WANG X Q,ZHAO Z L, et al.A lethal fungus infects the Chinese white wax scale insect and causes dramatic changes in the host microbiota[J].Scientific Reports,2018,8:5324.
[12] 梁军生,张玉荣,钟芳竹,等.芷江白蜡虫优势寄生蜂发生规律及综合防治[J].湖南林业科技,2017,44(5):12-16.
LIANG J SH,ZHANG Y R,ZHONG F ZH,et al.The seasonal occurrences and integrated control of the dominant parasitic wasps of Ericerus pela in Zhijiang[J].Hunan Forestry Science amp; Technology,2017,44(5):12-16.
[13] 蒲蛰龙,李增智.昆虫真菌学[M].合肥:安徽科学技术出版社,1996:394-395.
PU ZH L,LI Z ZH.Insect Mycology[M].Hefei:Anhui Publishing House of Science and Technology,1996:394-395.
[14] 樊春丽,罗来凤,温文照,等.1株桉大毛虫病原真菌的分离鉴定及其寄主范围测定[J].南方农业学报,2022, "53(8):2175-2185.
FAN CH L,LUO L F,WEN W ZH,et al.Isolation and" "identification of pathogenic fungus from a strain of Suana divisa and determination of range of its hosts[J].Journal of Southern Agriculture,2022,53(8):2175-2185.
[15] LACAP D C,HYDE K D,LIEW E C Y.An evaluation of the fungal ‘morphotype’ concept based on ribosomal DNA sequences[J].Fungal Diversity,2003,12:53-66.
[16] MAGO T,SALZBERG S L.Flash:fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[17]FADROSH D W,MA B,GAJER P,et al. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform[J].Microbiome,2014,2(1):6.
[18] CHEN S,ZHOU Y,CHEN Y, et al.Fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[19] EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-998.
[20] NGUYEN N H,SONG Z W,BATES S T,et al.FUNGuild:An open annotation tool for parsing fungal community datasets by ecological guild[J].Fungal Ecology,2016,20(1):241-248.
[21] TEDERSOO L,SNCHEZ-RAMREZ S,KLJALG U,et al.High-level classification of the fungi and a tool for evolutionary ecological analyses[J].Fungal Diversity,2018,90(1):135-159.
[22] ROGERS M B,FIREK B,SHI M,et al.Disruption of the microbiota across multiple body sites in critically ill children[J].Microbiome,2016,4(1):66.
[23] SEGATA N,IZARD J,WALDRON L,et al.Metagenomic biomarker discovery and explanation[J].Genome Biology,2011,12(6):R60.
[24] LITWIN A,NOWAK M,RZ-ALSKA S.Entomopathogenic fungi:unconventional applications[J].Reviews in Environmental Science and Biotechnology,2020,19:23-42.
[25] ROBERTS D W,HUMBER R A.Entomogenous Fungi[M].New York:Biology of Conidial Fungi,1981:201-236.
[26] BATTA Y A.The first report on entomopathogenic effect of" Fusarium avenaceum (Fries) Saccardo (Hypocreales,Ascomycota) against rice weevil (Sitophilus oryzae L.:Curculionidae,Coleoptera)[J].Journal of Entomological and Acarological Research,2012,44(3):e11.
[27] 白飞荣,姚 粟,田海霞,等.基于高通量测序和可培养方法的勐海发酵普洱茶真菌多样性分析[J].食品与发酵工业,2018,44(12):43-51.
BAI F R,YAO S,TIAN H X,et al.Fungal diversity in fermented Menhai Pu-erh tea using high throughput sequencing and culture isolation[J].Food and Fermentation Industries,2018,44(12):43-51.
[28] BAARLEN P,BELKUM A,SUMMERBELL R C,et al.Molecular mechanisms of pathogenicity:how do pathogenic microorganisms develop cross-kingdom host jumps?[J].Fems Microbiology Reviews,2007,31:239-277.
[29] SHABANA Y M,RAGAB M E.Alternaria infectoria,a promising biological control agent for the fig wax scale,Ceroplastes rusci (Homoptera:Coccidae),in Egypt[J].Biocontrol Science and Technology,1997,7(4):553-564.
[30] PASCHAPUR A U,SUBBANNA A.R.N.S,SINGH A K,et al.Alternaria alternata strain VLH1:a potential entomopathogenic fungus native to North Western Indian Himalayas[J].Egyptian Journal of Biological Pest Control,2022,32:138.
[31] SALVATORE M M,ANDOLFI A,NICOLETTI R.The genus" Cladosporium:a rich source of diverse and bioactive natural compounds[J].Molecules,2021,26(13):3959.
[32] 王雪庆,于淑惠,孙 涛,等.白蜡虫蜡花微生物多样性分析[J].昆虫学报,2016,59(10):1086-1092.
WANG X Q,YU SH H,SUN T, et al.Analysis of the diversity of microorganisms in the wax secreted by the Chinese white wax scale insect,Ericerus pela (Chavannes) (Hemiptera:Coccidae)[J].Acta Entomologica Sinica,2016,59(10):1086-1092.
[33] 孙 涛,王雪庆,赵遵岭,等.越冬白蜡虫微生物多样性分析[J].林业科学研究,2017,30(6):1009-1014.
SUN T,WANG X Q,ZHAO Z L,et al.Microorganism diversity analysis of overwintering Chinese white wax scale insect[J].Forest Research,2017,30(6):1009-1014.
[34] 李 河,周国英,徐建平,等.一种油茶新炭疽病原的多基因系统发育分析鉴定[J].植物保护学报,2014,41(5):602-607.
LI H,ZHOU G Y,XU J P,et al.Pathogen identification of a new anthracnose of camellia oleifera in chinabased on multiple-gene phylogeny[J].Journal of Plant Protection,2014,41(5):602-607.
[35]杨寒丽.苹果煤污病和蝇粪病病原菌多样性研究——横断孢属、锥梗孢属、后稷氏孢属[D].陕西杨凌:西北农林科技大学,2009.
YANG H L.Pathogen diversity of sooty blotch and flyspeck on apple caused by fungi in genus Strelitziana,Dissoconium, Houjiae[D].Yangling Shaanxi:Northwest Aamp;F University,2009.
[36] MARCELINO J,GIORDANO R,GOULI S,et al.Colletotrichum acutatum var.fioriniae (teleomorph:Glomerella acutata var.fioriniae var.nov.) infection of a scale insect[J].Mycologia,2008,100(3):353-374.
[37] MARCELINO J,SVETLANA G,PARKER B L,et al.Host plant associations of an entomopathogenic variety of the fungus,Colletotrichum acutatum,recovered from the elongate hemlock scale,Fiorinia externa[J].Journal of Insect Science,2009,9(25):1-11.
[38] MASCARIN G M,GUARN-MOLINA J H,ARTHURS S P,et al. Seasonal prevalence of the insect pathogenic fungus Colletotrichum nymphaeae in Brazilian citrus groves under different chemical pesticide regimes[J].Fungal Ecology,2016,22:43-51.
[39] URBANEJA-BERNAT P,WALLER T,RODRIGUEZ-SAONA C.Repellent,oviposition-deterrent,and insecticidal activity of the fungal pathogen Colletotrichum fioriniae on Drosophila suzukii (Diptera:Drosophilidae) in highbush blueberries[J].Scientific Reports,2020,10:14467.
[40] ZARE R,GAMS W.A revision of" Verticillium section Prostrata.IV.The genera Lecanicillium and Simplicillium gen.nov[J].Nova Hedwigia,2001,73(1):1-50.
[41] LU L,CHENG B,DU D,et al.Morphological,molecular and virulence characterization of three Lencanicillium species infecting Asian citrus psyllids in Huangyan citrus groves[J].Journal of Invertebrate Pathology,2015,125:45-55.
[42] MONTALVA C,VALENZUELA E,BARTA M Z,et al.Lecanicillium attenuatum isolates affecting the invasive cypress aphid (Cinara cupressi) in Chile[J].Journal of the International Organization for Biological Control,2017,62:625-637.
[43] WANG D,DENG J,PEI Y,et al.Identification and virulence characterization of entomopathogenic fungus Lecanicillium attenuatum against the pea aphid Acyrthosiphon pisum (Hemiptera:Aphididae)[J].Applied Entomology and Zoology,2017,52:511-518.
[44] 刘明科,闫芳芳,齐禹哲,等.对桃蚜高毒力的蜡蚧菌菌株筛选[J].昆虫学报,2020,63(6):751-758.
LIU M K,YAN F F,QI Y ZH,et al.Screening of Lecanicillium strains with high virulence to Myzus persicae (Hemiptera:Aphididae)[J].Acta Entomologica Sinica,2020,63(6):751-758.
[45] 孙大平,路 茜,王 鹏,等.4种病原真菌对桃蚜和温室白粉虱的致病力[J].吉林农业大学学报,2021,43(6):664-672.
SUN D P,LU Q,WANG P,et al.Pathogenicity of four pathogenic Fungi to Myzus persicae and Trialeurodes vaporariorum[J].Journal of Jilin Agricultural University,2021,43(6):664-672.
[46] LACEY L A,GRZYWACZ D,SHAPIRO-ILAN D I,et al.Insect pathogens as biological control agents:back to the future[J].Journal of Invertebrate Pathology,2015,132:1-41.
[47] GOETTEL M S,KOIKE M,KIM J J,et al.Potential of Lecanicillium spp.for management of insects,nematodes and plant diseases[J].Journal of Invertebrate Pathology,2008,98(3):256-261.
[48] KIM J J,KIM K C.Selection of a highly virulent isolate of" Lecanicillium attenuatum against cotton aphid[J].Journal of Asia-Pacific Entomology,2008,11(1):1-4.
[49] 李文英,贺运春,王建明,等.山西省虫生真菌生态多样性研究[J].生物多样性,2003,11(1):53-58.
LI W Y,HE Y CH,WANG J M,et al.Ecological diversity of entomogenous fungi of three nature reserves in Shanxi province[J].Biodiversity Science,2003,11(1):53-58.
[50] 裴晓亚,Maduka Nilakshi Jayasekara Arachchige,朱晨慧,等.川西高原昆虫病原真菌的多样性[J].林业科学,2020,56(8):73-79.
PEI X Y,MADUKA N J A,ZHU CH H,et al.Diversity of entomopathogenic fungi in western Sichuan Plateau[J].Scientia Silvae Sinicae,2020,56(8):73-79.
Pathogens" Analysis of Ericerus pela in Zhijiang Through a Culture-
dependent Approach and High-throughput Sequencing
Abstract To identify the main factors and" the pathogens responsible for the disease of Ericerus pela in Zhijiang,a culture-dependent approach combined with the high-throughput Illumina MiSeq technology was used to investigate the fungal community structure and diversity of six infected Ericerus pela samples ( five male samples and one female sample) collected from Lijiajie,Hujiatou,Tianjiaxi and Yangjiacun" in Zhijiang.The results showed a high similarity in fungal community structure" "among four male samples collected from Hujiatou,Tianjiaxi and Yangjiacun,with Lecanicillium attenuatum being the dominant pathogen (abundance more than 94%,isolation rate 28.12%).The male sample from Lijiajie exhibited a significantly different community structure compared to those of the four male samples (Plt;0.05).This sample demonstrated" relatively higher diversity,with Alternaria alstroemeriae (isolation rate 7.76%) and Cladosporium cladosporioides (isolation rate 9.75%) as the main pathogens.The female sample from Yangjiacun" showed distinct differences in fungal community structure compared to the male samples,with Colletotrichum fioriniae (isolation rate 18.50%) and Strelitziana sp.(abundance 25.77%) as the dominant pathogens.Moreover, the fungal community composition and structure in infected "Ericerus pela males significantly differ from those in infected females.These differences are mainly associated with the site environment rather than the origin of the breeding population of E.pela.
Key words Ericerus pela; Culture-dependent approach; Entomopathogenic fungi; Community structure and composition

