对藜高致病活性链格孢菌DT-DYLC的液体发酵培养基优化







摘 要 以链格孢菌(Alternaria alternata)DT-DYLC为研究对象,以生物量和孢子量(OD600nm)为响应值,采用单因素试验和Plackett-Burman试验及响应面试验对其发酵培养基进行优化。结果表明,察氏固体培养基7 d时的菌落直径为73.1 mm,菌丝质量达0.049 g,均显著高于其他培养基。通过Plackett-Burman试验筛选出无机盐为影响孢子量的主要因素。运用响应面分析确定最优发酵培养基为:蔗糖68.853 g/L,NaNO3 11.41 g/L、K2HPO4 5.523 g/L、KCl 1.405 g/L、MgSO4·7H2O 1.874 g/L、FeSO4 0.0375 g/L。在此条件下,孢子量达到3.4 ×107 CFU/mL,是优化前的2.72倍。优化培养基可用于液体发酵工厂化生产。
关键词 链格孢;孢子量;培养基优化;响应面法
杂草是影响农作物丰产丰收的重要生物因子之一。其与作物争光、争水肥、争空间,阻碍农作物机械化播种及收获,并在一定程度上传播病虫害,降低农作物的产量和质量,是导致农作物产量减少的重要因素。其中藜(Chenopodium album "L.)为藜科(Chenopodiaceae)藜属(Chenopodium)1 a生阔叶杂草,是青海省危害农田的一种阔叶杂草优势种[1]。在全世界分布有 250 个种和亚种[2],危害世界不同地区25种农作物[3]。藜干扰目的作物生长,恶化环境,是影响作物产量和品质的主要生物逆境之一[4]。减少杂草数量可以通过机械除草等综合管理的方法[5-6],可是仅使用单一的控制措施不能有效地控制田间杂草的生长,所以效果显著、使用便捷、便于大面积使用的化学除草剂[7]更容易被选择,但其最大的缺点便是对环境有污染[8-9]。因此,对环境友好、无污染的微生物除草剂应运而生。
微生物除草剂是指一类直接以微生物个体为对象开发制备的生物农药。而其中的主要成分为杂草生防微生物(主要为真菌),其多以自然界为来源,具有毒性低和长效防治的特点[10-11]。如“鲁保一号”是利用尖孢炭疽菌(Colletotrichum acutatum)制成的微生物制剂用于防除大豆田里的菟丝子[12](Cuscuta" sp.),其防效可达70%~95%[13];1971年,Hasan[14]从意大利维埃斯特引进了一株锈菌,并成功防治了澳大利亚当地泛滥的澳大利亚粉孢苣;Stierle等[15]发现链格孢菌(Alternaria alternate)产生的环肽毒素对黑矢车菊(Centaurea maculosa)有极强的毒性;顾琼楠等[16]在发病牛筋草上分离得到一株牛筋草炭疽菌(Colletotrichum eleusines)NJC-16,对牛筋草鲜重防效达到了73%;刘璐等[17]从野外感病稗草上分离得到的弯孢属新种(Curvularia" sp.)处理稗草的发病指数最高可达62.53。
具有生防活性的微生物自然生长条件下的生防能力不能够达到生防要求,故需要人工培养进行生防能力的优化,其中优化生长培养基是一种有效提高生防菌株能力的方式。杨景艳[18]对杀线虫活性菌株KM2501-1培养基成分进行了优化,优化后培养的菌株的杀线虫能力提高了 "61.61%;彭上[19]对刺糖多孢菌培养基进行了成分和发酵条件优化,所得多杀菌素较对照组提高了60.74%;黎秋雨等[20]对具有枸杞木虱生防效果的雷斯青霉进行了发酵培养基优化,优化后的产孢量提高了9.84倍,对枸杞木虱三龄若虫同期防效高了25.56%;可见,优化生防微生物生长培养基有助于优化其生防能力。
本研究团队前期从青海省西宁市大通县达隆村农田感病大叶藜叶片中分离到一株链格孢菌(Alternaria alternata)DT-DYLC,通过研究发现其对藜具有高致病活性,对小麦、青稞、玉米、番茄和黄瓜安全,具有在以藜为优势杂草的禾本科、茄科和葫芦科田中应用潜力[21]。为了筛选低成本、廉价的培养基配方,获得高浓度的链格孢菌的孢子量,本研究以孢子量(OD600nm)为响应值,采用单因素试验及响应面试验对Alternaria alternata DT-DYLC的培养基配方进行优化,得出其最优培养基配方,以期为该菌株规模化生产和农业化应用提供理论依据和数据支撑。
1 材料与方法
1.1 试验菌种
链格孢菌(Alternaria alternata) DT-DYLC,从青海省西宁市大通县达隆村农田中采集到自然感病的大叶藜(Chenopodium hybridum)植株叶片筛选获得。
1.2 试验方法
1.2.1 固体培养基的筛选
将于PDA培养基保存并活化好的DT-DYLC菌株接种于7种培养基平板中央(表1),于 25 ℃培养箱中培养7 d后,用游标卡尺以十字交叉法测量菌落直径,并拍照记录菌落形态后,将菌丝刮下放到50 ℃烘箱中烘至恒量后于分析天平上准确称量并记录数据。每个处理重复3次。
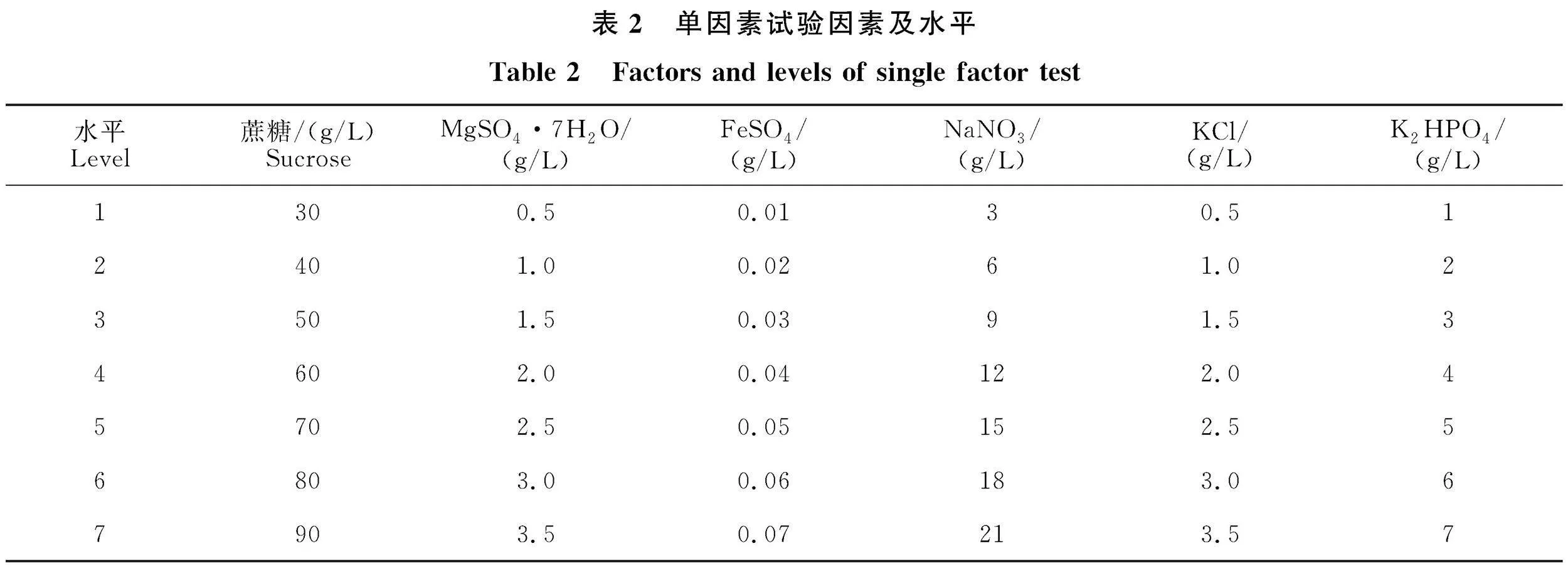
1.2.2 培养基的单因素优化 以“1.2.1”筛选出的最佳固体培养基为基础培养基,对配方各成分进行单因素试验。在接种并培养活化的平板中打直径为8 mm的菌饼接种于装有基础培养液的250 mL三角瓶中,于摇床培养7 d(25 ℃、180" "r/min),用紫外分光光度计测定培养液最大吸收波长λ=600 nm的OD值,重复3次。培养基各成分及水平选择如表2所示。
1.2.3 成分及配比优化 根据中心组合设计原理进行成分配比优化,以单因素结果为中心点,菌株DT-DYLC的OD(λ=600 nm)值为响应值(Y),以碳、氮源及无机盐含量设计3因素5水平的响应面(RSM)试验,其因素及水平如表3 "所示。
1.2.4 统计分析 采用SPSS Statistics 27、 "Design Expert 13和Excel对试验数据进行统计分析,采用Duncan氏新复极差法比较差异显 "著性。
2 结果与分析
2.1 固体培养基的筛选
综合分析菌落直径和菌丝干质量,以水琼脂培养基作为对照,平板置于25 ℃培养箱7 d后。察氏培养基上的菌落直径最大,为73.1 mm,其次为PDA和PSA培养基,菌落直径分别达 "68.54 mm和67.74 mm;菌丝干质量,在PDA和察氏培养基上分别达0.052 g和0.049 g(图1)。结合二者评价,在察氏培养基中菌落直径和菌丝干质量均显著高于其他培养基,故选定察氏培养基为链格孢菌DT-DYLC菌株菌丝生长的最适培养基。由图2可见,DT-DYLC菌株菌落在察氏、PDA和PSA培养基长势最优。
2.2 液体发酵培养基的优化
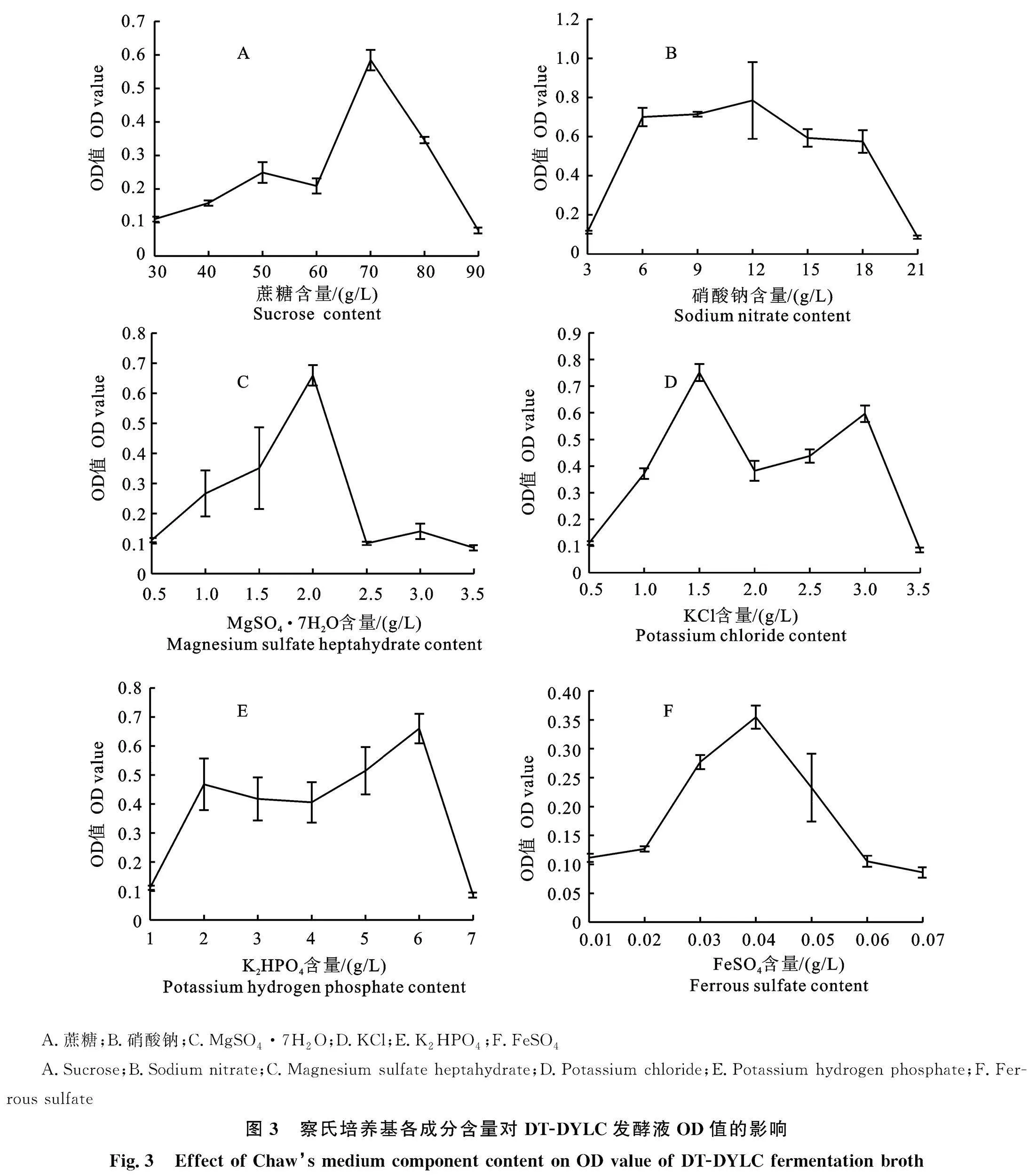
2.2.1 蔗糖含量对DT-DYLC液体发酵培养基OD值的影响 菌株DT-DYLC液体培养基的OD值在蔗糖含量30~50 g/L的区间内上升, "50~60 g/L下降,60~70 g/L又突然上升,并在70 g/L达到最大值之后,随着蔗糖含量增加,培养基的OD值迅速下降(图3-A),故选定70 g/L为菌株DT-DYLC液体发酵培养基的最佳蔗糖 "含量。
2.2.2 硝酸钠含量对DT-DYLC液体发酵培养基OD值的影响 随着硝酸钠含量增加,菌株DT-DYLC的OD值在3~6 g/L的区间内迅速上升,6~12 g/L间上升平缓,在12 g/L达到最大值,之后随着硝酸钠含量上升,OD值迅速下降(图3-B),故选定12 g/L为菌株DT-DYLC培养基的最佳硝酸钠含量。
2.2.3 MgSO4·7H2O含量对DT-DYLC液体发酵培养基OD值的影响 随着MgSO4·7H2O含量的增加,菌株DT-DYLC液体发酵培养基的OD值呈现先升高后降低的趋势,并在2 g/L时达到最大值,之后在MgSO4·7H2O含量2.0~2.5 g/L时急剧下降,2.5~3.0 g/L时略微上升,后又随着MgSO4·7H2O含量增加下降(图3-C)。故选定2 g/L为菌株DT-DYLC培养基的最佳MgSO4·7H2O含量。
2.2.4 KCl含量对DT-DYLC液体发酵培养基OD值的影响 随着KCl的含量增加,DT-DYLC液体发酵培养基的OD值呈升高-降低-升高-降低的形式,OD值在0.5~1.5 g/L内迅速上升,在1.5 g/L时达到最大值。后在1.5~2.0" "g/L内下降,在2.0~3.0 g/L区间内上升。在 "3.0~ "3.5 g/L区间内下降(图3-D)。故选定1.5 g/L为菌株DT-DYLC液体发酵培养基的最佳KCl含量。
2.2.5 K2HPO4含量对DT-DYLC液体发酵培养基OD值的影响 随着K2HPO4的含量增加,DT-DYLC的OD值先升高后降低,在1~2 g/L内迅速升高,2~4 g/L开始略微下降,4~6 g/L内上升,最终在6 g/L达到最大值。6~7 g/L内下降(图3-E)。故选定6 g/L为菌株DT-DYLC液体发酵培养基的最佳K2HPO4含量。
2.2.6 FeSO4含量对DT-DYLC液体发酵培养基OD值的影响 随着FeSO4含量的增加,DT-DYLC的OD值总体呈先升高后降低的趋势,在0.01~0.04 g/L区间内DT-DYLC液体发酵培养基OD值呈上升趋势。并在0.04 g/L达到最大值之后开始下降(图3-F)。故选定0.04 g/L为菌株DT-DYLC培养基的最佳FeSO4含量。
2.3 成分及配比优化
根据“2.2”得出的结果对链格孢菌 "DT-DYLC菌株的液体培养条件进行优化,利用Design expert中心组合试验设计3因素5水平试验,每个处理3个重复,结果以平均数±标准差表示,如表4所示。
以DT-DYLC发酵液的OD值(Y)为响应值,根据中心组合的试验结果(表4)进行分析得到OD值与蔗糖(A)、NaNO3(B)与无机盐(C)的二次多项回归方程:
Y=0.690 4-0.013 7A+0.023 4B-0.050 7C-0.039 4AB+0.045 6AC-0.031 7BC- "0.014 44A2-0.083 7B2-0.167 0C2
通过方差分析上述回归模型可知(表5),回归模型的Plt;0.000 1,显著性检验极显著,失拟项的P值0.341gt;0.05,显著性检验不显著,说明未知因素对试验的干扰很小,模型稳定,回归方程的决定系数为99.12%,证明该方程与实际情况较符合,该模型能够模拟菌株DT-DYLC的OD值与碳源、氮源和无机盐之间的关系。
模型数据显示,各因子的影响主次顺序为:C gt;AC gt; AB gt; BC gt; C2gt; B gt; A2gt;Agt; B2。一次项B、C、交互项AB、AC、BC及二次项 A2、C2影响显著。
根据试验因素(蔗糖、硝酸钠、无机盐)之间的交互效应三维立体响应面和等高线图(图4),确定一个因素后观察另外两个因素对DT-DYLC的OD值影响。综上,三者交互作用响应面皆为开口向下的凸形曲面,且交互效应的等高线形状为椭圆形,说明两两之间的交互作用效果较显著。
利用回归方程计算得到菌株DT-DYLC液体发酵培养基产孢量的培养基条件为:蔗糖 68.853 g/L,硝酸钠 11.41 g/L,无机盐8.94 g/L(其中K2HPO4 5.523 g/L、KCl 1.405 g/L、MgSO4·7H2O 1.874 g/L、FeSO4 0.0375 g/L)。
3 讨论与结论
微生物农药具有绿色环保、低毒无害、高效可控、抗性低、安全易存储等优点,是未来农业发展的重要方向之一。而筛选具有抑草作用的微生物是微生物除草剂研究的重要途径之一[22-24],孢子是微生物生长过程中的一个重要间体[25],孢子数量决定着生防菌剂的生防效用。故产孢率也是评价生防菌制剂的一个重要指标[26]。但在自然届筛选到的具有生防能力的菌株,其致病力和产孢量往往不能满足微生物农药的工业化生产,所以需要对自然筛选的菌株进行培养基碳源、氮源及无机盐的优化,以优化菌株产孢能力。同时,优化培养基也是提高经济效益的重要途径[27]。通过优化培养基提高孢子产量可为真菌制剂制备及其工业化生产提供基础保障[28]。
本研究通过先对固体培养基进行筛选,选出最适固体培养基,后进行单因素试验和响应面优化,旨在使链格孢DT-DYLC达到最适生长条件后,增加其孢子和抑草物质的产量。李祥等[29]研究得出察氏培养基为除草链格孢HY-02的最佳培养基,与本研究结果相同;通过单因素实验确定了培养基的最佳碳源为蔗糖,这与杜艳丽等[30]研究结果一致;本研究中所采用的无机盐对链格孢DT-DYLC培养基的OD值影响效果较明显,这与杨莹等[25]利用中心组合优化出芽短梗霉菌PA-2菌株所用的无机盐效果相似,均能优化促进菌株生长产孢;王雪妍等[31]对贝莱斯芽孢杆菌(Bacillus velezensis)HP-24进行发酵条件优化,发酵液中的活菌数可达到 1.17×109 CFU/mL;郭建军等[32]通过响应面法优化发酵培养基使多粘类芽孢杆菌LY1发酵产芽孢数量达到了 "6.825×109 CFU/mL;戴宝等[33]通过响应面法优化了萎缩芽孢杆菌(Bacillus atrophaeus) BsR05的芽孢产量提高了1.27倍;证明通过响应面法优化培养基可以促进产孢。
本研究通过单因素试验和响应面试验,确定链格孢菌DT-DYLC的最佳固体培养基为察氏培养基,液体发酵培养基产孢的最佳条件为:蔗糖 68.853 g/L、NaNO3 11.41 g/L、无机盐 8.94 g/L(其中K2HPO45.523 g/L、KCl 1.405 g/L、 "MgSO4·7H2O 1.874 g/L、FeSO4 0.037 5" "g/L),在此条件下,孢子量达到3.4×107" "CFU/mL,是优化前的2.72倍。优化后的发酵条件,不仅能有效提高菌液中的孢子量,而且可进一步降低培养成本,为链格孢菌DT-DYLC生防菌剂的进一步开发应用提供参考。本研究目前只优化了该菌株液体发酵的配方,后期还需进行发酵条件探索,以满足工业化生产的需要。
参考文献 Reference:
[1] 王玉灵,王爱华,胡冠芳,等.喷雾助剂对灭草松防除马铃薯田阔叶杂草藜的增强作用[J].中国马铃薯,2021,35(3):250-261.
WANG Y L,WANG A H,HU G F,et al. Enhancement effects of bentazone plus spray" adjuvants on" control of" broadleaf" weed Chenopodium album in" potato" field[J].Chinese Potato Journal,2021,35(3):250-261.
[2]KRAK K,VIT P,BELYAYEV A,et al.Allopolyploid origin of" Chenopodium album str.(Chenopodiaceae):A molecular and cytogenetic insight[J].PLoS ONE,2016,11(8):e0161063.
[3]DMITROVIC′ S,SIMONOVIC′" A,MITIC′" N,et al.Hairy root exudates of allelopathic weed Chenopodium murale L.induce oxidative stress and down-regulate core cell cycle genes in Arabidopsis and wheat seedlings[J].Plant Growth Regulation,2015,75:365-382.
[4]BAJWA A A,ZULFIQAR U,SADIA S,et al.A global perspective on the biology,impact and management of" Chenopodium album and Chenopodium murale:two troublesome agricultural and environmental weeds[J]. Environmental Science and Pollution Research,2019,26(6):5357-5371
[5]李香菊.近年我国农田杂草防控中的突出问题与治理对策[J].植物保护,2018,44(5):77-84.
LI X J.Main problems and management strategies of weeds in agricultural" fields in China in recent years[J].Plant Protection,2018,44(5):77-84
[6]KOOCHEKI A,NASSIRI M,ALIMORADI L,et al.Effect of cropping systems and crop rotations on weeds[J].Agronomy for Sustainable Development,2009,29(2):401-408.
[7]陈世国,强 胜.生物除草剂研究与开发的现状及未来的发展趋势[J].中国生物防治学报,2015,31(5):770-779.
CHEN SH G,QIANG SH.The status and future directions of bioherbicide study and development[J].Chinese Journal of Biological Control,2015,31(5):770-779
[8]RADOSEVICH S R,HOLT J S,GHERSA C.Weed Ecology:Implications for Management[M].New York:Weed Ecology Implications for Management,1997.
[9]DUKE S O,DAYAN F E,RIMANDO A M,et al.Chemicals from nature for weed management[J].Weed Science,2002,50(2):138-151.[ZK)]
[10] 李海涛,王金信,杨合同,等.微生物除草剂的研究现状和应用前景[J].山东科学,2005(1):30-34,46.
LI H T,WANG J X,YANG H T, et al. The present research and application progress of mycoherbicides[J].Shandong Science,2005(1):30-34,46.
[11]EL-SAYED W.Biological control of weeds with pathogens:current status and future trends[J].Journal of Plant Diseases and Protection,2005,112(3):209-221.
[12]李 健,高兴祥,李 美,等.“鲁保一号”菌株的鉴定和生防增效助剂筛选[J].山东农业科学,2021,53(2):102-105.
LI J,GAO X X,LI M, et al. ldentification of ‘Lubao 1’ strain and screening of" pesticide adjuvants[J].Shandong Agricultural Sciences,2021,53(2):102-105.
[13]刘志海,朱全让.鲁保一号菌[M].济南:山东科学技术出版社,1980.
LIU ZH" H,ZHU Q R.Lubao 1 Strain[M].Jinan:Shandong Science and Technology" Press,1980.
[14]HASAN S.Specificity and host specialization of Puccinia chondrillina[J].Annals of Applied Biology,1972,72:57-263.
[15]STIERLE A,CARDELLINA H,STROBEL G.Maculosin a host-specific phytotoxin from Alternaria alternate on spotted knapweed [J].American Chemical Society Symposium Series,1989,439:53.
[16]顾琼楠,欧 翔,褚世海,等.牛筋草生防菌NJC-16的分离鉴定及生物学特性研究[J].中国生物防治学报,2021, "37(4):817-825.
GU Q N,OU X,CHU SH H,et al. Isolation identification and biological characteristics of the biocontrol" fungi NJC-16 for Eleusine indica[J]. Chinese Journal of Biological Control,2021,37(4):817-825.
[17]刘 璐,钟加日,朱哲远,等.稗草生防菌株NX1的生物学特性及致病性研究[J].微生物学报,2023,63(11):4245-4257
LIU L,ZHONG J R,ZHU ZH Y,et al.Biological characteristics and pathogenicity of the biocontrol fungal strain NX1 for Echinochloa crusgalli[J].Acta Microbiologica Sinica,2023,63(11):4245-4257
[18]杨景艳.多粘类芽胞杆菌KM2501-1培养基优化及巨大芽胞杆菌CP3挥发性杀线虫活性物质研究[D].武汉:华中农业大学,2018.
YANG J Y.Optimization of Paenibacillus polymyxa KM2501-1 medium and research of nematicidal volatiles produced by Bacillus megaterium CP3[D].Wuhan:Huazhong Agricultural University,2018.
[19]彭 上.刺糖多孢菌培养基成分优化和发酵条件研究[D].长沙:湖南师范大学,2016.
PENG SH.The optimization of fermentation medium and process of spinosad by Saccharopolyspora spinosa[D].Changsha:Hunan Normal University,2016
[20]黎秋雨,柴军发,蒲艳丽,等.雷斯青霉F-1发酵培养基优化及对枸杞木虱的毒力测定[J/OL].生态学杂志,2023:1-11[2023-12-15].http://kns.cnki.net/kcms/detail/21.1148.Q.20230428.0955.002.html.
LI Q Y,CHAI J F,PU Y L,et al. Optimization of the culturing medium for Penicillium raistrickii F-1 and determination of its virulence against Bactericera gobica[J/OL].Chinese Journal of Ecology,2023:1-11.[2023-12-15].http://kns.cnki.net/kcms/detail/21.1148.Q.20230428.0955.002.html.
[21]程海洋,程 亮,朱海霞,等.链格孢菌DT-DYLC菌株的除草活性及对作物的安全性[J].中国生物防治学报,2023,39(2):418-428.
CHENG H Y,CHENG L,ZHU H X,et al.Herbicidal activity and safety to crops of Alternaria alternata DT-DYLC[J]. Chinese Journal of Biological Control,2023,39(2):418-428.
[22]HOAGLAND R E,BOYETTE M A,BOYETTE C D.Myrothecium verrucaria fungus:a bioherbicide and strategies to reduce its non-target risks[J].Allelopathy Journal, 2007,19(1):179-192.
[23]HAO S H,WEI Y,WANG J,et al. Allelopathy and the active metabolites of the endophytic fungus,Alternaria J46,from Platycladus orientalis[J].Weed Biology and Management, 2015,15(3):95-101.
[24]ANDE R,SON K I,HALLETT S G.Herbicidal spectrum and activity of Myrothecium verrucaria[J].Weed Science,2004,52(4):623-627.
[25]杨 莹,庄新亚,程 亮,等.出芽短梗霉菌PA-2发酵培养基及发酵条件优化[J].南方农业学报,2019,50(9):1998-2008.
YANG Y,ZHUANG X Y,CHENG L,et al.Fermentation medium of Aureobasidium pullulans PA-2 and optimization of fermentation conditions[J].Journal of Southern Agriculture,2019,50(9):1998-2008.
[26]王晓梅,刘国宁,程 丽,等.辣椒疫霉菌拮抗真菌M-12发酵条件的优化[J].吉林农业大学学报,2015,37(6):658-663.
WANG X M,LIU G N,CHENG L,et al. Study on optimal fermentation of M-12 strain against Phytophthora capsici[J].Journal of Jilin Agricultural University,2015,37(6):658-663.
[27]易征璇,王 征,谭著名.康氏木霉固体发酵产孢子粉工艺研究[J].现代农业科技,2013(8):194-196.
YI ZH X,WANG ZH,TAN ZH M.Study on producction technical of spores by" adopting Konningii trichoderma solid-state fermination[J].Xiandai Nongye Keji,2013(8):194-196.
[28]李鸿文,冯明光.球孢白僵菌不同菌株分生孢子的耐热能力[J].浙江大学学报(农业与生命科学版),2008,34(2):158-162.
LI H W,FENG M G,Bioassay of conidial thermotolerance of Beauveria bassiana strains from different hosts and geographic origins[J].Journal of Zhejiang University(Agriculture amp; Life Sciences),2008,34(2):158-162
[29]李 祥,朱海霞.除草链格孢菌HY-02的培养和发酵条件优化[J].甘肃农业大学学报,2022,57(3):111-120,128.
LI X,ZHU H X.Optimization of culture and fermentation conditions of "Alternaria alternate HY-02[J].Journal of Gansu Agricultural University,2022,57(3):111-120,128.
[30]杜艳丽,曹 兴,王桂清,等.百合灰霉病病原菌鉴定及其部分生物学特性测定[J].南方农业学报,2019,50(2):307-314.
DU Y L,CAO X,WANG G Q,et al. ldentification and partial biological characteristics of pathogen causing lily gray mold [J].Journal of Southern Agriculture,2019,50(2):307-314.
[31]王雪妍,马 焕,岳丹丹等.一株西瓜细菌性果斑病生防菌的筛选、鉴定及其培养基优化[J].中国瓜菜,2022,35(9):9-15.
WANG X Y,MA H,YUE D D.et al.Screening and identification of a biocontrol strain against bacterial fruit blotch of watermelon and optimization of its culture medium [J].Zhongguo Gua-cai,2022,35(9):9-15.
[32]郭建军,曾 静,袁 林,等.响应面法优化多粘类芽孢杆菌LY1的产芽孢条件[J].湖南农业科学,2022(4):6-11.
GUO J J,ZENG J,YUAN L,et al. Optimization of sporenbsp; production conditions of Paenibacillus polymyxa LY1 by response surface" methodology[J].Hunan Agricultural Sciences,2022(4):6-11.
[33]戴 宝,扈进冬,尹姗姗,等.响应面法优化萎缩芽孢杆菌BsR05发酵培养基[J].山东科学,2017,30(4):31-37.
DAI B,HU J D,YIN SH SH,et al.Optimization of fermentation medium composition for Bacillus atrophaeus BsR05 by response surface method[J]. Shandong Science,2017,30(4):31-37.
Liquid Medium Optimization of Alternaria alternata DT-DYLC with High
Pathogenic Activity" against Chenopodium album
Abstract Using Alternaria alternata DT-DYLC as the research object, and with mycelium biomass and spore number (OD600nm) as the response value, the fermentation medium was optimized by single factor test, Plackett-Burman test, and response surface test. The results showed that after 7 days of cultivation at 25 °C on Chaw’s medium, the colony diameter and mycelium mass of DT-DYLC reached 73.1 mm, and the mycelial mass was 0.049 g, both significantly higher than other tested media. The main factors affecting the spore number of A.alternata DT-DYLC was inorganic salt. The optimal fermentation medium for spore production was determined by response surface methodology consisted of sucrose 68.853 g/L, NaNO3 11.41 g/L, K2HPO4 5.523 g/L, KCl" 1.405 g/L, MgSO4·7H2O" "1.874 g/L, FeSO4 0.037 5 g/L. Under these conditions, the spore number in the fermentation broth of A.alternata DT-DYLC reached 3.4×107 CFU/mL, which was 2.72 times that of the unoptimized condition. The optimized medium can be used for the industrial-scale liquid fermentation of" A.alternata" DT-DYLC.
Key words Alternaria alternata; Spore yield; Medium optimization;Response surface methods

