不同披碱草种质对低氮胁迫的形态和生理响应分析及耐低氮性评价













摘要:本研究以22份披碱草(Elymus dahuricus Turcz.)种质为试验材料,设置全氮(1 mmol·L-1,TN)和1/100氮(0.01 mmol·L-1,LN)两个氮浓度处理28 d,对处理后披碱草的形态指标和生理指标进行测定,并对各测定值进行隶属函数分析比较,探究22份披碱草种质在长期低氮胁迫下的耐低氮特性。结果表明:在低氮胁迫下,22份披碱草的植株表型均受到不同程度影响,表现为株高降低,根长缩短;生理指标方面:低氮显著降低了披碱草幼苗的硝态氮含量、净光合速率、蒸腾速率、胞间二氧化碳浓度、气孔导度、硝酸还原酶和谷氨酸合成酶活性以及可溶性糖含量;低氮显著提高了谷氨酰胺合成酶和谷氨酸脱氢酶活性,同时显著增加了超氧阴离子、过氧化氢以及可溶性蛋白的含量。经过相关性分析、主成分分析和隶属函数分析,提取7个主成分作为披碱草耐低氮性评价的综合指标,经过计算得出耐低氮性较强的种质是E17,E19,低氮敏感型种质是E12,E16。研究结果为披碱草耐低氮品种选育工作提供理论支持。
关键词:披碱草;低氮胁迫;形态特征;生理特性;耐低氮性;综合评价
中图分类号:Q945.78""" 文献标识码:A""""" 文章编号:1007-0435(2024)07-2128-15
doi:10.11733/j.issn.1007-0435.2024.07.014
引用格式:
张心怡, 何菲菲, 张" 亮,等.不同披碱草种质对低氮胁迫的形态和生理响应分析及耐低氮性评价[J].草地学报,2024,32(7):2128-2142
ZHANG Xin-yi, HE Fei-fei, ZHANG Liang,et al.Analysis of the Morphology and Physiological Response of Different Elymus Dahuricus Germplasm under Low Nitrogen Stress[J].Acta Agrestia Sinica,2024,32(7):2128-2142
收稿日期:2024-03-15;修回日期:2024-04-23
基金项目:四川省自然基金青年基金(2023 NSFSC1134);西南民族大学双一流建设项目(CX2023011)资助
作者简介:
#张心怡(2000-),女,汉族,内蒙古呼伦贝尔人,硕士研究生,主要从事牧草育种研究,E-mail:1607962193@qq.com;#何菲菲(1995-),女,汉族,四川遂宁人,硕士研究生,主要从事牧草育种研究,E-mail:2865319187@qq.com;*通信作者Author for correspondence,E-mail:leiyingxia@hotmail.com
Analysis of the Morphology and Physiological Response of Different
Elymus Dahuricus Germplasm under Low Nitrogen Stress
ZHANG Xin-yi1#, HE Fei-fei1#, ZHANG Liang1, LUO Ying1, ZHOU Qing-ping1, 2, LEI Ying-xia1, 2*
(1. College of Grassland Resources, Southwest Minzu University, Chengdu, Sichuan Province 610041, China;
2. Sichuan Zoige Alpine Wetland Ecosystem National Observation and Research Station, Southwest Minzu University,
Chengdu, Sichuan Province 610041, China)
Abstract:In this study,22 Elymus dahuricus Turcz. germplasms were used as experimental materials,and two nitrogen concentrations of total N (1 mmol·L-1,TN) and 1/100 N (0.01 mmol·L-1,LN) were set to treat for 28 d. Morphological and physiological indexes of the lanceolate were measured after the treatments,and the values of the measurements were subjected to the analysis of the affiliation function. The morphological and physiological indexes of lanceolate were measured after treatment,and the values were compared with each other in an affiliation function analysis to investigate the low nitrogen tolerance characteristics of 22 lanceolate germplasm under long-term low nitrogen stress. The results showed that the plant phenotypes of 22 Elymus dahuricus Turcz. were affected to different degrees under low nitrogen stress,as evidenced by reduced plant height and shortened root length. For physiological indicators:low nitrogen significantly reduced nitrate nitrogen content,net photosynthetic rate,transpiration rate,intercellular carbon dioxide concentration,stomatal conductance,nitrate reductase and glutamate synthetase activities,and soluble sugar content in Elymus dahuricus Turcz. seedlings. Low nitrogen significantly increased glutamine synthetase and glutamate dehydrogenase activities,along with significant increases in superoxide anion,hydrogen peroxide,and soluble protein content. After correlation analysis,principal component analysis and affiliation function analysis,seven principal components were extracted as comprehensive indexes for the evaluation of low-nitrogen tolerance of Elymus dahuricus Turcz,and the germplasm with stronger low-nitrogen tolerance were calculated to be E17 and E19,and low-nitrogen-sensitive germplasm were E12 and E16. The results of the study provide theoretical support for the selection and breeding of low-nitrogen-tolerant varieties of Elymus dahuricus Turcz.
Key words:Elymus dahuricus;Low nitrogen stress;Morphological characteristics;Physiological characteristics;Low nitrogen resistance;Comprehensive evaluation
氮(N)是植物生长和发育的关键元素之一,参与植物体内多种重要有机化合物的构成(如激素、酶、叶绿素、核酸和生物碱等),是维持和促进植物生长发育的必要组成物质[1]。因此,在农业生产中,常通过施加氮肥来获取较高的作物产量。然而,据相关研究统计,所施氮肥中有60%~70%的氮素未被植物所吸收利用[2]。并且,过量施用氮肥会污染水环境,并导致土壤板结、破坏其理化性质,进而降低植物的生产效率[3]。因此,适量减施氮肥不仅可以改善土壤质地,提高土壤保水性,还可以减少土壤中余留的氮肥,使土壤中的氮素得到更好地利用,同时也可以降低土壤中的氮素流失,促进土壤生态系统的健康发展[4]。有研究表明,低氮条件会降低植物的产量及品质,但耐低氮种质相比氮敏感种质受影响较小,如:王玉乾等[5]对不同氮效率品种油菜(Brassica napus L.)进行低氮处理,结果表明氮高效油菜为保障其光合速率和营养体生长,将更多的氮元素分配至地上部分;韩霖等[6]对超高产玉米(Zea mays L.)和普通玉米品种在低氮条件下产量的比较研究中发现,氮缺乏较大程度影响了普通玉米的产量,而超高产玉米则能保持较高的产量。由此可见,充分发掘和利用作物自身的遗传潜力,筛选出耐低氮种质,降低对肥料的过分依赖,是实现减肥增效的有效途径之一,具有十分重要的意义。
披碱草(Elymus dahuricus Turcz.)是禾本科(Poaceae)小麦族(Triticea)披碱草属(Elymus)的一种多年生植物。全世界范围内披碱草主要分布在温带和寒温带地区,在中国主要分布于四川、西藏、新疆、东北、华北等地[7]。披碱草作为一种小麦族野生近缘种,具有多种优质、高产、抗虫、抗病的基因,这些特性使其成为改良麦类作物和丰富牧草遗传多样性的遗传资源库[8]。此外,披碱草作为高寒草原和草甸的建群种和优势种,具有分蘖能力强、再生性好和营养价值高等特点,使得其在畜牧业中具有显著的应用价值[9]。同时,披碱草在防风固沙和水土保持等方面也发挥着不可或缺的作用[10]。因此,研究披碱草对牧草育种、草牧业发展及生态环境的保护都具有重要的意义。
目前,对于耐低氮品种的筛选与评价工作在烟草(Nicotiana tabacum L.)[11]、谷子(Setaria italica L.)[12]、大豆(Glycine max L.)[13]等植物上已有较多研究。如刘芯欣等[14]以株高、地上部鲜重、地上部干重、地下部干重、根冠比等9个指标对大豆的耐低氮性进行研究,从260份大豆资源中筛选出强耐低氮资源17份。张楚等[15]则以株高、茎粗、可溶性蛋白、根系超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化物酶(Peroxidase,POD)活性、丙二醛(Malondialdehyde,MDA)可溶性糖等25个指标对苦荞(Fagopyrum tataricum L.)的耐低氮性展开研究,从9个苦荞品种中筛选出‘迪庆’苦荞的耐低氮能力最强。然而,对于披碱草耐低氮性的相关研究报道较少,且主要集中在田间实验[16-17],对披碱草进行室内苗期低氮胁迫试验来对披碱草耐低氮种质筛选与评价鲜有报道。为此,本试验以22份不同披碱草种质为材料,采用水培的方法,分析不同种质披碱草苗期对全氮和低氮的响应,通过Pearson相关性分析、主成分分析(Principal component analysis,PCA)、隶属函数分析综合评价各种质的耐低氮性特征,筛选出耐低氮披碱草种质,以期为披碱草耐低氮品种选育工作提供理论支持。
1" 材料与方法
1.1" 试验材料
试验材料由西南民族大学草地资源学院提供,选自具有不同地域代表性的披碱草种质,且以下种质均已通过核型鉴定,见表1。
1.2" 试验设计
本试验采用纸上发芽法,选取籽粒饱满的种子,1% 的NaClO溶液消毒5 min,蒸馏水冲洗3~4次,置于铺双层湿润滤纸的培养皿上进行萌发,萌发后放入光温周期为26℃光照16 h和16℃黑暗8 h的光照培养箱中进行培养。待其幼苗生长至10 cm高左右时,挑选出长势一致的披碱草幼苗定植于水培箱(45 cm×32 cm×20 cm)中,试验设置6个生物学重复,每个处理各定植6槽,每槽定植10株。使用霍格兰营养液(海博生物技术有限公司www.hopebiol.com)水培。设置两个供氮水平,分别为全氮(1 mmol·L-1)和低氮(0.01 mmol·L-1),以下简称TN和LN。本试验以Ca(NO3)2·4H2O为氮源,用CaCl2补充缺失的Ca2+。每7 d更换一次营养液,增氧泵通气。经连续培养28 d后,从每个处理中选取6株长势一致的健康植株进行农艺性状指标的测定。剪取披碱草幼苗的新鲜叶片于-80℃冰箱中保存,用于进行生理指标的测定。
1.3" 相关指标及其测定方法
1.3.1" 生长指标测定" 从每个处理中完整取出6株长势一致的披碱草,用卷尺测量其株高(Plant height,PH)和根长(Root length,RL)。分析天平(精度为 0.000 1 g)称量地上部鲜重(Shoot fresh weight,SFW)和地下部鲜重(Root fresh weight,RFW)。再将植株鲜样放入105℃的烘箱中杀青半小时,在65℃的烘箱中烘干至恒重,取出测定地上部分干重(Shoot dry weight,SDW)和地下部分干重(Root dry weight,RDW),根冠比(Root-shoot ratio,RSR)计算公式为:
根冠比(RSR)=地下部干重/地上部干重
1.3.2" 生理指标测定" 光合指标包括净光合速率(Net photosynthesis rate,Pn)、蒸腾速率(Evapotranspiration rate,Tr)、气孔导度(Transpiration rate,Gs)和胞间二氧化碳浓度(Intercellular CO2concentration,Ci),用Li-6800光合作用全自动测量系统(美国LI-COR公司研发)在大气CO2浓度为400 μmol·m-1,光合有效辐射为1 200 μmol·m-2·s-1,叶片温度为22℃的条件下,于上午9:00—12:00,下午14:00—17:00测定。谷氨酸合成酶(Glutamate synthase,GOGAT)、硝酸还原酶(Nitrate reductase,NR)、谷氨酸脱氢酶(glutamate dehydrogenase,GDH)、谷氨酰胺合成酶(Glutamine synthetase,GS),均使用对应指标的微量法试剂盒(苏州科铭生物技术有限公司www.cominbio.com)测定。过氧化氢(Hydrogen peroxide,H2O2)与超氧阴离子(Superoxide anion,O-2)含量均参照微量法试剂盒(苏州科铭生物技术有限公司www.cominbio.com)测定。根据张志良等[18]的试验方法,对以下指标进行测定:丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸法进行测定;硝态氮(Nitrate nitrogen,NO-3-N)含量采用用水杨酸比色法进行测定;可溶性糖(Soluble sugar,SS)含量采用蒽酮比色法进行测定,可溶性蛋白(Soluble protein,SP)的含量采用考马斯亮蓝法进行测定。
1.4" 数据处理
1.4.1" 耐低氮系数=低氮条件下性状表型值/对照组性状表型值
1.4.2" 各材料隶属函数值公式如下:
U(Xj)=(Xj -Xmin)/(Xmax-Xmin),j=1,2,3,…,n(1)
其中:Xj表示第j个综合指标;Xmin和Xmax分别表示第j个综合指标最小值和最大值。
1.4.3 "各材料权重公式如下:
Wj=Pj/∑nj=1Pj,j=1,2,3,…,n(2)
其中:Wj代表第j个综合指标在整个评价体系中的权重;而Pj则是各个基因型第j个综合指标上的贡献率。
1.4.4" 各材料综合评价值公式如下:
D=∑nj=1[U(Xj)×Wj],j=1,2,3,…,n(3)
其中:D值代表各基因型在低氮胁迫条件下,通过综合指标评价得出的耐低氮性综合评价值。
所有数据用Excel 2020进行整理,用SPSS 23.0进行统计分析和系统聚类,对各指标进行T检验、根据耐低氮系数进行主成分分析,隶属函数分析,用Origin绘制柱状图和相关性热图。
2" 结果与分析
2.1" 低氮胁迫下披碱草形态指标的响应
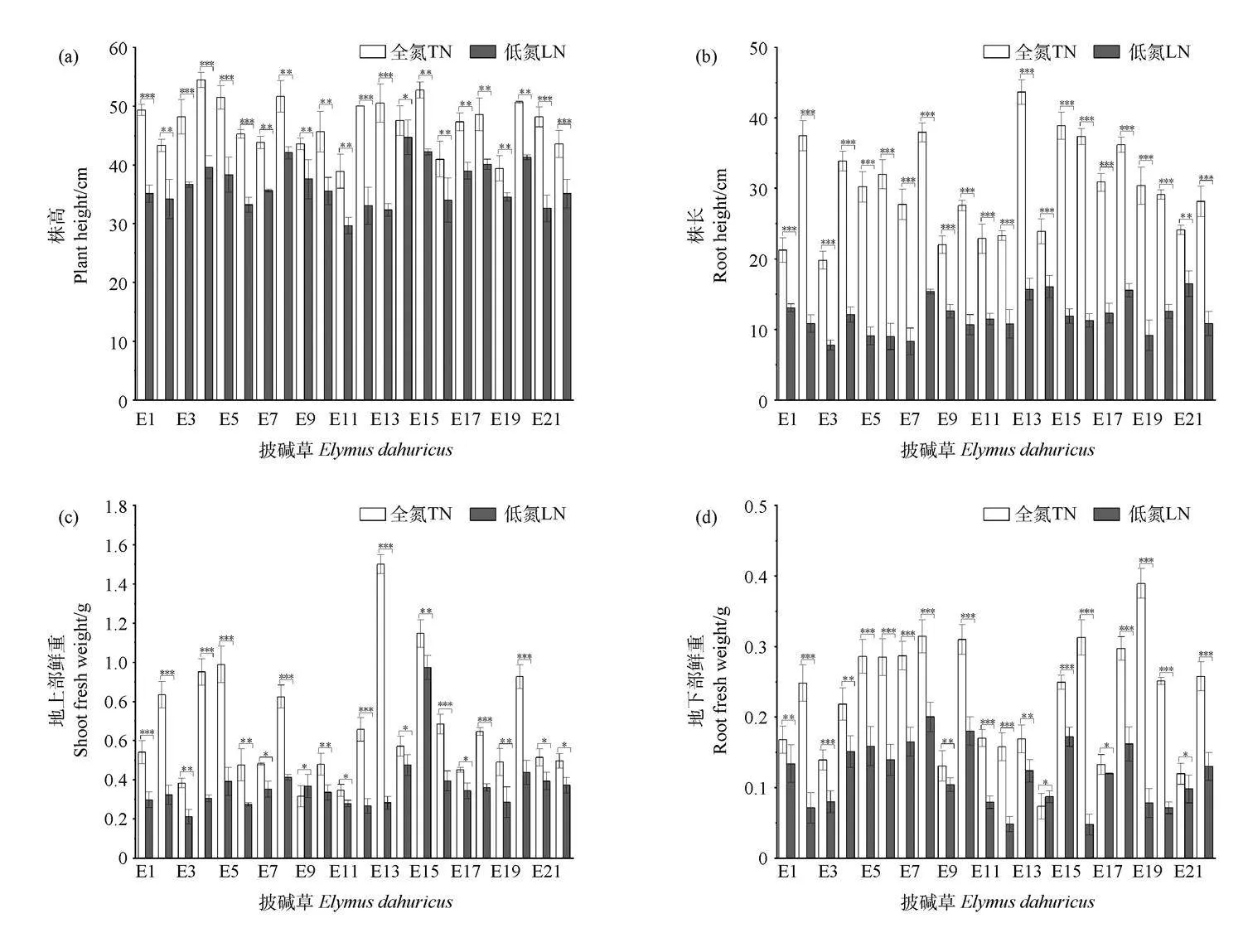
在低氮胁迫下,与TN相比,22份不同披碱草种质的株高和根长均呈下降趋势。从株高降幅来看,E13的株高下降最多(36.08%),其次是E12(33.98%),且差异极显著(Plt;0.01),下降最少的是E14(6.03%)。从根长降幅来看,E6的根长下降最多为71.88%,E21下降较少为31.66%(图1a~1b,表2)。地上部鲜重除E9上升了15.63%外,其余种质均呈下降趋势,降幅在15.63%~81.33%之间,其中E13下降了81.33%,E15下降了15.63%。地下部鲜重除E14上升了28.57%外,其余均呈下降趋势,降幅在7.69%~72.00%之间,其中E20降幅最大为72%(Plt;0.001),E1降幅最小为7.69%。低氮条件下,披碱草干物质量变化不一,整体表现为呈下降趋势(图1c~1f,表2)。然而对于披碱草幼苗根冠比,除E4,E1,E13,E21和E14的根冠比出现升高,且升高幅度分别为50%,40.9%,33.3%,20%和9.1%外,其余均呈下降趋势,且下降幅度范围为11.11%~74.07%,其中下降最多的为E16(74.07%),其次是E15(56%),E18下降最少(11.11%)(图1g,表2)。
2.2" 低氮胁迫下披碱草光合作用的响应
由图2所示,与TN相比,22份披碱草种质在低氮胁迫下的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)均有一定程度的降低,且差异显著(Plt;0.05)。其中Pn下降幅度最大的是E12(53.41%),Pn下降最少的是E18(5.83%);Tr降幅最大的是E12(44.81%),降幅最小的是E4(3.23%);Ci降幅最大的是E1(24.87%),降幅最小的是E20(1.23%);Gs降幅最大的是E11和E14(47.62%),降幅最小的是E7和E8(8.33%)。
2.3" 低氮胁迫下披碱草硝态氮的响应
低氮胁迫显著降低了硝态氮的含量,下降幅度不尽相同,低氮组和全氮组变化呈现极显著差异(Plt;0.01)。其中下降较多为E14(99.5%),E9(99%),E18(98.8%)和E13(98.6%)。E20下降了65.4%,E12下降了67.2%,E1下降了68.8%,其他品种的变化趋于一致。且TN中E8的硝态氮含量最多,E15的硝态氮含量最少。低氮处理后E12,E20的硝态氮含量最高,E9,E13,E14和E18的硝态氮含量最低(图3)。
2.4" 低氮胁迫下披碱草氮代谢相关酶的响应
由图4所示,低氮处理对披碱草的硝酸还原酶(NR)活性影响存在差异。除E3、E4、E5、E7和E21有上升趋势外,其余大部分呈不同程度的下降趋势,且差异显著(Plt;0.05)。其中E10的NR活性降幅最多(65.56%),E8、E2和E15分别下降了65.07%,63.27%和62.29%,E14下降的最少(3.5%)(图4a)。
与TN相比,低氮条件下除E1,E2,E5,E7,E8,E14,E15,E21和E22的谷氨酰胺合成酶(GS)活性有所下降外,其余披碱草的GS活性均有不同程度的上升,上升幅度在1.93%~93.74%之间。其中E17上升的最多(93.74%),E19上升的最少(1.93%)(图4b)。
低氮胁迫下谷氨酸合成酶(GOGAT)活性与TN相比,大部分呈降低趋势,少部分呈升高趋势,多数披碱草降幅在60%左右。其中E20降幅最大(80.17%),E15降幅最小(6.64%)(图4c)。
在低氮胁迫下,谷氨酸脱氢酶(GDH)除E19有所下降外,其余均呈上升趋势。上升幅度较大的3个种质为E12gt;E16gt;E7(13.25%gt;10.91%gt;10.22%)(图4d)。
2.5" 低氮胁迫下披碱草活性氧、氧化产物丙二醛的响应
在低氮胁迫下,22份披碱草种质中19份种质超氧阴离子(O-2)含量均呈不同程度的上升趋势,3份种质呈下降趋势。其中E2(168.22%)、E11(158.72%)、E20(137.46%)和E14(116.30%)上升幅度极为显著(Plt;0.01)。其次E12上升了97.35%、E1上升了95.81%、E8上升了88.63%,E22变化最小(8.06%)。E6,E7和E9分别下降了1.93%,10.93%和16.90%。试验品种的过氧化氢(H2O2)含量变化除3份种质呈下降趋势,其余呈上升趋势,且差异极显著(Plt;0.01),上升幅度最为明显的是E4(215%),E9上升了119.13%,E16上升了111.82%,E9上升幅度最小(2.3%)(图5a~5b)。
所有试验品种的丙二醛(MDA)含量在低氮胁迫下除E5,E7,E9,E10和E20下降外,其余均有不同程度的上升,且差异极显著(Plt;0.01),其中E19上升幅度最大(251.05%),其次是E8,E14,E2,E24,E22和E15,分别为175.89%,160.18%,160.11%,121.22%,106.63%和102.93%(图5c)。
2.6" 低氮胁迫下披碱草渗透调节物质的响应
低氮胁迫下,相比TN,试验中除E3,E16,E19,E21的可溶性蛋白(SP)含量有所上升外,其余披碱草种质均有不同程度下降,且差异性显著(Plt;0.05)。其中E4的下降幅度最大(52.35%),E15下降了44.93%,E1下降了44.25%,E7下降了41.47%,E8下降了40.34%,E20下降的最少(4.34%)。与此同时,E1,E9,E12,E13,E15,E16,E18的可溶性糖(SS)含量呈下降趋势,且差异性显著(Plt;0.05),其余披碱草种质均呈上升趋势。其中E12下降了49.53%,E15下降了31.35%,E9下降了22.68%,E1下降了14.74%,E13下降了13.95%,E16下降了10.82,E18下降了10.63%。而上升披碱草种质中,E22和E20分别上升幅度较多且增幅较一致,分别为85.46%和83.28%;其次E2上升了73.41%,E5上升最少(0.08%)(图6)。
2.7" 各指标耐低氮系数相关性分析
根据1.4.1中的公式可以计算出不同披碱草指标间的耐低氮系数(表3)。研究结果显示12对指标间均存在不同程度的相关性,综合影响着披碱草幼苗的耐氮能力,其中株高(PH)与地上部干重(RDW)呈极显著正相关,相关系数为0.543,与地上部鲜重(SFW)呈显著正相关,与根冠比(RSR)呈显著负相关;根长(RL)与地下部鲜重(RFW)、地下部干重呈极显著正相关,相关系数分别为0.597和0.665;根冠比与地下部鲜重、地下部干重呈极显著正相关,相关系数分别为0.602和0.549,与气孔导度呈显著正相关,与地上部干重呈显著负相关;地上部鲜重(SFW)与地上部干重呈极显著正相关,相关系数为0.947,与地下部干重呈显著正相关;地下部鲜重与地下部干重呈极显著正相关,相关系数为0.763,与硝态氮(NO-3-N)呈显著负相关;地下部干重与硝态氮呈显著负相关;净光合速率(Pn)与蒸腾速率(Tr)呈极显著正相关,相关系数为0.747,与气孔导度(Gs)呈显著正相关,与硝态氮呈显著负相关;蒸腾速率与气孔导度呈极显著正相关,相关系数为0.576,与硝酸还原酶(NR)呈显著正相关。(图7)
2.8" 披碱草各指标主成分分析
由表4可知,在21项指标的耐低氮系数基础上进行主成分分析,结果提取出7个主成分,方差贡献率分别为20.36,18.29,12.474,10.283,8.355,6.473和4.975,累计贡献率达到81.21%。第一主成分(PC1)特征值和贡献率分别为4.276%,20.36%,主要由蒸腾速率(Tr),气孔导度(Gs)决定,代表着光合作用指标信息;第二主成分(PC2)特征值和贡献率分别为3.841%和18.29%,主要受地上部鲜重(SFW)、地下部干重(RDW)、根长(RL)、地上部干重(SDW)作用,反映了地上部生长和根系生长信息;第三主成分(PC3)特征值和贡献率分别为2.619%和12.474%,主要受株高(PH)和净光合速率(Pn)作用,与第一主成分反映基本一致;第四主成分(PC4)特征值和贡献率分别为2.16%,10.283%,主要受丙二醛(MDA)、超氧阴离子(O-2),反映了披碱草的抗氧化能力;第五主成分(PC5)特征值和贡献率分别为1.755%和8.355%,主要受谷氨酰胺合成酶(GS)作用,反映了披碱草的氮代谢效率。第六主成分(PC6)特征值和贡献率分别为1.359%,6.473%,主要受过氧化氢(H2O2)作用,反映了披碱草的抗氧化能力;第七主成分(PC7)特征值和贡献率分别为1.045%,4.975%,主要受可溶性蛋白(SP)作用,反映了渗透调节能力。综上分析,7个主成分中贡献率占主导的性状可作为披碱草苗期综合评价的指标。
2.9" 隶属函数分析及综合评价
通过隶属函数计算各指标的隶属值,进而综合评价22份披碱草种质对低氮胁迫的耐受能力。根据1.4.2中的公式(1)进行主成分隶属函数分析并根据7个主成分的贡献率,利用1.4.3中的公式(2)计算出各主成分的权重。最后,利用公式(3)得出22份种质对低氮胁迫的耐受综合值(D值)。22份种质中耐低氮性综合评分(D值)排名平均值越大,说明该种质耐低氮能力越强,平均值越小,说明该种质耐低氮性越弱。由低到高排序为:E12lt;E16lt;E13lt;E2lt;E20lt;E11lt;E6lt;E15lt;E22lt;E19lt;E10lt;E5lt;E1lt;E21lt;E3lt;E7lt;E8lt;E18lt;E4lt;E14lt;E9lt;E17(表5)。
2.10" 不同披碱草种质聚类分析结果
利用欧式距离法对D值进行系统聚类,可以综合评估不同披碱草种质的对低氮环境的耐受能力。当欧式距离阈值为10时,可以将22份披碱草材料分为三类。其中E17、E9的耐氮性较强,E12和E16属于低氮敏感型种质,其余种质则被归类为低氮胁迫中间型(图8)。
3" 讨论
3.1" 低氮条件下披碱草苗期生长的响应
氮素是植物生长发育过程中必不可少的主要元素之一,植物在氮素亏缺环境下生长时,因其无法获得正常生长所需的氮含量,导致植物体对氮素吸收利用效率降低,生长受抑制,进而影响其产量和品质[11]。有研究表明:低氮条件下9个藜麦基因型的株高较正常氮水平均有所下降[19]。赵明丽[20]研究发现,低氮胁迫下普通型野大豆与耐低氮型野大豆的地上部和地下部的生物量均下降,但耐低氮型野大豆的降幅显著低于普通型野大豆。郭红霞等[21]研究表明,低氮胁迫下不同藜麦品系的株高、茎粗和茎叶干重均有所降低。在本试验中,22份披碱草种质的株高、根长趋势与前人研究结果相符,但E9的降幅与其他种质相比较小,说明E9较其他种质受低氮影响较小。有研究表明,植物在受到低氮胁迫时,植物会优先将吸收的氮素供给叶片合成叶绿素,增强对环境的适应性,从而提高氮素的利用效率[22],故推测E9为耐低氮型种质。
3.2" 低氮条件下披碱草苗期光合作用的响应
植物光合酶系统及光合器官的建成依赖于氮素供应,土壤中氮素的供应量影响着植物对光能的吸收,进而影响着光合作用能否正常运转[23]。在正常处理下,植物会将土壤中吸收的氮,作为氮源供给健壮的叶片,增强光合作用;低氮处理下,植物光合作用一般会受到抑制[24]。佟容等[23]在探究低施氮对菠菜生长发育及品质的影响时发现,在低氮条件下菠菜叶片净光合速率、蒸腾速率、气孔导度呈下降趋势。王晓慧等[24]发现花生叶片在缺氮处理会因缺乏叶绿素而变黄,且氮会从衰老组织转移至幼嫩组织。也有研究表明谷子叶片在氮限制条件下,光合速率及叶绿素都会呈现出下降趋势,影响植株光合作用[25]。在本试验中,披碱草的所有光合指标都表现出下降趋势,这一结果与前人研究结果一致,但E12下降幅度较其他种质更明显,表明低氮胁迫能够更大程度抑制叶绿素和相关酶含量合成,而叶绿素是植物进行光合作用的关键色素[26],其减少会直接影响到光能的捕获和转换效率,从而降低光反应和暗反应的速率,推测E12为氮敏感型种质。
3.3" 低氮条件下披碱草苗期氮代谢的响应
氮代谢是植物体内基础且重要的生理过程,涉及对氮素的吸收、同化和利用[24]。植物通过根系吸收土壤中的无机氮,但这些氮不能被植物直接利用,都要经过一系列酶的参与和调控,才能转化成有机氮,进而被植物利用[27]。硝酸还原酶(NR)作为氮代谢中的限速酶,对植物吸收硝态氮至关重要,而谷氨酰胺合成酶和谷氨酸脱氢酶则对植物同化氨起关键作用[28]。王汉霞等[29]通过研究小麦品种氮代谢遗传差异及其氮效率之间的关系时发现,正常氮供应下,小麦叶片及根部的NR含量相较于低氮水平均有所降低。刘鹏等[30]通过研究低氮环境下不同基因型高粱的生理响应时发现,低氮敏感型高粱叶片的NR,GS和GOGAT活性显著降低,显示出高粱不同基因型对氮胁迫反应存在差异。本研究中,各种质NR活性在低氮条件下均呈现被抑制的状态,其中E14的被抑制效果最弱,说明该种质能够在低氮环境下相对维持氮同化效率。
3.4" 低氮条件下披碱草苗期抗氧化能力的响应
植物遭受低氮胁迫时,体内会产生损伤细胞膜的活性氧(ROS),导致植物体内活性氧代谢紊乱,为了维持生理之间的动态平衡,植物会产生ROS清除剂来进行防御,从而缓解ROS引起的氧化损伤[31]。ROS清除剂包含过氧化氢酶(CAT)、过氧化物酶(POD)、氧化物歧化酶(SOD)等,ROS包括过氧化氢(H2O2)、超氧阴离子(O-2)等[32]。相关研究表明,干旱和低氮胁迫诱发小麦植株体内超氧阴离子、过氧化氢及羟基自由基等活性氧数量增多[33]。同时MDA是衡量细胞膜损伤程度的指标,作为膜脂过氧化的产物,MDA能够反映细胞膜损伤程度,MDA含量积累越多,说明膜脂过氧化程度越严重[15]。王文博[34]在黄瓜低氮耐受性指标评价中发现,氮胁迫下黄瓜种质23、种质47、种质9930地上部及根系的丙二醛含量显著增加,说明这三种种质都受到不同程度的氧化胁迫伤害。赵阳等[35]研究发现甜菜幼苗在缺氮及低氮环境下,其根和叶的丙二醛含量上升。本试验中,低氮处理下大部分披碱草种质的MDA含量呈上升趋势,说明披碱草的细胞膜系统受到了氧化损伤。而E9的丙二醛含量下降,推测可能与植物体内基因表达水平的上调及活性氧清除酶的活性能力明显增强有关,为了应对活性氧的积累,提高其耐氮能力,植物会增加编码活性氧清除酶基因的表达,进而增强体内活性氧清除酶的活性[38]。
3.5" 低氮条件下披碱草苗期渗透调节能力的响应
可溶性蛋白(SP)与可溶性糖(SS)等有机物含量的积累,有助于增加渗透调节能力,维护蛋白质生物合成系统,从而提高自身对逆境的抗性,所以许多研究人员认为SP和SS积累的数量可作为植物的耐性指标[36]。在植物体内,氮代谢与碳代谢相互作用,共同影响着植物生长发育,可溶性糖是植物体内重要的碳源,而糖酵解对生产碳骨架具有不可替代的作用,帮助植物应对不良环境[38]。李强等[39]研究表明,玉米苗期叶片在低氮条件下可溶性蛋白含量会降低,但耐低氮性强的品种可溶性蛋白含量降幅较小。罗颖等[37]对低氮胁迫下不同皮燕麦的早期生理响应研究结果发现18份皮燕麦的SS和SP含量显著降低。张心怡等[40]的研究显示,在低氮处理下,耐低氮品种燕麦的可溶性糖含量降幅最小。在本研究中,E12的SS含量降幅最大,可能是由于低氮条件下含氮化合物减少,影响了披碱草的SS的合成,从而降低披碱草自身水分吸收能力与渗透调节能力,诱导早期披碱草叶片衰老,故推测E12为低氮敏感型品种。低氮条件下,部分披碱草种质可溶性蛋白含量降低,说明此时的低氮胁迫并没有促进披碱草可溶性蛋白的合成。而少数种质可溶性糖上升,可能跟糖酵解的代谢过程有关。
3.6" 披碱草苗期耐低氮种质筛选
植物在面对胁迫时会表现出一种整体的反应机制,这种应对方式并不因其抗性强弱而有所不同,显示出在胁迫下,植物普遍采取相似的生理和代谢调节方式。但不同种质植物可能会表现出各指标变化幅度的差异,这种差异成为种质筛选的关键指标之一。如:马越等[41]对92份番茄种质进行干旱处理,结果表明在干旱胁迫下6个指标均显著降低,但仍可通过综合评价将其分为抗旱性不同的几类;罗鑫等[42]以垂穗披碱草为研究对象进行干旱复水处理,结果表明:在胁迫下9份材料各形态和生理指标均表现为相似趋势,但根据不同种质的变化程度结合隶属函数法综合评价体系,成功计算出9份垂穗披碱草的抗旱性强弱顺序;赵继秀等[43]在研究燕麦苗期性状对低氮胁迫的响应时发现,耐低氮种质和低氮敏感种质的各指标在低氮胁迫下表现一致,但较对照组变化程度有所差异,故其认为:一致的变化趋势是燕麦在低氮胁迫下的统一应对措施,在此基础上进行主成分分析、隶属函数分析和聚类分析是筛选耐低氮种质的常用方法。故本研究中,通过分析不同种质披碱草所表现出的各项指标变化幅度的差异,可以更好地评估不同种质在低氮胁迫下的表现和适应能力。
以往研究表明,由于缺乏足够的氮素供应,会导致植物体内蛋白质合成受损,细胞分裂和生长受限,进一步导致作物的产量和品质下降[22]。由于试验品种或种质的不一,其耐受能力也因其基因型不同而不同[13]。目前,为了使筛选出的耐低氮材料更加准确可靠,Liu等[44]采用皮尔森相关性分析、主成分分析及从属函数分析相结合的方法,对20个糜子品种在氮胁迫条件下的株高、根长、地上部生物量及氮含量进行综合评估,从而精确评估它们的耐低氮性。安立昆等[45]采用变异系数、相关性、主成分和隶属函数分析对低氮下8种青稞品种的生理指标进行评价,认为根部GS活性可以作为青稞耐低氮资源的初步筛选指标,而渗透调节物与抗氧化酶活性在青稞耐低氮性中占主导地位,是筛选耐低氮青稞的关键指标。贵会平等[45]在低氮和适氮两个处理下,对棉花苗期的氮积累量、SPAD值、总干物质质量等指标进行分析,并通过主成分分析及隶属函数法,筛选出了32个低氮耐受性品种以及32个对氮胁迫敏感品种。以上文献均说明测定生理生化指标并结合数据分析如主成分分析和隶属函数分析等方法可以构建作物种质资源筛选与评价体系,得出较可靠结论,在品种筛选上广泛运用,且较为成熟。所以本研究基于披碱草21项指标的的耐低氮系数,通过主成分分析法将22份不同披碱草种质的农艺性状与生理性状简化为7个主成分。将主成分分析与隶属函数相结合,通过D值计算对不同披碱草种质的耐低氮性进行综合评价。结果显示耐低氮性较强的种质为E17,E9,较弱的为:E16,E12,其余材料为中间型种质。再进一步结合欧式距离法将D值进行系统聚类分析,筛选出三大类种质。E17,E9,E14,E18,E4,E8,E7,E3,E21划分为耐低氮种质,将E12和E16划分为氮敏感种质,其余种质均为中等耐低氮型。由隶属函数综合评价与系统聚类分析可以看出二者耐低氮型种质与中等耐低氮型种质划分较为一致,说明此综合分析方法对于综合评价披碱草的耐低氮性具有较高的可靠性。
4" 结论
与全氮处理组相比:低氮显著降低了披碱草幼苗的株高,缩短了其根长;低氮显著降低了披碱草幼苗的硝态氮含量、净光合速率、蒸腾速率、胞间二氧化碳浓度、气孔导度、硝酸还原酶和谷氨酸合成酶活性以及可溶性糖含量;低氮显著提高了谷氨酰胺合成酶和谷氨酸脱氢酶活性,同时显著增加了超氧阴离子、过氧化氢以及可溶性蛋白的含量。
在22份披碱草种质中,E17,E9为耐低氮型种质。E12和E16为低氮敏感型种质。
参考文献
[1]" ZHANG M L,RUI G,LI M X,et al. Physiological characteristics and metabolomics reveal the tolerance mechanism to low nitrogen in Glycine soja leaves[J]. Physiologia Plantarum,2020,168(4):819-834
[2]" SUN X,REN W,WANG P,et al. Evaluation of maize root growth and genome-wide association studies of root traits in response to low nitrogen supply at seedling emergence[J]. The Crop Journal,2021,9(4):794-804
[3]" YOON D,ISHIYAMA K,SUGANAMI M,et al. Transgenic rice overproducing Rubisco exhibits increased yields with improved nitrogen-use efficiency in an experimental paddy field[J]. Nature Food,2020,1(2):134-139
[4]" 邵士梅. 减氮对不同穗型粳稻品种产量及品质的影响[D].扬州:扬州大学,2021:13
[5]" 韩霖,董本春,王思远,等. 低氮胁迫对玉米产量的影响[J]. 农业科技通,2017(9):48-49
[6]" 王玉乾,巢成生,代晶,等. 不同氮效率油菜苗期碳氮代谢差异[J]. 中国油料作物学报,2022,44(3):589-601
[7]" 王沛,陈玖红,王平,等. 披碱草属植物抗逆性研究现状和存在的问题[J]. 草业学报,2019,28(5):151-162
[8]" 闫志勇,周青平,刘文辉,等. 青藏高原6份披碱草属牧草农艺性状及生产性能评价[J]. 草业科学,2014,31(1):108-115
[9]" 张卫红,苗彦军,马飞,等. 披碱草属牧草在西藏草地系统中的地位探究[J]. 黑龙江畜牧兽医,2017(4):172-174
[10]贾祥,多吉格桑,赵爱民,等. 4种禾本科牧草苗期抗寒性综合评价[J]. 草地学报,2020,28(5):1372-1378
[11]王俊,梁喜欢,王子璇,等. 不同基因型烟草抗逆生理指标对低氮胁迫的响应[J]. 江苏农业科学,2020,48(21):97-103
[12]连盈,卢娟,胡成梅,等. 低氮胁迫对谷子苗期性状的影响和耐低氮品种的筛选[J]. 中国生态农业学报,2020,28(4):523-534
[13]孙浩楠,曹霞,朱贵爽,等. 耐低氮大豆资源的苗期筛选与评价[J]. 大豆科学,2023,42(5):545-553
[14]刘芯欣,侯云龙,杜楠琳,等. 大豆耐低氮资源的苗期鉴定与筛选[J]. 植物遗传资源学报,2023,24(2):408-418
[15]张楚,张永清,路之娟,等. 苗期耐低氮基因型苦荞的筛选及其评价指标[J]. 作物学报,2017,43(8):1205-1215
[16]孙小妹,陈菁菁,李金霞,等. 施肥后青藏高原亚高寒草甸典型物种生态化学计量特征及光合特性的变化[J]. 兰州大学学报(自然科学版),2018,54(6):804-810
[17]黎鹏宇,李佳璞,何奕成,等. 高寒草甸植物叶片氮和磷重吸收率对养分添加的响应及机理[J]. 北京林业大学学报,2024,46(1):93-103
[18]高志强,乌汉夫,徐文,等. 不同耐旱性肥披碱草干旱胁迫下生理响应和转录组学分析[J/OL]. 草地学报,1-11.https://kns-cnki-net.webvpn.swun.edu.cn/kcms/detail/11.3362.s.20240516.1334.027.html,2024-05-17/2024-05-31
[19]DENG Y,SUN X,ZHANG Q,et al. Comprehensive Evaluation and Physiological Response of Quinoa Genotypes to Low Nitrogen[J]. Agronomy,2023,13(6):1597
[20]赵明丽. 低氮胁迫下野大豆(Glycine soja Sieb. et Zucc.)幼苗叶片生理特性及代谢组学研究[D].长春:东北师范大学,2021:11
[21]郭红霞,王创云,邓妍,等. 藜麦对低氮胁迫的响应研究[J]. 作物杂志,2023(3):221-229
[22]王小辉. 花生响应低氮胁迫的形态、生理与分子生物学基础研究[D].新乡:河南科技学院,2023:32
[23]佟容,王国臣,乔建磊,等. 减氮施肥对菠菜生长发育及品质的影响[J]. 北方园艺,2021(14):59-64
[24]WANG X H,KAN X J,LIU L J,et al. Rubisco small subunits genome-wide identification and their function from gene expression to rubisco activity and photosynthesis among peanut genotypes under different nitrogen levels[J]. Agronomy,2022,12(10):2316
[25]周俊江,梁颖颖,周佳敏,等.不同氮处理对不同基因型谷子氮素吸收与分配动态的影响[J/OL]. 甘肃农业大学学报,1-11[2024-05-31].https://kns-cnki-net.webvpn.swun.edu.cn/kcms/detail/62.1055.S.20231205.1434.026.html
[26]DENG Y,SUN X,ZHANG Q,et al. Comprehensive evaluation and physiological response of quinoa genotypes to low nitrogen[J]. Agronomy,2023,13(6):1597
[27]CUN C,CHEN Y G,HE Q J,et al. Morphological,physiological,and transcriptional responses to low nitrogen stress in Populus deltoides Marsh. clones with contrasting nitrogen use efficiency[J]. BMC Genomics,2021,22(1):697
[28]YING L,NICOLAUS W V. Ammonium as a signal for physiological and morphological responses in plants[J]. Journal of Experimental Botany,2017,68(10):2581-2592
[29]王汉霞,马巧云,单福华,等. 不同氮效率小麦品种苗期相关指标的杂种优势[J]. 麦类作物学报,2023,43(4):442-452
[30]刘鹏,武爱莲,王劲松,等. 不同基因型高粱的氮效率及对低氮胁迫的生理响应[J]. 中国农业科学,2018,51(16):3074-3083
[31]王峰. 青稞对低氮胁迫的生理响应及交替呼吸途径影响低氮耐受性的机理研究[D].兰州:兰州大学,2016:62
[32]XIN Z,MA Y J,QI B B,et al. Alleviation effect of GR24,a strigolactone analogue,on low-nitrogen stress in Malus baccata seedlings[J]. The Journal of Applied Ecology,2023,34(6):1592-1600
[33]刘志鹏,陈曦,杨梦雅,等. 氮量及减灌对冬小麦旗叶生理参数和细胞保护酶活性的影响[J]. 麦类作物学报,2018,38(2):175-182
[34]王文博. 黄瓜耐低氮种质筛选及其低氮耐受性指标评价[D].武汉:华中农业大学,2023:35
[35]赵阳,石俊婷,芮秀丽,等. 甜菜幼苗对氮胁迫及复氮后的生理生化响应[J].中国糖料,2022,44(4):30-35
[36]SUN W J,ZHANG X L,ZHANG Z H,et al. Genome and transcriptome-wide identification of trehalose-6-phosphate phosphatases (TPP) gene family and their expression patterns under abiotic stress and exogenous trehalose in soybean[J]. BMC Plant Biology,2023,23(1):641-641
[37]罗颖,李聪,王沛,等. 低氮胁迫下不同皮燕麦品种早期的响应研究及耐低氮性综合评价[J].草业学报,2024,33(2):164-184
[38]WANG H,GUO R,HU Y J,et al. Carbon-Nitrogen metabolic responses and adaptive strategies to Low-Nitrogen stress in glycine soja[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2019,47(4):1215-1223
[39]李强,罗延宏,余东海,等. 低氮胁迫对耐低氮玉米品种苗期光合及叶绿素荧光特性的影响[J].植物营养与肥料学报,2015,21(5):1132-1141
[40]张心怡,赵新玥,田莉华,等. 9个裸燕麦品种苗期耐低氮性评价[J].中国草地学报,2024,46(1):56-69
[41]马越,李玉姗,王帆,等. 番茄种质资源萌发期抗旱性综合评价及筛选[J/OL].植物遗传资源学报,1-17.https://doi.org/10.13430/j.cnki.jpgr.20231116001,2024-05-08/2024-05-31
[42]罗鑫,闫利军,李达旭,等. 野生垂穗披碱草种质资源抗旱性筛选与评价[J/OL].草地学报,1-12.https://kns-cnki-net.webvpn.swun.edu.cn/kcms/detail/11.3362.S.20240416.1510.002.html,2024-04-18/2024-05-31
[43]赵继秀,马祥,琚泽亮,等. 燕麦苗期性状对低氮胁迫的响应及耐低氮种质筛选[J].草业科学,2023,40(12):3095-3103
[44]LIU C J,GONG X W,WANG H L,et al. Low-nitrogen tolerance comprehensive evaluation and physiological response to nitrogen stress in broomcorn millet (Panicum miliaceum L.) seedling[J]. Plant Physiology and Biochemistry,2020,151:233-242
[45]安立昆,姚有华,姚晓华,等. 低氮胁迫对不同青稞苗期生理特征影响和耐低氮性评价[J].西北农业学报,2023,32(11):1697-1706
[46]贵会平,董强,张恒恒,等. 棉花苗期耐低氮基因型初步筛选[J].棉花学报,2018,30(4):326-337
(责任编辑" 刘婷婷)

