不同品种番茄幼苗在弱光条件下对亚适温的适应性研究
何明明+王秀峰+韩会会+贾海晨+杨凤娟+史庆华+魏珉

摘 要:以10个番茄品种为试材,研究弱光条件下亚适温对番茄幼苗生长及生理特性的影响。结果表明:弱光条件下经过14 d亚适温处理后,番茄幼苗的生长量、叶片叶绿素含量、根系活力下降;电解质渗漏率及丙二醛、脯氨酸含量,不同品种表现差异明显。综合比较,在弱光条件下6#(红粉冠军)对亚适温的适应能力优于其它参试品种,适宜在我国北方冬季日光温室栽培。植物体内发生的生理反应与植物的生长情况基本一致。幼苗生长量、叶片电解质渗漏率、叶绿素含量、丙二醛含量、脯氨酸含量、根系活力等,可以作为番茄苗期亚适温弱光抗性指标,几项指标应相互参照。
关键词:番茄;弱光;亚适温;生理特性
中图分类号:S641.201文献标识号:A文章编号:1001-4942(2016)12-0037-06
Abstract The effects of low light and suboptimal temperature on growth and physiological characteristics of tomato seedlings were studied with ten tomato varieties as experiment materials.The results showed that the growth, leaf chlorophyll content and root activity of tomato seedlings decreased; the electrolyte leakage, MDA content and proline content were different obviously between different vclrieties after treated for 14 days under low light and suboptimal temperature. The adaptability of 6# (Hongfen Champion) to suboptimal temperature under low light condition was superior to the others, so it was suitable for cultivation in solar greenhouse in winter of north China. The physiological reaction was similar to growth situation in plant. The growth increment of seedlings, leaf electrolyte leakage, chlorophyll content, MDA content, proline content and root activity could be used as the indicators for identifying the tolerance of tomato seedlings to poor light and suboptimal temperature.
Keywords Tomato; Low light; Suboptimal temperature; Physiological characteristics
我国北方大部分地区设施栽培是以非加温的日光温室和塑料大棚为主,低温冷害发生频繁,弱光亚适温逆境也较为常见[1,2]。生产过程中经常发生弱光亚适温逆境对喜温光作物造成生长发育不良和产量及品质下降的现象[3]。控制环境条件下,对低温弱光或亚适温弱光下作物生理机制的研究,是蔬菜生物学研究领域中的重要内容,且在番茄[4-9]和黄瓜[10-12]的研究中已见报道。有关番茄耐低温弱光的研究报道较多,但不同品种(基因型)番茄幼苗对弱光亚适温适应性的研究较少。番茄的耐弱光亚适温能力是由其自身长期适应环境而形成的且受遗传因素控制的一种生理特性。在弱光亚适温的逆境条件下,番茄通过形态、生理生化反应和代谢功能等的改变,来提高自身对逆境胁迫的适应能力[10]。不同基因型的番茄对弱光亚适温逆境的适应能力存在差异[13]。因此,本试验通过人工模拟弱光亚适温条件,研究不同基因型番茄幼苗的生长和生理特性变化,以及对弱光亚适温适应性的差异,旨在筛选北方日光温室适宜冬季栽培的番茄品种,为番茄设施栽培提供一定的理论和实践指导。
1 材料与方法
1.1 试验材料
供试番茄品种:1#,金龙;2#,欧粉2号;3#,越冬新秀;4#,金玉x1;5#,以色列89;6#,红粉冠军;7#,浙粉202;8#,荷粉;9#,荷宝;10#,中蔬4号。试验材料由北京金玉种业公司、寿光富华种业、农大种业提供。
1.2 试验设计
试材准备:每个番茄品种挑选100粒饱满种子进行温汤浸种,催芽,播种。将混好的基质(草炭∶蛭石=2∶1)填入50孔的穴盘中,浇透水,每品种播1个穴盘,每孔播种2粒,摆放于山东农业大学玻璃温室育苗床进行常规管理。根据天气情况和基质的缺水情况进行浇水,一叶一心后每两天浇1次营养液(大量元素参照Hoagland配方、微量元素参照Arnon配方)。当幼苗长至4~5片叶时,挑选长势相对一致的幼苗转移至智能光照培养箱(济南科益试验设备有限公司)中培养。
试验处理:在常温弱光下适应3 d后进行亚适温处理。亚适温处理(T)温度为18℃/12℃(昼/夜)[14];适温对照处理(CK)温度为 25℃/18℃(昼/夜)。光量子通量密度(PFD)为100 μmol·m-2·s-1,日照时数 12 h,空气相对湿度80%左右。处理14 d后测定各项指标,重复3次,取平均值。
1.3 测定项目及方法
1.3.1 生长量的测定 分别用直尺测量幼苗的株高和所有功能叶的长、宽,按照任乐等[15]的方法计算叶面积。幼苗用去离子水冲洗干净并吸干表面水分,称其鲜重,在通风烘箱中105℃杀青15 min,75℃烘干至恒重,称其干重。
1.3.2 电解质渗漏率的测定[16] 取鲜叶用去离子水冲洗并吸干表面水分,打孔,称取0.5 g,装入大试管中,加入蒸馏水20 mL,抽气3次,室温保持4 h,多次摇动,测定初电导值S1,封口沸水浴 10 min,冷却,平衡10 min 后测终电导值S2,同时测定蒸馏水电导值S0。用相对电导率表示电解质渗漏率,计算方法如下:相对电导率(%)=(S1-S0) /(S2-S0)×100。
1.3.3 丙二醛(MDA)和可溶性蛋白含量的测定 丙二醛(MDA)含量参照Cakmak等[17]的方法测定,可溶性蛋白含量采用Bradford[18]的方法测定。
1.3.4 脯氨酸的测定 根据Barroso等[19]的方法测定,称鲜叶0.5 g,加5 mL磺基水杨酸,封口沸水浴10 min,冷却,过滤,取滤液2 mL(对照加蒸馏水2 mL),分别加2 mL冰乙酸和3 mL酸性水合茚三酮显色液,沸水浴40 min,冷却,加5 mL甲苯,充分震荡,静置分层,取上层甲苯液于520 nm下比色测定OD值。
1.3.5 光合色素的测定 参照李合生等[20]的方法,以95%乙醇(25 mL)浸提剪碎的番茄幼苗叶片(0.2 g)24 h,采用UV-160 分光光度计分别测定665、649、470 nm下的吸光度值,用Arnon[21]的方法计算幼苗叶片叶绿素 a(Chl a)、叶绿素b(Chl b)、类胡萝卜素、Chl(a+b)含量及Chl a/b。
1.3.6 根系活力的测定 采用TTC法测定,于485 nm下用分光光度计比色,以95%乙醇作对照。
1.4 数据处理
采用 Microsoft Excel 2003 软件进行数据处理和作图,采用 Duncans 新复极差法进行差异显著性检验。
2 结果与分析
2.1 弱光条件下亚适温对不同品种番茄幼苗生长的影响
由表1可知,在弱光条件下,适温处理的番茄幼苗株高增加量以10#最大,显著高于其它品种;其次是3#、8#、6#、7#,品种间差异不显著;1#、2#、5#、9#和4#增加量较小,品种间差异不显著。亚适温处理的番茄幼苗株高增加量最大的是6#,显著高于其它品种;其次是8#、5#、3#、2#、7#、9#、10#、1#;4#增加量最小,与1#、10#差异不显著,显著低于其它品种。适温处理的叶面积增加量较大的是8#和10#,显著高于其它品种;其次是7#、3#、9#、1#、6#、2#、5#;4#增加量最小,与5#差异不显著,但显著低于其它品种。亚适温处理的叶面积增加量最大的是2#,其次是7#、6#、8#、9#、5#、1#、3#、10#;4#增加量最小,与1#、3#、10#差异不显著,但显著低于其它品种。
弱光条件下适温处理的番茄幼苗鲜重增加量较大的是3#和8#,与10#差异不显著,显著高于其它品种;其次是5#、1#、7#、9#、6#、2#;4#增加量最小,与2#差异不显著,显著低于其它品种。亚适温胁迫处理后鲜重增加量较大的是5#、6#、3#和7#,四者只与增加量最小的10#差异显著,与其它品种差异不显著。适温处理的番茄幼苗干物质增加量较大的是3#、6#和8#,与增加量较小的4#和9#差异显著,与其它品种差异不显著。亚适温处理后干物质增加量最大的是6#,与7#差异不显著,但显著高于其它品种;增加量最小的是10#,与2#、3#差异不显著,显著低于其它品种。
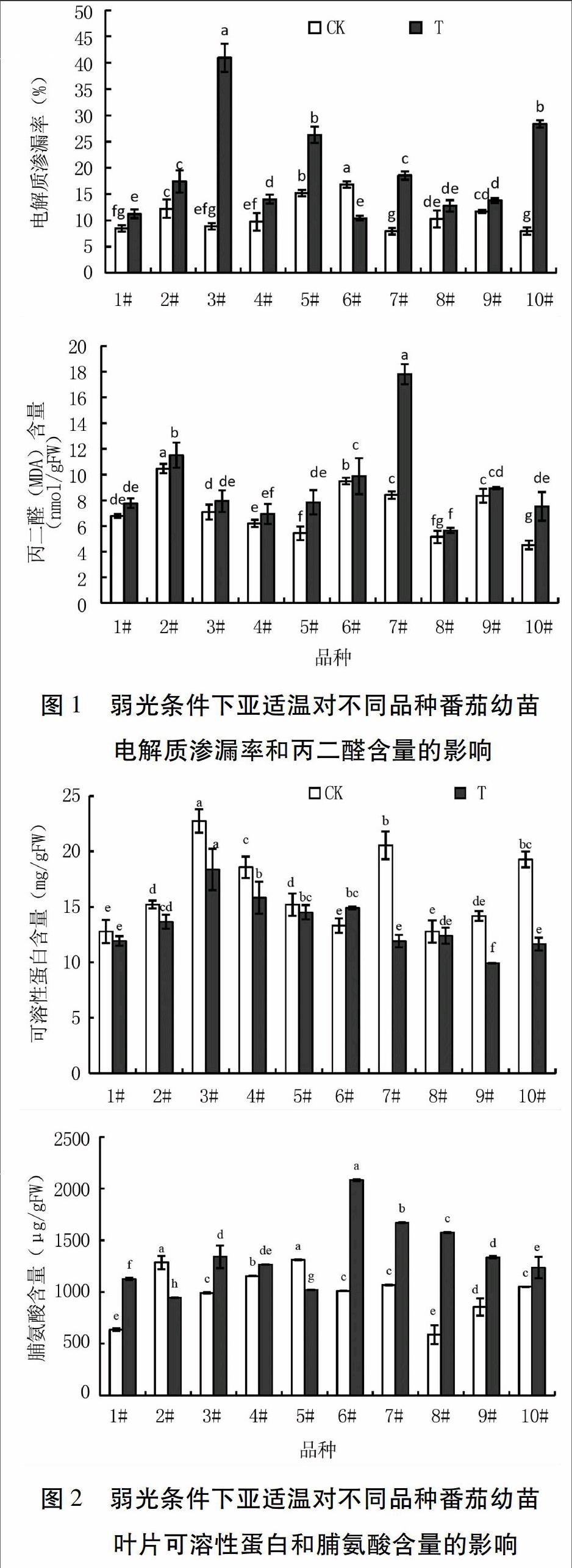
2.2 弱光条件下亚适温对不同品种番茄幼苗电解质渗漏率和丙二醛含量的影响
由图1可以看出,在弱光条件下,适温处理的番茄幼苗叶片的电解质渗漏率以6#和5#较大,显著高于其它品种;2#、9#、8#、4#、3#、1#次之, 10#和7#较小。亚适温处理后的番茄幼苗叶片电解质渗漏率以3#、10#、5#较大,显著高于其它品种;其次是7#、2#、4#、9#、8#、1#,差异较小;6#最小,除与8#、1#差异不显著外,与其它品种差异均达显著水平。
在弱光条件下,适温处理的番茄幼苗叶片的丙二醛(MDA)含量以2#和6#较大,显著高于其它品种;其次是7#、9#、3#、1#、4#、5#、8#;10#最小,除与8#差异不显著外,显著低于其它品种。亚适温处理后番茄幼苗叶片丙二醛含量较大的是7#和2#,显著高于其它品种;其次是6#、9#、3#、1#、5#、10#、4#;8#最小,除与4#差异不显著外,与其它品种差异均达显著水平。
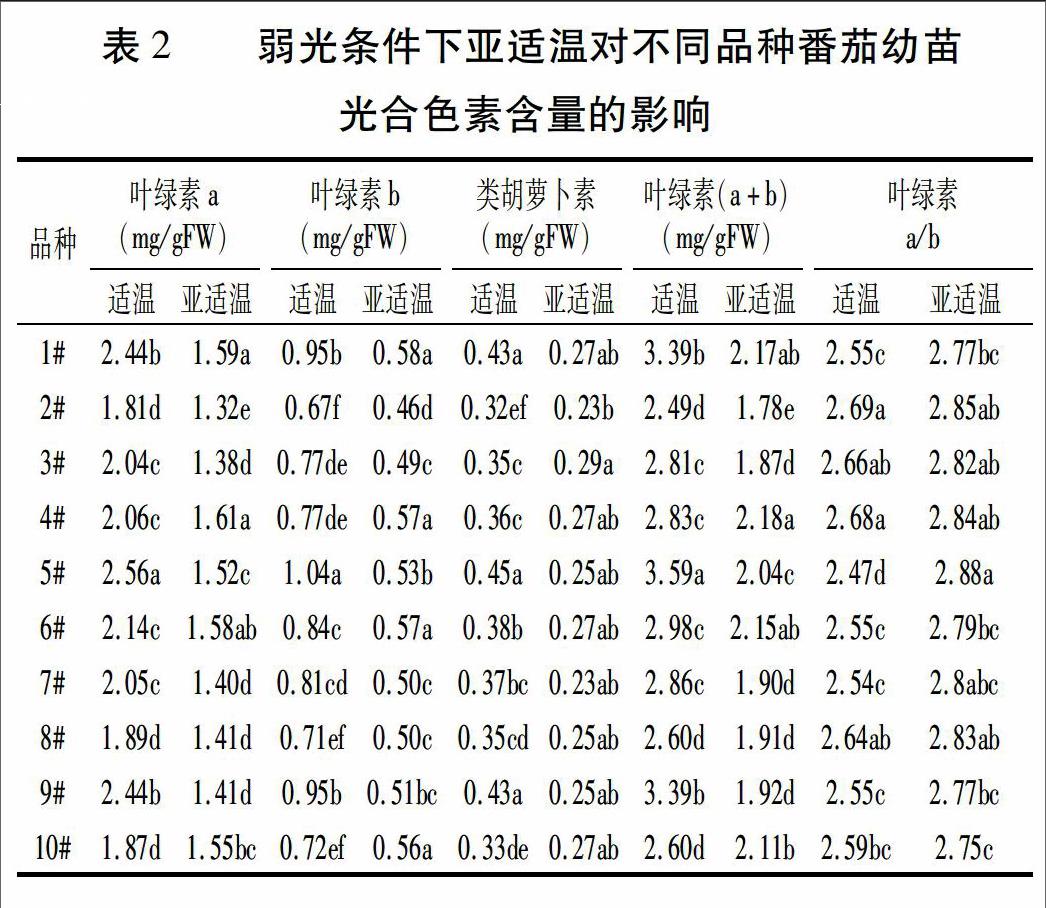
2.3 弱光条件下亚适温对不同品种番茄幼苗叶片可溶性蛋白和脯氨酸含量的影响
如图2所示,在弱光条件下,适温处理的番茄幼苗叶片可溶性蛋白含量以3#最大,显著高于其它品种;其次是7#、10#、4#、2#、5#、9#; 8#、1#、6#含量最小,除与9#差异不显著外,显著低于其它品种。亚适温处理的番茄幼苗叶片可溶性蛋白含量以3#最大,显著高于其它品种;其次为4#、6#、5#、2#、8#、1#、7#、10#;9#含量最小,显著低于其它品种。
在弱光条件下,适温处理的番茄幼苗叶片脯氨酸含量以2#和5#较大,显著高于其它品种;其次是4#、7#、10#、6#、3#、9#;1#和8#最小,显著低于其它品种。亚适温处理后番茄幼苗脯氨酸含量以6#最大,显著高于其它品种;其次是7#、8#、3#、9#、4#、10#、1#、5#;2#最小,显著低于其它品种。
2.4 弱光条件下亚适温对不同品种番茄幼苗光合色素含量的影响
由表2可知,弱光条件下,适温处理的番茄幼苗叶片的叶绿素a、叶绿素b和叶绿素(a+b)含量以5#最大,显著高于其它品种;其次是1#、9#、6#、4#、7#、3#;2#、10#和8#叶绿素含量较小。亚适温处理后番茄幼苗叶片的叶绿素a、叶绿素b和叶绿素(a+b)含量以4#、1#、和6#较大,三者间差异不显著;其次是10#、5#、9#、8#、7#、3#;2#最小,显著低于其它品种。
弱光条件下,亚适温处理后叶绿素a、叶绿素b、类胡萝卜素和叶绿素(a+b)含量较适温对照均有不同程度的降低,叶绿素a/b较适温对照有不同程度的升高,但差值不大。可见亚适温处理对叶绿素(a+b)含量的影响相对较大,对类胡萝卜素和叶绿素a/b含量的影响相对较小。叶绿素a含量、叶绿素b含量和叶绿素(a+b)含量在各个品种之间表现出较为一致的位次关系,说明弱光亚适温环境对不同叶绿素含量的影响基本一致。
2.5 弱光条件下亚适温对不同品种番茄幼苗根系活力的影响
由图3可知,在弱光条件下,适温处理的番茄幼苗根系活力以7#和6#较大,显著高于其它品种;其次是9#、10#、1#、2#、8#,差异不大; 3#、4#、5#的根系活力较小,显著低于其它品种。亚适温处理的番茄幼苗根系活力以6#最大,显著高于其它品种;其次是7#、3#、10#、8#、9#,品种间差异不显著;5#、1#、2#根系活力较小;4#根系活力最小,除与2#差异不显著外,显著低于其它品种。
3 讨论与结论
弱光亚适温逆境对植物株高、叶面积、鲜重和干重的增大有明显影响,因此在弱光亚适温条件下测定株高、功能叶叶面积、鲜重和干重的增加量,在某种程度上可以判断植株对弱光亚适温逆境的忍耐力[22]。本试验中番茄幼苗在弱光条件下经亚适温处理后,株高、叶面积、鲜重、干重增长量均受到不同程度的抑制。综合分析可得,6#(红粉冠军)的增长量降低程度最小,说明该品种对弱光条件下亚适温的抗性较强。
叶片电解质渗漏率表示细胞质膜相对透性,是植物受逆境胁迫后细胞膜受损伤程度的重要指标[23]。当植物处于逆境条件下(如高温、干旱、低温等)时,诱导植物体内产生和释放大量的活性氧,使生物膜受损,不同程度地丧失选择透性,细胞液和内含物外渗,电解质渗漏率增加。本研究结果发现,弱光亚适温处理的大部分品种番茄幼苗的电解质渗漏率升高,说明弱光亚适温对细胞质膜造成伤害[24];个别品种(6#,红粉冠军)的电解质渗漏率降低,说明在临界弱光亚适温下,该品种的膜透性并没有受到破坏,相反,可能由于在临界温度时细胞质浓度增加,细胞液流动变慢,电解质渗透率反而降低[25],表现出了较强的耐亚适温弱光能力。MDA是膜脂过氧化的产物之一,低温伤害导致杏花体内生理功能发生变化,自由基的增加引发膜系统伤害,其最终产物MDA可以扩散到植物其它部位,破坏体内正常代谢的进行[26]。MDA含量与植物的抗寒性密切相关,抗寒性强的品种MDA含量较低[27-29]。本试验中,弱光亚适温处理的番茄品种MDA含量与适温相比均有所增加,但6#和8#品种增加量相对最小,表现出对弱光亚适温有较好的适应性。
抗寒型的番茄品种在低温胁迫下其蛋白质合成系统运行正常,而对低温胁迫较为敏感的番茄品种,许多蛋白质合成系统会受到明显的抑制,主要表现为蛋白质的亚基种类减少、含量降低。蛋白质含量下降越多的品种,其耐低温的能力越弱[14]。李本湘等[30]提出了一种与抗寒性相关的蛋白质合成模式:低温胁迫下,可溶性糖含量增加,细胞液浓度升高,从而导致ABA积累,特殊的蛋白质合成,植物产生较为显著的抗寒力。在植物经受冷驯化的过程中,组织中可溶性蛋白质含量的增加是植物产生抗寒性的重要过程。经14 d弱光亚适温处理后发现只有6#品种的可溶性蛋白含量较适温对照升高,说明6#品种的耐弱光亚适温的能力较强。
脯氨酸是多种植物体内最有效的一种亲和性渗透调节物质。当植物处于对自身生长发育不利的环境条件时,体内会合成和积累大量的渗透调节物质以缓解逆境对自身造成的伤害[31]。本研究结果表明,供试品种中除2#和5#以外的其它品种经亚适温处理后的脯氨酸含量都升高,6#增加的最多,其次是8#和7#。2#和5#脯氨酸含量降低可能是脯氨酸积累没有表现即时效应,亚适温影响具有滞后性所致[32]。弱光条件下亚适温的逆境对植株脯氨酸含量的增加有明显影响,因此在弱光亚适温条件下测定植株的脯氨酸含量可以判断植株对弱光亚适温逆境的忍耐力。
叶绿素是光合色素中最重要的组成部分,叶绿素的生物合成是一系列酶促反应,因此受温度的影响很大。在一定范围内,光合能力随叶绿素含量的增加而提高。实际上,很少的叶绿素就可以满足光合作用的需要,叶绿素含量一般不会成为限制光合作用的因素,但在弱光下,叶绿素就可能成为一个限制因素[33]。弱光亚适温处理后,番茄幼苗叶片叶绿素含量减少,可能是因为弱光亚适温抑制了与叶绿素合成有关的酶活性[29,34,35],这与杨全勇等[14]的结论一致。
根系活力是表示植物根系吸收能力的重要指标之一。不良环境会使抗性弱的植物根系受到伤害。在一定范围内,随着温度的升高,根系吸收水分和矿质元素的速率提高,因为温度影响根系的呼吸作用,从而影响其主动吸收。温度低时,根系代谢弱,主动吸收慢;细胞质黏性增大,离子进入困难,根系活力下降。抗性强的品种根系活力下降较少,甚至增强根系活力,以抵抗修复不良环境影响[36]。试验中亚适温处理后3#幼苗根系活力下降不显著,5#和6#幼苗根系活力比适温下还略有升高。弱光条件下亚适温的逆境对植株根系活力有明显影响,因此在弱光亚适温条件下测定植株根系活力也可以判断植株对弱光亚适温逆境的忍耐力。
综上可得,供试不同品种番茄幼苗的耐弱光亚适温能力不同,以6#(红粉冠军)对弱光亚适温的适应性较强,10#(中蔬4号)和4#(金玉x1)对弱光亚适温的适应性弱,3#(越冬新秀)不适宜于亚适温条件下栽培。同时还可以看出,不同品种番茄幼苗的耐弱光亚适温能力的特性表现也不尽一致,对特定品种应该找到最具代表性的特性指标为最好。
参 考 文 献:
[1] 王永健,张海英,张峰.低温弱光对不同黄瓜品种幼苗光合作用的影响[J].园艺学报,2001,28(3): 230-231.
[2] 胡文海,喻景权.低温弱光对番茄叶片光合作用和叶绿素荧光参数的影响[J].园艺学报,2001,28(1): 41-46.
[3] 何勇,符庆功,朱祝军.低温弱光对辣椒叶片光合作用、叶绿素荧光猝灭及光能分配的影响[J].核农学报, 2013, 27(4):479-486.
[4] 朱龙英,徐悌惟,康高强,等.番茄耐低温和耐弱光鉴定方法初探[J].上海农业学报,1998,14(1): 45-50.
[5] 胡文海,喻景权.低温弱光对番茄植株生长发育及生理功能的影响[J].中国生态农业学报,2003,7(3): 55-57.
[6] 朱世东.茄果类幼苗低温伤害与膜脂过氧化作用[J].安徽农业学报,1991,18(2):141-146.
[7] 郑东虎,王兴国,梁运江,等.番茄苗期耐寒性鉴定技术的研究[J].延边大学学报,1999,21(3):163-167.
[8] 杜永臣.弱光对番茄生育的影响[J].中国蔬菜,1996(6):51-53.
[9] 黄伟,任华中,张福墁.低温弱光对番茄苗期生长和光合作用的影响[J].中国蔬菜,2002(4):15-17.
[10]陈青君,张福墁,高丽红.不同类型黄瓜苗期对亚适温弱光生理适应的差异[J].中国农学通报,2003, 19(2): 1-3.
[11]余纪柱,李建吾,王美平,等.低温弱光对不同生态型黄瓜苗期若干测定指标及光合特性的影响[J].上海农业学报,2003,19(4):46-50.
[12]艾希珍,王秀峰,崔志峰,等.钙对弱光亚适温下黄瓜光合作用的影响[J].中国农业科学,2006,39(9): 1865-1871.
[13]赵瑞秋.亚低温环境对4个番茄品种幼苗生理生化特性的影响[D].银川:宁夏大学,2013.
[14]杨全勇,王秀峰,张蒙,等.弱光条件下亚适温对黄瓜幼苗生长及抗氧化酶活性的影响[J].山东农业科学,2014,46(7):42-46.
[15]任乐,罗新兰,李天来,等.日光温室温度对番茄叶面积扩展的影响[J].安徽农业科学,2007,35(9):2610- 2612.
[16]习岗,张振瀛.植物抗逆性研究的物理学方法[J].物理,1997,26(3):162-166.
[17]Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves[J]. Plant Physiology, 1992, 98(4): 1222-1227.
[18]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[19]Barroso J B, Corpas F J, Carreras A, et al. Localization of nitric-oxide synthase in plant peroxisomes[J]. Journal of Biological Chemistry, 1999, 274(51): 36729-36733.
[20]李合生,孙群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:138-142.
[21]Arnon D I. Coper enzymes in isolated chloroplants poly phenoloridase in Beta vulgaris[J].Plant Physiol.,1949, 24: 1-15.
[22]Janssen L H J, Wams H E, Hass E L T, et al. Temperature dependence of chlorophyll fluorescence induction and photosynthesis in tomato as affected by temperature and light[J]. Journal of Plant Physiology, 1992, 139(5): 549-554.
[23]赵世杰.植物生理学试验技术[M].北京:中国农业科学出版社,1998.
[24]蒋燕,赵会杰.低温弱光处理对番茄幼苗生长的影响[J].河南农业科学,2005, 25(1):87-91.
[25]陈青君,张福墁,王永健,等.临界低温弱光对黄瓜光合特性及其酶变化的影响[J].华北农学报,2003, 18(4): 31-34.
[26]张剑云.不同苜蓿品种中丙二醛含量与抗逆性关系的研究[J].黑龙江畜牧兽医,2008(8):53-54.
[27]李荣富.低温对杏花丙二醛含量及过氧化物酶与超氧化物歧化酶活性的影响[J].内蒙古农业科技, 2005(6):29-30.
[28]杨全勇.亚适温条件下黄瓜幼苗生长及镁吸收对硝酸盐胁迫的响应[D].泰安:山东农业大学,2014.
[29]徐伟慧,王兰兰,王志刚,等.低温对辣椒幼苗生理生化特性的影响[J].甘肃农业大学学报,2006,41(3):56-59.
[30]李本湘,沈征言.低温锻炼对番茄幼苗抗寒性的影响[J]. 北京农业大学学报,1983(2):45-50.
[31]王小华,庄南生.脯氨酸与植物抗寒性的研究进展[J]. 中国农学通报,2008,24(11): 398-402.
[32]杨国柱,温小成,杨予海,等.冷季紫花苜蓿根系可溶性碳水化合物和脯氨酸含量变化动态的研究[J].草业与畜牧,2007,135(2):19-21.
[33]鲁福成,王明启,魏雪生,等.逆境条件下几种蔬菜生理指标的变化[J].天津农业科学,2001(6):6-9.
[34]鲁福成,王明启,张仲国,等.弱光对番茄苗期生长发育影响的研究[J].天津农学院学报,2001, 8(3): 24-27.
[35]庞金安,沈文云,马德华.黄瓜幼苗耐低温指标研究初报[J].天津农业科学,1998,4(2):53-56.
[36]黄伟,任华中,张福墁.低温弱光对番茄苗期生长和光合作用的影响[J].中国蔬菜,2002(4):15-17.

