低温胁迫下罗非鱼的鳃组织结构变化及其生理响应





摘要:【目的】探究低温胁迫下罗非鱼鳃组织损伤的调控机制,为后续开展罗非鱼越冬养殖提供理论依据。【方法】以广温性草鱼为参照,对罗非鱼进行12℃室外低温胁迫及18℃室内复温试验,采集罗非鱼和草鱼的鳃组织,分别制作组织切片、测定抗氧化酶活性及采用实时荧光定量PCR检测免疫相关基因表达情况。【结果】当温度由18℃降至12℃后,罗非鱼鳃组织发生严重损伤,具体表现为细胞凋亡程度加重,次级鳃瓣形态不完整,板层融合,层间细胞团增多,组织内空泡化,血细胞堆积较多;复温至18℃后,罗非鱼鳃组织细胞凋亡程度有所缓解,但板层融合现象并未好转。草鱼在12℃低温胁迫下其鳃丝上皮组织略微增厚,但次级鳃瓣和鳃小片结构相对较完整,凋亡细胞数量远少于罗非鱼;复温至18℃后,草鱼的次级鳃瓣结构损伤情况好转,鳃丝上皮组织厚度下降,凋亡细胞数量明显减少。在12℃低温胁迫下,罗非鱼鳃组织中的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性极显著升高(Plt;0.01,下同),而谷胱甘肽过氧化物酶(GSH-PX)活性极显著降低;草鱼则表现为CAT活性极显著升高,GSH-Px活性显著升高(Plt;0.05,下同),SOD活性无显著变化(Pgt;0.05,下同)。此外,罗非鱼的BPI、MKK6、STAT1、CD122和IL-2基因相对表达量在12℃低温胁迫下极显著下降,而IL-1β基因相对表达量极显著上升;而草鱼在12℃低温胁迫下表现为STAT1和IL-1β基因相对表达量极显著上升,CD122和IL-2基因相对表达量显著上升,BPI和MKK6基因相对表达量下降,但差异不显著。【结论】在低温胁迫下,氧化应激、细胞凋亡、免疫功能受损三者间的相互作用可能共同介导了罗非鱼鳃组织的损伤,且这种损伤不可逆转。在今后的罗非鱼抗寒工作中应以抗寒相关基因为分子标记,通过分子标记辅助育种加速抗寒品种(系)的培育。
关键词:罗非鱼;鳃组织;低温胁迫;氧化应激;细胞凋亡;免疫功能
中图分类号:S965.125文献标志码:A文章编号:2095-1191(2024)10-3127-09
Changes on the gill tissue structure and physiological responses of tilapia(Oreochromis niloticus)under low temperature stress
GEYu-teng1,2,TONG Jing-yuan1,2,LI Wei1,2,ZHOU Yan1,2,CHEN Liang-biao1,2*
(1Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources(Shanghai Ocean University),Shanghai201306,China;2International Research Center for Marine Biosciences,Ministry of Science and Technology(ShanghaiOcean University),Shanghai 201306,China)
Abstract:【Objective】The aim of this study was to explore the regulatory mechanism of tilapia gill tissue damage un‐der low temperature stress and provide theoretical basis for the subsequent overwintering of tilapia.【Method】Tilapia was subjected to 12℃outdoor low temperature stress and 18℃indoor rewarming experiments,with the eurythermal grass carp as reference.The gill tissues of tilapia and grass carp were collected,and tissue sections were made,antioxidant en‐zyme activities were determined,and real-time fluorescence quantitative PCR was used to detect the expression of im‐mune related genes.【Result】When the temperature dropped from 18℃to 12℃,the gill tissue of tilapia was severely damaged,which was manifested by aggravated apoptosis,incomplete secondary gill lamellae,fused lamellae,increasedinterlamellar cell clusters,vacuolation in the tissue,and more blood cell accumulation;after rewarming to 18℃,the de‐gree of apoptosis in the gill tissue of tilapia was alleviated,but the lamellae fusion phenomenon did not improve.Underlow temperature stress of 12℃,the epithelial tissue of the gill filaments of grass carp was slightly thickened,but the se-condary gill lamellae and gill lamellae were relatively intact,and the number of apoptotic cells was much less than that oftilapia;after rewarming to 18℃,the secondary gill lamellae structure damage of grass carp improved,the thickness of epithelial tissue of gill filament decreased,and the number of apoptotic cells decreased greatly.Under low temperaturestress of 12℃,the activities of superoxide dismutase(SOD)and catalase(CAT)in the gill tissue of tilapia increased extremely significantly(Plt;0.01,the same below),while the activity of glutathione peroxidase(GSH-Px)decreased sig‐nificantly;grass carp showed an extremely significant increase in CAT activity,a significant increase in GSH-Px activity(Plt;0.05,the same below),and no significant change in SOD activity(Pgt;0.05,the same below).In addition,therela‐tive expression of BPI,MKK6,STAT1,CD122 and IL-2 genes in tilapia showed extremely significant down-regulationtrend under 12℃low temperature stress,while the relative expression of IL-1βgene showed extremely significant up-regulation trend;while the relative expression of STAT1 and IL-1βgenes in grass carp showed extremely significant up-regulation under 12℃low temperature stress,and the relative expression of CD122 and IL-2 genes up-regulated signifi‐cantly,and the relative expression of BPI and MKK6 genes showed a down-regulation trend,but the difference was notsignificant.【Conclusion】Under low temperature stress,the interaction between oxidative stress,apoptosis and impairedimmune function may jointly mediate the damage of tilapia gill tissue,and the damage is irreversible.In the future work on cold resistance of tilapia,molecular marker-assisted selection technology can be used to accelerate the breeding of coldresistant breeds(lines)with cold resistant related genes as molecular markers.
Key words:tilapia(Oreochromis niloticus);gill tissue;low temperature stress;oxidative stress;apoptosis;im‐mune function
Foundation items:National Natural Science Foundation of China(32130109);National Key Research and Develop‐ment Program of China(2022YFD2400800)
0引言
【研究意义】我国是全球罗非鱼的最大生产和出口国(江东能等,2022),而广西作为我国罗非鱼的重要养殖产区,罗非鱼产业对广西渔业起着至关重要的作用(赵立朝等,2019)。近年来,广西地区寒潮频发,且寒潮持续时间长,大部地区气温下降幅度高达12℃,局部地区降温幅度甚至在14℃以上(董雪晗等,2022)。气温大幅度下降导致罗非鱼大批量死亡,给罗非鱼养殖业带来巨大经济损失和挑战。因此,亟待研究低温胁迫下罗非鱼的表型变化及应激机制,以确保我国罗非鱼产业的持续健康发展。【前人研究进展】低温胁迫对不同温度适性鱼类的生理机能均会产生显著影响,但具体表现在不同组织和生理过程中存在一定差异。鲤(Cyprinus carpio)在15℃下暴露90 s后因大脑供血量不足,导致神经系统生理功能受损(van den Burg et al.,2005);莫桑比克罗非鱼(Oreochromis mossambicus)经过低温或高温胁迫后,其体内白细胞数量、呼吸爆发和吞噬活性等免疫指标下降,机体免疫力降低(Ndong et al.,2007);虹鳟(Oncorhynchus mykiss)在低温胁迫下其心脏肌肉和结缔组织含量增加,导致心脏肥大,最终引起心脏功能受损(Klaiman et al.,2011);草鱼(Ctenopharyngodonidellus)在12℃低温胁迫下,其脑组织中与类固醇生物合成、蛋白代谢及吞噬体功能相关的基因表达发生显著变化(Shi et al.,2020);在越冬期间,草鱼肝胰腺、肌肉和脂肪等组织中不饱和脂肪酸(UFA)与多不饱和脂肪酸(PUFA)的比例显著上升(Sun et al.,2021);军曹鱼(Rachycentron canadum)幼鱼在低温胁迫后其血清抗氧化相关酶活性显著降低,肝脏中凋亡相关基因表达上调,从而造成氧化损伤及细胞凋亡(李豫等,2022)。鳃作为鱼类的主要呼吸器官,在外界环境变化时发挥着调节机体生理稳态的重要作用(岳苗等,2024),且鳃组织已被证实是感知外界温度变化最敏感的器官(Hu et al.,2016)。Qiang等(2013)研究发现,新吉富罗非鱼幼鱼在37℃高温胁迫下其鳃组织中Na+,K+-ATPase活性显著增加,即高温胁迫会增加鳃组织的离子运输;胡玲红等(2021)研究证实,高温或低温胁迫致使青鳉(Oryziaslatipes)鳃组织发生不同程度的氧化应激,并诱导细胞凋亡;刘明丽等(2021)研究表明,低温胁迫导致罗非鱼鳃组织中凋亡相关蛋白RPL11和P53的表达增加,且罗非鱼对低温的响应较斑马鱼更敏感;Esam等(2022)研究发现,热应激暴露会引起罗非鱼的原发性和继发性鳃丝变性、毛细血管扩张及上皮血管充血等现象;Zhou等(2022)将罗非鱼暴露于36℃高温下,结果发现其鳃组织发生鳃片卷曲和丝端增生,且有氧代谢受到抑制;耿传业等(2023)利用代谢组学技术研究高温胁迫下的虹鳟生理反应,结果发现热应激导致其鳃组织脂质代谢紊乱,鳃细胞发生炎症并产生免疫应答。【本研究切入点】硬骨鱼类的鳃组织具有呼吸、渗透调节及含氮废物排泄等多种生理功能(Evans et al.,2005),能对金属离子、低pH和洗涤等多种刺激物作出反应,且随刺激物的变化而发生相应改变,是生态环境监测项目的良好候选器官(Danget al.,2020)。鳃组织生理功能的正常发挥对维持鱼类生长、生活及其生理生化状态尤为重要,但至今鲜见低温胁迫下罗非鱼鳃组织结构变化及其生理响应的相关报道。【拟解决的关键问题】以广温性草鱼为参照,对新吉富罗非鱼进行12℃室外低温胁迫及18℃室内复温试验,通过病理组织切片观察及生理指标比较,进一步探究低温胁迫下罗非鱼鳃组织损伤的调控机制,为后续开展罗非鱼越冬养殖提供理论依据。
1材料与方法
1.1温度处理与样品采集
新吉富罗非鱼和草鱼均由广西水产科学研究院提供。罗非鱼和草鱼的成鱼各50尾,从广西良种场引进后采用网箱养殖于上海海洋大学校园内的天然河道(30°53′14.33″N,121°53′35.38″E,水深2.5 m),使罗非鱼和草鱼处于自然季节性变化的温度和光周期下。以电子温度计记录每天的最高水温和最低水温。选用对低温具有较强适应性的草鱼为参照,有利于揭示不同温度适性鱼类对低温胁迫的生理反应。参照李晨虹和李思发(1996)的研究结论,本研究设定18℃为第1个处理温度、12℃为第2个处理温度,河道温度为18℃时胁迫7d后取样,河道温度为12℃时胁迫12 d后取样(图1),每次取样均随机挑选罗非鱼和草鱼各3尾。由于河道自然温度的不可控性,待低温胁迫试验结束后将剩余的罗非鱼和草鱼转移至18℃室内循环水养殖系统中,恢复7 d后再次随机取样。动物试验由上海海洋大学动物伦理委员会批准,批准号SHOU-DW-20210118。
1.2组织切片及染色
解剖采集罗非鱼和草鱼的鳃组织,放入4%多聚甲醛中过夜固定,随后进行梯度酒精脱水、透明、浸蜡及包埋,采用Leica切片机切片(切片厚度5μm)。切片干燥后再进行脱蜡、复水等操作,然后分别进行苏木素—伊红染色和Tunel染色,以中性树胶封片,置于Eclips 80i荧光显微镜(日本Nikon公司)下观察拍照。
1.3抗氧化酶活性测定
采用购自南京建成生物工程研究所的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等酶活性试剂盒,分别测定罗非鱼和草鱼鳃组织抗氧化酶活性,测定方法按试剂盒说明进行操作。
1.4实时荧光定量PCR扩增
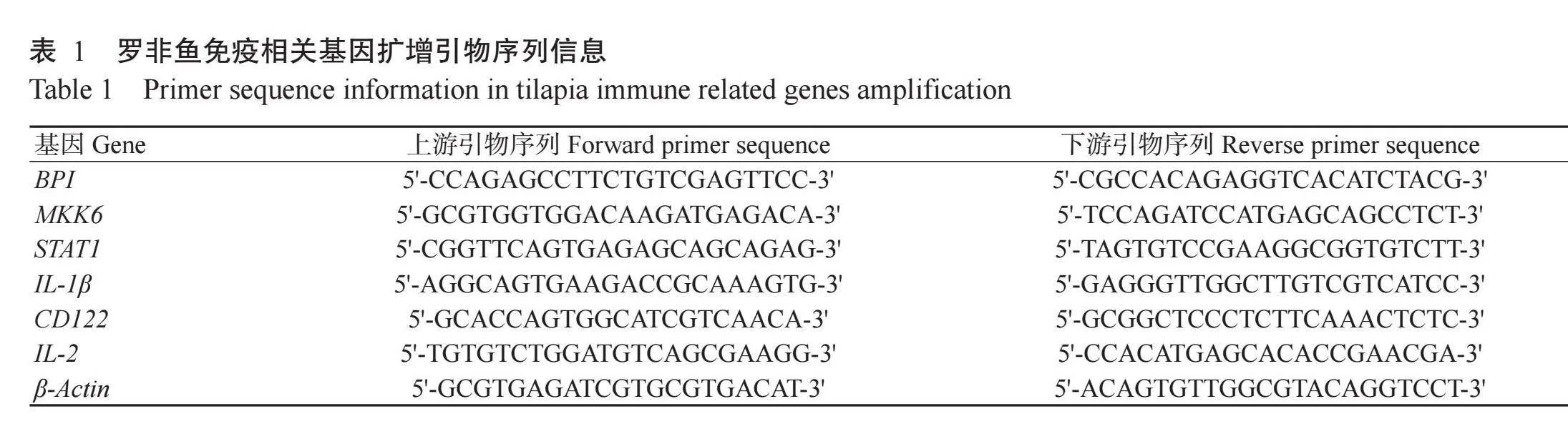
采用实时荧光定量PCR检测低温胁迫下罗非鱼和草鱼的免疫相关基因(BPI、MKK6、STAT1、IL-1β、CD122和IL-2)表达变化。使用RNA提取试剂盒[天根生化科技(北京)有限公司]提取鳃组织RNA,以反转录试剂盒(TaKaRa)将RNA反转录合成cDNA,以β-Actin为内参基因,通过SYBR®Green Master Mix(Vazyme)在CFX96 qPCR仪(Bio-Rad)上对目的基因进行定量分析。实时荧光定量PCR反应体系20.0μL:cDNA模板2.0μL,SYBR®Green Master Mix 10.0μL,上、下游引物(表1和表2)各0.4μL,RNase-Free H2O 7.2μL。扩增程序:95℃预变性30 s;95℃10 s,60℃30 s,进行40个循环。采用2-∆∆Ct法计算目的基因相对表达量,并运用R语言中的TukeyHSD函数进行单因素方差分析(One-way ANOVA)。
2结果与分析
2.1低温胁迫下罗非鱼鳃组织结构的变化
当河道温度处于18℃时,罗非鱼的次级鳃瓣(Secondary gill lamellae,SGL)结构相对较完整(图2-A);通过观察鳃组织局部放大图,发现罗非鱼鳃丝上皮由多层上皮细胞组成(图2-D),包括泌氯细胞(Chloride cell,CC)和黏液细胞(Mucous cell,MC)等;鳃小片中含有血细胞(Blood cell,BC)和柱细胞(Pillar cell,PiC)等,细胞结构清晰,形态完整。2种鱼的鳃组织结构在18℃时并无明显差异,草鱼次级鳃瓣结构清晰,鳃小片数量较多(图2-G),可清楚观察到柱细胞、血细胞及上皮细胞(Epithelial cell,EC)(图2-J)。当罗非鱼处于12℃(亚致死温度)时,鳃组织结构发生明显变化,具体表现为次级鳃瓣形态不完整,间隙萎缩,出现板层融合现象,层间细胞团(Interlamellar cell mass,ILCM)面积增大,鳃小片结构模糊(图2-B);从局部放大图来看,鳃组织内有明显的空泡,毛细血管内充血现象严重,血细胞堆积较多(图2-E)。相对于罗非鱼而言,草鱼在12℃下的鳃丝上皮组织略微增厚,但次级鳃瓣和鳃小片结构相对较完整(图2-H和图2-K)。当复温至18℃后,罗非鱼次级鳃瓣的融合现象并未好转,但鳃小片完整性得到改善(图2-C和图2-F);草鱼在复温后,其次级鳃瓣结构损伤情况好转,鳃丝上皮组织厚度下降(图2-I和图2-L)。
2.2低温胁迫下罗非鱼鳃组织细胞凋亡检测结果
由图3可看出,当温度由18℃降至12℃后罗非鱼鳃组织中出现大量凋亡细胞,且凋亡细胞相对聚集(图3-B);当复温至18℃后,罗非鱼鳃组织中的凋亡细胞数量相对减少,细胞凋亡程度有所缓解(图3-C)。从草鱼鳃组织来看,在12℃低温胁迫下鳃组织凋亡细胞数量较18℃下略微增多,但与罗非鱼相比凋亡细胞数量较少(图3-E);当复温至18℃后,草鱼鳃组织凋亡细胞数量明显减少(图3-F)。
2.3低温胁迫下罗非鱼鳃组织抗氧化酶活性测定结果
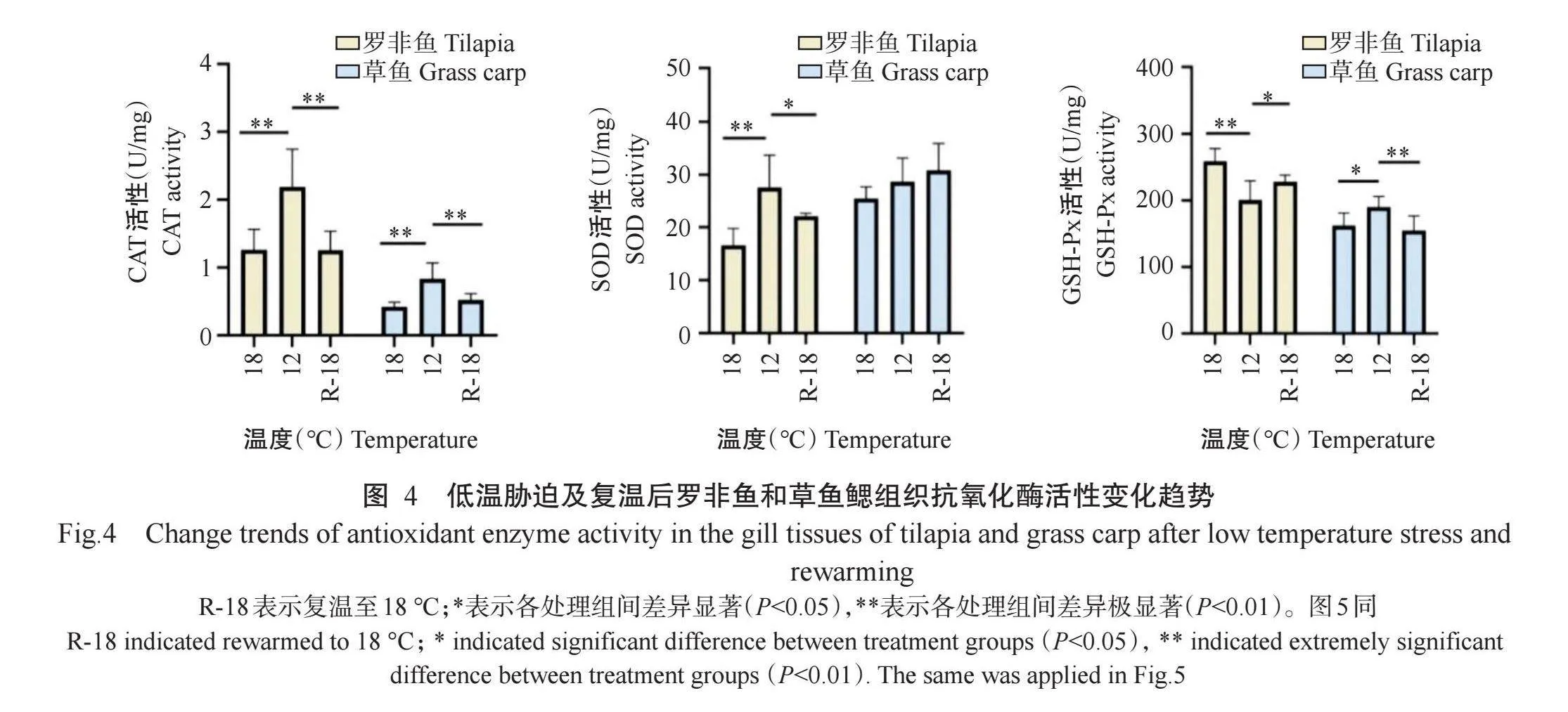
由图4可看出,当温度由18℃降至12℃后,罗非鱼鳃组织中的CAT和SOD活性极显著升高(Plt;0.01,下同),GSH-Px活性则极显著降低;草鱼鳃组织中的CAT活性也极显著升高,但升高幅度小于罗非鱼,GSH-Px活性显著升高(Plt;0.05,下同),SOD活性则无显著变化(Pgt;0.05,下同)。复温至18℃后,罗非鱼鳃组织中的CAT、SOD和GSH-Px活性基本恢复到初始水平。
2.4低温胁迫下罗非鱼免疫相关基因表达变化
采用实时荧光定量PCR检测低温胁迫下罗非鱼和草鱼鳃组织免疫相关基因的表达情况,结果(图5)显示,当温度由18℃降至12℃后,罗非鱼鳃组织的BPI、MKK6、STAT1、CD122和IL-2基因相对表达量均极显著下降,而IL-1β基因相对表达量极显著上升;草鱼鳃组织的STAT1和IL-1β基因相对表达量极显著上升,CD122和IL-2基因相对表达量显著上升,BPI和MKK6基因相对表达量下降,但差异不显著。复温至18℃后,免疫相关基因在罗非鱼鳃组织中的相对表达量基本上恢复至初始水平。
3讨论
鱼类鳃组织受温度影响发生形态重塑的现象最先在欧洲鲫(Carassius carassius)中被发现(Sollid et al.,2003),在低温且氧气充足的环境下,鳃小片间会产生层间细胞团,且这些细胞团的聚集被认为会减少鳃组织有效交换气体和离子的区域,从而降低鱼体进行气体交换和离子调节的能力(Sollid and Nils-son,2006);当鲫暴露于高温且缺氧的环境下,鳃小片间的层间细胞团消失,次级鳃瓣的整个表面区域扩大,以提高其摄氧能力(Sollid et al.,2005a;Nils-son,2007)。本研究结果表明,在18℃下罗非鱼次级鳃瓣完整,可清晰观察到与鳃组织呼吸、离子交换相关的黏液细胞和泌氯细胞等,说明罗非鱼在18℃下其鳃组织功能仍保持正常的运作状态;当罗非鱼处于12℃(亚致死温度)时,鳃组织结构发生重塑,具体表现为层间细胞团增多,次级鳃瓣形态不完整,组织内空泡化严重,有血细胞堆积,与Wu等(2017)的研究结果相似。故推测当水温降至罗非鱼的极端耐受低温时,水分可能会在罗非鱼鳃组织细胞内形成结晶,导致细胞膜破裂及细胞器受损,进而引起细胞内容物泄漏并形成空泡;血细胞堆积可能是由于细胞破裂引起的出血,层间细胞团增多可能与罗非鱼鳃组织细胞大量凋亡堆积有关,板层融合现象导致其呼吸表面积减少,致使罗非鱼面临着缺氧的风险。当复温至18℃后,罗非鱼鳃组织的板层融合现象并未好转,说明低温胁迫对罗非鱼造成了不可逆转的伤害,次级鳃瓣损伤的不可逆现象可能致使罗非鱼在低温条件下面临着呼吸困难的风险。已有研究证实,欧洲鲫在15℃下会发生明显的鳃组织重塑(Sollid etal.,2005a),而金鱼(C.auratus)需在7.5℃下才发生鳃组织重塑(Sollid etal.,2005b)。本研究中,草鱼在12℃下并未出现明显的鳃组织重塑现象,可能是不同鲤科鱼类的种间差异所致,也可能是12℃还不足以致使草鱼鳃组织发生重塑以适应周围环境温度的变化。
在低温胁迫下,鱼类线粒体膜多不饱和脂肪酸合成速率增加,从而促使线粒体呼吸速率加快。这一过程可能会导致鱼体内活性氧生成及质子泄漏,最终导致膜脂过氧化(Pavlovićet al.,2010)。当鱼类受到氧化应激时,SOD、CAT和GSH-Px等抗氧化酶可消除鱼体内过多的活性氧,使其维持在正常的生理水平(Jeevitha etal.,2014)。本研究结果表明,当温度由18℃降至12℃后,罗非鱼鳃组织中的CAT和SOD活性极显著升高,即低温胁迫诱导了罗非鱼的氧化应激,与Xu等(2018)研究发现凡纳滨对虾在冷休克后SOD和CAT等抗氧化酶活性升高、Wang等(2022)研究发现斑马鱼成纤维细胞ZF4在短期低温刺激下SOD和CAT活性升高的结论相似。此外,在12℃低温胁迫下罗非鱼鳃组织中的GSH-Px活性极显著降低,与de Cassia Santos Przepiura等(2019)对罗氏南极鱼(Nototheniarossii)、Ratko等(2022)对湖丽脂鲤(Astyanax lacustris)的研究结果相似。GSH-Px活性下降可能与生物体维持还原型谷胱甘肽与氧化型谷胱甘肽比值(GSH/GSSG)有关(Alak etal.,2017),且这种平衡对于维持机体内的氧化还原状态和细胞功能至关重要。谷胱甘肽可在许多代谢途径中被氧化(Iskusnykh et al.,2022)。在12℃低温胁迫下,草鱼鳃组织中的CAT、SOD和GSH-Px活性均升高,表明草鱼也受到氧化应激,但受到的氧化应激损伤远低于罗非鱼。
鳃组织是鱼类与水接触最密切的生理器官,像肠道组织一样通过表面黏膜相关淋巴组织中的淋巴细胞、嗜酸性粒细胞和巨噬细胞等,参与机体的免疫防御(罗智文等,2021)。由于鱼类长期生活在水中,体温变化较大,在免疫反应过程中主要依赖于固有免疫(非特异性免疫)机制(白姗姗等,2017)。在鱼类的免疫体系中,Toll样受体(TLR)扮演着重要角色,作为模式识别受体对识别和应对入侵病原体发挥着重要作用(Barton and Medzhitov,2003)。本研究中,Toll样受体信号通路相关基因BPI、MKK6和STAT1等在罗非鱼经历低温胁迫后极显著下调表达,复温至18℃后其相对表达量又基本恢复至初始水平,表明低温胁迫抑制了罗非鱼鳃组织的免疫功能,导致其免疫功能受损。已有研究表明,草鱼体内免疫活性在10℃时达到临界点,环境温度一旦下降至10℃以下其免疫反应能力显著减弱(郭帅等,2010)。本研究发现,在12℃低温胁迫下草鱼的Toll样受体信号通路相关基因并未完全发生变化,可能与尚未达到其临界免疫温度有关,与Basu等(2015)研究发现卡特拉鲃鱼(Catlacatla)在热胁迫下鳃组织中TLR4基因表达显著下调、Qi等(2017)研究发现花斑裸鲤(Gymnocypriseckloni)在急性缺氧时头肾和鳃组织中大多数Toll样受体基因(TLRs)表达显著下调的结果相似。促炎细胞因子IL-1β是炎症发生及组织严重损伤的主要指标之一(Huang et al.,2014;Gao et al.,2019),而细胞免疫因子IL-2可通过JAK-STAT信号通路促进T细胞和B细胞增殖及产生特异性抗体(Mu et al.,2023)。在本研究中,罗非鱼鳃组织中的IL-1β基因在低温胁迫后极显著上调表达,IL-2基因及其受体基因(CD122)则在低温胁迫后极显著下调表达,进一步证实低温胁迫激活了罗非鱼体内的炎症信号转导通路,导致其免疫过程受到抑制。
4结论
在低温胁迫下,氧化应激、细胞凋亡、免疫功能受损三者间的相互作用可能共同介导了罗非鱼鳃组织的损伤,且这种损伤不可逆转。在今后的罗非鱼抗寒工作中应以抗寒相关基因为分子标记,通过分子标记辅助育种加速抗寒品种(系)的培育。
参考文献(References):
白姗姗,贾智英,石连玉.2017.鱼类免疫应答机制研究进展[J].水产学杂志,30(4):59-67.[Bai S S,Jia Z Y,Shi L Y.2017.Research progress of immune response mecha‐nism in fish[J].Chinese Journal of Fisheries,30(4):59-67.]doi:10.3969/j.issn.1005-3832.2017.04.012
董雪晗,农孟松.2022.2021年12月25—27日广西寒潮天气过程分析[J].气象研究与应用,43(2):41-44.[Dong X H,Nong M S.2022.Analysis of cold wave weather pro‐cess in Guangxi from December 25 to 27,2021[J].Journal of Meteorological Research and Application,43(2):41-44.]doi:10.19849/j.cnki.CN45-1356/P.2022.2.07.
耿传业,孙言春,李博伦,丁璐,刘英杰,魏晓凤,刘文质,韩琳,袁芳英,王鹏,韩世成.2023.基于UPLC-Q-TOF/MS代谢组学探究虹鳟鳃对热应激的生理反应[J].水生生物学报,47(8):1185-1194.[Geng C Y,Sun Y C,Li B L,Ding L,Liu Y J,Wei X F,Liu W Z,Han L,Yuan F Y,Wang P,Han S C.2023.Physiological responses to heat stress in the gill of rainbow trout(Oncorhynchus mykiss)revealed based on UPLC-Q-TOF/MS metabolomics[J].Acta Hydrobiologica Sinica,47(8):1185-1194.]doi:10.7541/2023.2022.0447.
郭帅,李家乐,吕利群.2010.草鱼呼肠孤病毒的致病机制及抗病毒新对策[J].渔业现代化,37(1):37-42.[Guo S,Li J L,LüL Q.2010.Molecular pathogenesis of grass carp reovirus and novel anti-viral strategies[J].Fishery Moder-nization,37(1):37-42.]doi:10.3969/j.issn.1007-9580.2010.01.009.
胡玲红,王映,王化敏,陈良标.2021.不同温度胁迫对青鳉鳃凋亡的影响[J].大连海洋大学学报,36(6):929-936.[Hu L H,Wang Y,Wang H M,Chen L B.2021.Effects of different temperature stress on the gill apoptosis of medaka Oryziaslatipes[J].Journal of Dalian Fisheries University,36(6):929-936.]doi:10.16535/j.cnki.dlhyxb.2021-053.
江东能,焦开智,张峻铭,彭友幸,杨空松,郑德锋,郭向召,石红娟,李广丽.2022.罗非鱼性别控制遗传育种研究进展[J].广东海洋大学学报,42(2):148-156.[Jiang D N,Jiao K Z,Zhang J M,Peng Y X,Yang K S,Zheng D F,Guo X Z,Shi H J,Li G L.2022.A review of on genetic sex control breeding of tilapia[J].Journal of Guangdong Ocean University,42(2):148-156.]doi:10.3969/j.issn.1673-9159.2022.02.019.
李晨虹,李思发.1996.不同品系尼罗罗非鱼致死低温的研究[J].水产科技情报,23(5):195-198.[Li C H,Li S F.1996.Study on low lethal temperature of different strains of Nile tilapia(Oreochromis niloticus)[J].Fisheries Scien-ceamp;Technology Information,23(5):195-198.]doi:10.16446/j.cnki.1001-1994.1996.05.001.
李豫,黄建盛,陈有铭,温震威,欧光海,黄鉴鹏,蒋鑫涛,郭潮安,马骞,陈刚.2022.低温胁迫对军曹鱼幼鱼血清生化指标、肝脏抗氧化酶活性及凋亡相关基因表达量的影响[J].广东海洋大学学报,42(5):18-26.[Li Y,Huang J S,Chen Y M,Wen Z W,Ou G H,Huang J P,Jiang X T,Guo C A,Ma Q,Chen G.2022.Effects of low-temperaturestress on serum biochemical,antioxidant enzymes activi‐ties and apoptosis-related gene expression in liver of juve‐nile cobia(Rachycentron canadum)[J].Journal of Guang‐dong Ocean University,42(5):18-26.]doi:10.3969/j.issn.1673-9159.2022.05.003.
刘明丽,杨文意,王金凤,陈良标.2021.低温胁迫下鱼类鳃中RPL11/MDM2/P53信号通路相关基因及蛋白表达差异分析[J].大连海洋大学学报,36(1):51-56.[Liu M L,Yang WY,Wang J F,Chen L B.2021.Expression analysis of RPL11/MDM2/P53 pathway related gene and protein in gills of fish exposed to cold stress[J].Journal of Dalian Fisheries University,36(1):51-56.]doi:10.16535/j.cnki.dlhyxb.2020-008.
罗智文,董志祥,林连兵,张棋麟.2021.鱼类重要免疫器官抗菌机制的研究进展[J].水产科学,40(4):624-634.[Luo Z W,Dong Z X,Lin L B,Zhang Q L.2021.Advances on immunological mechanisms of important immune organs against pathogenic microorganisms in fish:A review[J].Fisheries Science,40(4):624-634.]doi:10.16378/j.cnki.1003-1111.19236.
岳苗,卫唯,高子韩,卫福磊,梁健.2024.青海湖裸鲤颗粒蛋白基因克隆及其参与盐碱适应机制研究[J].南方农业学报,55(5):1480-1492.[Yue M,Wei W,Gao Z H,Wei F L,Liang J.2024.Cloning of granulin gene in Gymnocyprisprzewalskii and its involvement in salinity-alkalinity adap‐tation mechanism[J].Journal of Southern Agriculture,55(5):1480-1492.]doi:10.3969/j.issn.2095-1191.2024.05.024.
赵立朝,吴志强,张曼,郑雄,李德越,刘博文.2019.广西南部主要水系野生罗非鱼建群状况调查分析[J].南方农业学报,50(2):397-404.[Zhao L C,Wu Z Q,Zhang M,Zheng X,Li D Y,Liu B W.2019.Establishment of wild tilapia population community in main rivers of southern Guangxi[J].Journal of Southern Agriculture,50(2):397-404.]doi:10.3969/j.issn.2095-1191.2019.02.26.
Alak G,Ucar A,Parlak V,YeltekinAÇ,TaşI H,Ölmez D,Kocaman E M,Yılgın M,Atamanalp M,Yanık T.2017.Assessment of 8-hydroxy-2-deoxyguanosine activity,gene expression and antioxidant enzyme activity on rainbow trout(Oncorhynchus mykiss)tissues exposed to biopesti‐cide[J].Comparative Biochemistry and Physio-logy,203:51-58.doi:10.1016/j.cbpc.2017.10.007.
Barton G M,Medzhitov R.2003.Toll-like receptor signaling pathways[J].Science,300(5625):1524-1525.doi:10.1126/science.1085536.
Basu M,Paichha M,Swain B,Lenka S S,Singh S,Chakrabarti R,Samanta M.2015.Modulation of TLR2,TLR4,TLR5,NOD1 and NOD2 receptor gene expressions and their downstream signaling molecules following thermal stress in the Indian major carp catla(Catlacatla)[J].3 Biotech,5:1021-1030.doi:10.1007/s 13205-015-0306-5.
Dang M,Pittman K,Sonne C,Hansson S,Bach L,Søndergaard J,Stride M,Nowak B.2020.Histological mucous cell quantification and mucosal mapping reveal different aspects of mucous cell responses in gills and skin of short‐hornsculpins(Myoxocephalusscorpius)[J].Fishamp;Shell‐fish Immunology,100:334-344.doi:10.1016/j.fsi.2020.03.020.
de Cassia Santos Przepiura T,Herrerias T,Kandalski P K,Zaleski T,Machado C,Forgati M,de Souza M R D P,Donatti L.2019.Metabolic responses in Antarctic Notothe‐niidae brains subjected to thermal stress[J].Brain Resea-rch,1708:126-137.doi:10.1016/j.brainres.2018.12.004.
Esam F,Khalafalla M M,Gewaily M S,Abdo S,Hassan A M,Dawood MA O.2022.Acute ammonia exposure combined with heat stress impaired the histological features of gills and liver tissues and the expression responses of immune and antioxidative related genes in Nile tilapia[J].Ecotoxi‐cology and Environmental Safety,231:113187.doi:10.1016/j.ecoenv.2022.113187.
Evans D H,Piermarini P M,Choe K P.2005.The multifunc‐tional fish gill:Dominant site of gas exchange,osmoregu‐lation,acid-base regulation,and excretion of nitrogenous waste[J].Physiological Reviews,85(1):97-177.doi:10.1152/physrev.00050.2003.
Gao X J,Tang B,Liang H H,Yi L,Wei Z G.2019.Selenium deficiency inhibits micRNA-146a to promote ROS-induced inflammation via regulation of the MAPK path‐way in the head kidney of carp[J].Fishamp;ShellfishImmu‐nology,91:284-292.doi:10.1016/j.fsi.2019.05.039.
Hu P,Liu M L,Liu Y M,Wang J F,Zhang D,Niu H B,Jiang S W,Wang J,Zhang D S,Han B S,Xu Q H,Chen L B.2016.Transcriptome comparison reveals a genetic network regulating the lower temperature limit in fish[J].Scientific Reports,6:28952.doi:10.1038/srep28952.
Huang D,Yang L B,Wang C L,Ma S H,Cui L,Huang S Y,Sheng X,Weng Q,Xu M Y.2014.Immunostimulatory activity of protein hydrolysate from Oviductus Ranae onmacrophagein vitro[J].Evidence-Based Complementary and Alternative Medicine,2014:180234.doi:10.1155/2014/180234.
Iskusnykh I Y,Zakharova A A,Pathak D.2022.Glutathione in brain disorders and aging[J].Molecules,27(1):324.doi:10.3390/molecules27010324.
Jeevitha K,Mohana Priya K,Khora S.2014.Antioxidant acti-vity of fish protein hydrolysates from Sardinella longiceps[J].International Journal of Drug Development and Re-search,6(4):137-145.
Klaiman J M,Fenna A J,Shiels H A,Macri J,Gillis T E.2011.Cardiac remodeling in fish:Strategies to maintain heart function during temperature change[J].PLoS One,6(9):e24464.doi:10.1371/journal.pone.0024464.
Mu P F,Teng Y,Wu H Y,Li X R,Huo J Y,Ao J Q,Chen X H.2023.Large yellow croaker(Lrimichthyscrocea)IL-2 mo-dulates humoral immunity via the conserved JAK-STAT5 signal pathway[J].Fishamp;Shellfish Immunology,133:108519.doi:10.1016/j.fsi.2023.108519.
Ndong D,Chen Y Y,Lin Y H,Vaseeharan B,Chen J C.2007.The immune response of tilapia Oreochromis mossambicus and its susceptibility to Streptococcus iniae under stress in low and high temperatures[J].Fishamp;Shellfish Immuno-logy,22(6):686-694.doi:10.1016/j.fsi.2006.08.015.
Nilsson G E.2007.Gill remodeling in fish—A new fashion or an ancient secret?[J].The Journal of Experimental Bio-logy,210(14):2403-2409.doi:10.1242/jeb.000281.
PavlovićS Z,BorkovićMitićS S,RadovanovićT B,Perendija B R,DespotovićS G,GavrićJ P,SaičićZ S.2010.Sea‐sonal variations of the activity of antioxidant defense enzymes in the red mullet(Mullus barbatus L.)from the Adriatic Sea[J].Marine Drugs,8(3):413-428.doi:10.3390/md8030413.
Qi D L,Xia M Z,Chao Y,Zhao Y L,Wu R R.2017.Identifica‐tion,molecular evolution of toll-like receptors in a Tibetan schizothoracine fish(Gymnocypriseckloni)and their ex-pression profiles in response to acute hypoxia[J].Fishamp;Shellfish Immunology,68:102-113.doi:10.1016/j.fsi.2017.07.014.
Qiang J,Wang H,Kpundeh M D,He J,Xu P.2013.Effect of water temperature,salinity,and their interaction on growth,plasma osmolality,and gill Na+,K+-ATPase acti-vity in juvenile GIFT tilapia Oreochromis niloticus(L.)[J].Journal of Thermal Biology,38(6):331-338.doi:10.1016/j.jtherbio.2013.04.002.
Ratko J,da Silva N G,da Silva D O,Corrêa A P N,Pereira D M C,Schleger I C,NeundorfA K A,Herrerias T,Corso C R,de Souza M R D P,Donatti L.2022.Can high-and low-temperature thermal stress modulate the antioxidant defense response of Astyanax lacustris brain?[J].Brain Research,1797:148118.doi:10.1016/j.brainres.2022.14 8118.
Shi M J,Zhang Q X,Li Y M,Zhang W T,Liao L J,Cheng Y Y,Jiang Y X,Huang X L,Duan Y,Xia L,Ye W D,Wang Y P,Xia X Q.2020.Global gene expression profile under low-temperature conditions in the brain of the grasscarp(Ctenopharyngodonidellus)[J].PLoS One,15(9):e0239730.doi:10.1371/journal.pone.0239730.
Sollid J,de Angelis P,Gundersen K,Nilsson G E.2003.Hypoxia induces adaptive and reversible gross morphologi‐cal changes in crucian carp gills[J].The Journal of Expe-rimental Biology,206(20):3667-3673.doi:10.1242/jeb.00594.
Sollid J,Kjernsli A,de Angelis P M,RøhrÅK,Nilsson G E.2005a.Cell proliferation and gill morphology in anoxic crucian carp[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,289(4):R1196-R1201.doi:10.1152/ajpregu.00267.2005.
Sollid J,Nilsson G E.2006.Plasticity of respiratory struc‐tures—Adaptive remodeling of fish gills induced by am-bient oxygen and temperature[J].Respiratory Physiologyamp;Neurobiology,154(1-2):241-251.doi:10.1016/j.resp.2006.02.006.
Sollid J,Weber R E,Nilsson G E.2005b.Temperature alters the respiratory surface area of crucian carp Carassius carassius and goldfish Carassius auratus[J].Journal of Experimental Biology,208(6):1109-1116.doi:10.1242/jeb.01505.
Sun J,Wu W Y,Ji H.2021.Effect of overwintering on body composition,antioxidant enzyme activities,fatty acid composition,glucose and lipid-metabolic related gene expression of grass carp(Ctenopharyngodonidellus)[J].Aquaculture,545:737125.doi:10.1016/j.aquaculture.2021.737125.
van den Burg E H,Peeters R R,Verhoye M,Meek J,Flik G,van der Linden A.2005.Brain responses to ambient tem‐perature fluctuations in fish:Reduction of blood volume and initiation of a whole-body stress response[J].Journal of Neurophysiology,93(5):2849-2855.doi:10.1152/jn.01113.2004.
Wang H M,Wang Y,Niu M H,Hu L H,Chen L B.2022.Cold acclimation for enhancing the cold tolerance of zebrafish cells[J].Frontiers in Physiology,12:813451.doi:10.3389/fphys.2021.813451.
Wu M,Chen N,Huang C X,He Y,Zhao Y Z,Chen X H,Chen X L,Wang H L.2017.Effect of low temperature on globin expression,respiratory metabolic enzyme activities,and gill structure of Litopenaeusvannamei[J].Biochemistry,82(7):844-851.doi:10.1134/S0006297917070100.
Xu Z H,Regenstein J M,Xie D D,Lu W J,Ren X C,Yuan J J,Mao L C.2018.The oxidative stress and antioxidant responses of Litopenaeusvannamei to low temperature and air exposure[J].Fishamp;Shellfish Immunology,72:564-571.doi:10.1016/j.fsi.2017.11.016.
Zhou Y,Zhang Y J,Wei S,Li W,Li W H,Wu Z C,Jiang S W,Lu Y,Xu Q H,Chen L B.2022.Reduced hypoxia tole-rance and altered gill morphology at elevated temperatures may limit the survival of tilapia(GIFT,Oreochromis nilo-ticus)under global warming[J].Fishes,7(5):216.doi:10.3390/fishes7050216.
(责任编辑兰宗宝)

