KillerRed介导消除鸡原始生殖细胞的研究





摘要:【目的】构建特异性表达KillerRed(KR)的鸡原始生殖细胞系(PGCs),为制备生殖细胞可消除的受体鸡胚和提高外源PGCs在嵌合体中的基因传递效率提供理论参考。【方法】利用hyPBase转座酶将KR整合到鸡胚成纤维细胞系(DF-1)基因组中,建立稳定表达CAG-KR-EGFP的DF-1细胞系(KR-DF-1)。利用绿光照射细胞,台盼蓝染色检测DF-1的消除效率。采用CRISP/Cas9系统将KR定点敲入到鸡生殖细胞水平的PGCs中DAZL基因的第11号外显子中,建立生殖细胞特异表达DAZL-KR-EGFP的PGCs细胞系(KR-PGCs)。利用绿光照射细胞,台盼蓝染色检测PGCs消除效率。实时荧光定量PCR检测生殖细胞特异性表达基因的相对表达量。显微注射KR-PGCs到受体鸡胚,孵化产生嵌合体后代,PCR检测嵌合体后代精液中是否含有KR。【结果】成功构建KR-DF-1,与野生型DF-1相比,细胞增殖无显著差异(Pgt;0.05,下同);绿光照射后,KR-DF-1死亡率极显著升高(Plt;0.01,下同);成功构建KR-PGCs,绿光照射后,KR-PGCs死亡率极显著升高,细胞核呈破碎状;绿光照射12 h,KR-PGCs中SOD2和CAS3基因相对表达量极显著升高;细胞计数结果显示,KR-PGCs在绿光照射后出现负增长;KR-PGCs的特异性基因DAZL、DDX4、Pou5f3、NANOG和DNA1正常表达,仍具有迁移定植到性腺的能力,且性成熟嵌合体公鸡精液能产生含KR的精液。【结论】成功构建了在DAZL基因位点特异性表达KR的KR-GCs细胞系,且绿光照射后可特异性消除KR-PGCs。通过显微注射成功获得了含有KR-PGCs且能产生含KR精液的嵌合体后代。
关键词:鸡;原始生殖细胞;KillerRed;特异性消除;嵌合体
中图分类号:S831.49文献标志码:A文章编号:2095-1191(2024)10-3136-11
Research on KillerRed-mediated elimination of chickenprimordial germ cells
ZHANG Jia-le,HUANG Zhen-wen,JIA Xiao-xuan,PENG Yu-lin,WEN Jing-er,JI Na,XU Hui-yan,LIU Xing-ting,RAN Ming-xia,LU Yang-qing*
(College of Animal Science and Technology,Guangxi University/Guangxi Key Laboratory of Livestock and PoultryBreeding and Disease Prevention and Control,Nanning,Guangxi 530004,China)
Abstract:【Objective】To construct a chicken primordial germ cell line(PGCs)that specifically expressed KillerRed(KR)in order to provide theoretical reference for preparing germ cell-eliminable recipient chicken embryos and impro-ving the gene transfer efficiency of exogenous PGCs in chimeras.【Method】KR was integrated into the genome of chicken embryo fibroblast cell line(DF-1)using hyPBase transposase,and a DF-1 cell line(KR-DF-1)stably expressing CAG-KR-EGFP was established.The cells were irradiated with green light,and the elimination efficiency of DF-1 was detected by Trypan blue staining.KR was site-specifically knocked into exon number 11 of the DAZL gene in PGCs at the chicken germ cell level using the CRISP/Cas9 system,and a PGCs cell line(KR-PGCs)specifically expressing DAZL-KR-EGFPin germ cells was established.After irradiating the cells with green light,the elimination efficiency of PGCs was detected by Trypan blue staining.Real-time fluorescence quantitative PCR was used to detect the relative expression of genes spe-cifically expressed in germ cells.KR-PGCs were microinjected into recipient chicken embryos,and were hatched to pro-duce chimeric offspring.PCR was used to detect whether the semen of chimeric offspring contained KR.【Result】KR-DF-1was successfully constructed.Compared with wild-type DF-1,there was no significant difference in cell proliferation(Pgt;0.05,the same below).After green light irradiation,the death rate of KR-DF-1 was extremely significantly increased(Plt;0.01,the same below).KR-PGCs were successfully constructed.After green light irradiation,the mortality rate of KR-PGCs was extremely significantly higher than that of other groups.After green light irradiation,the nuclei were frag-mented.After green light irradiation for 12 h,the relative expression levels of SOD2 and CAS3 genes in KR-PGCs were extremely significantly increased;cell counting results showed that KR-PGCs showed negative growth after green light ir-radiation;the specific genes DAZL,DDX4,Pou5f3,NANOG and DNA1 of KR-PGCs were normally expressed,andthey still had the ability to migrate and colonize to the gonads,and the semen of sexually mature chimeric roosters could produce semen containing KR.【Conclusion】The KR-PGCs cell line which expresses specifically at the DAZL gene loci issuccessfully constructed,and KR-PGCs can be specifically eliminated after green light irradiation.Throughmicroinjec-tion,chimeric offspring with KR-PGCs in the gonads and capable of producing KR sperm are successfully obtained.
Key words:chicken;primordial germ cells;KillerRed;specific elimination;chimera
Foundation items:National Key Research and Development Program of China(2021YFD1300100)
0引言
【研究意义】禽类具有特殊的生殖系统和胚胎发育方式,操作受精卵产生基因编辑鸡具有一定挑战性,常用于生产基因编辑鸡的方法有逆转录病毒载体法(Bosselman et al.,1989)、原始生殖细胞(Primor-dial germ cells,PGCs)介导法(Vick et al.,1993)和DNA显微注射法(Love et al.,1994)等。随着PGCs体外培养体系的不断优化,越来越多有利于维持PGCs干性和种系传递能力的特定因子及有利于提高培养基支持性的物质被添加到培养体系中(Naito et al.,2015;Whyte et al.,2015;Chen et al.,2018;Szc-zerbaetal.,2020;Dehdilani et al.,2023)。研究表明,富集培养基能增强PGCs特异性标记物和转录因子的表达,提高PGCs的增殖效率,可用于体外长期培养PGCs,且不影响PGCs迁移并定植到性腺的能力(Dehdilani et al.,2023)。高效的扩增体系有利于缩短细胞培养时间,维持PGCs原有的特性和迁移能力,进而提高产生嵌合体的效率。外源PGCs注射到受体鸡胚后会与内源PGCs竞争生存物质和空间,导致外源PGCs定植到性腺的效率下降(Qin et al.,2024),限制了PGCs介导的基因编辑技术在制备基因编辑鸡领域中的应用。减少内源PGCs是提高外源PGCs在受体鸡胚性腺中定植效率和嵌合体鸡产生外源配子概率的途径之一(Ballantyneetal.,2021)。因此,制备能特异性消除内源PGCs的受体鸡对提高PGCs介导的基因编辑鸡的制备具有重要意义。【前人研究进展】常用的消除内源PGCs的方法有伽马射线照射法、白消安处理法和通过基因编辑在生殖细胞中引入自杀基因等。其中,伽马射线照射法会显著降低胚胎孵化率,白消安处理法存在致死、不育和胚胎畸形等副作用(Bishop and Wassom,1986)。因此,在生殖细胞中引入自杀基因是特异性最高、副作用最小的内源生殖细胞消除方法。生殖细胞中DEAD-Box解旋酶4(DEAD-Box helicase 4,DDX4)基因属于鸡Vasa同源物(CVH),对其谱系的形成至关重要,利用类转录激活子效应核酸酶(Transcription activator-like effector nuclease,TALEN)介导的DDX4基因大型缺失会导致雌性PGCs发育异常和卵巢不育(Taylor et al.,2017);DAZL基因位点表达caspase-9蛋白与FK506结合蛋白(FKBP),并通过药物诱导FKBP二聚化,随后激活相邻的caspase-9蛋白能特异性诱导内源PGCs凋亡(Ballantyneetal.,2021);利用CRISPR-Cas12a(Cpf1)家族核酸酶MAD7打靶DDX4基因能造成DNA双链断裂,在引入硝基还原酶(Nitroreductase,NTR)基因后能产生NTR基因编辑鸡,在NTR基因编辑鸡胚中同时注射外源PGCs和甲硝唑(Metronidazole,Mtz)能显著促进内源PGCs凋亡,增加性腺中外源PGCs占比(Chen et al.,2023)。这些研究为特异性消除内源PGCs和提高种系嵌合体效率提供了新策略,但均需添加外源药物,可能会影响鸡胚的正常发育(Berg etal.,1999;Carere and Balthazart,2007)。【本研究切入点】Kill-erRed(KR)是一种由水螅色素蛋白anm2CP(与绿色荧光蛋白同源)进一步开发而成的荧光蛋白(Bulina et al.,2006)。KR具有光毒性,受到绿光照射后能通过I型光动力反应与氧分子相互作用而形成超氧阴离子O2-,进而产生活性氧(Reactive oxygen species,ROS)并激活细胞凋亡相关通路(Carpentier et al.,2009;Pletnevetal.,2009);但KR的光毒性效应不会扩散到邻近细胞(Kobayashi et al.,2013;Williamset al.,2013)。因此,KR介导的内源PGCs消除方法无需添加外源药物,是一种较理想的消除内源PGCs的手段,而利用KR的光毒性消除鸡细胞系或特异性消除鸡PGCs的研究鲜见报道。【拟解决的关键问题】在鸡胚成纤维细胞系(DF-1)水平上验证KR光毒性可普遍应用于消除鸡细胞系,利用CRISPR/Cas9系统构建生殖细胞水平上特异性表达KR的PGCs细胞系,探究KR光毒性能否用于特异性消除鸡PGCs,进而通过PGCs移植制备PGCs特异性表达KR的嵌合体后代,为制备绿光照射消除内源PGCs的鸡胚模型提供理论参考。
1材料与方法
1.1试验材料
DF-1购自ATCC细胞库,鸡PGCs源自本课题组前期分离培养的PGCs细胞系(Xie et al.,2019)。主要试剂:DL2000 DNA Marker、DL5000 DNA Marker、限制性内切酶BamH I和Mlu I、Xfect质粒转染试剂盒购自日本TaKaRa公司;DNA提取试剂盒、DNA纯化回收试剂盒购自天根(北京)生化科技有限公司;PCR预混试剂、RT-qPCR预混试剂、RNA反转录试剂盒购自北京全式金生物技术股份有限公司;总RNA提取试剂盒、无内毒素质粒提取试剂盒购自美国Omega公司;0.4%台盼蓝购自北京索莱宝科技有限公司;DMRIE-C转染试剂购自美国Invitrogen公司;0.05%胰蛋白酶-EDTA购自美国ThermoFisher Scientific公司;DMEM高糖液体培养基购自武汉博士德生物工程有限公司。主要仪器设备:血球计数板购自上海求精生化试剂仪器有限公司;400 mW/cm2 531 nm绿色激光器购自井冈山市龙市镇宏都超耐电子。
1.2试验方法
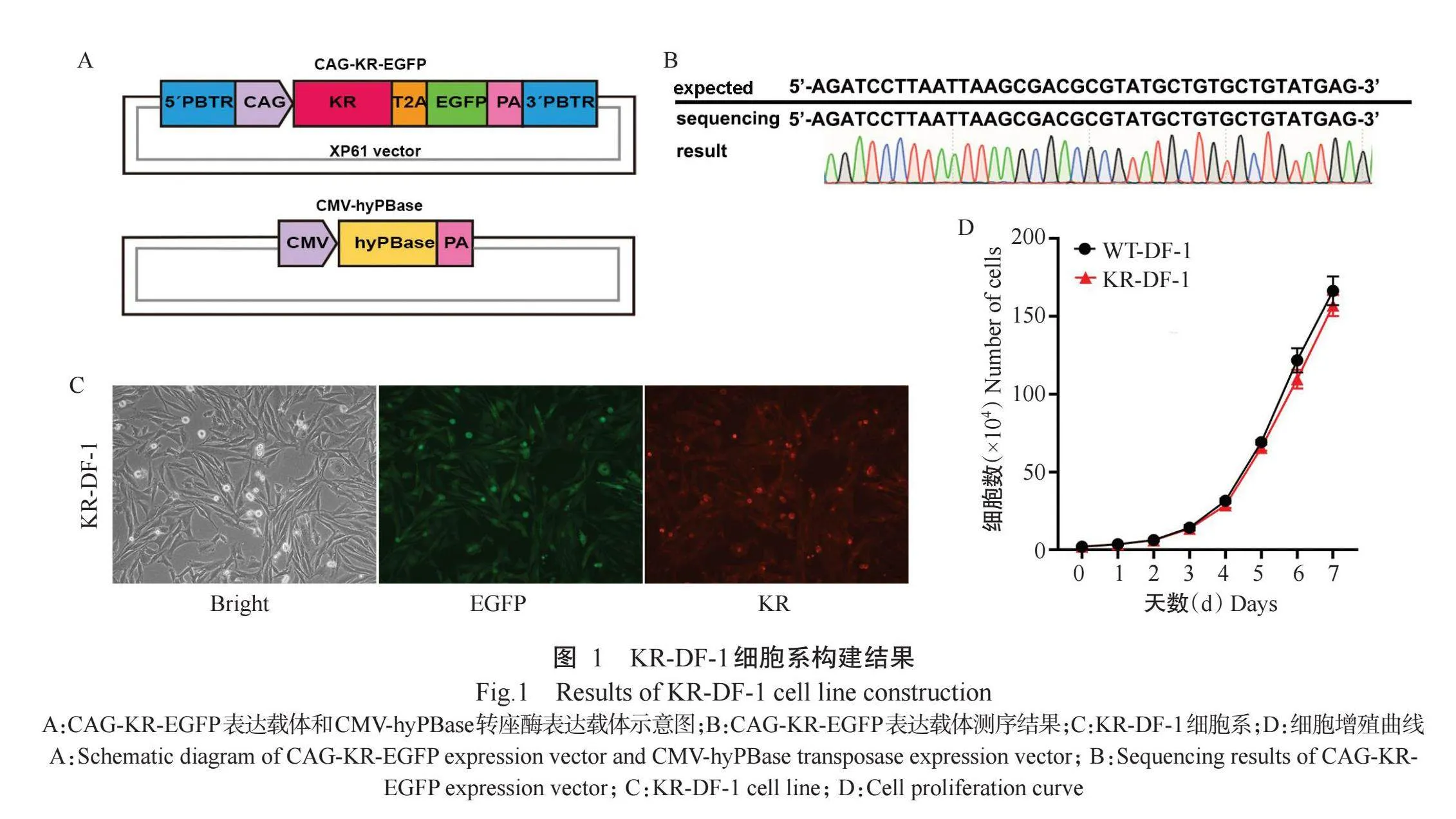
1.2.1表达载体构建本研究中,光照处理组记为Light,对照组记为Cont。带有质膜定位信号的KR基因委托深圳华大基因科技有限公司合成。CMV-hyPBase转座酶表达载体由本课题组保存。DF-1细胞采用hyPBase转座酶系统随机整合插入KR载体,相关载体构建:利用Mlu I和BamH I将XP61载体进行双酶切,并将KR片段与XP61骨架相连接,最终获得CAG-KR-EGFP表达载体。PGCs使用CRISPR/Cas9系统定点敲入KR供体,相关载体构建:利用EcoR V将pMD18-T载体进行单酶切,通过In-Fusion克隆方案在KR片段前后各设计与载体同源的15 bp,并将KR片段克隆到pMD18-T载体上,最终获得DAZL-KR-EGFP表达载体。靶向定位鸡原始生殖细胞标志基因DAZL的sgRNA设计:参考NCBI数据库中鸡DAZL基因序列数据(Gene ID:374054),针对DAZL基因的11号外显子设计用于CRISPR/Cas9系统敲入的sgRNA表达载体。测序均委托深圳华大基因科技有限公司完成,利用SnapeGene进行序列比对。
1.2.2细胞系建立与纯化利用Xfect质粒转染试剂盒将CAG-KR-EGFP和CMV-hyPBase表达载体转染DF-1细胞。利用DMRIE-C转染试剂盒将DAZL-KR-EGFP和sgRNA表达载体转染鸡PGCs。转染后DF-1细胞和PGCs均同时呈现红色荧光和绿色荧光,利用显微镜观察转染效率。持续培养14 d后,利用流式细胞仪分选带有荧光的阳性细胞,继续培养建系以获得稳定表达CAG-KR-EGFP的DF-1细胞系(KR-DF-1)和稳定表达DAZL-KR-EGFP的PGCs细胞系(KR-PGCs)
1.2.3 RNA提取与实时荧光定量PCR检测收集野生型PGCs(WT-PGCs)和KR-PGCs细胞悬液,利用总RNA提取试剂盒提取细胞总RNA,采用RNA反转录试剂盒反转录成cDNA。反转录体系20μL:RNA 500 ng,2×ES Reaction Mix 10μL,EasyScript®RT/RI Enzyme Mix 1μL,gDNA Remover 1μL,Ran-dom Primer 1μL,RNase-free H2O补足至20μL。反转录程序:25℃10 min;42℃30 min;85℃5 s。PCR反应体系20μL:cDNA模板10 ng,2×Easy Taq®PCRSuperMix 10μL,上、下游引物各1μL,ddH2O补足至20μL。PCR扩增程序参照2×Easy Taq®PCRSuperMix试剂盒说明设定。实时荧光定量PCR反应体系20μL:cDNA模板10 ng,上、下游引物各1μL,2×PerfectStart®Green qPCR SuperMix 10μL,ddH2O补足至20μL。实时荧光定量PCR反应程序参照PerfectStart®Green qPCR SuperMix试剂盒说明设定。以ACTB为内参基因,采用2-ΔΔCt法计算目的基因相对表达量。扩增引物序列信息见表1。
1.2.4细胞照射利用20倍物镜下汞灯绿光照射PGCs和DF-1细胞,分别照射10、20和40 min。照射前后采集图像,统计红色荧光细胞数量。采用400 mW/cm2 531 nm绿色激光器进行细胞淬灭照射。PGCs照射程序:将PGCs重悬为密度为2×106个/mL的细胞悬液,吸取100μL至96孔细胞培养板,照射6 h。DF-1细胞照射程序:将DF-1细胞重悬至密度为3×106个/mL的细胞悬液;吸取100μL细胞悬液至96孔细胞培养板中照射12 h。照射前后采集图像,分析照射对PGCs和DF-1细胞活性的影响。
1.2.5细胞计数采用血球计数板进行细胞计数,步骤如下:无水乙醇擦洗计数板,风干后盖上盖玻片;吸取10μL 1.2.4中的PGCs和DF-1细胞悬液滴加到细胞计数板中;10倍物镜下统计计数室边缘四大象限内的细胞数量;4个象限内细胞数量的平均值记为1次重复,压线细胞记录左侧和上侧的细胞数量,重复3次。细胞密度按照以下公式计算:
细胞密度(个/mL)=4个象限方格细胞平均数×104。1.2.6细胞染色利用台盼蓝染色统计细胞死亡率,步骤如下:0.4%台盼蓝与细胞悬液按1∶9比例混匀(台盼蓝工作浓度为0.04%);染色5min后吸取10μL悬液到血细胞计数板中进行细胞计数。细胞死亡率按照以下公式计算:
细胞死亡率(%)=死亡细胞数/总细胞数×100
采用Hoechst 33342进行细胞核染色,步骤如下:细胞照射后,1500 r/min离心3 min;收集细胞并加入Hoechst 33342重悬染色10 min;离心后弃上清液,100μL培养液重悬细胞;吸取10μL悬液滴加到载玻片上,显微镜下采集图像;细胞核不圆润、松散、破碎的记为阳性细胞。阳性细胞率按照以下公式计算:
阳性细胞率(%)=阳性细胞数/总细胞数×100
1.2.7细胞显微注射PGCs显微注射步骤如下:收集细胞悬液,1500 r/min离心3 min,弃上清液;培养液重悬并计数;调整细胞密度,加入10%台盼蓝混匀;吸取100μL混液滴加到培养皿上形成细胞液滴;加入矿物油密封细胞液滴;细胞静置沉淀10min;在消毒后孵化2.5 d的鸡胚气室上开洞,镊子撕掉蛋壳薄膜;显微注射1×104个细胞至鸡胚心脏中;滴加含青链霉素的PBS,石蜡膜密封继续孵化;孵化10.5 d时解剖部分鸡胚分离性腺,显微镜下观察;其余鸡胚继续孵化。
1.2.8精液PCR检测利用背部按摩法人工采集公鸡精液于1.5 mL微量离心管中,混匀后吸取10μL提取DNA进行PCR。PCR反应体系与扩增程序同1.2.3,KR精液鉴定引物F:5'-AGGCACCTGTACTGT GAAACC-3',R:5'-GAACTTCTGGCCGTTCACCT-3',扩增片段长度383bp。
1.3统计分析
使用GraphPad Prism 10.0对试验数据进行统计分析并制图,采用单因素方差分析(One-way ANOVA)进行差异显著性分析。
2结果与分析
2.1 KR-DF-1细胞系构建结果
将KR片段插入含CAG启动子的XP61骨架中,构建持续表达KR的表达载体CAG-KR-EGFP(图1-A)。对构建的CAG-KR-EGFP表达载体进行测序,测序结果显示,表达载体中包含KR序列,表明载体构建成功(图1-B)。随后,将CAG-KR-EGFP表达载体转染DF-1细胞,转染14 d后通过流式细胞分选仪分选出稳定转染的DF-1细胞,继续培养以获得纯化的KR-DF-1(图1-C)。绘制KR-DF-1细胞和野生型DF-1(WT-DF-1)细胞增殖曲线,结果(图1-D)显示,2种细胞增殖曲线基本一致,无显著差异(Pgt;0.05,下同)。表明KR的整合不影响DF-1细胞的正常增殖。
2.2绿光照射对消除KR-DF-1的影响
为验证绿光照射能否选择性消除KR-DF-1,将WT-DF-1与KR-DF-1按1∶1比例混养,并在20倍物镜下汞灯绿光照射。细胞形态观察结果显示,随着照射时间的增加,KR-DF-1细胞形态收缩,一些原本贴壁的细胞逐渐悬浮并汇聚成细胞团(图2-A),且KR-DF-1的红色荧光细胞占比极显著降低(Plt;0.01,下同)(图2-B)。20倍镜下汞灯只能照射到少部分贴壁细胞,为更准确获得绿光照射下KR-DF-1的消除效率,采用具有更大照射面积(400 mW/cm2、531 nm)的绿色激光器照射,结果显示,在531 nm绿光下照射12h后,KR-DF-1的红色荧光几乎完全淬灭(图2-C);台盼蓝染色结果显示,KR-DF-1 Light组死亡细胞占比极显著高于Cont组(图2-D),与红色荧光淬灭结果相符。表明绿光照射能有效消除KR-DF-1。
2.3 KR-PGCs细胞系构建结果
DAZL基因在迁移的PGCs和性腺生殖细胞中均高度表达(Kito etal.,2010;Lee et al.,2016),为获得特异性表达KR的PGCs,通过CRISPR/Cas9系统将DAZL-KR-EGFP表达载体敲入到DAZL基因的第11号外显子中以构建KR-PGCs(图3-A)。稳定转染PGCs后采用流式细胞仪分选纯化KR-PGCs并继续培养,建立KR-PGCs细胞系,结果显示,KR-PGCs细胞均带有红色荧光(图3-B)。提取KR-PGCs细胞系总RNA,对插入位点含有KR供体的左右同源臂进行PCR检测和测序分析,结果显示,扩增获得条带大小约为250和150bp,与预期结果相符(左同源臂233 bp和右同源臂159bp)。测序结果也显示插入位点含有预期的KR供体序列(图3-C)。表明KR-PGCs细胞系构建成功。
2.4绿光照射对消除KR-PGCs的影响
显微镜下观察绿光照射对KR-PGCs红色荧光淬灭的影响,结果(图4-A)显示,KR-PGCs经400mW/cm2、531 nm的绿色激光器照射6h后,KR的红色荧光几乎完全淬灭。台盼蓝染色统计绿光照射后不同时间点KR-PGCs的死亡率,结果(图4-B)显示,随着时间的增加,KR-PGCs死亡率逐渐增加,光照12和24 h的死亡率极显著高于其他组。统计绿光照射后细胞的数量变化并分析绿光照射对细胞增殖的影响,结果(图4-C)显示,KR-PGCs Light组细胞数在第2 d显著少于KR-PGCs Cont组(Plt;0.05,下同),第4和6d细胞数量均极显著低于其他组,其他组间细胞增殖趋势相近且无显著差异,表明绿光照射对KR-PGCs增殖存在负面影响。此外,在0~6 d,WT-PGCs Cont组和KR-PGCs Cont组细胞数差异不显著,表明KR的敲入不影响PGCs增殖。细胞凋亡率统计结果显示,绿光照射后,KR-PGCs Light组细胞凋亡率极显著高于KR-PGCs Cont组、WT-PGCs Cont组和WT-PGCs Light组(图4-D),且核碎片化程度加重(图4-E)。实时荧光定量PCR结果(图4-F和4-G)显示,绿光照射12 h,KR-PGCs Light组抗氧化基因SOD2和促凋亡基因CAS3的相对表达量均极显著高于其他组。表明绿光照射能有效消除KR-PGCs。
2.5 KR-PGCs定植到性腺与生精能力验证结果
PCR结果显示,KR-PGCs和WT-PGCs中的PGCs特异性基因DAZL、DDX4、Pou5f3、NANOG、DND1在mRNA水平均有表达,而体细胞水平的WT-DF-1未见表达(图5-A),表明KR-PGCs能表达生殖细胞特异性基因。将KR-PGCs移植到受体鸡胚中,鉴定KR-PGCs的迁移能力。结果显示,将带红色荧光和绿色荧光的KR-PGCs注射到受体鸡胚的血液循环系统后,能在受体鸡胚性腺中观察到颗粒分明的细胞荧光(图5-B),表明KR-PGCs仍具备迁移并定植到性腺的能力。此外,同一批注射的鸡胚成功孵化获得生殖细胞特异性表达KR的嵌合体后代(图5-C)。精液PCR鉴定结果表明,性成熟的KR嵌合体公鸡可产出含有KR的精液(图5-D)。
3讨论
随着PGCs体外培养体系和移植技术的优化(秦洁等,2006;陈美娟等,2016;Dehdilani et al.,2023),PGCs介导的基因编辑技术逐渐成熟(Kim et al.,2023)。由于受体鸡胚PGCs的内源竞争,移植的外源PGCs存在种系遗传效率低等问题,限制了PGCs介导的基因编辑技术在制备基因编辑鸡领域中的应用。因此,制备内源PGCs消除的基因编辑鸡模型有利于提高外源移植PGCs的嵌合体效率。研究发现,通过基因编辑技术引入自杀基因是目前较理想的内源PGCs消除方法,包括通过二聚化配体激活的iCaspase9介导法(Ballantyne et al.,2021;孙玲玲,2023)和通过甲硝唑激活的NTR介导法(Chen et al.,2023)等,这些方法均是通过药物传递系统选择性诱导细胞凋亡坏死,进而达到消除内源PGCs的目的。但外源药物的添加会影响胚胎的正常生长发育(Berg etal.,1999;Carere and Balthazart,2007)。KR可通过照射绿光产生有限空间范围的ROS(Kobayashi et al.,2013;Williamset al.,2013),利用该特点能特异性消除内源PGCs,且不损伤邻近细胞。
鸡体细胞水平的永生化鸡胚成纤维细胞系DF-1具有更低的培养成本和更高的转染效率,能快速在体细胞水平验证KR光毒性效应是否能用于鸡细胞系的消除。研究表明,长时间低强度光照能使表达KR的细胞出现凋亡特征,而短时间高强度的光照则会导致细胞直接坏死(Serebrovskaya et al.,2014)。本研究中,通过hyPBase转座酶系统完成了KR在鸡体细胞DF-1基因组上的整合,使KR在DF-1的基因组中出现多个拷贝数,CAG持续表达的启动子也加强了KR的表达水平。此外,定点在鸡生殖细胞PGCs的DAZL基因敲入KR,KR在PGCs的基因组中表达量最多为2个拷贝。研究发现,通过充分的绿光照射淬灭KR的荧光,可充分发挥KR的ROS毒性(Bulina et al.,2006)。本研究中,KR-DF-1在红色荧光淬灭后0 h直接死亡,而KR-PGCs则是在红色荧光淬灭后0、12和24 h细胞死亡率逐渐增加。在绿光照射时,KR-PGCs细胞数量呈现第2 d先增长,第4 d后负增长和第6d再增长趋势,可能是由于绿光照射细胞数量过多,所使用的培养基能促进体外培养4~6 d的PGCs快速增殖(Xie et al.,2019),导致部分未凋亡坏死的细胞仍能恢复增殖所致。光照后的KR-PGCs细胞核呈现破碎状态,出现凋亡的特征(Cummings and Schnelmann,2021),提示部分细胞可能通过细胞凋亡途径被消除。
本研究发现,绿光照射后极显著提高了KR-PGCs的死亡率、抑制了其增殖活性并增加了CAS3和SOD2基因的相对表达量。CAS3是细胞凋亡相关基因,参与多个细胞凋亡途径的调节。在细胞凋亡过程中,caspase-9作为高度特异性蛋白酶只切割有限的蛋白,而caspase-3和caspase-7参与大部分蛋白的切割(Slee et al.,1999);KR在绿光照射后能通过增强细胞色素C/caspase-3信号通路激活细胞凋亡(Li et al.,2019)。本研究与Li等(2019)的研究结果相符,表明KR介导的细胞自杀体系也能应用于内源PGCs的消除。超氧化物歧化酶(SOD)是细胞中主要的抗氧化酶,在清除超氧化物过程中起重要作用(Miao and Clair,2009),SOD2是SOD家族成员,主要存在于线粒体基质中(Slot et al.,1986)。本研究结果表明,绿光照射12h后,KR-PGCs中SOD2基因相对表达量极显著上调,提示KR-PGCs可能产生了氧化损伤,部分细胞可能通过抗氧化机制保护自身免受KR光毒性效应带来的损伤。研究表明,caspase-3是有效杀死细胞的caspase效应器,可抑制ROS的产生(Brentnall et al.,2013),在绿光照射12 h后,KR-PGCs中促凋亡的CAS3基因相对表达量极显著升高,可能是绿光照射增强了KR-PGCs的氧化损伤,进而导致了细胞凋亡。
利用KR的光毒性效应诱导细胞凋亡已应用在光动力疗法领域(Liu et al.,2021),但利用KR诱导消除受体鸡胚内源PGCs的研究鲜见报道。本研究通过在生殖细胞特异性基因DAZL的第11号外显子末端插入KR成功构建了特异性表达KR的PGCs细胞系,且KR的敲入不影响PGCs的正常增殖活性和生殖细胞特性基因的表达。证明了充分照射绿光后能有效减少KR-PGCs的数量,最后对KR-PGCs进行移植获得PGCs特异性表达KR的嵌合体公鸡,且KR嵌合体公鸡能正常产生含KR的精液,为制备PGCs特异性表达KR的纯合子基因编辑鸡奠定了基础。
4结论
成功构建了在DAZL基因位点特异性表达KR的KR-GCs细胞系,且绿光照射后可特异性消除KR-PGCs。通过显微注射成功获得了含有KR-PGCs且能产生含KR精液的嵌合体后代。
参考文献(References):
陈美娟,陈东阳,谢龙,陆振萍,杨蒙蒙,莫丽芬,卢克焕,陆阳清.2016.受体胚龄对鸡原始生殖细胞移植后归巢的影响[J].南方农业学报,47(6):1014-1018.[Chen M J,Chen D Y,Xie L,Lu Z P,Yang M M,Mo L F,Lu K H,Lu Y Q.2016.Effect of recipient embryos age on homing of chicken primordial germ cell after transplantation[J].Jour-nal of Southern Agriculture,47(6):1014-1018.]doi:10.3969/j:issn.2095-1191.2016.06.1014.
秦洁,蔡琳琳,李碧春,韩威,周冠月,吴宏,孙思宇.2006.鸡胚胎原始生殖细胞的体外培养[J].中国兽医学报,26(4):444-447.[Qin J,Cai L L,Li B C,Han W,Zhou G Y,Wu H,Sun S Y.2006.In vitro culture of chicken embryo-nic primordial germ cells[J].Chinese Journal of Veteri-nary Science,26(4):444-447.]doi:10.3969/j.issn.1005-4545.2006.04.031.
孙玲玲.2023.利用iCaspase9特异性诱导鸡原始生殖细胞消除的研究[D].南宁:广西大学.[Sun LL.2023.Studyon the specific induction of elimination of chicken primordial germ cell by iCaspase9[D].Nanning:Guangxi University.]doi:10.27034/d.cnki.ggxiu.2023.002714.
Ballantyne M,Woodcock M,Doddamani D,Hu T J,Taylor I,Hawken R J,McGrew M M.2021.Direct allele introgres-sion into pure chicken breeds using Sire Dam Surrogate(SDS)mating[J].Nature Communications,12(1):659.doi:10.1038/s41467-020-20812-x.
Berg C,Halldin K,Fridolfsson A K,Brandt I,Brunström B.1999.The avian egg as a test system for endocrine disrup-ters:Effects of diethylstilbestrol and ethynylestradiol on sex organ development[J].Science of the Total Environ-ment,233(1-3):57-66.doi:10.1016/s0048-9697(99)00179-5.
Bishop J B,Wassom J S.1986.Toxicological review of busul-fan(Myleran)[J].Mutation Research,168(1):15-45.doi:10.1016/0165-1110(86)90020-5.
Bosselman RA,Hsu R Y,Boggs T,Hu S,Bruszewski J,Ou S,Kozar L,Martin F,Green C,Jacobsen F,Nicolson M,Schultz J A,Semon K M,Rishell W,Stewart R G.1989.Germline transmission of exogenous genes in the chicken[J].Science,243(4890):533-535.doi:10.1126/science.2536194.
Brentnall M,Rodriguez-Menocal L,De Guevara R L,Cepero E,Boise L H.2013.Caspase-9,caspase-3 and caspase-7 have distinct roles during intrinsic apoptosis[J].BMC Cell Biology,14:32.doi:10.1186/1471-2121-14-32.
Bulina M E,Chudakov D M,Britanova O V,YanushevichY G,Staroverov D B,Chepurnykh T V,Merzlyak E M,Shkrob M A,Lukyanov S,Lukyanov K A.2006.A genetically encoded photosensitizer[J].Nature Biotechnology,24(1):95-99.doi:10.1038/nbt 1175.
Carere C,Balthazart J.2007.Sexual versus individual differen-tiation:The controversial role of avian maternal hormones[J].Trends in Endocrinology and Metabolism,18(2):73-80.doi:10.1016/j.tem.2007.01.003.
Carpentier P,Violot S,Blanchoin L,Bourgeois D.2009.Struc-tural basis for the phototoxicity of the fluorescent protein KillerRed[J].FEBS Letters,583(17):2839-2842.doi:10.1016/j.febslet.2009.07.041.
Chen Y C,Chang W C,Lin S P,Minami M,Jean C,Hayashi H,Rival-Gervier S,Kanaki T,Wu S C,Pain B.2018.Three-dimensional culture of chicken primordial germ cells(cPGCs)in defined media containing the functional polymer FP003[J].PLoS One,13(9):e0200515.doi:10.1371/journal.pone.0200515.
Chen Y C,Saito D,Suzuki T,Takemoto T.2023.An inducible germ cell ablation chicken model for high-grade germline chimeras[J].Development,150(18):dev202079.doi:10.1242/dev.202079.
Cummings B S,Schnellmann R G.2021.Measurement of cell death in mammalian cells[J].Current Protocols,1(8):e210.doi:10.1002/cpz 1.210.
Dehdilani N,Yousefi Taemeh S,Rival-Gervier S,Montillet G,Kress C,Jean C,Goshayeshi L,Dehghani H,Pain B.2023.Enhanced cultivation of chicken primordial germ cells[J].Scientific Reports,13(1):12323.doi:10.1038/s41598-023-39536-1.
Kim Y M,Woo S J,Han J Y.2023.Strategies for the generation of gene modified avian models:Advancement in avian germline transmission,genome editing,and applications[J].Genes,14(4):899.doi:10.3390/genes 14040899.
Kito G,Aramaki S,Tanaka K,Soh T,Yamauchi N,Hattori M A.2010.Temporal and spatial differential expression of chicken germline-specific proteins cDAZL,CDH and CVH during gametogenesis[J].The Journal of Reproduc-tion and Development,56(3):341-346.doi:10.1262/jrd.09-218a.
Kobayashi J,Shidara H,Morisawa Y,Kawakami M,Tanahashi Y,Hotta K,Oka K.2013.A method for selective ablation of neurons in C.elegans using the phototoxic fluorescent protein,KillerRed[J].Neuroscience Letters,548:261-264.doi:10.1016/j.neulet.2013.05.053.
Lee H C,Choi H J,Lee H G,Lim J M,Ono T,Han J Y.2016.Dazl expression explains origin and central formation of primordial germ cells in chickens[J].Stem Cells and Deve-lopment,25(1):68-79.doi:10.1089/scd.2015.0208.
Li X,Fang F,Gao Y,Tang G,Xu W Q,Wang Y H,Kong R X,Tuyihong A,Wang Z C.2019.ROS induced by KillerRed targeting mitochondria(mtKR)enhances apoptosis caused by radiation via Cyt c/Caspase-3 pathway[J].Oxidative Medicine and Cellular Longevity,2019(4528616.doi:10.1155/2019/4528616.
Liu J X,Wang F,Qin Y,Feng X L.2021.Advances in the genetically engineered KillerRed for photodynamic therapy applications[J].International Journal of Molecular Sciences,22(18):10130.doi:10.3390/ijms221810130.
Love J,Gribbin C,Mather C,Sang H.1994.Transgenic birds by DNA microinjection[J].Nature Biotechnology,12(1):60-63.doi:10.1038/nbt0194-60.
Miao L,St Clair D K.2009.Regulation of superoxide dis-mutase genes:Implications in disease[J].Free Radical Bio-logyamp;Medicine,47(4):344-356.doi:10.1016/j.freerad-biomed.2009.05.018.
Naito M,Harumi T,Kuwana T.2015.Long-term culture of chicken primordial germ cells isolated from embryonic blood and production of germline chimaericchickens.Ani-mal Reproduction Science[J],153:50-61.doi:10.1016/j.anireprosci.2014.12.003.
Pletnev S,Gurskaya N G,Pletneva N V,Lukyanov K A,Chu-dakov D M,Martynov V I,Popov V O,Kovalchuk M V,Wlodawer A,Dauter Z,Pletnev V.2009.Structural basis for phototoxicity of the genetically encoded photosensi-tizerKillerRed[J].The Journal of Biological Chemistry,284(46):32028-32039.doi:10.1074/jbc.M109.054973.
Qin H M,Jia X X,Huang Z W,Zhi Y F,Ji N,Lan M Y,ZhangL,Liu X T,Xu H Y,Lu Y Q.2024.Establishing an induced infertile chicken line for efficient germline trans-mission of exogenous PGCs[J].Journal of Integrative Agriculture.doi:10.1016/j.jia.2024.08.009.
Serebrovskaya E O,Ryumina A P,Boulina M E,Shirmanova M V,Zagaynova E V,Bogdanova E A,Lukyanov S A,Lukyanov K A.2014.Phototoxic effects of lysosome-associated genetically encoded photosensitizer KillerRed[J].Journal of Biomedical Optics,19(7):071403.doi:10.1117/1.Jbo.19.7.071403.
Slee EA,Harte M T,Kluck R M,Wolf B B,Casiano CA,New-meyer D D,Wang H G,Reed J C,Nicholson D W,Alnemri E S,Green D R,Martin S J.1999.Ordering the cytochrome c-initiated Caspase cascade:Hierarchical acti-vation of Caspases-2,-3,-6,-7,-8,and-10 in a Caspase-9-dependent manner[J].The Journal of Cell Biology,144(2):281-292.doi:10.1083/jcb.144.2.281.
Slot J W,Geuze H J,Freeman BA,Crapo J D.1986.Intracellu-lar localization of the copper-zinc and manganese superoxi-de dismutases in rat liver parenchymal cells[J].Labora-tory Investigation,55(3):363-371.
Szczerba A,Kuwana T,Paradowska M,Bednarczyk M.2020.In vitro culture of chicken circulating and gonadal primor-dial germ cells on a somatic feeder layer of avian origin[J].Animals,10(10):1769.doi:10.3390/ani 10101769.
Taylor L,Carlson D F,Nandi S,Sherman A,Fahrenkrug S C,McGrew M J.2017.Efficient TALEN-mediated gene tar-geting of chicken primordial germ cells[J].Development,144(5):928-934.doi:10.1242/dev.145367.
Vick L,Li Y,Simkiss K.1993.Transgenic birds from trans-formed primordial germ cells[J].Proceedings.Biological Sciences,251(1332):179-182.doi:10.1098/rspb.1993.0026.
Whyte J,Glover J D,Woodcock M,Brzeszczynska J,Taylor L,Sherman A,Kaiser P,McGrew M J.2015.FGF,insulin,and SMAD signaling cooperate for avian primordial germ cell self-renewal[J].Stem Cell Reports,5(6):1171-1182.doi:10.1016/j.stemcr.2015.10.008.
Williams D C,Bejjani R E,Ramirez P M,Coakley S,Kim S A,Lee H,Wen Q,Samuel A,Lu H,Hilliard M A,Hammar-lund M.2013.Rapid and permanent neuronal inactivation in vivo via subcellular generation of reactive oxygen with the use of KillerRed[J].Cell Reports,5(2):553-563.doi:10.1016/j.celrep.2013.09.023.
Xie L,Lu Z P,Chen D Y,Yang M M,Liao YY,Mao W R,Mo L F,Sun J J,Yang W H,Xu H Y,Lu K H,Lu Y Q.2019.Derivation of chicken primordial germ cells using an indi-rect co-culture system[J].Theriogenology,123:83-89.doi:10.1016/j.theriogenology.2018.09.017.
(责任编辑兰宗宝)

