转ICE1基因水稻耐冷性与膜脂过氧化和抗氧化酶活性的关系
杨悦 张兴梅 孙壮等
摘要: 为探讨转 ICE1 基因水稻耐冷性与膜脂过氧化和抗氧化酶活性的关系,以转 ICE1 基因和非转基因水稻垦鉴稻10号为材料,研究4 ℃低温胁迫对水稻幼苗膜脂过氧化程度和抗氧化酶活性的影响。结果表明,低温胁迫期间,转 ICE1 基因水稻的相对电导率及丙二醛(MDA)含量均显著低于非转基因水稻,说明 ICE1 基因的过量表达减轻了膜脂过氧化程度,保护了细胞膜系统;随着冷处理时间的延长,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均呈现先增强后减弱的趋势,转 ICE1 基因水稻的SOD、CAT活性均强于非转基因水稻,但POD活性弱于非转基因水稻。说明 ICE1 基因的过量表达可能通过减轻膜脂过氧化程度与调整抗氧化酶活性来增强转基因水稻的耐冷性。
关键词: 水稻; ICE1 基因;低温胁迫;耐冷性;膜质过氧化;抗氧化酶活性
中图分类号:Q943.2;S511.034 文献标志码: A
文章编号:1002-1302(2015)08-0071-03
黑龙江省地处高寒地区,水稻(Oryza sativa L.)因受到低温冷害会导致减产甚至绝收,因此,冷害极大地限制了黑龙江省水稻产量的进一步提高。水稻整个生长发育过程中都存在低温冷害的可能,低温可导致水稻生长缓慢、发育不良,甚至停滞生长;特别在水稻扬花期遭遇低温容易导致花粉败育、受精不良、影响结实。在黑龙江省有限的积温条件下,低温会对水稻产量及其品质造成极大地不良影响。 ICE1 (inducer of CBF expression 1)基因是从拟南芥中克隆到的、能调节植株耐冷性的转录因子,在低温条件下可以活化ICE1蛋白,活化了的ICE1蛋白能激活 CBF3 基因表达,CBF3蛋白通过调控 CBF3 基因下游低温应答基因的表达,从而增强拟南芥的抗冷性 [1]。前期从拟南芥中克隆到了 ICE1 基因,并将其与35S 启动子连接,构建了植物表达载体pCAMBIA1300-35S- ICE1 ,导入垦鉴稻10号水稻植株中,从而获得转 ICE1 基因水稻的再生植株,并进行继代培养 [2]。本研究对转 ICE1 基因水稻耐冷性与膜脂过氧化和抗氧化酶活性的关系进行研究,以揭示转 ICE1 基因水稻膜脂特性及抗氧化酶活性。
1 材料与方法
1.1 试验材料
本研究采用转 ICE1 基因水稻垦鉴稻10号第4代T4-8和T4-9株系及未转基因水稻品种垦鉴稻10号(CK)为试验材料,转 ICE1 基因水稻株系来自黑龙江八一农垦大学生命学院分子生物学实验室,该实验室利用PCR检测目的基因的方法对转基因水稻的遗传稳定性进行检测,转基因水稻材料的 ICE1 基因稳定遗传 [2]。
1.2 试验方法
采用转 ICE1 基因T4-8株系、T4-9株系与CK水稻种子,在25 ℃恒温条件下浸种,播种在小培养钵中,每个品种(系)18个重复,共计54个处理。将培养钵置于光照培养箱中,[JP3]培养条件为温度25 ℃,光照16 h/d,照度250 μmol/(m2·s), 相对湿度80%,培养期间浇灌Hoagland营养液。水稻幼苗培养4周后,放置4 ℃条件下进行冷处理,分别在0、2、4、6、8、10 d后停止冷处理,测定水稻植株中相对电导率、丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性。冷处理10 d非转基因水稻幼苗外观表现萎蔫,转基因水稻变化不大 [2]。
1.3 测定项目
水稻植株电导率的测定采用郝建军等的方法 [3];水稻植株丙二醛(MDA)含量的测定参照王学奎等的方法 [4];水稻植株酶活性的测定 [4]:超氧化物歧化酶(SOD) 活性的测定采用氮蓝四唑法(NBT),过氧化物酶(POD)活性的测定采用愈创木酚法,过氧化氢酶(CAT)活性的测定采用紫外吸收法。
1.4 统计分析
试验数据采用 Excel 和 SPSS 13.0 软件进行统计分析。
2 结果与分析
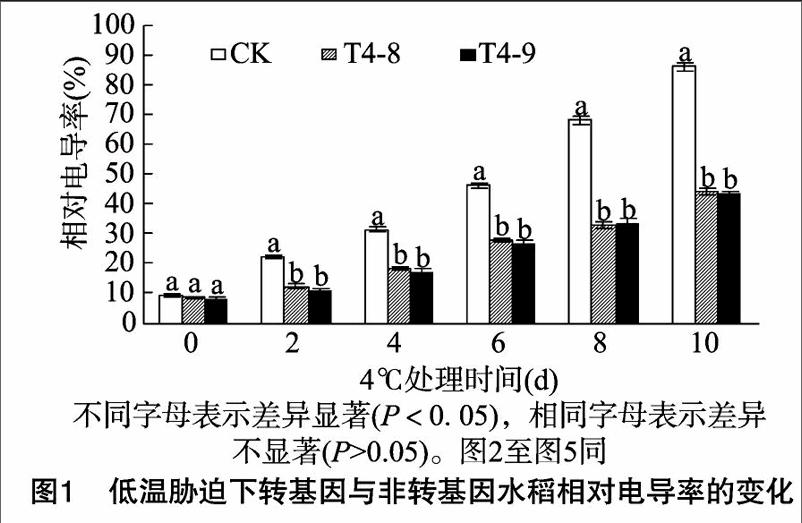
2.1 低温胁迫下转 ICE1 基因水稻电导率的变化
植物组织外渗液电导率的变化能够反映出细胞质膜的伤害程度和植物抗逆性的强弱。低温胁迫下,细胞膜的结构和功能会受到伤害,导致膜透性增大,电解质外渗,电导率增大 [6]。本研究水稻幼苗经低温处理后的相对电导率结果如图1所示,低温处理前(0 d),转 ICE1 基因水稻的相对电导率略低于CK,但差异不显著。低温处理后,转基因水稻与CK的相对电导率均增加,且随着低温胁迫时间的延长呈直线增加的趋势,相对电导率与处理时间的关系拟合的直线方程分别为y=5.072+7.674x,r=0.990(CK);y=6.570+3.536x,r=0.989(T4-8);y=5.563+3.609x,r=0.989(T4-9),CK增幅较大,T4-8、T4-9增幅相对较小。低温胁迫2 d,CK水稻相对电导率为22.51%,分别比T4-8、T4-9水稻高994、11.08百分点;低温胁迫10 d,CK水稻相对电导率达最大,为86.30%,[JP3]分别比T4-8、T4-9水稻高42.00、42.60百分点。方差分析结果表明,在低温胁迫期间,转 ICE1 基因水稻与CK之间的相对电导率差异显著,而T4-8与T4-9之间差异不显著。
低温胁迫后,转 ICE1 基因和非转基因水稻的电导率变化规律相同,其相对电导率均是随着低温胁迫时间的延长趋于增大,但分析数据结果表明,转 ICE1 基因水稻的相对电导率显著低于CK,说明低温胁迫下 ICE1 基因的导入保护了细胞膜,减少了细胞液的外渗,提高了水稻的耐冷性,使植株受伤害的程度较轻。由此可见,低温胁迫下 ICE1 基因具有增强水稻对低温冷害的抗御作用。
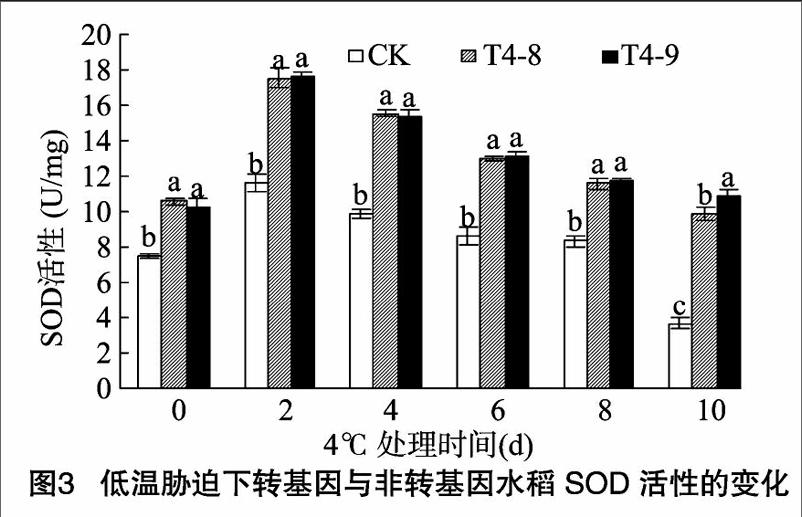
2.2 低温胁迫下转 ICE1 基因水稻丙二醛含量的变化
植物在逆境条件下往往发生膜脂过氧化作用,MDA是膜脂过氧化的产物之一,其含量可以反映细胞膜脂过氧化程度及细胞遭受伤害的程度 [7]。本试验水稻幼苗经低温处理后的MDA含量如图2所示,低温处理前(0 d),转 ICE1 基因水稻的MDA含量与CK相近。在低温胁迫下,CK水稻中MDA含量随冷处理时间的延长呈线性增加的趋势,MDA含量与处理时间的关系可以拟合为直线方程:y=3.259+1.350x,r=0.980;低温处理2 d,转基因水稻中MDA含量略有增加,其后基本处于相对稳定状态。由图2可以看出,低温胁迫2 d,CK水稻中的MDA含量快速增加,与胁迫前相比提高了71.9%;而T4-8、T4-9水稻MDA含量与胁迫前相比分别提高291%、30.2%。低温胁迫10 d,CK水稻MDA含量最高达1531 μmol/g;而T4-8、T4-9水稻MDA含量分别为4.53、 4.63 μmol/g。低温处理前,CK与T4-8、T4-9水稻MDA含量差异不显著;低温处理后,CK与T4-8、T4-9水稻差异显著,T4-8、T4-9的MDA含量相差不大。由此可见,外源基因 ICE1 提高了水稻细胞膜脂的抗氧化能力。
一些试验结果证明 [8-10],低温会使植物幼苗的MDA含量增加,从而促进膜脂过氧化过程,导致膜伤害。此外,MDA本身也是具有细胞毒性的物质,它与细胞体内的酶结合、交联后[CM(25],会使之失去活性,从而进一步破坏膜结构。本试验中转ICE1 基因水稻在低温胁迫下MDA含量显著低于CK,表明低温胁迫下外源基因 ICE1 可能对膜保护系统发挥作用。
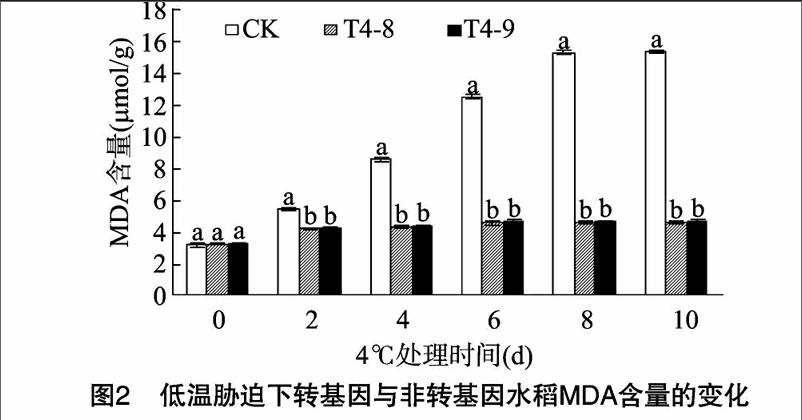
2.3 低温胁迫对转 ICE1 基因水稻SOD的影响
SOD是生物体内特异清除超氧阴离子自由基的酶,能催化超氧阴离子发生歧化反应,清除植物组织和细胞内的超氧自由基,减缓氧自由基对细胞膜的损伤,减轻活性氧对植物的危害。图3为低温胁迫下转 ICE1 基因与非转基因水稻SOD活性的变化。在低温胁迫期间,水稻中SOD活性呈规律性变化,低温胁迫初期,水稻中的SOD活性增强,低温胁迫2 d 3个品种(系)水稻中的SOD活性均达到最大值,分别为1163、17.55、17.61 U/mg,其后CK和转基因水稻的SOD活性均呈下降趋势。低温胁迫10 d,CK水稻SOD活性减至368 U/mg;而T4-8、T4-9水稻中的SOD活性与胁迫前相近。在整个低温胁迫期间,转 ICE1 基因水稻SOD活性均强于CK,且差异显著。表明在低温胁迫条件下, ICE1 基因的过量表达有助于增强SOD活性,增强水稻清除超氧自由基的能力,保护细胞膜,从而提高水稻的耐冷性。
2.4 低温胁迫对转 ICE1 基因水稻POD的影响
由图4可知,低温处理前,转基因和非转基因水稻的POD活性差异不大,低温处理后,非转基因水稻的POD活性显著增强,低温胁迫 2 d时达到最大值,为33.08 U/(mg·min),其后POD活性直线减弱,低温胁迫 10 d时减至 19.86 U/(mg·min)。[JP3]T4-8和T4-9水稻的POD活性在低温处理后虽然有所增强,但明显弱于CK,在低温胁迫 4 d时达到最大值,为19.41、19.53 U/(mg·min), 其后POD活性处于相对稳定水平,低温胁迫 10 d时T4-8和T4-9水稻POD活性分别减至14.84、15.16 U/(mg·min)。方差分析结果表明,低温处理后T4-8和T4-9水稻POD活性均显著弱于非转基因水稻,但T4-8和T4-9之间差异不显著。由此推测,外源基因可能插入到影响POD基因表达的相关序列中, ICE1 基因可能削弱了原水稻植株中POD基因的表达,从而使转基因
水稻的POD活性低于非转基因水稻。
2.5 低温胁迫对转 ICE1 基因水稻CAT的影响
CAT是植物体内分解过氧化物、消除其对植物的危害、防止植物衰老的抗性酶,它可以促使H2O2分解为O2和H2O,防御细胞遭受H2O2的毒害。通过检测CAT活性可以看出, ICE1 基因的表达是否提高了水稻抵御过氧化氢的能力。由图5可知,随着低温胁迫时间的延长,水稻中的CAT活性表现为先增强后逐渐减弱,并且转基因水稻T4-8和T4-9的CAT活性均强于CK,其差异显著,而T4-8和T4-9之间差异不显著。低温胁迫前,转基因与非转基因水稻体内CAT活性均相对较弱,但T4-8、T4-9水稻CAT活性强于CK,分别比CK强14.88%、16.72%。低温胁迫2 d,CK水稻CAT活性达到最大值,为13.35 U/(mg·min),但弱于同期T4-8和T4-9水稻,其后CK水稻的CAT活性持续减弱,低温胁迫 10 d时减至最低值,为9.92 U/(mg·min)。T4-8、 T4-9水稻 CAT活性在低温胁迫 4 d时达到最大值,较同期CK强4815%、49.72%,其后T4-8、T4-9水稻CAT活性缓慢减弱,低温胁迫 10 d时分别减为11.8、12.2 U/(mg·min), 但分别比同期CK强1.88、2.28 U/(mg·min)。以上结果表明, ICE1 基因过量表达能提高水稻体内的CAT活性,或促进CAT的合成,从而提高水稻清除H2O2的能力。
3 结论与讨论
植物体自身具有复杂的抗冷防御机制,在逆境条件下可以开启多个防御系统。1个基因可以调控多个防御应答机制,而1个应答机制也受多个基因的调控。在植物体内 ICE1 作为上游转录因子,可能调控多个级联反应,参与到耐冷机制中,从而使植株获得较高的耐冷性 [11]。
应用组成型启动子CaMV35S与 ICE1 基因构建植物表达载体, ICE1 基因可以在转基因植株内组成型表达。由试验结果可知,常温下转基因和非转基因水稻植株在表型上没有表现出明显的差异,两者抗氧化酶活性差异不大。由此可见,在正常生长条件下,过量表达 ICE1 基因对水稻植株的生长及生理指标影响不大。常温下可能 ICE1 基因表达产物不起作用或作用较弱,因此,过量表达 ICE1 基因没有产生级联反应,水稻植株的表型和体内生理指标没有表现出明显的差异。低温胁迫条件下,转基因水稻抗冷性增强,主要表现为转 ICE1 基因水稻的相对电导率远低于非转基因水稻;低温胁迫期间转基因水稻MDA含量变化不大,且显著低于非转基因水稻,说明 ICE1 基因的过量表达减轻了膜脂过氧化程度,抑制了MDA的积累,保护了细胞膜系统,减少了细胞内容物的外渗。SOD、POD和CAT是膜保护系统重要的3种酶,具有清除植物组织和细胞内的自由基,使植物体内自由基维持在一个较低水平,减缓自由基对细胞膜伤害的作用 [12]。本研究结果表明,低温胁迫期间,水稻中的SOD、POD、CAT活性表现为先增强后减弱,说明低温胁迫初期水稻启动了体内抗氧化系统,抗氧化酶活性增强,清除自由基能力提高了;随着胁迫时间的延长,抗氧化酶活性减弱,可能是因为随着低温胁迫的加剧,自由基产生量增加,对抗氧化酶造成伤害,抗氧化酶活性减弱,这又会加重自由基对植物细胞和组织的伤害。转基因水稻SOD、CAT活性均高于非转基因水稻,酶活性差异显著,在低温处理后期表现更为突出,说明在低温胁迫条件下, ICE1 基因过量表达并发挥了作用,通过提高抗氧化酶活性来提高清除自由基的能力,从而减轻自由基对植物细胞和组织的伤害。 ICE1 基因可能是通过一系列级联反应作用于抗氧化酶,从而维持植物较高的抗氧化酶活性,有利于细胞的正常代谢,最终表现出转基因水稻耐冷性增强。
本研究中转基因水稻POD活性的变化趋势与SOD、CAT不同,虽然低温胁迫期间POD活性缓慢减弱,但低温胁迫后酶活性低于非转基因水稻。这暗示着外源基因 ICE1 的转入和过量表达对过氧化物酶活性产生了一定的影响。 ICE1 基因的转入可能插入到影响POD基因表达的序列内,影响了POD的表达,或者 ICE1 自身表达产物对POD活性有作用,从而使转基因水稻的POD活性弱于非转基因水稻;另外,也有可能与CAT活性有关,CAT和POD同为清除H2O2的主要酶类,CAT活性的增强影响了POD活性,CAT对低温胁迫表现敏感而POD表现不敏感。总体上看,POD的不敏感并没有影响转基因植株整体的耐冷性,低温胁迫条件下转 ICE1 基因水稻的耐冷性仍高于非转基因水稻。
综上所述,尽管在低温胁迫条件下转基因和非转基因水稻各种抗氧化酶活性的变化存在一定的差异,但转基因水稻整体表现出了明显的耐冷性,本研究结果表明,转 ICE1 基因水稻抗膜质过氧化能力高于非转基因水稻。本试验中转 ICE1 基因水稻膜脂过氧化酶和抗氧化酶活性方面的研究与前人的研究结果 [13]基本一致。
[HS2*3][HT8.5H]参考文献:
[1] Chinnusamy V,Ohta M,Kanrar S,et al. ICE1 :a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J]. Genes Dev,2003,17:1043-1054.
[2]张兴梅,孙 壮,殷奎德,等. 低温胁迫下转 ICE1 基因水稻养分变化的研究[J]. 干旱地区农业研究,2013,31(6):140-145.
[LM]
[3] 郝建军,康宗利,于 洋.植物生理学实验技术[M]. 北京:化学工业出版社,2007:169-173.
[4]王学奎.植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006:167-172,280-281.
[6]李海林,王林辉,黄燕湘.低温胁迫对水稻再生芽抗冷性的影响[J]. 江西农业学报,2007,19(1):10-13.
[7]Katsuhara M,Otsuka T,Ezaki B.Salt stress-induced lipid peroxidation is reduced by glutathione S-transferase,but this reduction of lipid peroxides is not enough for a recovery of root growth in Arabidopsis[J]. Plant Sci,2005,169:369-373.
[8]侯丽霞.CaCl2浸种对低温胁迫下水稻幼苗生理指标的影响[J]. 江苏农业科学,2013,41(8):70-71.
[9]黄秋凤,罗兴录,王春莲,等. 低温胁迫对木薯幼苗生理特性的影响[J]. 中国农学通报,2010,26(17):172-177.
[10] 刘世彪,易 萍,罗 奥,等. 低温胁迫对绞股蓝和五柱绞股蓝抗寒性生理指标的影响[J]. 热带作物学报,2008,29(5):572-576.
[11]Lee B H,Henderson D A,Zhu J K. The Arabidopsis cold responsive transcriptome and its regulation by ICE1 [J]. Plant Cell,2005,17:3155-3175.
[12]Hernandez J,Imenez A,Mullineaux P,et al.Tolerance of pea(Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defenses[J]. Plant Cell Biology,2000,23:853-862.
[13]Xiang D J,Hu X Y,Zhang Y,et al. Over-expression of ICE1 gene in transgenic rice improves cold tolerance[J]. Rice Science,2008,15(3):173-178.

