小菜蛾RyR调控蛋白FKBP基因克隆及其时空表达谱




摘要:【目的】明确FK506结合蛋白(FKBP)基因在小菜蛾对氯虫苯甲酰胺抗性形成中的作用,筛选出起主要作用的关键FKBP基因,为阐明小菜蛾抗双酰胺类杀虫剂的分子机理提供新思路。【方法】以抗氯虫苯甲酰胺种群和敏感种群小菜蛾为研究对象,采用浸叶法测定不同种群小菜蛾对氯虫苯甲酰胺的敏感性差异;利用cDNA末端快速扩增(RACE)方法克隆3个FKBP基因(FKBP8、FKBP12和FKBP52)的全长序列,并通过GSDS 2.0、CDD和MEME在线分析软件分析其基因结构与蛋白保守结构域和Motif;采用实时荧光定量PCR分析抗性种群不同发育阶段和敏感、抗性种群4龄幼虫不同组织FKBP基因的时空表达特性。【结果】生物测定结果显示,抗性种群小菜蛾对氯虫苯甲酰胺的抗性倍数为122.67倍,属于高水平抗性。实时荧光定量PCR分析发现,抗性种群小菜蛾体内3个FKBP基因的相对表达量均显著高于敏感种群(Plt;0.05,下同),其中FKBP8基因的表达差异最显著,是敏感种群的968倍。通过RACE方法克隆得到FKBP52、FKBP8和FKBP12基因的全长序列,长度分别为1473、1525和649 bp,分别编码423、307和108个氨基酸残基,其蛋白均为亲水蛋白。FKBP52、FKBP8和FKBP12基因具有相同的基因结构,FKBP52和FKBP12蛋白具有相同的保守结构域FkpA,而FKBP8蛋白具有2个不同的保守结构域。抗性种群小菜蛾4龄幼虫体内3个FKBP基因表达量均高于蛹期,其中FKBP12和FKBP8基因在4龄幼虫中的表达量最高,显著高于其他龄期和蛹期。FKBP8基因在抗性种群小菜蛾中肠和表皮中的表达量显著高于敏感种群,分别是敏感种群的3.2和3.7倍。【结论】FKBP52、FKBP8和FKBP12基因在氯虫苯甲酰胺抗性种群小菜蛾中均过量表达,其中FKBP8基因在高抗氯虫苯甲酰胺种群小菜蛾的中肠高表达,表明其可能通过过量表达参与小菜蛾对氯虫苯甲酰胺的抗药性。
关键词:FK506结合蛋白;FKBP基因;小菜蛾;氯虫苯甲酰胺;时空表达特性;抗药性
中图分类号:S433.4文献标志码:A文章编号:2095-1191(2024)10-3023-10
Cloning and spatiotemporal expression analysis of RyRregula⁃tory protein FKBP gene in Plutellaxylostella(L.)
ZHANG Wan-li1,GE Tian-cheng2,CHEN Qi-chun2,PENG Zheng-ke2,XIAO Yong2,LI Zhen-yu2*,YIN Fei2*
(1Guangdong Tianhe Agricultural Resources Co.,Ltd.,Guangzhou,Guangdong 510080,China;2Institute of PlantProtection,Guangdong Academy of Agricultural Sciences/Guangdong Provincial Key Laboratory of HighTechnology for Plant Protection,Guangzhou,Guangdong 510640,China)
Abstract:【Objective】The role of FK506-binding protein(FKBP)gene in the development of resistance of Plutellaxylostella(L.)to chlorantraniliprole was determined,and key FKBP genes involved in this process was identified,provi-ding new insights into the molecular mechanism underlying diamide insecticide resistance in P.xylostella.【Method】Chlorantraniliprole resistant and susceptible populations of P.xylostella were used to determine chlorantraniliprole suscep-tibility difference of P.xylostella by leaf-dip bioassay.The full-length sequence of 3 FKBP genes(FKBP8,FKBP12 and FKBP52)were cloned using rapid amplification of cDNA end(RACE),and its gene structure,protein conserved do-mains and Motifs were analyzed using online softwares including MEME,CDD and GSDS 2.0.Real-time fluorescence quantitative PCR(RT-qPCR)was used to analyzespatiotemporal expression patterns of FKBP genes in different develop-mental stages of the resistant population,and in different tissues of fourth-instar larvae of both resistant and susceptible populations.【Result】The bioassay revealed a 122.67-time resistance to chlorantraniliprole in the resistant population of P.xylostella,indicating high-level resistance.RT-qPCR analysis showed that the relative expression levels of all 3 FKBP genes of P.xylostella in the resistant population were significantly higher than those in susceptible population(Plt;0.05,the same below).The full-length sequence of FKBP52,FKBP8 and FKBP12 genes were cloned by the RACE method,with lengths of 1473,1525 and 649 bp,encoding 423,307 and 108 amino acids residues respectively.All 3 proteins were predicted to be hydrophilic.They shared similar gene structures.FKBP52 and FKBP12 protein had the same conserved do-main FkpA,while FKBP8 protein contained 2 different conserved domains.The difference of FKBP8 gene expression was the most significant,which was as 968 times as that in the resistant population.The expression levels of 3 FKBP genes in fourth-instar larvae in the resistant population were higher than those in pupae.The expression levels of FKBP12 and FKBP8 genes were the highest in fourth-instar larvae,significantly higher than in other larval stages and pupae.The expression levels of FKBP8 gene in the midgut and epidermis of the resistant population were significantly higher than those in the susceptible population,being 3.2 and 3.7 times as those in susceptible population respectively.【Conclusion】FKBP52,FKBP8 and FKBP12 genes ofP.xylostella in the chlorantraniliprole-resistant population are all over-expressed.The high expression of FKBP8 gene in the midgut of the highly resistant population suggests its potential involvement in chlorantraniliprole resistance through over-expression.
Key words:FK506 binding protein;FKBP gene;Plutellaxylostella(L.);chlorantraniliprole;spatiotemporal ex-pression patterns;insecticide resistance
Foundation items:Guangdong Basic and Applied Basic Research Foundation Project(2022A1515012395);Project of Collaborative Innovation Center of Guangdong Academy of Agricultural Sciences(XTXM202209)
0引言
【研究意义】小菜蛾[Plutellaxylostella(L.)]隶属于属鳞翅目(Lepidoptera)菜蛾科(Plutellidae),是十字花科蔬菜上的一种世界性害虫,该虫已对多种常用杀虫剂产生了不同程度的抗药性(向立刚等,2022)。在我国,小菜蛾危害造成的经济损失及用于小菜蛾防控的相关费用年均约7.7亿美元(Li etal.,2016;Zhang et al.,2016)。氯虫苯甲酰胺是首个具有新型邻酰胺苯甲酰胺类化学结构的一种广谱双酰胺类杀虫剂,自上市以来被广泛应用于防治鳞翅目害虫,其销售量持续增长且年增长率居众多杀虫剂之首(陈鹃和柏亚罗,2021;张新凤等,2024)。然而,由于氯虫苯甲酰胺的长期不合理使用,致使小菜蛾对其产生了抗药性,从而使十字花科蔬菜生产遭受重大损失。阐明小菜蛾抗性分子机理是有效治理小菜蛾抗药性的基础。氯虫苯甲酰胺可结合在鱼尼丁受体(Ryanodine receptor,RyR)跨膜区的伪电压传感器结构域中,通过激活RyR使其不能正常关闭,导致钙离子持续释放,致使害虫的肌肉持续收缩并最终瘫痪死亡。FK506结合蛋白(FKBP)具有调控RyR的功能,并在维持钙离子通道的稳定关闭中发挥重要作用。为此,本研究拟从RyR调控蛋白FKBP着手,探索关键FKBP基因在小菜蛾对氯虫苯甲酰胺抗性形成中的作用,旨在为阐明小菜蛾抗双酰胺类杀虫剂的分子机理提供新思路,对治理小菜蛾的抗药性及延长双酰胺类杀虫剂的使用寿命具有重要意义。【前人研究进展】FKBP是一类大环内酯免疫抑制剂,可限制蛋白质折叠过程的速度。其属于肽基—脯氨酸顺反异构体大家族,具有肽基—脯氨酰基—顺反异构酶(PPIases)活性,可催化多肽或蛋白质底物中的肽基—脯氨酸顺反子转换,从而影响其活性、磷酸化状态、蛋白质间相互作用、亚细胞定位及稳定性;其家族因不同的异构体调节不同的细胞途径,具有多种生物功能,如分子伴侣、转运蛋白质、免疫抑制和凋亡等(Harrar et al.,2001;Barik,2007;Kang et al.,2008;Blackburn and Walkinshaw,2011)。研究表明,FKBP12可与三磷酸肌醇受体(IP3R)和RyR的钙释放通道相互作用,具有调节RyR的功能,对信号传导和Ca2+调控起关键作用(Tong and Yu,2015;Kasahara,2021)。FKBP11调控MAPK信号通路中蛋白的表达,影响骨肉瘤细胞的增殖和凋亡,其可作为骨肉瘤治疗的潜在靶点(曾铎,2023)。FKBP因其功能多样,可为多种药物提供药物靶点,他克莫司、雷帕霉素、子囊霉素及其衍生物已作为药物应用于临床(刘菲等,2014)。应用FKBP防控害虫的研究结果表明,其量变可影响杀虫剂活性(Bultyncket al.,2000;MacMillan et al.,2008)。FKBP52蛋白与金龟子绿僵菌(Metarhiziumanisopliae)联合使用对东亚飞蝗(Locusta migratoriamanilensis)和西花蓟马(Frankliniella occidentalis)的致死率显著高于单独使用金龟子绿僵菌的致死率(田野等,2021b;尹仙枫等,2024)。FKBP46与金龟子绿僵菌混用可显著增加东亚飞蝗的死亡率(田野等,2021a)。【本研究切入点】FKBP具有使RyR的钙离子通道处于稳定的关闭状态等多种功能,其量变影响杀虫剂对东亚飞蝗和西花蓟马的活性。本课题组前期通过转录组测序发现3个FKBP基因(FKBP8、FKBP12和FKBP52)在氯虫苯甲酰胺抗性种群小菜蛾中过量表达。然而,FKBP基因在小菜蛾对氯虫苯甲酰胺等双酰胺类杀虫剂抗性形成中的作用尚未见报道。【拟解决的关键问题】以抗氯虫苯甲酰胺种群和敏感种群小菜蛾为研究对象,采用cDNA末端快速扩增(RACE)方法克隆3个FKBP基因(FKBP8、FKBP12和FKBP52)的全长序列,并利用GSDS 2.0、CDD和MEME在线软件分析其基因结构与蛋白保守结构域和Motif;通过实时荧光定量PCR比较分析不同种群小菜蛾体内3个FKBP基因的表达差异及其时空表达谱,旨在筛选出在小菜蛾抗氯虫苯甲酰胺中起主要作用的关键FKBP基因,为阐明小菜蛾抗双酰胺类杀虫剂的分子机理提供新思路。
1材料与方法
1.1试验材料
1.1.1试虫供试敏感种群小菜蛾于2004年采集自深圳市十字花科蔬菜田,经菜心苗(Brassica campestris)在室内未接触任何杀虫剂条件下饲养至今,饲养条件:温度(25±2)℃、相对湿度65%~70%、光周期L∶D=16 h∶8 h。抗性种群小菜蛾为田间采集于广东惠州地区的小菜蛾老熟幼虫和蛹,置于养虫室(条件同上)内饲养,待其羽化后,补充10%蜂蜜水;用菜心苗供成虫产卵,待幼虫孵化后饲养至3龄初期用于试验。敏感种群和抗性种群小菜蛾分别记为SS和HZ。抗性种群隔代用亚致死浓度(LC25)的氯虫苯甲酰胺处理以维持其抗性水平。
1.1.2供试药剂与试剂98.6%氯虫苯甲酰胺原药(广州进展生物科技有限公司),使用二甲基亚砜(DMSO)和乳化剂911将其配制成5%乳油。2×HiFiTaq PCR StarMix、DNA Maker、限制性核酸内切酶、T4 DNA连接酶、EASYspin组织/细胞RNA快速提取试剂盒、Reverse Transcritase M-MLV反转录试剂盒、cDNA第一链合成试剂盒、StarPrep Plasmid Miniprep Kit(200)快速质粒小提取试剂盒和Star-Prep DNA纯化/胶回收试剂盒等均购自北京康润诚业生物科技有限公司。Clotech BD SMARTTM RACEcDNA Amplification Kit、大肠杆菌DH5α、pMD18-T载体均购自宝日医生物技术(北京)有限公司。无水乙醇、三氯甲烷、异丙醇等均为国产分析纯。
1.1.3主要仪器设备PCR仪(T100,伯乐生命医药产品上海有限公司);荧光定量仪(qTOWER3,德国耶拿分析仪器股份有限公司);超微量紫外可见分光光度计(ND-100,杭州米欧仪器有限公司);组织研磨机(JXFSTPRP-24,上海净信实业发展有限公司);电泳仪(美国Bio-Rad公司)。
1.2试验方法
1.2.1不同种群小菜蛾对氯虫苯甲酰胺的敏感性测定采用浸叶法,测定方法、结果调查和抗性倍数(RR)计算方法等均参照中华人民共和国农业行业标准NY/T 2360—2013《十字花科小菜蛾抗药性监测技术规程》进行。RR=抗性种群的致死中浓度(LC50)/敏感品系的LC50。抗性水平划分标准:RR≤10,低水平抗性;10lt;RR≤100,中等水平抗性;RRgt;100,高水平抗性。
1.2.2 FKBP基因全长克隆
1.2.2.1引物设计合成根据RACE试剂盒说明设计并合成RACE引物,利用Primer Premier 5.0进行巢式引物及荧光定量PCR引物设计,如表1所示。
1.2.2.2总RNA提取和FKBP基因的PCR扩增及其产物纯化取5~10头敏感种群小菜蛾3龄幼虫整虫,先用焦碳酸二乙酯(DEPC)水清洗3次,以滤纸吸干后置于1.5 mL无菌离心管中,加入液氮急冻,用特制的小研磨棒快速将其研磨成粉末,按照EASYspin组织/细胞RNA快速提取试剂盒说明提取小菜蛾总RNA。根据反转录试剂盒及RACE试剂盒的操作说明合成cDNA第一链,并置于-20℃冰箱中保存备用。根据RACE试剂盒操作说明进行PCR扩增,扩增程序:94℃预变性5 min;94℃35 s,45~55℃35 s,72℃20 s,进行35个循环;72℃延伸10 min,4℃终止反应。用StarPrep DNA纯化/胶回收试剂盒对PCR产物进行纯化回收,并用超微量紫外可见分光光度计检测回收产物的浓度。
1.2.3原核表达质粒pMD-FKBP构建及测序将回收产物和载体pMD18-T于16℃连接过夜,连接产物用大肠杆菌DH5α转化,筛选阳性重组子,用StarPrep Plasmid Miniprep Kit(200)快速质粒小提取试剂盒进行重组质粒抽提。再用Hind III和Bam I进行双酶切鉴定,取5μL酶切产物进行1%琼脂糖凝胶电泳检测。委托赛默飞世尔科技公司对酶切产物进行测序,并将获得的序列利用NCBI的BLAST进行序列比对和分析。
1.2.4 FKBP基因的表达差异及其时空表达谱收集敏感和抗性种群小菜蛾4龄幼虫头部、表皮、中肠组织及抗性种群小菜蛾1~4龄幼虫整虫、蛹进行总RNA提取。根据反转录试剂盒说明进行cDNA第一链合成并以其为模板,采用SYBR Green染料法,通过实时荧光定量PCR检测不同种群4龄幼虫及其不同组织和抗性种群不同发育阶段FKBP基因的相对表达量。反应体系25µL:cDNA模板1µL,上、下游引物各1µL,2×HiFiTaq PCR StarMix 10µL,ddH2O 12µL。每个样品4次重复。扩增程序:94℃预变性5 min;94℃35 s,42~60℃35 s,72℃1 min,进行35个循环;72℃延伸10 min,4℃终止反应。采用2-ΔΔCt法(Livak and Schmittgen,2001)并以小菜蛾RPL32基因为内参基因,定量分析3个FBKP基因的相对表达量。
1.3基因结构分析
利用GSDS 2.0(https://gsds.gao-lab.org/)进行基因结构分析。采用MEME在线软件(https://meme-suite.org/meme/info/status?service=MEMEamp;id=appM EME_5.5.517144433127781391122981)进行Motif分析。利用NCBI中的CDD进行保守结构域分析。
1.4统计分析
采用SPSS 19的最小显著差异(LSD)法对试验数据进行差异显著性分析。
2结果与分析
2.1不同种群小菜蛾对氯虫苯甲酰胺的敏感性测定结果
由表2可知,抗性种群小菜蛾对氯虫苯甲酰胺的LC50为92.01 mg/L;相较于敏感种群,其RR为122.67倍,属于高水平抗性。
2.2不同种群小菜蛾体内FKBP基因的相对表达量
由图1可知,抗性种群小菜蛾4龄幼虫中3个FKBP基因(FKBP8、FKBP52和FKBP12)的相对表达量均显著高于敏感种群(Plt;0.05,下同),分别是敏感种群的968、117和44倍。
2.3 FKBP基因全长序列克隆与分析结果
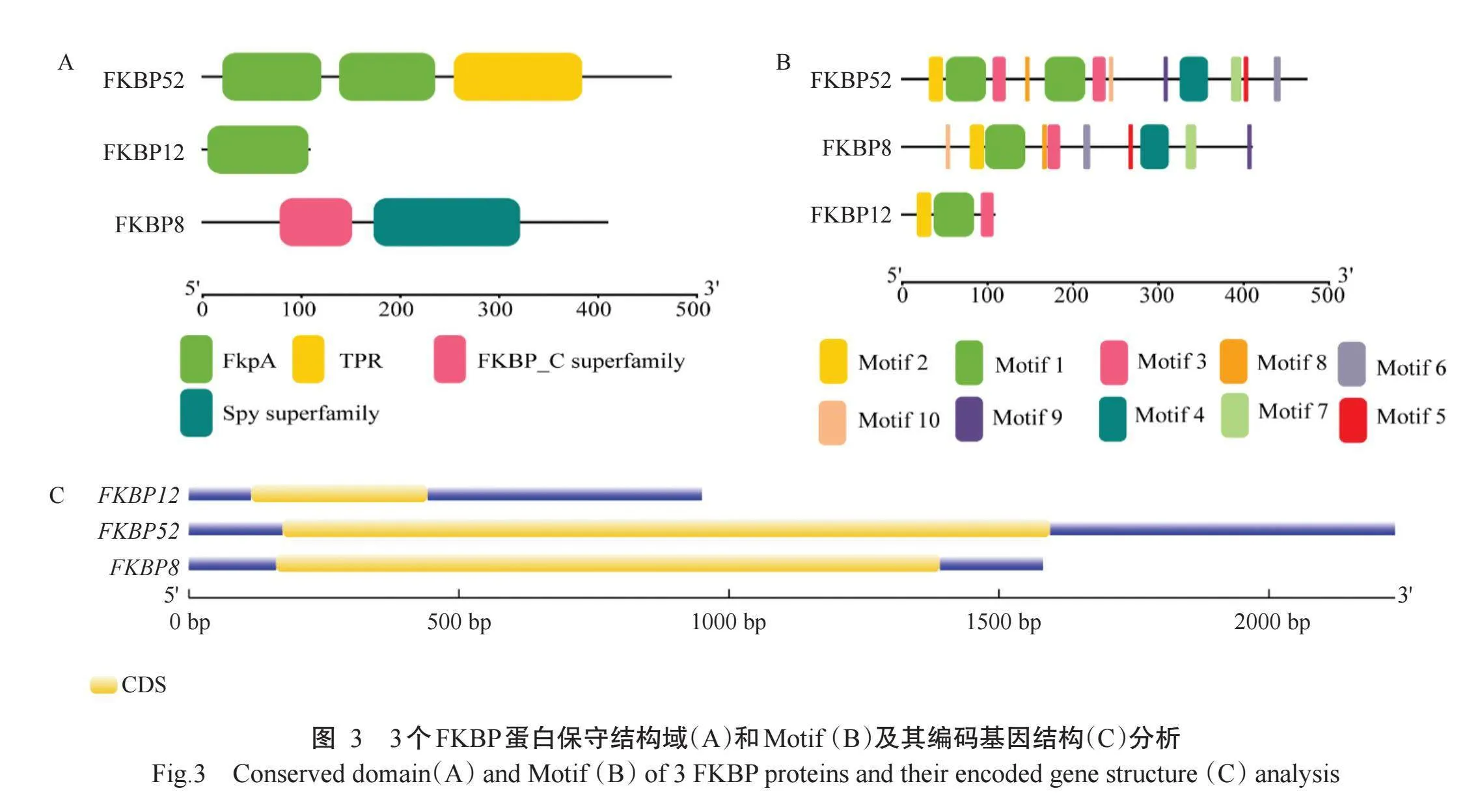
按照RACE试剂盒说明,以敏感种群小菜蛾的cDNA为模板,并用特异性引物进行PCR扩增后,克隆得到3个FKBP基因的全长序列,结果如图2所示。FKBP12、FKBP8和FKBP52基因均具有完整的开放阅读框及起始密码子ATG,其中FKBP52基因全长1473 bp,其编码区(CDS)长1272 bp,编码423个氨基酸残基,蛋白分子量46982.25 Da,理论等电点5.83,亲水性-0.564,属于亲水蛋白。FKBP8基因全长1525bp,其CDS长921bp,编码307个氨基酸残基,蛋白分子量33839.70 Da,理论等电点4.87,亲水性-0.660,属于亲水蛋白。FKBP12基因全长649bp,其CDS长324bp,编码108个氨基酸残基,蛋白分子量11699.29 Da,理论等电点7.85,亲水性-0.369,属于亲水蛋白。
如图3所示,FKBP52蛋白含有2个FkpA结构域、1个TPR结构域、10个Motif,其编码基因含有1个CDS区域;FKBP8蛋白含有FKBP_C superfamily和Spy superfamily结构域及10个Motif,其编码基因含有1个CDS区域;FKBP12蛋白含有1个FKpA保守结构域及3个Motif,其编码基因含有1个CDS区域。
2.4抗性种群小菜蛾不同发育阶段的FKBP基因表达差异
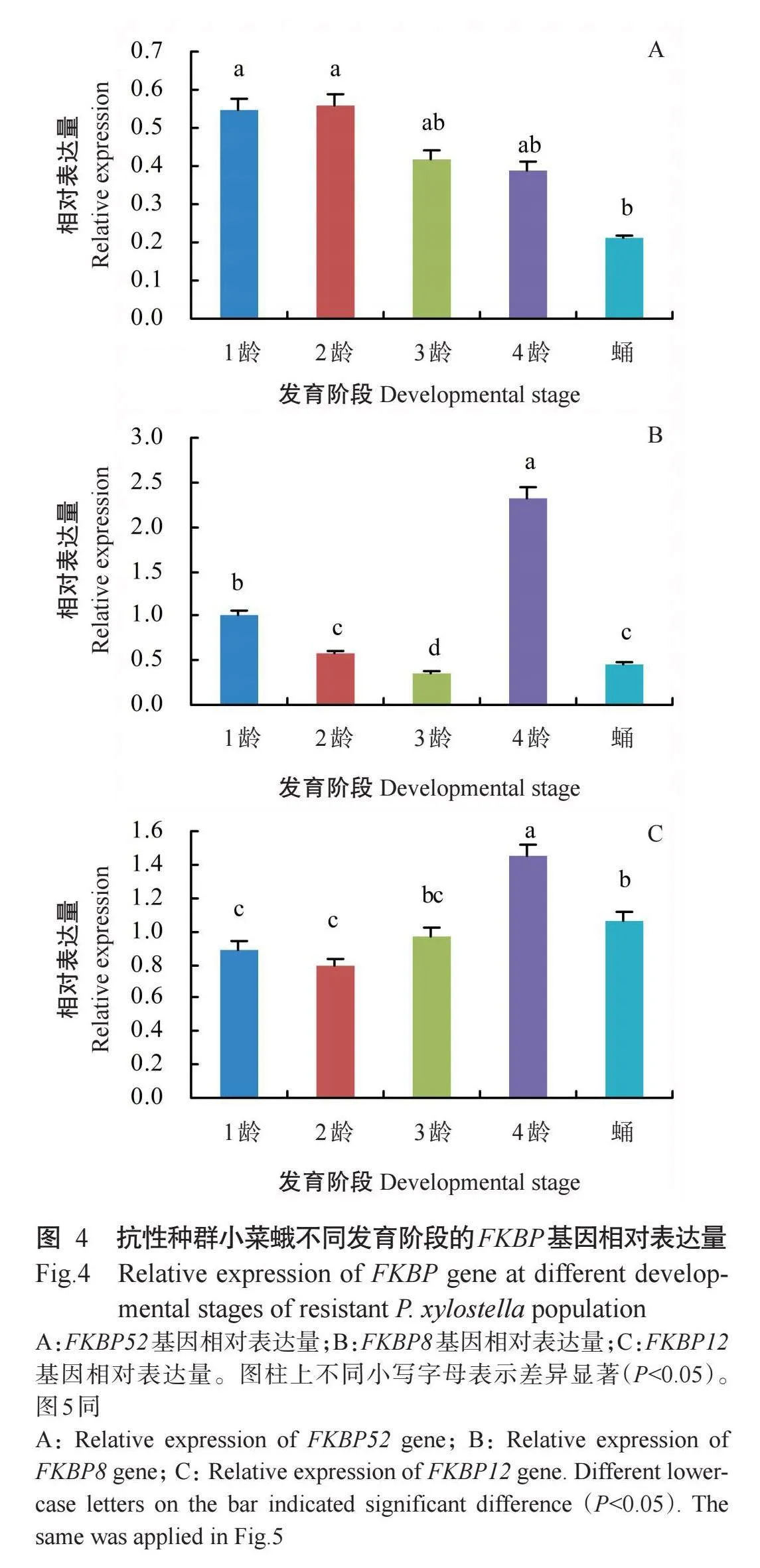
由图4-A可知,抗性种群小菜蛾1~4龄幼虫之间的FKBP52基因相对表达量差异不显著(Pgt;0.05,下同)且均高于蛹期,不同发育阶段的相对表达量排序为2龄幼虫gt;1龄幼虫gt;3龄幼虫gt;4龄幼虫gt;蛹期,其中1~2龄幼虫的相对表达量显著高于蛹期。由图4-B可知,抗性种群小菜蛾1~4龄幼虫之间的FKBP8基因相对表达量差异显著,4龄小菜蛾FKBP8基因相对表达量最高,不同发育阶段的相对表达量排序为4龄幼虫gt;1龄幼虫gt;2龄幼虫gt;蛹期gt;3龄幼虫。由图4-C可知,抗性种群小菜蛾4龄幼虫FKBP12基因的相对表达量显著高于1~3龄幼虫和蛹期,不同发育阶段的相对表达量排序为4龄幼虫gt;蛹期gt;3龄幼虫gt;1龄幼虫gt;2龄幼虫,在1、2和3龄小菜蛾中的相对表达量差异不显著。
2.5小菜蛾4龄幼虫不同组织的FKBP基因表达差异
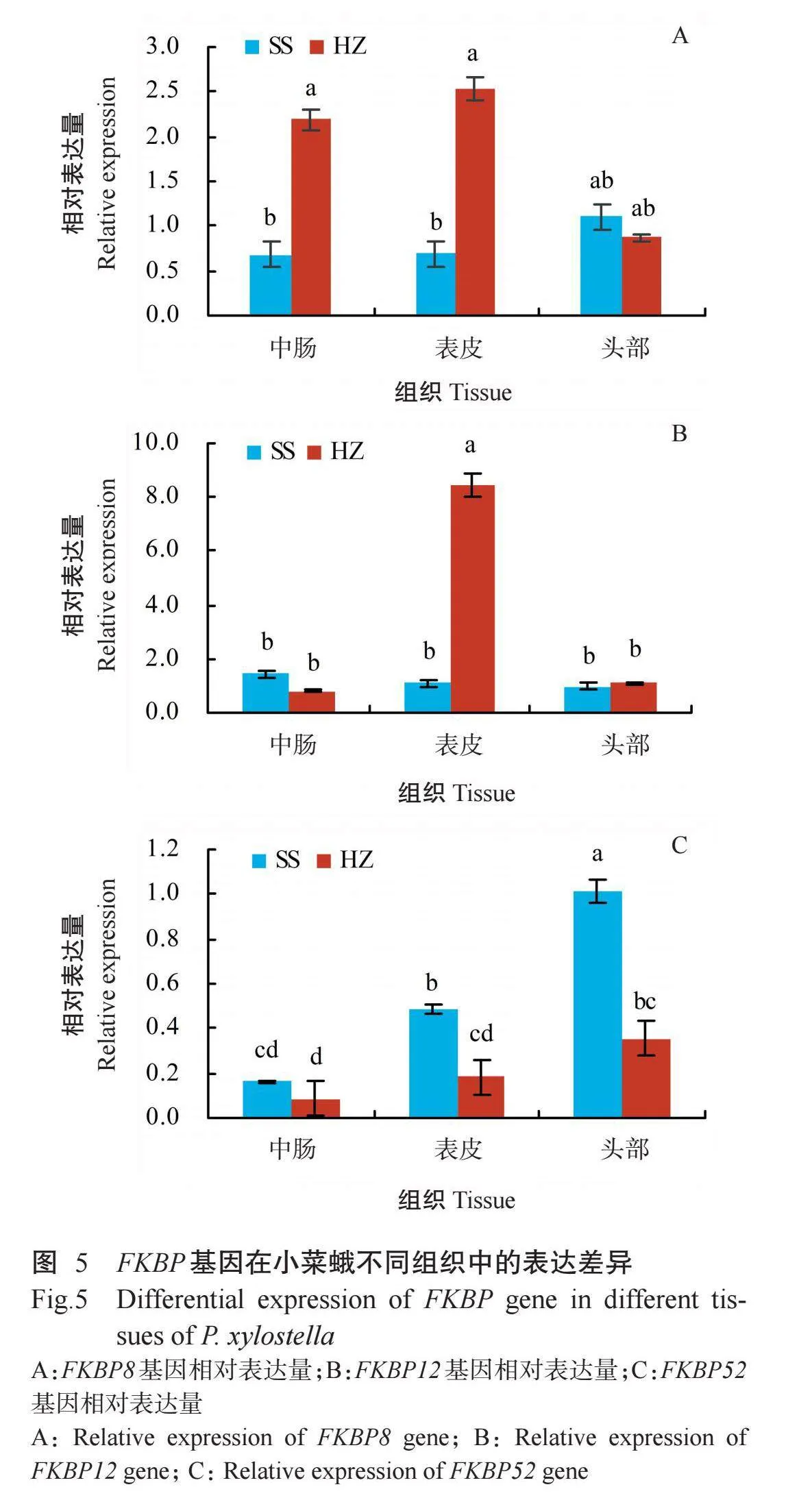
为进一步了解FKBP基因在小菜蛾体内的时空表达特性及其在小菜蛾抗氯虫苯甲酰胺中的作用,同时基于该药剂的作用特点,解剖小菜蛾4龄幼虫头部、表皮和中肠组织并提取总RNA后进行实时荧光定量PCR分析,结果如图5所示。FKBP8基因在同一种群不同组织中的相对表达量差异不显著,在敏感种群以头部的相对表达量最高,在抗性种群以表皮的相对表达量最高;在不同种群同一组织中除头部的相对表达量差异不显著外,在中肠和表皮的相对表达量差异显著,在抗性种群中肠和表皮中的相对表达量均显著高于敏感种群,分别是敏感种群的3.2和3.7倍(图5-A)。FKBP12基因在敏感种群不同组织中的相对表达量差异不显著,而其在抗性种群表皮中的相对表达量显著高于敏感种群3种组织及抗性种群头部和中肠(图5-B)。FKBP52基因在敏感种群头部的相对表达量最高,显著高于表皮和中肠;抗性种群各组织中FKBP52基因的相对表达量均低于敏感种群,且头部和表皮中的相对表达量显著低于敏感种群(图5-C)。
3讨论
氯虫苯甲酰胺是一种双酰胺类杀虫剂,对鳞翅目害虫具有较好的防治效果(刘嘉楠等,2023;周春丽等,2023);其2012年销售额为9.10亿美元,并逐年递增,至2019年销售额达17.50亿美元(陈小平等,2021)。由于氯虫苯甲酰胺被广泛、大量地使用,害虫对其陆续产生了不同程度的抗药性,给农业生产带来了极大损失。在我国,小菜蛾对氯虫苯甲酰胺在短时间内已产生了严重的抗药性,RR值最高达1749.96倍,给十字花科蔬菜的安全生产带来困扰(李振宇等,2020)。已有研究发现,小菜蛾、斜纹夜蛾、番茄潜叶蛾等多种鳞翅目害虫对氯虫苯甲酰胺和溴氰虫酰胺产生了交互抗性(Camposet al.,2015;Liu et al.,2015;Sanget al.,2016;Li etal.,2023)。抗氯虫苯甲酰胺的二化螟对氯氟氰虫酰胺和四氯虫酰胺等具有交互抗性(赵丹丹等,2017)。抗氯虫苯甲酰胺的稻纵卷叶螟对氟氯虫酰胺、四唑虫酰胺、溴氰虫酰胺、环丙虫酰胺和四氯虫酰胺也表现出中等至高水平抗性(王立等,2024)。
阐明抗药性机理是抗药性治理的基础。因此,研究并阐明害虫对氯虫苯甲酰胺的抗药性机理,将有助于保护双酰胺类杀虫剂的使用命寿,并为新药剂的研发提供新思路。FKBP已成为多个领域中备受关注的主题,其可以影响产前发育和许多人类疾病发病机制的多种细胞和分子途径。FKBP具有免疫抑制、凋亡等功能,其不同的异构体调节不同的细胞途径,因此,FKBP可为药物研发提供一系列的药物靶点。FKBPs在不同生物体内与多种受体信号通路相互作用,钙调磷酸酶(CaN)信号通路是其中之一。CaN信号通路由钙通道(Cch1)、转运蛋白(Mid1)、钙感觉蛋白(钙调素,CaM)、钙调素依赖性磷酸酶和钙调神经磷酸酶相互作用蛋白组成。FKBP通过与FK506结合抑制钙调磷酸酶A亚基(CnA)和钙调磷酸酶B亚基(CnB),从而抑制钙信号级联反应(Park etal.,2019)。张道刚等(2023)研究发现,FKBP46基因通过调控CaN参与飞蝗(Locusta migratoria)卵的滞育。FKBP59是瞬时受体电位样(TRPL)复合物——INAD信号复合物的一部分,通过与位于通道细胞质口附近的保守的亮氨酰—脯氨酰二肽相互作用,调节转录和蛋白质运输(Goel et al.,2001)。FKBP是RyR钙离子通道的调节蛋白,两者结合起到稳定通道关闭状态的作用。氯虫苯甲酰胺可结合在RyR跨膜区的伪电压传感器结构域中,激活钙离子通道,使其不能正常关闭,从而导致Ca2+释放量增加,引起害虫的肌肉收缩并最终死亡(Bultyncketal.,2000;MacMillan et al.,2008)。由氯虫苯甲酰胺和FKBP蛋白的作用特点可知,两者存在必然联系。因此,研究FKBP基因在小菜蛾抗氯虫苯甲酰胺中的作用具有重要意义。Ghartey-Kwansah等(2018)研究发现,黑腹果蝇(Drosophila melanogaster)中8个已知的FKBP基因与人类(Homo sapiens)FKBP12基因具有同源性,其功能也具有多样性。因此,研究哺乳动物和黑腹果蝇中FKBP基因功能方面的差异,有助于设计新型杀虫剂。本研究中FKBP基因为前期从氯虫苯甲酰胺抗性小菜蛾种群的转录组分析得到的差异表达基因,经NCBI检索后发现,其与多种生物的FKBP基因具有同源性;其中,FKBP8基因与人类FKBP基因序列相似性和一致性分别为83%和30%,E值为8e-43,由此可推断3个FKBP基因在小菜蛾体内具有重要功能。
本研究克隆得到3个FKBP基因,分别为FKBP12、FKBP52和FKBP8。FKBP12基因是目前研究最多的FKBP基因,其与信号转导密切相关,具有参与细胞信号转导、蛋白质转运、细胞凋亡和转录等多种生理功能(刘国通和杨成明,2006;Maruyama et al.,2011)。FKBP12是2种结构相关药物FK506和雷帕霉素的主要靶点,其与FK506或雷帕霉素结合后,分别抑制钙调神经磷酸酶和雷帕霉素复合物1的靶标(TORC1);FKBP12还具有调节RyR的功能,其与RyR钙离子释放通道的紧密联系,有利于向全电导水平跃迁,如FKBP12可动态改变RyR2的活性,即以高亲和力激活RyR2,并以低亲和力抑制RyR2(Kasahara,2021;Richardson et al.,2023)。FKBP12影响钙调神经磷酸酶依赖的磷酸化蛋白质组,促进一部分蛋白质的去磷酸化,从而导致α-突触核蛋白(α-synuclein,α-syn)毒性(Caraveo etal.,2017)。Gómez等(2004)研究表明,FKBP12.6过表达使Wistar大鼠(Rattus norvegicus)心肌细胞的总钙离子浓度瞬时增加(与肌浆网的钙超载有关),从而促进兴奋—收缩耦联。FKBP52与激素依赖性、应激反应和神经退行性疾病相关(Hanaki and Shimada,2023);其与瞬时电位离子通道(TRP)或TRPL结合,使Ca2+浓度升高(Goel et al.,2001)。FKBP8在免疫调节中发挥作用,参与细胞内运输和蛋白质折叠、细胞凋亡、细胞自噬、细胞生长和分化及癌症等病理过程(Agu-ileraetal.,2022)。FKBP8过表达显著减弱仙台病毒诱导的干扰素β启动子(IFN-β)、核转录因子(NF-κB)和干扰素刺激反应元件(ISRE)的激活;FKBP8过表达也降低了二聚体IRF3的活性,但增强了病毒的复制,而RNA干扰敲低FKBP8的表达则显示出相反的效果(Xu etal.,2019)。此外,FKBP8是雷帕霉素受体蛋白(mTOR)激酶的内在抑制剂,其通过mTOR激酶参与代谢调控(Zhang et al.,2021);其还通过将抗凋亡蛋白募集到线粒体抑制凋亡,影响mTOR激酶的调节及细胞缺氧反应的调节(Misaka et al.,2018;王红等,2019)。本研究发现,小菜蛾不同发育阶段的3个FKBP基因相对表达量均存在差异;氯虫苯甲酰胺抗性种群小菜蛾4龄幼虫表皮中的FKBP12和FKBP8基因相对表达量最高,显著高于敏感种群,而抗性种群4龄幼虫不同组织的FKBP52基因表达量均低于敏感种群,说明FKBP12、FKBP8和FKBP52基因可能在小菜蛾体内具有不同的功能。已有研究表明,FKBP蛋白在各组织中所处地位不同及其在不同组织与RyR各个亚型的亲和力不同,会导致其表达量有所差异(陈默,2013;范娟等,2015)。本研究还发现,抗性种群小菜蛾中3个FKBP基因的相对表达量均显著高于敏感种群,说明其可能通过表达量的变化以提高小菜蛾的免疫活性,进而增强小菜蛾对氯虫苯甲酰胺的抗药性。此外,FKBP8基因在高抗氯虫苯甲酰胺种群小菜蛾的中肠高表达,且显著高于敏感种群,说明其可能通过表达量的增高导致小菜蛾抗药性的变化。因此,FKBP8基因可能在小菜蛾对氯虫苯甲酰胺的抗性形成中具有重要作用。
4结论
克隆得到的3个FKBP基因FKBP52、FKBP8和FKBP12均由1个CDS组成。3个FKBP基因在氯虫苯甲酰胺抗性种群小菜蛾中均过量表达,其中FKBP8基因在高抗氯虫苯甲酰胺种群小菜蛾的中肠高表达,说明FKBP8基因可能通过过量表达参与小菜蛾对氯虫苯甲酰胺的抗药性。
参考文献(References):
陈鹃,柏亚罗.2021.双酰胺类杀虫剂的研发概况及在中国的登记情况[J].世界农药,43(3):22-34.[Chen J,Bai Y L.2021.Overview on Ramp;D of diamide insecticides and their registrations in China[J].World Pesticide,43(3):22-34.]doi:10.16201/j.cnki.cn10-1660/tq.2021.03.04.
陈默.2013.柞蚕线粒体控制区的结构特征与FK506结合蛋白基因的表达谱分析[D].沈阳:沈阳农业大学.[Chen M.2013.Structural characteristics of mitochondrial DNA control region and expression pattern of the FKBP genes from Antheraea pernyi[D].Shenyang:Shenyang Agricul-tural University.]
陈小平,柳爱平,关少飞,余蔚蔚,任叶果,刘兴平.2021.双酰胺类杀虫剂及其应用市场与防治刺吸式口器害虫前景[J].世界农药,43(11):1-12.[Chen X P,Liu AP,Guan S F,Yu W W,Ren Y G,Liu X P.2021.Diamide insecticides and their application market and prospect of controllingsucking pests[J].World Pesticide,43(11):1-12.]doi:10.16201/j.cnki.cn10-1660/tq.2021.11.01.
范娟,杨瑾,周鑫,董治龙,王李阳,Xu M M,牟玉莲,Nishi M,Issacs W,安书成,Takeshima H,Ma J J,徐学红.2015.Ryanodine受体的功能结构和调节因子[J].中国细胞生物学学报,37(1):6-15.[Fan J,Yang J,Zhou X,Dong Z L,Wang LY,Xu M M,Mou Y L,Nishi M,Issacs W,An S C,Takeshima H,Ma J J,Xu X H.2015.Ryanodine recep-tors:Functional structure and their regulatory factors[J].Chinese Journal of Cell Biology,37(1):6-15.]doi:10.11844/cjcb.2015.01.9002.
李振宇,肖勇,冯夏.2020.广东蔬菜害虫综合治理研究进展[J].广东农业科学,47(12):90-97.[Li Z Y,Xiao Y,Feng X.2020.Research progress in integrated management of vegetable pests in Guangdong[J].Guangdong Agricultural Sciences,47(12):90-97.]doi:10.16768/j.issn.1004-874x.2020.12.010.
刘菲,魏继福,孟铃,龚晓健,王永庆.2014.大环内酯类免疫抑制剂的研究进展[J].药学与临床研究,22(1):61-66.[Liu F,Wei J F,Meng L,Gong X J,Wang Y Q.2014.Research progress of macrolide immunosuppressive drugs[J].Pharmaceutical and Clinical Research,22(1):61-66.]doi:10.13664/j.cnki.pcr.2014.01.019.
刘国通,杨成明.2006.FK506结合蛋白12介导免疫抑制作用机制的研究进展[J].国际检验医学杂志,27(4):309-311.[Liu G T,Yang C M.2006.Research progress on the mechanism of immunosuppression mediated by FK506 binding protein 12[J].International Journal of Laboratory Medicine,27(4):309-311.]doi:10.3969/j.issn.1673-4130.2006.04.009.
刘嘉楠,程金金,孙星,周春丽,闫小龙,耿韧华,王冬兰,万群,余向阳.2023.水稻对三种常用农药的吸收及转运[J].江苏农业学报,39(1):53-64.[Liu J N,Cheng J J,Sun X,Zhou C L,Yan X L,Geng R H,Wang D L,Wan Q,Yu X Y.2023.Absorption and transport of three commonly used pesticides in rice[J].Jiangsu Journal of Agricultural Sciences,39(1):53-64.]doi:10.3969/j.issn.1000-4440.2023.01.007.
田野,李贝贝,崔志刚,农向群,张泽华,王广君,刘廷辉.2021a.东亚飞蝗FK506结合蛋白基因克隆及其免疫功能分析[J].植物保护学报,48(1):106-114.[Tian Y,Li B B,Cui Z G,Nong X Q,Zhang Z H,Wang G J,Liu T H.2021a.Cloning and immune functional analysis of FK506 binding protein gene in Locusta migratoriamanilensis[J].Journal of Plant Protection,48(1):106-114.]doi:10.13802/j.cnki.zwbhxb.2021.2021813.
田野,李贝贝,李霜,农向群,张泽华,刘廷辉,王广君.2021b.FK506结合蛋白FKBP52对金龟子绿僵菌侵染东亚飞蝗的影响[J].植物保护,47(2):37-45.[Tian Y,Li B B,Li S,Nong X Q,Zhang Z H,Liu T H,Wang G J.2021b.Effects of FK506-binding protein FKBP52 on Metarhi-zium anisopliae infesting Locusta migratoriamanilensis[J].Plant Protection,47(2):37-45.]doi:10.1668/j.zwbh.2020019.
王红,孙鹏,王岩,张武锔,张晟.2019.成骨细胞条件性FKBP8基因敲除小鼠模型构建[J].中国实验诊断学,23(8):1427-1430.[Wang H,Sun P,Wang Y,Zhang W J,Zhang S.2019.Construction of conditional knockout of FKBP8 in osteoblasts[J].Chinese Laboratory Diagnostics,23(8):1427-1430.]doi:10.3969/j.issn.1007-4287.2019.08.048.
王立,董蓓蓓,刘思彤,陈韵潇,杨凤霞,张帅,高聪芬.2024.稻纵卷叶螟对氯虫苯甲酰胺的抗性监测及其抗氯虫苯甲酰胺种群对其他双酰胺类杀虫剂的交互抗性[J].昆虫学报,67(4):1-9.[Wang L,Dong B B,Liu S T,Chen Y X,Yang F X,Zhang S,Gao C F.2024.Monitoring of chlorantraniliprole resistance in the rice leaffolder,Cnaphalocrocismedinalis(Lepidoptera:Pyralidae)and the cross-resistance of its chlorantraniliprole-resistant po-pulations to other diamides[J].Acta Entomologica Sinica,67(4):1-9.]doi:10.16380/j.kcxb.2024.04.006.
向立刚,李文红,郑苹,李凤良,汪汉成,余知和.2022.溴氰虫酰胺对小菜蛾肠道微生物群落及其代谢功能的影响[J].河南农业科学,51(10):96-105.[Xiang L G,Li W H,Zheng P,Li F L,Wang H C,Yu Z H.2022.Effects of cyan-traniliprole on intestinal microbial community and meta-bolic function of Plutellaxylostella(Linnaeus)[J].Jour-nal of Henan Agricultural Sciences,51(10):96-105.]doi:10.15933/j.cnki.1004-3268.2022.10.011.
尹仙枫,朱凯辉,王芳,张蓉,王福莲,涂雄兵.2024.绿僵菌与FKBP52联合使用对西花蓟马的毒力[J].植物保护学报,51(1):178-185.[Yin X F,Zhu K H,Wang F,Zhang R,Wang F L,Tu X B.2024.Synergistic toxicity of Metarhizium anisopliae and FKBP52 against the western flower thrips Frankliniella occidentalis[J].Journal of Plant Protection,51(1):178-185.]doi:10.13802/j.cnki.zwbhxb.2024.2023037.
曾铎.2023.FK506结合蛋白11通过MAPK通路调控骨肉瘤的发生[D].南昌:南昌大学.[Zeng D.2023.FK506-bin-ding protein 11 promotes the development of osteosarcoma via MAPK pathway[D].Nanchang:Nanchang University.]doi:10.27232/d.cnki.gnchu.2022.000446.
张道刚,陈俊,崔栋楠,李霜,潘凡,朱凯辉,涂雄兵,张泽华.2023.FKBP46对飞蝗卵滞育具有促进作用(英文)[J].植物保护学报,50(2):485-492.[Zhang D G,Chen J,Cui D N,Li S,Pan F,Zhu K H,Tu X B,Zhang Z H.2023.FKBP46 plays a role in promoting the egg diapause of the migratory locust,Locusta migratoria[J].Journal of Plant Protection,50(2):485-492.]doi:10.13802/j.cnki.zwbhxb.2023.2021161.
张新凤,张国,于居龙,束兆林.2024.氯虫苯甲酰胺与成膜剂复合拌种对水稻防御酶活性和稻纵卷叶螟防效的影响[J].江苏农业科学,52(5):134-140.[Zhang X F,Zhang G,Yu J L,Shu Z L.2024.Effects of chlorantraniliprole and film-forming agent on Cnaphalocrocismedinalis con-trol and defense enzyme activity of rice[J].Jiangsu Agri-cultural Sciences,52(5):134-140.]doi:10.15889/j.issn.1002-1302.2024.05.020.
赵丹丹,周丽琪,张帅,姚蓉,邱运霞,高聪芬.2017.二化螟对双酰胺类杀虫剂的抗药性监测和交互抗性研究[J].中国水稻科学,31(3):307-314.[Zhao D D,Zhou L Q,Zhang S,Yao R,Qiu Y X,Gao C F.2017.Resistance monitoring and cross-resistance to the diamides in the rice stem borer,Chilo suppressalis(Lepidoptera:Pyralidae)[J].Chinese Journal of Rice Science,31(3):307-314.]doi:10.16819/j.1001-7216.2017.6124.
周春丽,万群,程金金,蒋文奇,刘嘉楠,陆顺,张国,于居龙,曹崇江,余向阳.2023.6种生物刺激素对水稻吸收氯虫苯甲酰胺的影响[J].江苏农业科学,51(6):94-99.[Zhou C L,Wan Q,Cheng J J,Jiang W Q,Liu J N,Lu S,Zhang G,Yu J L,Cao C J,Yu X Y.2023.Effects of six biostimu-lants on chlorantraniliprole uptake in rice[J].Jiangsu Agri-cultural Sciences,51(6):94-99.]doi:10.15889/j.issn.1002-1302.2023.06.014.
Aguilera M O,Robledo E,Melani M,Wappner P,Colombo MI.2022.FKBP8 is a novel molecule that participates in theregulation of the autophagic pathway[J].Biochimica et Biophysica Acta(BBA)-Molecular Cell Researchs,1869(5):119212.doi:10.1016/j.bbamcr.2022.119212.
Barik S.2007.Immunophilins:For the love of proteins[J].Ce-llular and Molecular Life Sciences,63(24):2889-2900.doi:10.1007/s00018-006-6215-3.
Blackburn E A,Walkinshaw M D.2011.Targeting FKBP iso-forms with small-molecule ligands.[J].Current Opinion in Pharmacology,11(4):365-371.doi:10.1016/j.coph.2011.04.007.
Bultynck G,De Smet P,Weidema A F,Ver Heyen M,Maes K,Callewaert G,MissiaenL,Parys J B,De Smedt H.2000.Effects of the immunosuppressant FK506 on intracellular Ca2+release and Ca2+accumulation mechanisms[J].The Journal of Physiology,525(3):681-693.doi:10.1111/j.1469-7793.2000.t01-1-00681.x.
Campos M R,Silva T B,Silva W M,Silva J E,Siqueira H A.2015.Susceptibility of Tuta absoluta(Lepidoptera:Ge-lechiidae)Brazilian populations to ryanodine receptor modulators[J].Pest Management Science,71(4):537-544.doi:10.1002/ps.3835.
Caraveo G,Soste M,Cappelleti V,Fanning S,van Rossum D B,Whitesell L,Huang Y,Chung C Y,Baru V,Zaichick S.2017.FKBP12 contributes to alpha-synuclein toxicity by regulating the calcineurin-dependent phosphoproteome[J].Proceedings of the National Academy of Sciences of the United States of America,114(52):11313-11322.doi:10.1073/pnas.1711926115.
Ghartey-Kwansah G,Li Z G,Feng R,Wang L Y,Zhou X,Chen F Z,Xu M M,Jones O,Mu Y L,Chen S W,Bryant J,Isaacs W B,Ma J J,Xu X H.2018.Comparative analy-sis of FKBP family protein:Evaluation,structure,and func-tion in mammals and Drosophila melanogaster[J].BMC Developmental Biology,18(1):7.doi:10.1186/s 12861-018-0167-3.
Goel M,Garcia R,Estacion M,Schilling W P.2001.Regulation of Drosophila TRPL channels by immunophilin FKBP59[J].Journal of Biological Chemistry,276(42):38762-38773.doi:10.1074/jbc.M104125200.
Gómez A M,Schuster I,Fauconnier J,Prestle J,Hasenfuss G,Richard S.2004.FKBP12.6 overexpression decreases Ca2+spark amplitude but enhances[Ca2+]i transient in rat car-diac myocytes[J].American Journal of Physiology-Heart and Circulatory Physiology,287(5):H1987-H1993.doi:10.1152/ajpheart.00409.2004.
Hanaki S,Shimada M.2023.Impact of FKBP52 on cell prolife-ration and hormone-dependent cancers[J].Cancer Scien-ce,114(7):2729-2738.doi:10.1111/cas.15811.
Harrar Y,Bellini C,Faure J D.2001.FKBPs:At the crossroads of folding and transduction[J].Trends in Plant Science,6(9):426-431.doi:10.1016/s 1360-1385(01)02044-1.
Kang C B,Hong Y,Dhe-Paganon S,Yoon H S.2008.FKBP family proteins:Immunophilins with versatile biological functions[J].Neurosignals,16(4):318-325.doi:10.1159/000123041.
Kasahara K.2021.Physiological function of FKBP12,a pri-mary target of rapamycin/FK506:A newly identified role in transcription of ribosomal protein genes in yeast[J].Current Genetics,67(3)383-388.doi:10.1007/s00294-020-01142-3.
Li Y Y,Qu C,Zhang Q H,Zhang L P,Luo C,Wang R.2023.Baseline susceptibility,cross-resistance,and sublethal effects of broflanilide,a novel meta-diamide pesticide,in Spodoptera litura[J].International Journal of Molecular Sciences,24(6):5351.doi:10.3390/ijms24065351.
Li Z Y,Feng X,Liu S S,You M S,Furlong M J.2016.Bio-logy,ecology,and management of the diamondback moth in China[J].Annual Review of Entomology,61(1):277-296.doi:10.1146/annurev-ento-010715-023622.
Liu X,Wang H Y,Ning Y B,Qiao K,Wang K Y.2015.Resis-tance selection and characterization of chlorantraniliproleresistance in Plutellaxylostella(Lepidoptera:Plutellidae)[J].Journal of Economic Entomology,108(4):1978-1985.doi:10.1093/jee/tov098.
Livak K J,Schmittgen T D.2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,25:402-408.doi:10.1006/meth.2001.1262.
MacMillan D,Currie S,McCarron J G.2008.FK506-binding protein(FKBP12)regulates ryanodine receptor-evoked Ca2+release in colonic but not aortic smooth muscle[J].Cell Calcium,43(6):539-549.doi:10.1016/j.ceca.2007.09.002.
Maruyama M,Li B Y,Chen H Y,Xu X H,Song L S,Guati-mosim S,Zhu W Q,Yong W D,Zhang W J,Bu G X,Lin S F,Fishbein C,Lederer W J,Schild J H,Field L J,Rubart M,Chen P S,Shou W N.2011.FKBP12 is a critical regulator of the heart rhythm and the cardiac voltage-gated sodium current in MiceNovelty and signifi-cance[J].Circulation Research,108(9):1042-1052.doi:10.1161/CIRCRESAHA.110.237867.
Misaka T,Murakawa T,Nishida K,Omori Y,Taneike M,Omiya S,Molenaar C,Uno Y,Yamaguchi O,Takeda J,Shah A M,Otsu K.2018.FKBP8 protects the heart from hemodynamic stress by preventing the accumulation of misfolded proteins and endoplasmic reticulum-associated apoptosis in mice[J].Journal of Molecular and Cellular Cardiology,114:93-104.doi:10.1016/j.yjmcc.2017.11.004.
Park H S,Lee S C,Cardenas M E,Heitman J.2019.Calcium-Calmodulin-Calcineurin signaling:A globally conserved virulence cascade in eukaryotic microbial pathogens[J].Cell Hostamp;Microbe,26(4):453-462.doi:10.1016/j.chom.2019.08.004.
Richardson S J,Thekkedam C G,Casarotto M G,Beard N A,Dulhunty A F.2023.FKBP12 binds to the cardiac ryano-dine receptor with negative cooperativity:Implications for heart muscle physiology in health and disease[J].Philo-sophical Transactions of the Royal Society B,378(1879):20220169.doi:10.1098/rstb.2022.0169.
Sang S,Shu B S,Yi X,Liu J,Hu M Y,Zhong G H.2016.Cross-resistance and baseline susceptibility of Spodoptera litura(Fabricius)(Lepidoptera:Noctuidae)to cyantra-niliprole in the south of China[J].Pest Management Scien-ce,72(5):922-928.doi:10.1002/ps.4068.
Tong M M,Yu J.2015.FK506-Binding proteins and their diverse functions[J].Current Molecular Pharmacology,9(1):48-65.doi:10.2174/1874467208666150519113541.
Xu S S,Xu L G,Yuan C L,Li S N,Chen T,Wang WY,Li C S,Cao LZ,Rao H.2019.FKBP8 inhibits virus-induced RLR-VISA signaling[J].Journal of Medical Virology,91(3):482-492.doi:10.1002/jmv.25327.
Zhang J H,Yin Y N,Wang J H,Zhang J J,Liu H,Feng W W,Yang W,Zetter B,Xu Y J.2021.Prohibitin regulates mTOR pathway via interaction with FKBP8[J].Frontiers of Medicine,15(3):448-459.doi:10.1007/s 11684-020-0805-6.
Zhang S Z,Zhang X L,Shen J,Mao K K,You H,Li J H.2016.Susceptibility of field populations of the diamondback moth,Plutellaxylostella,to a selection of insecticides in Central China[J].Pesticide Biochemistry and Physiology,132:38-46.doi:10.1016/j.pestbp.2016.01.007.
(责任编辑麻小燕)

