基于转录组学解析超显性基因在烟叶生物量杂种优势形成中的作用机制













摘要:【目的】基于转录组学解析基因超显性效应在烟叶生物量杂种优势形成中的作用机制,为高产杂交种选育提供理论依据。【方法】以具有生物量杂种优势的杂交种(K326×GDH88)及其双亲为材料,通过测定烟草亲本与杂交种的生物量,确定杂种优势形成的关键时期,并采用转录组测序技术分析烟草烟叶生物量杂种优势相关差异表达基因(DEGs)及其表达模式。【结果】移栽后45~52 d杂交种的生物量出现正向杂种优势,移栽后45~52 d的中亲优势变化最大的阶段,且杂交种基因的表现模型从加性中亲模型转变为正向显性模型,故移栽后45 d是解析杂交种烟叶生物量形成关键时期。对移栽后45 d的样品进行转录组测序分析,结果发现杂交种与双亲之间存在2660个DEGs,超显性表达的DEGs有1683个,占比63.27%,可能是烟叶生物量杂种优势形成的主要原因。在超显性表达的DEGs中,有28个超显性上调表达的DEGs富集在光合作用相关通路上;10个超显性下调表达的DEGs富集在呼吸作用相关的蔗糖和淀粉代谢通路上,光合作用和呼吸作用中超显性表达的DEGs可能是调控杂交种生物量杂种优势形成的关键候选基因。【结论】烟草杂交种烟叶生物量杂种优势形成的关键时期是移栽后45 d。烟叶生物量杂种优势的形成主要受DEGs的超显性效应影响;光合作用和呼吸作用相关的DEGs超显性上调表达和超显性下调表达可能是烟叶生物量杂种优势的形成原因。
关键词:烟草;烟叶生物量;杂种优势;转录组学;超显性效应
中图分类号:S572.035.1文献标志码:A文章编号:2095-1191(2024)10-2966-14
Mechanisms of overdominance gene in the formation of biomass heterosis in tobacco leaves based on transcriptomics analysis
TAN Yong-yan1,ZENG Shuai-bo2,LU An-bin1,TANG Hua-jiang1,YANG Hao1,PENG Li-sha1,SHEN Si1,LIU Ren-xiang1*
(1Tobacco College,Guizhou University/Key Laboratory of Tobacco quality Research of Guizhou,Guiyang,Guizhou550025,China;2Tongren Company,Guizhou Tobacco Company,Tongren,Guizhou 554300,China)
Abstract:【Objective】This study aimed to elucidate the mechanisms by which overdominance gene contributed to biomass heterosis in tobacco leaves through transcriptomic analysis,thereby providing theoretical reference for the breeding of high-yield hybrids.【Method】The study utilized a hybrid(K326×GDH88)exhibiting biomass heterosis and its parental lines as experimental materials.By measuring the biomass of the tobacco parents and the hybrid,the critical period for heterosis formation was identified.Transcriptome sequencing technology was employed to analyze differen-tially expressed genes(DEGs)associated with biomass heterosis in tobacco leaves and their expression patterns.【Result】Positive heterosis in biomass was observed in the hybrid between 45 and 52 d after transplantation.The mid-parent advan-tage was the highest between 45 and 52 d post-transplantation.During this period,the gene expression model of the hybrid shifted from an additive mid-parent model to a positive dominance model,indicating that 45 d post-transplantation was the critical period for analyzing biomass formation in hybrid tobacco leaves.Transcriptome sequencing of samples col-lected 45 d after transplantation revealed 2660 DEGs between the hybrid and its parents.Of these,1683 DEGs(63.27%)exhibited overdominant expression,which was likely the primary cause of biomass heterosis in tobacco leaves.Amongtheoverdominantly expressed DEGs,28 were up-regulated and enriched in photosynthesis-related pathways,while 10 were down-regulated and enriched in sucrose and starch metabolism pathway related to respiration.These DEGs with over-dominant expression in photosynthesis and respiration were potential key candidate genes regulating biomass heterosis in hybrid.【Conclusion】The critical period for the formation of biomass heterosis in tobacco hybrid leaves is 45 d post-transplantation.The formation of biomass heterosis is primarily influenced by the overdominance effect of DEGs.Theoverdominant up-regulation and down-regulation of related DEGs in photosynthesis and respiration may be the underlying reasons for biomass heterosis in tobacco leaves.
Key words:tobacco;tobacco leaf biomass;heterosis;transcriptomics;overdominance effect
Foundation items:National Natural Science Foundation of China(32060510);Guizhou Tobacco Company Project(2022XM02);Bijie Tobacco Company Project(2024520500240064)
0引言
【研究意义】烟草(Nicotiana tabacum L.)是我国重要的叶用经济作物,其叶片生物量的大小直接决定了烟农的种植收益。杂种优势主要表现在杂交后代的长势、适应性、抗逆性和产量等性状优于双亲,近年来烤烟杂种优势利用研究成效显著(刘仁祥等,2016),已在烟草烟碱(王国琴,2015)、K+含量(罗雯,2022)、叶片数(梁婷等,2023)、根系生物量(皮凯,2023)等性状中开展了杂种优势研究,但性状不同,其遗传机制也不同。遗传学家对于杂种优势的解释提出了许多假说,其中显性假说、超显性假说和上位性假说被广泛认可和接受(Jones,1917;Stuber et al.,1992;曹立勇等,2003),但杂种优势的产生取决于物种、性状和遗传背景,单一的假说无法独立地解释杂种优势形成的遗传机制(Li etal.,2008)。因此,对具有生物量杂种优势的杂交组合进行转录组测序,以期解析杂种优势的形成机理,对明确烟叶生物量杂种优势的形成机制和提高丰产杂交种选配效率具有重要的研究意义。【前人研究进展】利用杂种优势可有效提高作物产量和品质,已在小麦(张爱民等,2002)、水稻(唐志明等,2021)、玉米(魏锋等,2022)等作物上得到了广泛的应用。烟草叶片生物量受许多因素影响,包括栽培措施(陆星星等,2012)、光照条件(魏明月等,2017)、烟株个体发育(刘国侠等,2018)和品种(悦飞雪等,2019)等因素,其中受品种因素影响最大(尹剑藤等,2011)。尹剑藤等(2011)对10个烟草品种的田间性状及烟叶组织结构进行比较,结果发现品种基因型差异是导致其生物量出现差异的主要原因。陆星星等(2012)对4个烤烟品种在耕地条件、土壤肥力和前作等不同耕作措施下的产量进行差异分析,结果发现同一品种烤烟在不同耕作措施下产量存在明显差异。刘国侠等(2018)对41个烟草品种产量与农艺性状进行相关分析,结果发现产量与节距和叶数呈显著正相关,而与茎围则呈显著负相关。悦飞雪等(2019)研究发现,在同一镉、铅胁迫水平下,15个不同基因型烟草的生物量之间存在明显差异,且在这2种胁迫下烟草生物量变化趋势基本一致。魏明月等(2017)对遮荫、自然光、强光3个光照强度下的盆栽烟草进行生物量及光合特性分析,结果发现不同光照环境对烟草生物量积累有显著影响,高光强条件对烟草生物量的积累有利,而弱光下则受到抑制。曾帅波(2023)研究发现,烟叶生物量遗传力高,杂种优势明显,可利用杂种优势进行烟叶生物量改良。【本研究切入点】随着基因测序技术的发展,转录组测序技术为解析杂种优势形成机制提供了可能(Nejat etal.,2018),且已在玉米(Wang et al.,2022)、油菜(Xiong et al.,2022)、水稻(Huang et al.,2023)等作物中开展相关研究,为杂种优势的形成机理解析提供了基础。本课题组前期发现,烟草杂交种烟叶生物量具有杂种优势,但对烟叶生物量杂种优势形成的相关机制及基因表达模式尚不明确,也未见相关研究报道。【拟解决的关键问题】以具有生物量杂种优势的杂交种(K326×GDH88)及其双亲为材料,通过测定烟草亲本与杂交种的生物量,确定杂种优势形成的关键时期,并采用转录组测序技术分析烟草烟叶生物量杂种优势相关基因及其表达模式,以期解析烟叶生物量杂种优势形成机制,为丰产杂交种的选育提供理论依据。
1材料与方法
1.1试验材料
以本课题组前期筛选获得的具有生物量杂种优势的杂交种(K326×GDH88)及其双亲为供试材料,由贵州省烟草品质研究重点实验室提供。RNAprep Pure Plant Kit试剂盒、FastKing gDNA Dispelling RT SuperMix试剂盒和Talent qPCR PreMix(SYBR Green)试剂盒购自天根生化科技(北京)有限公司。主要仪器设备:CFX96 Real-Time System(Bio-Rad公司)、凝胶成像系统(Bio-Rad公司)、冷冻离心机(Thermo-Fisher Scientific公司)、DYCP-44N电泳仪(上海新诺仪器设备有限公司)和LI-6400便携式光合测定仪(LICOR公司)。
1.2田间试验设计
试验于2022年在安顺市西秀区杨武乡贵州大学烟草科研基地进行,田间采用随机区组设计,设3次重复,每小区种植3行(行距1.10 m、株距0.55 m),每行15株,共计45株。土壤肥力中等且一致,田间栽培管理按优质烤烟种植规程进行,地块四周设置保护行(2~3行),每行第一株和最后一株不参与数据测定。
1.3测定项目及方法
1.3.1生物量测定生物量采用杀青烘干方式测定:将全株叶片于105℃下杀青30min,75℃烘干至恒重,测定其干重。
1.3.2光合性状测定于上午9:00-11:00在各小区挑选3株生长整齐的健壮烟株,采集其从下往上数第7~9叶,利用LI-6400便携式光合测定仪进行净光合速率测定。
叶绿素含量测定采用无水乙醇浸提法(努尔凯麦尔·木拉提等,2021),用紫外分光光度计分别在470、649和665 nm下测定吸光度,计算叶绿素含量(叶绿素含量=叶绿素a含量+叶绿素b含量)。
1.4转录组测序
1.4.1样品采集烟叶样品于团棵期(移栽后38 d)开始采集,每隔7 d取样1次,共取4次。各小区选取3株生长整齐的健壮烟株,选取从下往上数第7~9叶,利用打孔器分别取出一部分样品混合,置于离心管中,用液氮处理后存入-80℃冰箱用于后续试验分析。
1.4.2 RNA提取、文库构建及测序采用TRIzol法提取叶片组织中的RNA,并利用NanoDrop 2000超微量分光光度计进行纯度和浓度检测。质检合格的RNA样品用于cDNA文库构建,并用Agilent 2100生物分析仪进行cDNA文库质检,合格后使用Illu-mina NovaSeq 6000平台进行测序。
1.4.3差异表达基因筛选通过HISAT2(Version 2.1.0)将Clean reads与烟草基因组进行比对,并对比对结果进行质检。再通过RSEM结合基因组比对结果和注释文件,获取每个样本基因/转录本的Read Counts,并进行FPKM转换,得到标准化的基因表达量。然后使用DESeq2(Version 1.10.1)进行差异表达分析,以Plt;0.05且Fold Change≥1.5或Fold Change≤0.67为条件筛选出差异表达基因(Differen-tially expressed genes,DEGs)。
1.4.4基因表达模式分类将DEGs的表达量矩阵数据导入STEM(http://www.cs.cmu.edu/~jernst/stem/)中,归一化处理后进行聚类分析(Ernst and Bar-Joseph,2006)。根据聚类分析结果,对基因的表达模式进行划分。
1.4.5 GO功能注释和KEGG信号通路富集分析将DEGs导入GO数据库,将DEGs分成生物学过程(Biological process)、细胞组分(Cellular component)和分子功能(Molecular function)三大类,分析其在功能上的差异。利用KEGG数据库解析DEGs参与的信号通路,并进行分类,筛选出显著(Plt;0.05)富集的信号通路,深入解析DEGs的生物学功能。
1.5实时荧光定量PCR检测
根据转录组数据选择6个DEGs,获得其编码区(CDS)全长,利用Primer 5.0设计其扩增引物(表1),委托北京擎科生物科技有限公司合成。以烟草LR25(GenBank登录号:LI890)为内参基因,利用Talent qPCR PreMix(SYBR Green)试剂盒对6个DEGs进行实时荧光定量PCR检测。反应体系20.0μL:2×qPCR PreMix 10.0μL,正、反向引物(10μmol/L)各0.6μL,65.9μmol/L cDNA模板2.0μL,ddH2O补足至20.0μL。扩增程序:95℃预变性3 min;95℃5 s,退火温度(表1)10 s,75℃15 s,进行40个循环。采用2-ΔΔCt法计算DEGs的相对表达量(Livak and Schmittgen,2001)。
1.6杂交种基因表达模式划分及杂种优势计算
杂交种基因的表达模式按照Stupar(2008)的方法进行划分。用F1表示杂种一代的数值。当F1高于高亲值10%以上,说明杂交种基因超显性表达;当F1介于亲本值的-10%~10%,说明杂交基因显性表达;当F1介于双亲平均值的-10%~10%,说明杂交种基因加性表达;不符合以上情况的定义为其他。
根据陈泽辉(2009)的方法计算烟叶生物量杂种优势,包括中亲优势(MPH)和超亲优势(HPH),计算公式如下:
MPH(%)=(F1-MP)/MP×100
HPH(%)=(F1-HP)/HP×100
式中,MP表示双亲平均值;HP表示高亲值。
1.7统计分析
采用Excel 2019计算数据平均值、标准差及烟叶生物量杂种优势。利用SPSS 26.0进行单因素方差分析和Duncan’s多重比较,并利用GraphPad Prism 9.4绘制柱形图。
2结果与分析
2.1杂交种烟叶生物量形成关键时期分析
由表2和表3可知,移栽后38 d杂交种(K326×GDH88)的生物量小于双亲,中亲优势为-5%,移栽后45 d杂交种的生物量介于双亲之间,中亲优势为-1%,这2个时期中杂交种与双亲的生物量差异不显著(Pgt;0.05,下同),表现为负向生物量杂种优势;移栽后52 d杂交种表现出正向生物量杂种优势,中亲优势为18%,随后中亲优势下降,在移栽后59 d降至4%。由图1可知,移栽后38、45和59 d杂交种基因的表达模式为加性(中亲本)模型,移栽后52 d为正向显性模型,表明移栽后45~52 d杂交种的生物量出现正向杂种优势,移栽后45 d的中亲优势变化最大的阶段,且杂交种基因的表达模式从加性(中亲本)模型转变为正向显性模型,移栽后45 d是解析杂交种烟叶生物量形成关键时期。因此,选取移栽后45d所取样本进行转录组测序,深入分析杂交种烟叶生物量杂种优势的形成机制。
2.2杂交种与亲本间的转录组差异分析结果
2.2.1测序数据质量评估采用Illumina NovaSeq 6000测序平台对杂交种和亲本材料进行转录组测序,结果如表3所示。各样本Clean data均达10.24 Gb以上,Q20和Q30分别在97.45%和92.63%以上,GC含量为42.93%~43.55%。将各样品质控后的原始数据与烟草K326参考基因组(https://solgenomics.net/organism/Nicotiana_tabacum/genome)进行序列比对,对比率为95.92%~96.82%。可见,测序质量均已满足测序要求,可用于后续数据分析。
2.2.2杂交种与亲本间的DEGs分析为了解基因差异表达对生物量杂种优势的影响,对杂交种及双亲的基因表达情况进行比较,结果如图2所示。杂交种与K326比对组(KG vs K)共有918个DEGs,其中589个上调表达,329个下调表达;杂交种与GDH88比对组(KG vs G)共有2123个DEGs,其中1412个上调表达,711个下调表达;杂交种与双亲(K326和GDH88)比对组(KG vs K and G)有868个DEGs,其中503个上调表达,365个下调表达;排除杂交种与双亲之间重复的DEGs后,共筛选到2660个DEGs,推测这些DEGs与杂交种生物量杂种优势的形成有关。
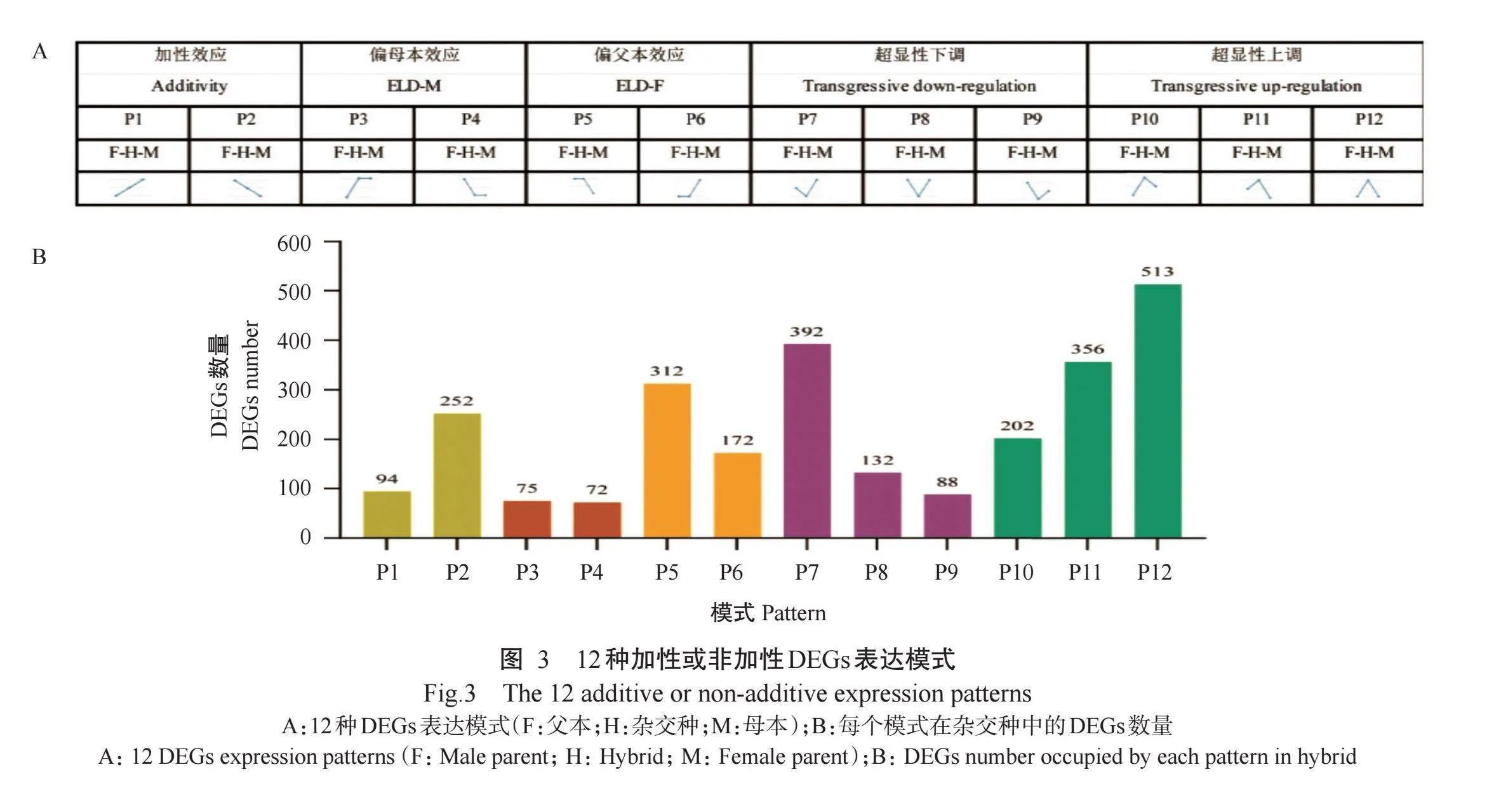
2.2.3 DEGs的表达模式分析结果为更深入分析杂交种与亲本间的DEGs,按Rapp(2009)的方法将DEGs划分成12种表达模式(P1~P12)。由图3-A可知,P1和P2模式为加性表达,其余模式为非加性表达;P3~P6模式为显性表达,其中P3~P4模式偏母本显性表达,P5~P6模式偏父本显性表达;P7~P12模式为超显性表达,其中P7~P9模式为下调超显性,P10~P12模式为上调超显性。DEGs表达模式分析结果(图3-B和表5)显示,在杂交种中,加性表达的DEGs有346个,占DEGs总数的13.01%,非加性表达的DEGs有2314个,占DEGs总数的82.99%。在非加性表达的DEGs中,显性表达的DEGs有631个,占DEGs总数23.73%;超显性表达的DEGs有1683个,占DEGs总数的63.27%,其中超显性下调表达的DEGs有612个,占23.01%,超显性上调表达的DEGs有1071个,占40.26%,表明杂交种和双亲间DEGs的非加性效应可能是导致生物量杂种优势形成的主要原因,其中基因超显性表达的影响最大。
2.2.4杂交种超显性表达的DEGs GO功能注释和KEGG信号通路富集分析结果
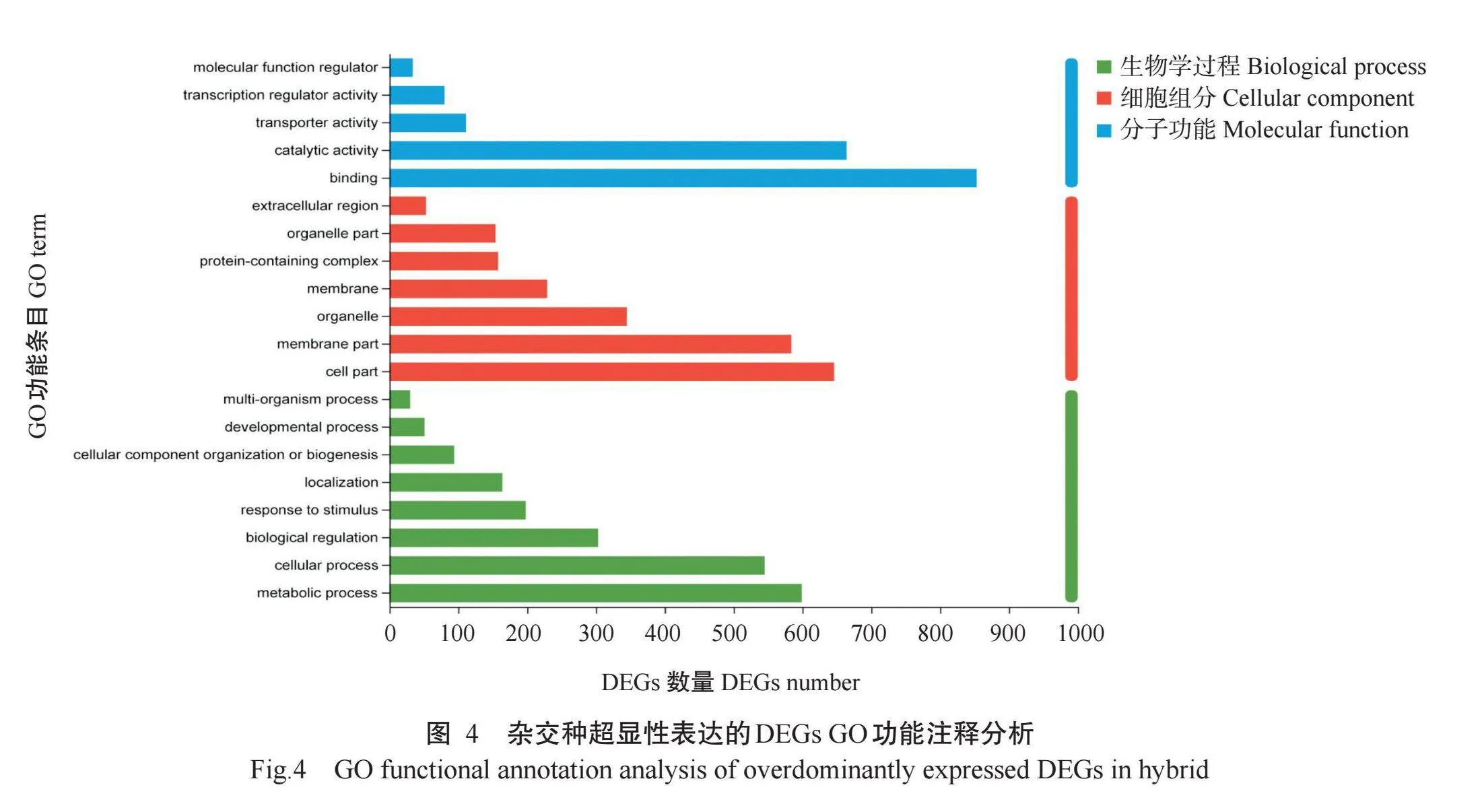
2.2.4.1 GO功能注释超显性表达的DEGs GO功能注释结果如图4所示。1683个超显性表达的DEGs被分成三大类,分别为分子功能、细胞组分和生物学过程。进一步深入分析发现,这些超显性表达的DEGs在分子功能中被注释到催化活性(Cata-lytic activity)、结合(Binding)、转录调节活性(Tran-scription regulator activity)和转录调节因子活性(Tran-scription factor activity)等5个条目,其中,催化活性和结合的DEGs较多,分别为664和853个,其次是转录调节活性和转录调节因子活性,分别为111和80个;在细胞组分中主要注释到膜部分(Membrane part)、细胞部分(Cell part)、细胞器(Organelle)和膜(Mem-brane)等7个条目,其中膜部分和细胞部分的DEGs较多,分别为584和646个,其次是细胞器和膜,分别为345和201个;在生物学过程中主要注释到刺激反应(Response to stimulus)、生物调节(Biological regu-lation)、细胞过程(Cellular process)和代谢过程(Meta-bolic process)等8个条目,其中,较多的DEGs被注释到细胞过程和代谢过程上,分别为545和599个,其次是生物调节过程和刺激反应过程,分别为303和198个。
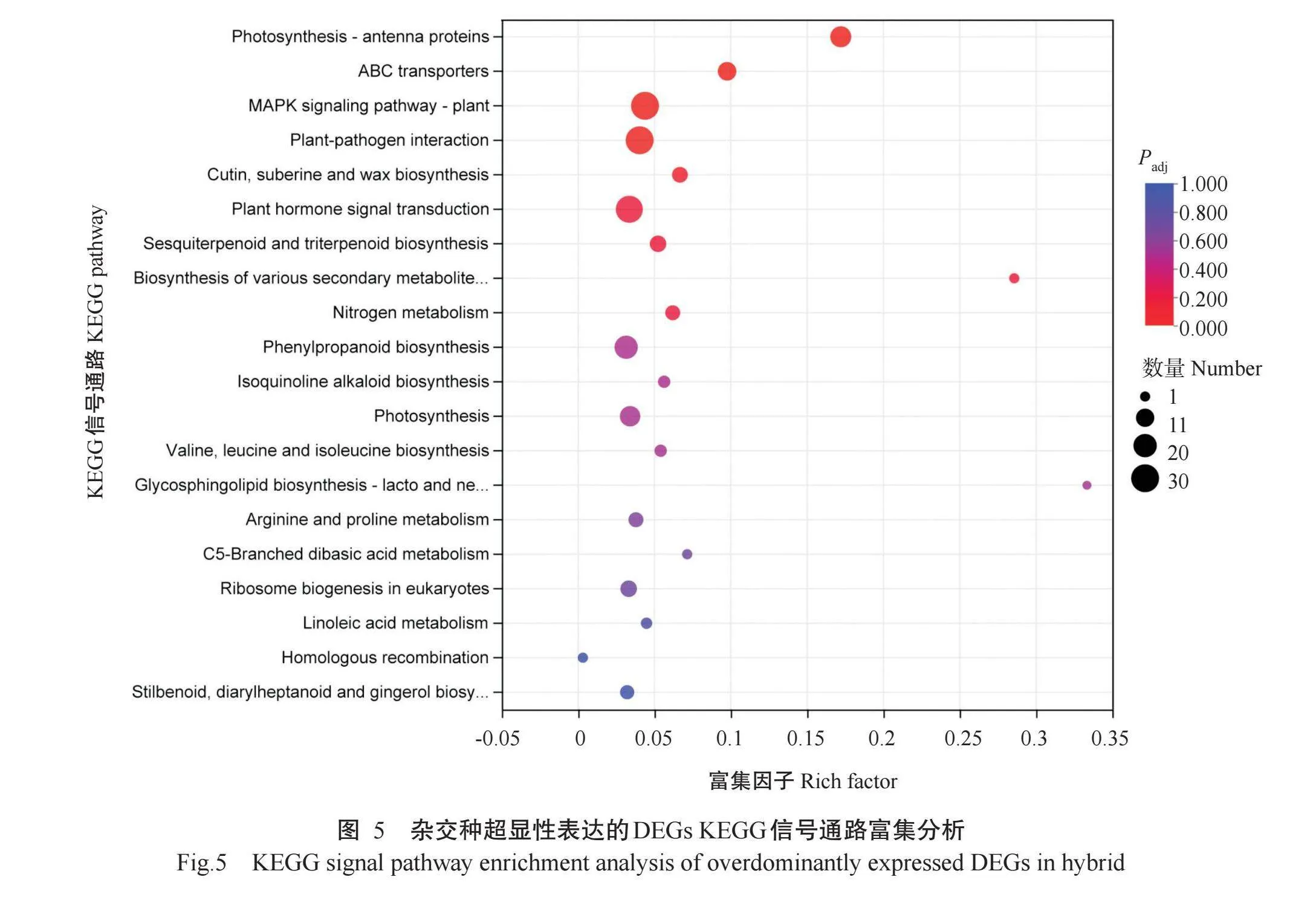
2.2.4.2杂交种超显性表达的DEGs KEGG信号通路富集分析为了解这些超显性表达的DEGs功能和代谢通路,对这些超显性表达的DEGs进行KEGG信号通路富集分析,结果显示,1683个超显性表达的DEGs被富集到99个信号通路上。对富集程度排名前20条信号通路进行分析,结果如图5所示。前20条信号通路包括光合作用—天线蛋白(Photosynthesis-antenna proteins)、ABC转运体(ABC transporters),MAPK信号通路(MAPK signaling pathway),植物病原体相互作用(Plant-pathogen interaction),角质、软碱和蜡的生物合成(Cutin,suberine and wax biosyn-thesis),植物激素信号转导(Plant hormone signal trans-duction),倍半萜和三萜的生物合成(Sesquiterpenoid and triterpenoid biosynthesis),苯丙素的生物合成(Phenylpropanoid biosynthesis)和光合作用(Photo-synthesis)等。在排名前20条信号通路中,与光合直接相关的通路如光合作用—天线蛋白通路和光合作用通路分别排名第1和第10,说明杂交种光合相关基因的超显性表达有助于烟叶生物量杂种优势的形成。
2.2.5超显性表达的DEGs在烟叶生物量杂种优势形成中的作用为了进一步探究超显性表达的DEGs对生物量杂种优势形成的影响,将超显性表达的DEGs划分为正向超显性表达和负向超显性表达,分别对其进行KEGG信号通路富集分析。由于光合作用和呼吸作用是同化物产生和消耗的主要途径,因此,后续对这2条途径及相关信号通路进行深入分析。
超显性上调表达的DEGs KEGG信号通路富集结果如图6所示。有28个超显性上调表达的DEGs被富集在光合作用相关的通路上(表6)。其中,光合作用—天线蛋白通路上有16个编码LHHCB1、LHCB2和LHCB3蛋白的DEGs超显性上调表达;光合作用通路上有12个超显性上调表达的DEGs,其中有1个超显性上调表达的DEGs编码Psb蛋白(位于光系统Ⅱ);有6个超显性上调表达的DEGs编码Psa蛋白(位于光系统Ⅰ)中;有3个超显性上调表达的DEGs编码Fd(位于光合电子传递);有2个超显性上调表达的DEGs编码F型ATP酶(F-type ATPase)亚基b。这些DEGs超显性上调表达使杂交种拥有更强的光合能力,在光能吸收和传递上起到重要作用,可产生更多的同化物,提高了杂交种的烟叶生物量。
超显性下调表达的DEGs KEGG信号通路富集结果如图7-A所示。有10个超显性下调表达的DEGs富集在蔗糖和淀粉代谢相关通路,其中,蔗糖分解过程中调控酶β-呋喃果糖苷酶和淀粉分解的α-淀粉酶DEGs超显性下调表达,减少了杂交种蔗糖和淀粉的分解,降低了果糖和葡萄糖的含量(图7-B)。蔗糖和淀粉是植物光合作用产物的重要存在形式,其分解产物是植物呼吸作用的重要底物,这些下调超显性表达的基因使蔗糖和淀粉的分解减弱,通过减少呼吸作用的底物含量来减弱杂交种的呼吸作用,减少了杂交种同化物的消耗,使杂交种拥有更高的生物量(图7-B)。筛选获得调控烟草生物量杂种优势的关键候选基因Nitab4.5_0004782g0020和Nitab4.5_0003280g0040(表7)。
2.3杂交种光合性状分析结果
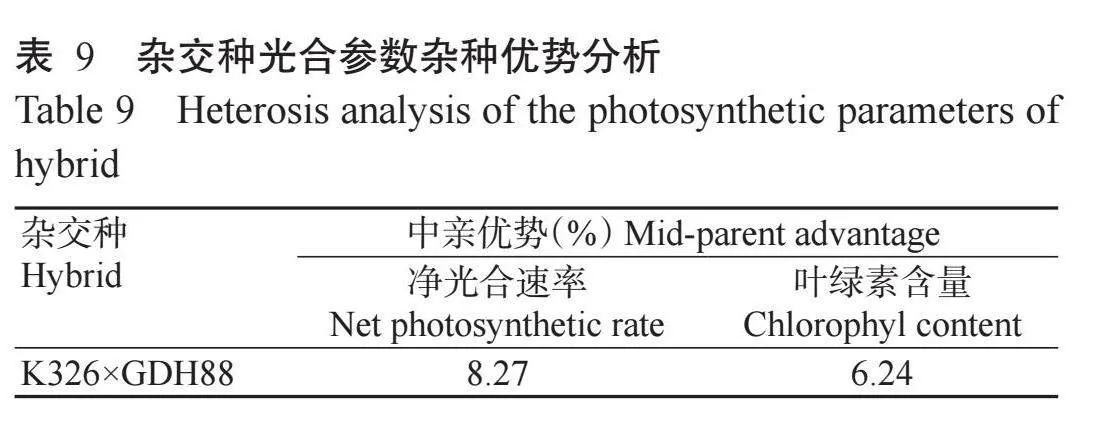
为进一步解析光合性状在生物量杂种优势形成中的重要作用,对杂交种及其亲本光合特性进行对比分析,结果(表8和表9)发现杂交种净光合速率介于双亲之间,为19.94μmol/(m2·s),与K326无显著差异,显著高于GDH88(Plt;0.05,下同),杂种优势值为8.27%,表现为正向优势;叶绿素含量以杂交种(K326×GDH88)最高,达2.73μg/cm2,与K326无显著差异,显著高于GDH88,杂种优势值为6.24%,表现为正向优势,表明超显性表达的光合相关基因可能提升了杂交种的叶绿素含量和净光合速率,从而形成了烟叶生物量杂种优势。
2.4实时荧光定量PCR验证结果
为了验证转录组测序结果的准确性,随机选择6个DEGs,以LR25基因为内参基因进行实时荧光定量PCR检测,结果(图8)显示,实时荧光定量PCR检测数据和转录组测序数据虽有部分差异,但基本表达趋势一致,说明转录组测序数据可靠。
3讨论
杂种优势利用作为提高作物产量和品质的重要途径之一,通过对杂种优势的利用可实现许多作物产量的提升(张爱民等,2002;唐志明等,2021;魏锋等,2022)。烟草作为我国重要的叶用经济作物,其叶片生物量的大小直接决定烟叶产量和烟农种植收益。本研究以具有烟叶生物量杂种优势的杂交种K326×GDH88及其亲本为材料,在移栽后不同时期对各材料生物量进行动态测量,最终确定移栽后45 d为生物量杂种优势形成关键时期。杂种优势的形成原因较复杂,Huang等(2011)在水稻中验证了基因的显性效应是杂种优势产生的原因;Shang等(2016)在陆地棉产量性状的杂种优势定位中发现,上位性是杂种优势产生的主要原因;Mo等(2022)从烟叶钾离子杂种优势形成的研究中发现基因的超显性效应发挥主要作用。本研究对杂种优势形成关键时期的样本进行转录组测序分析,结果发现63.27%的DEGs表现为超显性表达模式,说明烟叶生物量杂种优势主要受超显性表达的基因影响,与Stuber等(1992)、孙其信等(1997)的结果一致。
对超显性表达的DEGs进行KEGG信号通路富集分析,结果发现超显性上调表达的DEGs主要富集在光合作用—天线蛋白通路上,编码Lhcb1、Lhcb2和Lhcb3蛋白,这些蛋白收集光能并将光能传递到叶绿体的光合反应中心(Hasegawa et al.,2002),编码这类蛋白的DEGs超显性上调表达使杂交种具有更强的光合能力,与Joshi等(2023)沉默Lhcb1基因导致光合能力下降的结论基本一致。同时超显性上调表达的DEGs还富集在光合作用通路的光系统Ⅱ、光系统Ⅰ、光合电子传递链和F型ATP酶上,编码Psb、Psa、Fd、F型ATP酶亚基b等物质的作用,这些基因的超显性上调表达使杂交种在电荷分离、电荷稳定性、光保护、胁迫抗性(Sitaramametal.,2008;Pâques et al.,2013;Li et al.,2021)和ATP合成(Liu et al.,2019)等方面具有更强的能力,保证了光合作用高效运行。光合相关通路上超显性上调表达的DEGs使得杂交种具有更强的光合能力,可产生更多的同化物,为生物量杂种优势提供物质基础。
大多数植物光合产物的30%~60%会因为呼吸作用而被损耗(Cannell and Thornley,2000),故低呼吸速率与作物高产密切相关(Hauben etal.,2009)。在与呼吸作用相关的蔗糖与淀粉代谢通路中,调控蔗糖分解的β-呋喃果糖苷酶和淀粉分解的α-淀粉酶DEGs超显性下调表达,使得杂交种蔗糖和淀粉的分解能力减弱。蔗糖和淀粉是植物光合作用产物的主要存储方式,其分解产物果糖-6-磷酸(F6P)和葡萄糖是呼吸作用的重要底物(董文科等,2019)。杂交种蔗糖和淀粉的分解能力减弱导致杂交种同化物积累增加;同时,呼吸作用也因为底物的减少而减弱,与β-呋喃果糖苷酶(Fugate etal.,2024)和α-淀粉酶(谭彪等,2024)的活性和呼吸作用呈正相关性的结论一致。这些超显性下调表达的DEGs使得杂交种同化物的分解减弱,呼吸消耗降低,减少了同化物的消耗,使杂交种积累更高的生物量。
4结论
烟草杂交种烟叶生物量杂种优势形成的关键时期是移栽后45 d。烟叶生物量杂种优势的形成主要受DEGs的超显性效应影响;光合作用和呼吸作用相关的DEGs超显性上调表达和超显性下调表达可能是烟叶生物量杂种优势的形成原因。
参考文献(References):
曹立勇,占小登,庄杰云,郑康乐,程式华.2003.水稻产量性状的QTL定位与上位性分析[J].中国农业科学,36(11):1241-1247.[Cao LY,Zhan X D,Zhuang J Y,Zheng K L,Cheng S H.2003.QTL mapping and epistasis analysis for yield components in a RIL population of rice(Oryza sativa L.subsp.Indica)[J].Scientia Agricultura Sinica,36(11):1241-1247.]doi:10.3321/j.issn:0578-1752.2003.11.002.
曾帅波.2023.杂交种烟叶生物量优势形成的生理及分子基础研究[D].贵阳:贵州大学.[Zeng S B.2023.Physi-ological and molecular basis research on the formation of biomass dominance in hybrid tobacco leaves[D].Guiyang:Guizhou University.]
陈泽辉.2009.群体与数量遗传学[M].贵阳:贵州科技出版社.[Chen Z H.2009.Population and quantitative genetics[M].Guiyang:Guizhou Science and Technology Press.]
董文科,马祥,张玉娟,郭睿,张兆恒,张岩,马晖玲.2019.低温胁迫对不同早熟禾品种糖酵解代谢及其相关基因表达的影响[J].草地学报,27(6):1503-1510.[Dong W K,Ma X,Zhang Y J,Guo R,Zhang Z H,Zhang Y,Ma H L.2019.Effects of low temperature stress on glycolysis metabolism and related gene expression of different Poa pratensis varieties[J].Acta Agrestia Sinica,27(6):1503-1510.]doi:10.11733/j.ISSN.1007-0435.2019.06.006.
梁婷,阙远慧,姜超英,贾傛吏,段丽丽,黄莺,刘洋,刘仁祥.2023.烤烟品种韭菜坪2号叶片数的遗传分析[J].山地农业生物学报,42(1):70-74.[Liang T,Que Y H,Jiang C Y,Jia R L,Duan L L,Huang Y,Liu Y,Liu R X.2023.Genetic analysis of leaf number of flue-cured tobacco varie-ty Jiucaiping No.2[J].Journal of Mountain Agriculture and Biology,42(1):70-74.]doi:10.15958/j.cnki.sdnyswxb.2023.01.010.
刘国侠,冉法芬,李云,薛琳,李世金,朱启法,季学军,刘旦.2018.皖南地区不同烤烟种质产量产值与农艺性状的相关分析[J].科技通报,34(2):46-50.[Liu G X,Ran F F,Li Y,Xue L,Li S J,Zhu Q F,Ji X J,Liu D.2018.Analysis of correlation between yield and production value and agronomic traits in different varieties of flue-cured tobacco[J].Bulletin of Science and Technology,34(2):46-50.]doi:10.13774/j.cnki.kjtb.2018.02.011.
刘仁祥,夏志林,崔庆伟,喻奇伟,张庆明,聂琼,徐秀红,刘洋.2016.贵州烤烟育种工作进展与对策探讨[J].山地农业生物学报,35(4):1-6.[Liu R X,Xia Z L,Cui Q W,Yu Q W,Zhang Q M,Nie Q,Xu X H,Liu Y.2016.Prog-ress in tobacco breeding in Guizhou Province and discus-sion for solutions[J].Journal of Mountain Agricultural and Biology,35(4):1-6.]doi:10.15958/j.cnki.sdnyswxb.2016.04.001.
陆星星,龚兰芳,李明福,董军忠.2012.不同栽培条件与烤烟产质量关系分析[J].山地农业生物学报,31(3):231-234.[Lu X X,Gong L F,Li M F,Dong J Z.2012.Analy-sis of relationship between different cultivation conditions and yield and quality of flue-cured tobacco[J].Journal of Moun-tain Agricultural and Biology,31(3):231-234.]doi:10.15958/j.cnki.sdnyswxb.2012.03.017.
罗雯.2022.基于转录组学的烟叶钾含量杂种优势形成机理研究[D].贵阳:贵州大学.[Luo W.2022.Study on the formation mechanism of heterosis of potassium content in tobacco leaves based on transcriptome[D].Guiyang:Gui-zhou University.]
努尔凯麦尔·木拉提,杨亚杰,帕尔哈提·阿布都克日木,玛依努尔·吾斯曼.2021.小麦叶绿素含量测定方法比较[J].江苏农业科学,49(9):156-159.[Murat N,Yang Y J,Abudukerimu P,Osman M.2021.Comparative study on determination methods of chlorophyll content in wheat[J].Jiangsu Agricultural Sciences,49(9):156-159.]doi:10.15889/j.issn.1002-1302.2021.09.028.
皮凯.2023.烟草杂交种根系数量优势相关基因分析[D].贵阳:贵州大学.[Pi K.2023.Analysis of genes related to heterosis of tobacco root number[D].Guiyang:Guizhou University.]
孙其信,倪中福,陈希勇,刘志勇,黄铁城.1997.冬小麦部分基因杂合性与杂种优势表达[J].中国农业大学学报,2(1):64.[Sun Q X,Ni Z F,Chen X Y,Liu Z Y,Huang T C.1997.Heterozygosity and heterosis expression of some genes in winter wheat[J].Journal of China Agricultural University,2(1):64.]
谭彪,任慕瑶,杨正鹏,徐佳依,郑华斌,唐启源,王慰亲.2024.GA3和KNO2引发处理对水稻芽期生长、淀粉及呼吸代谢的影响[J].中国稻米,30(3):40-47.[Tan B,Ren M Y,Yang Z P,Xu J Y,Zheng H B,Tang Q Y,Wang W Q.2024.Effects of GA 3 priming and KNO2 priming on the seedling establishment,starch metabolism and respiratory metabolism of rice[J].China Rice,30(3):40-47.]doi:10.3969/j.issn.1006-8082.2024.03.006.
唐志明,马荣荣,王晓燕,陆永法,周华成,蔡克峰.2021.甬优系列籼粳杂交组合产量优势与亲本籼粳成分及农艺性状间的关系研究[J].杂交水稻,36(5):65-72.[Tang Z M,Ma R R,Wang X Y,Lu Y F,Zhou H C,Cai K F.2021.Relationship of yield heterosis of Yongyou series of indica-japonica hybrid combinations to the genetic distance and agronomical traits of parents[J].Hybrid Rice,36(5):65-72.]doi:10.16267/j.cnki.1005-3956.20200612.199.
王国琴.2015.烟草烟碱杂种优势表现及其基因差异表达分析[D].贵阳:贵州大学.[Wang G Q.2015.Studies on tobacco nicotine trait of heterosis and related gene differen-tial expression analysis[D].Guiyang:Guizhou University.]
魏锋,史大坤,卫晓轶,马毅,洪德峰,马俊峰,王稼苜,郑秋道.2022.不同玉米杂交种产量和品质性状的杂种优势分析[J].山东农业科学,54(12):25-30.[Wei F,Shi D K,Wei X Y,Ma Y,Hong D F,Ma J F,Wang J M,Zheng Q D.2022.Heterosis analysis of yield and quality charac-ters of different maize hybrids[J].Shandong Agricultural Science,54(12):25-30.]doi:10.14083/j.issn.1001-4942.2022.12.004.
魏明月,云菲,刘国顺,宋亮.2017.不同光环境下烟草光合特性及同化产物的积累与分配机制[J].应用生态学报,28(1):159-168.[Wei M Y,Yun F,Liu G S,Song L.2017.Response of photosynthetic characteristics and accumula-tion and distribution of assimilation products in tobacco to different light environments[J].Chinese Journal of Applied Ecology,28(1):159-168.]doi:10.13287/j.1001-9332.201701.010.
尹剑藤,李佛琳,杨焕文,段树苍,陈茂建,李成杰,蔡寒玉.2011.10个烤烟新品种田间性状及叶片组织结构的比较[J].中国农学通报,27(10):92-97.[Yin J T,Li F L,Yang H W,Duan S C,Chen M J,Li C J,Cai H Y.2011.Field property and leaf dissecting structure comparison in ten new flue-cured tobacco cultivars[J].Chinese Agricul-tural Science Bulletin,27(10):92-97.]
悦飞雪,李继伟,王艳芳,刘杉,王小东,陈明灿,刘领.2019.不同基因型烤烟对镉、铅富集特征评价[J].江苏农业科学,47(8):105-111.[Yue F X,Li J W,Wang Y F,Liu S,Wang X D,Chen M C,Liu L.2019.Evaluation of accumu-lation characteristics of cadmium and lead in tobacco with different genotypes[J].Jiangsu Agricultural Science,47(8):105-111.]doi:10.15889/j.issn.1002-1302.2019.08.024.
张爱民,刘冬成,聂秀玲,郭小丽,黄铁城.2002.杂种小麦育种的战略[J].中国农业科技导报,(5):42-48.[Zhang A M,Liu D C,Nie X L,Guo X L,Huang T C.Strategy of hybrid wheat breeding[J].Journal of Agricultural Science and Technology,(5):42-48.]doi:10.3969/j.issn.1008-0864.2002.05.011.
Cannell M G R,Thornley J H M.2000.Modelling the compo-nents of plant respiration:Some guiding principles[J].An-nals of Botany,85(1):45-54.
Ernst J,Bar-Joseph Z.2006.STEM:A tool for the analysis of short time series gene expression data[J].BMC Bioinfor-matics,7:191.doi:10.1186/1471-2105-7-191.
Fugate K K,Eide J D,Lafta A M,Tehseen M M,Chu C G,Khan M F R,Finger F L.2024.Transcriptomic and metabolomic changes in postharvest sugarbeetroots reveal widespread metabolic changes in storage and identify genes potentially responsible for respiratory sucrose loss[J].Frontiers in Plant Science,15:1320705.doi:10.3389/fpls.2024.1320705.
Hasegawa K,Yukawa Y,Sugita M,Sugiura M.2002.Organi-zation and transcription of the gene family encoding chlo-rophyll a/b-binding proteins in Nicotiana sylvestris[J].Gene,289(1-2):161-168.doi:10.1016/S0378-1119(02)00539-5.
Hauben M,Haesendonckx B,Standaert E,Van Der Kelen K,Azmi A,Akpo H,Van Breusegem F,Guisez Y,Bots M,Lambert B,Laga B,De Block M.2009.Energy use effi-ciency is characterized by an epigenetic component that can be directed through artificial selection to increase yield[J].Proceedings of the National Academy of Sciences ofthe United States of America,106(47):20109-20114.doi:10.1073/pnas.0908755106.
Huang X H,Zhao Y,Wei X H,Li C Y,Wang A H,Zhao Q,Li W J,Guo Y L,Deng L W,Zhu C R,Fan D L,Lu Y Q,Weng Q J,Liu KY,Zhou TY,JingY F,Si L Z,Dong G J,Huang T,Lu T T,Feng Q,Qian Q,Li J Y,Han B.2011.Genome-wide association study of flowering time and grain yield traits in a worldwide collection of rice germ-plasm[J].Nature Genetics,44(1):32-39.doi:10.1038/ng.1018.
Huang Z B,Ye J,Zhai R R,Wu M M,Yu F M,Zhu G F,Wang Z F,Zhang X M,Ye S H.2023.Comparative transcrip-tome analysis of the heterosis of salt tolerance in inter-subspecific hybrid rice[J].International Journal of Mole-cular Sciences,24(3):2212.doi:10.3390/IJMS24032212.
Jones D F.1917.Dominance of linked factors as a means of accounting for heterosis[J].Genetics,2(5):466-479.doi:10.1093/genetics/2.5.466.
Joshi J,Amthor J S,McCarty D R,Messina C D,Wilson M A,Millar A H,Hanson A D.2023.Why cutting respiratory CO2 loss from crops is possible,practicable,and pruden-tial[J].Modern Agriculture,1(1):16-26.doi:10.1002/moda.1.
Li G Y,Chen T T,Feng B H,Peng S B,Tao L X,Fu G F.2021.Respiration,rather than photosynthesis,determines rice yield loss under moderate high-temperature conditions[J].Frontiers Plant Science,12:678653.doi:10.3389/fpls.2021.678653.
Li L Z,Lu K Y,Chen Z M,Mu T M,Hu Z L,Li X Q.2008.Dominance,overdominance and epistasis condition the he-terosis in two heterotic rice hybrids[J].Genetics,180(3):1725-1742.doi:10.1534/geneti cs.108.091942.
Liu Y M,Qu J T,Zhang L,Xu X Y,Wei G,Zhao Z F,Ren M Z,Cao M J.2019.Identification and characterization ofthe TCA cycle genes in maize[J].BMC Plant Biology,19(1):592.doi:10.1186/s 12870-019-2213-0.
Livak K J,Schmittgen T D.2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta DeltaC(T))[J].Methods,25(4):402-408.doi:10.1006/meth.2001.1262.
Mo Z J,Luo W,Pi K,Duan L L,Wang P S,Ke Y Z,Zeng S B,Jia R L,Liang T,Huang Y,Liu R X.2022.Comparative transcriptome analysis between inbred lines and hybrids provides molecular insights into K+content heterosis of tobacco(Nicotiana tabacumL.)[J].Frontiers in Plant Scien-ce,13:940787.doi:10.3389/fpls.2022.940787.
Nejat N,Ramalingam A,Mantri N.2018.Advances in tran-scriptomics of plants[J].Adv BiochemEngBiotechnol,164:161-185.doi:10.1007/10_2017_52.
Pâques E L,García-Casas M D C,Charpentier J P.2013.Distri-bution of heartwood extractives in hybrid larches and in their related European and Japanese larch parents:Rela-tionship with wood colour parameters[J].European Jour-nal of Forest Research,132(1):61-69.doi:10.1007/s 10342-012-0654-1.
Rapp R A,Udall J A,Wendel J F.2009.Genomic expression dominance in allopolyploids[J].BMC Biology,7(1):18.doi:10.1186/1741-7007-7-18.
Shang L G,Liang Q Z,Wang Y M,Zhao Y P,Wang K B,Hua J P.2016.Epistasis together with partial dominance,over-dominance and QTL by environment interactions contri-bute to yield heterosis in upland cotton[J].Theoretical and Applied Genetics,129(7):1429-1446.doi:10.1007/s00122-016-2714-2.
Sitaramam V,Bhate R,Kamalraj P,Pachapurkar S.2008.Res-piration hastens maturation and lowers yield in rice[J].Physiology and Molecular Biology of Plants,14(3):253-271.doi:10.1007/s 1229 8-008-0024-0.
Stuber C W,Lincoln S E,Wolff D W,Helentjaris T,Lander E S.1992.Identification of genetic factors contributing to heterosis in a hybrid from two elite maize inbred lines using molecular markers[J].Genetics,132(3):823-839.doi:10.1093/genetics/132.3.823.
Stupar R M,Gardiner J M,Oldre A G,Haun W J,Chandler V L,Springer N M.2008.Gene expression analyses in maize inbreds and hybrids with varying levels of heterosis[J].BMC Plant Biology,8(1):33.doi:10.1186/1471-2229-8-33.
Wang L F,Li J,Lin Y,Dang K T,Wan J,Meng S J,Qiu X Q,Wang Q Y,Mu L Q,Ding D,Luo H B,Tang J H.2022.Comparative transcriptomics analysis at the key stage of maize ear development dissect heterosis[J].The Plant Ge-nome,16(1):e20293.doi:10.1002/tpg2.20293.
Xiong J,Hu K N,Shalby N,Zhuo C J,Wen J,Yi B,Shen J X,Ma C Z,Fu T D,Tu J X.2022.Comparative transcrip-tomic analysis reveals the molecular mechanism under-lying seedling biomass heterosis in Brassica napus[J].BMC Plant Biology,22(1):283.doi:10.1186/S12870-022-03671-0.
(责任编辑陈燕)

