基于高通量测序的云南雪茄烟叶微生物群落结构及功能分析



摘要:【目的】探究云南不同产地及用途雪茄烟叶农业发酵后烟叶微生物群落结构和多样性,为雪茄烟叶功能微生物筛选及提高雪茄烟叶发酵品质提供参考。【方法】以云南德宏、临沧和普洱3个产地不同用途(茄衣、茄芯、茄套)的雪茄烟叶为试验材料,基于高通量测序技术分析微生物群落结构,并分析预测微生物群落代谢功能。【结果】按照97%相似性进行操作分类单元(OTU)聚类分析,共得到2393个OTUs,各个样品OTUs数在125~442,样品之间OTU数存在较大差异。同一产地不同用途烟叶样品的Chao1指数、ACE指数和Shannon指数有所差异,均表现为茄套烟叶高于茄衣和茄芯烟叶;同一用途不同产地烟叶样品比较,德宏和普洱2个产地烟叶样品的3个指数均高于临沧产地烟叶样品,具有更丰富的微生物种类。不同产地烟叶样品微生物以细菌为主,优势菌门主要为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)。不同用途烟叶优势菌属差异明显,3个产地茄衣烟叶中克雷伯杆菌属(Klebsiella)相对丰度占比较大,临沧和普洱茄芯烟叶中泛菌属(Pantoea)占主导地位,而3个产地茄套烟叶优势菌属种类更多元化且更丰富。KEEG和COG功能预测分析结果表明,9个烟叶样品微生物功能代谢途径和功能类型基本一致,但相对丰度存在较大差异。KEEG功能预测代谢通路主要有全局和概览地图、碳水化合物代谢、氨基酸代谢等;COG功能种类预测主要分布在未知功能、氨基酸运输和代谢、转录、无机离子运输和代谢、碳水化合物的运输和代谢等。【结论】烟叶用途是影响云南雪茄烟叶微生物多样性的重要因素,烟叶产地的影响相对较小,茄套烟叶微生物丰富度高于茄衣和茄芯烟叶。
关键词:雪茄烟叶;微生物群落;多样性;功能预测;云南
中图分类号:S572文献标志码:A文章编号:2095-1191(2024)10-2957-09
Microbial community structure and function of Yunnan cigar tobacco leaves based on high-throughput sequencing
LI Meng1,XIE Yun-xiao1,WANG Kai2,HAN Jing-mei2,HE Xiao-jian3,XIAO Dong2,MALin1*,RAO Zhi3*
(1College of Tobacco Science and Engineering,Zhengzhou University of Light Industry,Zhengzhou,Henan 450001,China;2Technology Center of China Tobacco Yunnan Industrial Co.,Ltd.,Kunming,Yunnan 650231,China;3Hongyun Honghe Tobacco(Group)Co.,Ltd.,Kunming,Yunnan 650231,China)
Abstract:【Objective】To explore the microbial community structure and diversity of cigar tobacco leaves after agri-cultural fermentation in different producing areas and uses in Yunnan,which could provide reference for screening func-tional microorganisms of cigar tobacco leaves and improving the fermentation quality of cigar tobacco leaves.【Method】The microbial community structure was analyzed based on high-throughput sequencing technology,and the metabolic functions of the microbial community were analyzed and predicted using cigar tobacco leaves with different uses(cigar wrapper,filler and binder leaves)from 3 origins,namely Dehong,Lincang and Pu’er in Yunnan,as the test materials.【Result】Operation taxonomic unit(OTU)cluster analysis was performed according to 97%similarity,and a total of 2393 OTUs were obtained.The number of OTUs in each sample ranged from 125 to 442,and there was a large difference between samples.The Chao1 index,ACE index and Shannon index of tobacco leaf samples of different uses from the same origin were different,all showed bindergt;wrapper and filler leaves.Comparing tobacco leaf samples for the same use but from different origins,the 3 indexes of tobacco leaf samples from Dehong and Pu’er were higher than those of Lincang tobacco samples,with more abundant microbial species.The microorganisms of cigar tobacco leaves from different producing areas were mainly bacteria,and the dominant phylum were Proteobacteria and Firmicutes.There were great differences in the dominant genera of tobacco leaves with different uses,with Klebsiella occupying a larger propor-tion of the cigar wrapper leaves from 3 origins,Pantoea dominated in the filler leaves from Lincang and Pu’er;and the dominant genera of the binder leaves from 3 origins were more diverse and abundant.The results of KEEG and COG func-tion prediction analysis showed that the microbial functional metabolic pathways and functional types of 9 tobacco samples were basically the same,but the relative abundance was greatly different.KEEG function prediction metabolic pathways were mainly global and overview maps,carbohydrate metabolism,amino acid metabolism,and the COG func-tion type prediction was mainly distributed in the unknown function,amino acid transport and metabolism,transcription,inorganic ion transport and metabolism,carbohydrate transport and metabolism.【Conclusion】The use of tobacco leaves is an important factor affecting the microbial diversity of cigar tobacco leaves in Yunnan,while the influence of producing area is relatively small,and the microbial richness of binder leaves is higher than that of cigar wrapper and filler leaves.
Key words:cigar tobacco leaves;microbial community;diversity;functional prediction;Yunnan
Foundation items:National Natural Science Foundation of China(21706244);Key Laboratory Project of China National Tobacco Corporation(110201503003);Key Project of China Tobacco Yunnan Industrial Co.,Ltd.(JB2022YL02)
0引言
【研究意义】雪茄是一种由经过调制及发酵后的烟叶卷制而成的特殊烟草制品(郑天飞,2022)。雪茄烟叶品质受多种因素影响,如栽培技术(陈栋等,2019)、品种(王琰琰等,2020)、采收方式(刘慧等,2021)、成熟度和晾制方式(叶科媛等,2022)等。发酵是雪茄生产的重要技术之一,对雪茄物理化学性质及吸食品质有重要影响(Hu etal.,2022;黄阔等,2023a);微生物在发酵过程中发挥着至关重要的作用,影响雪茄的香气和感官质量(张倩颖等,2020;Li et al.,2020)。近年来,高通量测序技术因具有操作简单、数据准确、速度快、通量高、周期短等优点(米其利等,2016),在微生物多样性分析中被广泛应用(韩凤等,2021;刘福童等,2022;Ansari et al.,2023;Blake et al.,2023)。因此,基于高通量测序技术分析雪茄烟叶微生物群落结构多样性及功能,对明确雪茄烟叶优势功能菌群、提升雪茄烟叶质量水平具有重要意义。【前人研究进展】目前,国内外关于雪茄烟叶微生物多样性的研究主要集中在雪茄烟叶微生物群落结构比较、雪茄烟叶发酵过程中的微生物变化等方面。Chattopadhyay等(2019)、Smyth等(2019)研究发现,雪茄烟叶细菌微生物群落以变形菌门(Proteobacteria)含量最高,属分类水平上以芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)和假单胞菌属(Pseudomonas)占主导地位;Liu等(2021)研究发现,雪茄烟叶发酵前后属分类水平上的微生物群落相对丰度变化明显,但在门分类水平上,变形菌门和子囊菌门(Ascomycota)始终是优势菌门;郑天飞等(2022)采用高通量测序技术对国内外雪茄烟叶进行分析,指出葡萄球菌属、假单胞菌属和鞘氨醇单胞菌属(Sphingomonas)为雪茄烟叶的优势菌属;黄阔等(2023b)、吴丽君等(2023)采用高通量测序技术对发酵过程中烟叶细菌群落多样性进行分析,发现细菌多样性呈下降趋势,优势菌属为不动杆菌属(Acinetobacter)、葡萄球菌属、克雷伯氏菌属(Klebsiella)和泛菌属(Pantoea)等;Zhang等(2023)研究得出雪茄烟叶发酵过程中的关键微生物为假单胞菌属、拟杆菌属(Bacteroides)、弧菌属(Vibrio)和曲霉属(Aspergillus),酶活性和发酵温湿度会影响发酵过程中微生物群落的变化;陈音等(2023)研究表明通过添加介质发酵雪茄烟叶可有效提高烟叶微生物群落多样性,延缓微生物群落演替速度,有改善雪茄烟叶香味的作用。【本研究切入点】近年来,我国雪茄市场发展迅速,但云南的雪茄原料技术研究较薄弱,雪茄烟叶发酵技术还不成熟(宋学茹等,2022)。因此,针对云南产地的雪茄烟叶微生物群落结构及功能预测尚需深入研究。【拟解决的关键问题】以云南3个产地不同用途的雪茄烟叶为试验材料,通过高通量测序技术分析微生物群落结构和多样性,探究雪茄烟叶微生物功能,为雪茄烟叶功能微生物的筛选及提高雪茄烟叶发酵品质提供参考。
1材料与方法
1.1试验材料
试验材料为云南中烟有限责任公司提供的云南德宏、临沧和普洱3个产区2020年生产的中部叶茄衣、茄套和茄芯,样品均经过农业发酵,醇化3年后取样。每个产区每类烟叶为1份,共9份样品,无菌条件下,对各雪茄烟叶样品进行随机取样,每个样品各取50 g,排掉自封袋中空气,置于-20℃冰箱密封保存。
1.2试验方法
1.2.1雪茄烟叶样品DNA提取在超净工作台无菌条件下,将雪茄烟叶样品剪成碎片,充分混匀,每个样品取1 g,根据HieffNGS®MaxUp II DNA Library Prep Kit for Illumina®试剂盒[翌圣生物科技(上海)股份有限公司]说明对样品微生物总DNA进行提取,并用1%琼脂糖凝胶电泳检验DNA纯度和浓度,所得DNA保存于-20℃冰箱备用,每个样品重复3次。
1.2.2 PCR扩增和高通量测序对9个样品细菌的16SrDNAV4~V5区和真菌的ITS1可变区进行PCR扩增。细菌扩增引物为27F(5'-AGAGTTTGATCCT GGCTCAG-3')和1492R(5'-ACGGCTACCTTGTTAC GACTT-3');真菌扩增引物为ITS1(5'-CTTGGTCAT TTAGAGGAAGTAA-3')和ITS4(5'-TCCTCCGCTT ATTGATATGC-3')。引物由生工生物工程(上海)股份有限公司合成。
反应体系20.0µL:DNA模板0.5µL,2×Taq Plus Master Mix II 10.0µL,细菌或真菌上、下游引物各0.5µL,ddH2O补足至20.0µL。扩增程序:95℃预变性15 min;95℃30 s,55℃(细菌)/60℃(真菌)1 min,72℃1.5 min,进行35个循环;72℃延伸6 min。PCR扩增产物置于-20℃冰箱保存备用。
用2.0%琼脂糖凝胶电泳对PCR产物进行检测,将合格的PCR产物利用Hieff NGSTM DNA Selection Beads试剂盒[翌圣生物科技(上海)股份有限公司]进行纯化回收,以Illumina HiSeq 2500高通量测序仪(美国Illumina公司)进行高通量测序。
1.3宏基因组高通量测序分析
将高通量测序得到的双端序列数据用fastp进行质控过滤,使用基于De Bruijn graph原理的拼接软件megahit对Clean reads进行多样本混合拼接;将各样本的Clean reads使用Bowtie2比对至组装后的contigs上,获取Unmapped PE reads;继续使用SPAdes对未比对Reads进行混合拼接;对于2次拼接组装生成的contigs,过滤小于500 bp的序列后进行统计和后续基因预测等下游分析。
使用DIAMOND将基因集蛋白序列与Nr数据库进行BLASTp同源性比对,得到功能注释和同源物种信息,筛选条件:E-valuelt;1e-5,Scoregt;60。同时根据NCBI的微生物分类学信息数据库,获得基因的物种分类注释信息,并在门分类水平与属分类水平上统计物种的相对丰度。使用DIAMOND将基因集蛋白序列与KEGG数据库和eggNOG数据库进行对比,获得基因对应的KO号和COG,在此基础上对基因进行功能注释,并统计各功能层级在各个样本中的丰度。
1.4统计分析
将有效数据在97%水平上聚类成操作分类单元(Operation taxonomic unit,OTU),基于OTUs聚类结果,通过Alpha多样性指数、门分类水平和属分类水平上微生物群落相对丰度及微生物功能预测等对雪茄烟叶样品进行注释与评估。
试验数据采用Excel 2016进行整理分析,用Chiplot(https://www.chiplot.online/)作图。
2结果与分析
2.1云南雪茄烟叶微生物OTU聚类与Alpha多样性分析
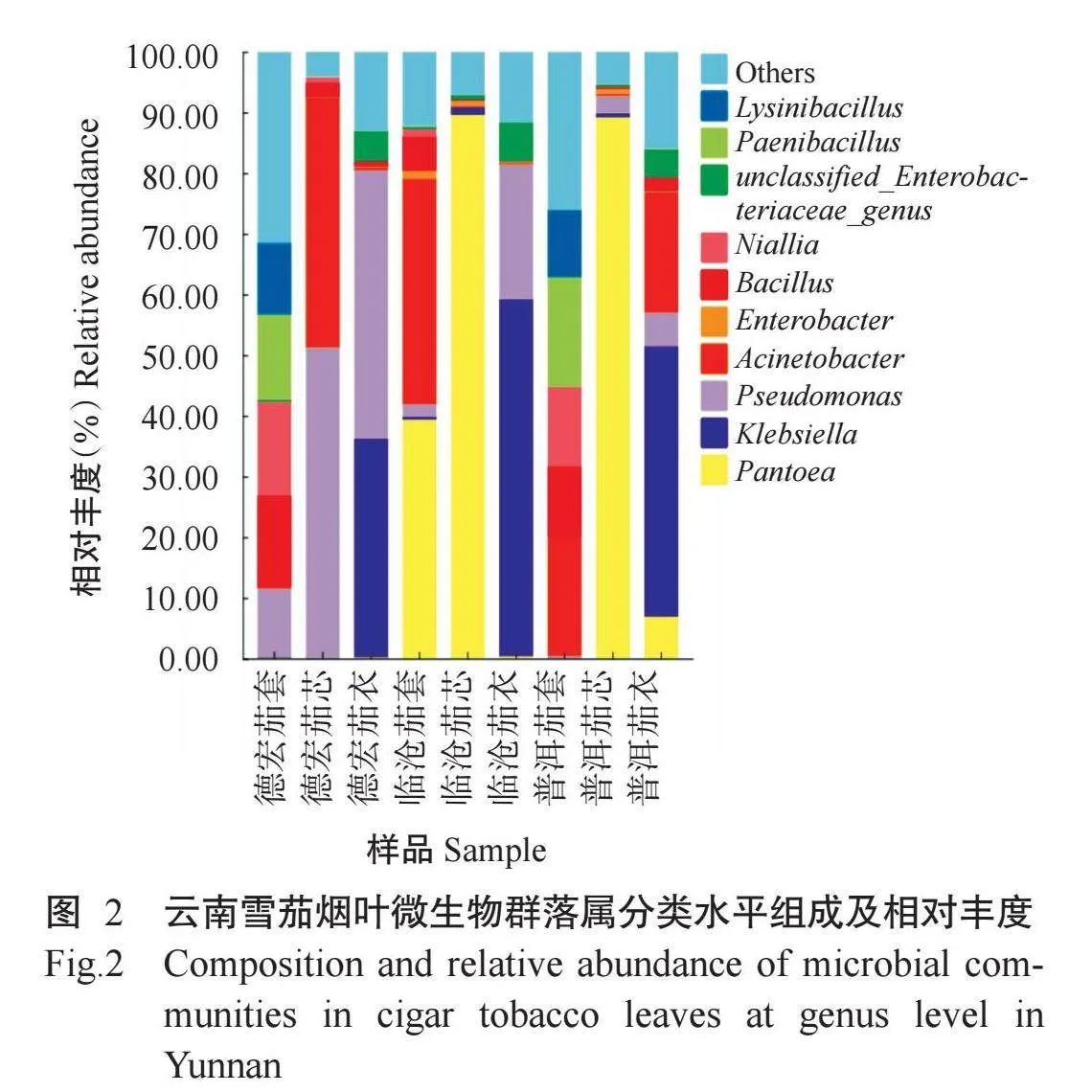
高通量测序结果(表1)表明,测序覆盖度均在99%以上,测序结果能覆盖雪茄烟叶表面微生物群落多样性,具有较好的代表性和研究意义,不同产地及用途雪茄烟叶样品微生物多样性存在明显差异。
按照97%相似性进行OTU聚类分析,共得到2393个OTUs,各个样品OTUs数量在125~442,样品之间OTU数量存在较大差异。从产地来看,普洱烟叶样品的OTUs数量最多,临沧最少。同一产地不同用途烟叶样品OTUs数量差异明显,均表现为茄套gt;茄衣gt;茄芯。同一用途不同产地烟叶样品进行比较,均表现为普洱gt;德宏gt;临沧。
从Alpha多样性指数来看,同一产地不同用途的烟叶样品Chao1指数、ACE指数和Shannon指数存在一定差异,均表现为茄套高于茄衣和茄芯,茄衣与茄芯差别不大,说明茄套烟叶微生物物种最多,物种多样性最丰富;同一用途不同产地的烟叶进行比较,临沧烟叶的Chao1指数、ACE指数和Shannon指数均最低,与OTUs数量表现一致,说明临沧雪茄烟叶的微生物物种较少,微生物群落多样性丰富度较低,而普洱和德宏雪茄烟叶的微生物多样性较丰富。
2.2云南雪茄烟叶微生物群落组成分析
2.2.1烟叶微生物群落门分类水平组成云南雪茄烟叶在门分类水平上的物种组成如图1所示。相对丰度较高的微生物包括变形菌门、厚壁菌门(Fir-micutes)、放线菌门(Actinobacteria)、未分类细菌门(unclassified_Bacteria_phylum)、尾噬菌体门(Urovi-ricota)、子囊菌门、拟杆菌门(Bacteroidetes)、担子菌门(Basidiomycota)、毛霉门(Mucoromycota)和霍夫奈病毒门(Hofneiviricota)。9个样品细菌相对丰度占比均超过99.84%,而真菌占比均低于0.09%,表明供试样品微生物群落优势微生物主要为细菌。
由图1可知,不同产地及用途雪茄烟叶样品均以变形菌门和厚壁菌门为主要优势菌门,平均相对丰度分别为77.53%和20.39%。其中,德宏和普洱茄套烟叶的优势菌门为厚壁菌门,相对丰度分别为83.17%和76.76%,与其他烟叶样品出现较大差异,其他烟叶样品的优势菌门为变形菌门,相对丰度均在85.00%以上。
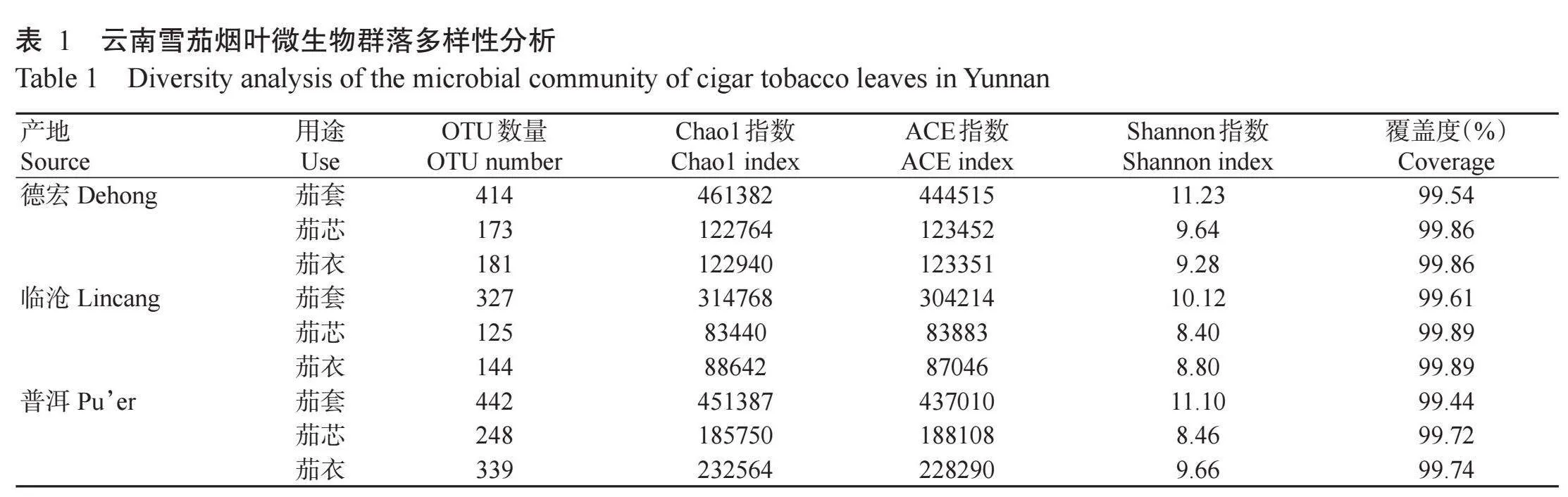
2.2.2烟叶微生物群落属分类水平组成云南雪茄烟叶样品微生物群落属分类水平分析结果如图2所示。烟叶样品的优势菌属平均相对丰度排名前10的有泛菌属(25.11%)、克雷伯杆菌属(Klebsiella,15.78%)、假单胞菌属(15.54%)、不动杆菌属(13.27%)、芽孢杆菌属(Bacillus,4.21%)、类芽孢杆菌属(Paeni-bacillus,3.60%)、尼亚利亚菌属(Niallia,3.45%)、赖氨酸芽孢杆菌属(Lysinibacillus,2.55%)、未分类肠杆菌属(unclassified_Enterobacteriaceae_genus,1.96%)和肠杆菌属(Enterobacter,0.41%)等。
由图2可知,从烟叶用途来看,克雷伯杆菌属为茄衣烟叶特有的优势菌属,在3个产地茄衣烟叶中的相对丰度均较高,且均高于茄芯和茄套烟叶,但产地之间差异较小,分别为临沧(58.83%)gt;普洱(44.55%)gt;德宏(44.27%)。未分类肠杆菌属在茄衣烟叶中平均相对丰度为5.27%,高于其在茄套和茄芯烟叶中的相对丰度(0.23%和0.36%),也属于茄衣烟叶优势菌属。泛菌属在临沧和普洱茄芯烟叶中占据主导地位,相对丰度均高达89.00%。与茄芯和茄衣烟叶相比,茄套烟叶的优势菌属更多元化且更丰富,尤其是德宏和普洱的茄套烟叶,优势菌属包括赖氨酸芽孢杆菌属、芽孢杆菌属、尼亚利亚菌属和类芽孢杆菌属等。
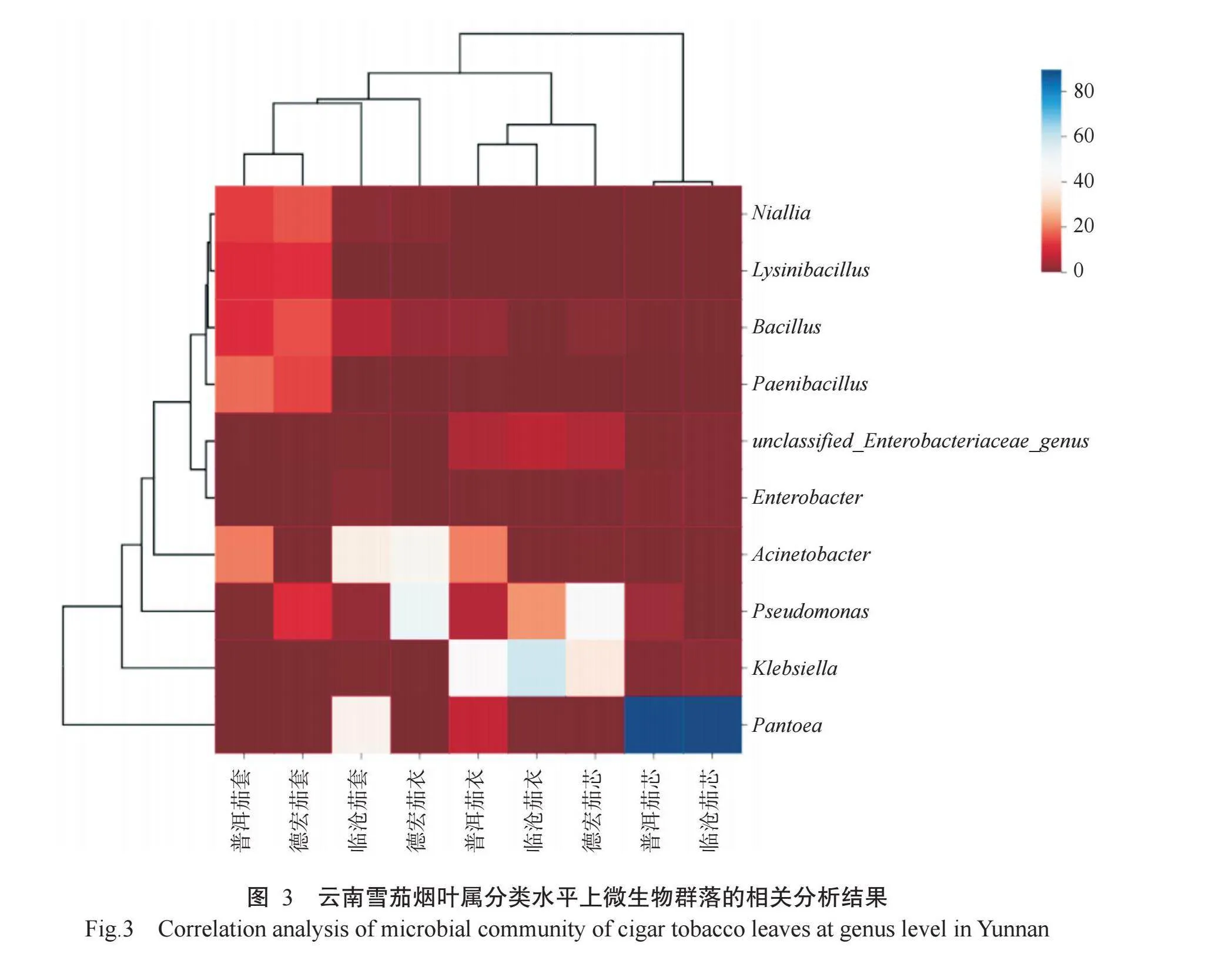
2.3云南雪茄烟叶微生物群落相关性分析
对属分类水平上平均相对丰度排名前10的菌群在各样品之间的物种进行聚类分析,将微生物群落呈现在热图上,颜色变化可反映出属分类水平上不同样品间的微生物群落结构相似性。颜色越蓝代表菌属在样品间的相对丰度越高,颜色越红代表菌属在样品间的相对丰度越低。由图3可看出,样品聚类结果与属分类水平微生物相对丰度分布结果基本一致,普洱茄芯烟叶和临沧茄芯烟叶聚在同一支上,说明这2个产地茄芯烟叶的群落结构较相似;同理,普洱茄套烟叶与德宏茄套烟叶2个样品的群落结构较相似。此外,相同用途的烟叶更易聚在同一分支。由此可知,雪茄烟叶微生物群落多样性受用途影响相对较大,与产地也有一定关系。
2.4云南雪茄烟叶样品微生物功能组成预测
2.4.1 KEGG代谢通路分析基于KEGG数据库二级通路的功能基因分析共富集到46条代谢通路,图4中展示9个样品代谢通路功能基因相对丰度前10的结果。由图4可知,主要代谢通路有全局和概览地图(Global and overview maps)、碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)、膜运输(Membrane transport)、能量代谢(Energy metabolism)等通路。不同产地及用途的雪茄烟叶样品主要富集在全局和概览地图通路上,其次,大多数样品富集在碳水化合物代谢、氨基酸代谢和膜运输等3个通路上。
2.4.2 COG功能注释分析将9个烟叶样品蛋白序列与eggNOG数据库进行比对,获得基因对应的COG。9个雪茄样品的基因功能大致可分为24类。图5中展示9个样品基因功能相对丰度前10的结果,功能基因相对丰度较高的依次为[S]:未知功能(Function unknown)、[E]:氨基酸运输和代谢(Amino acid transport and metabolism)、[K]:转录(Transcrip-tion)、[P]:无机离子运输和代谢(Inorganic ion trans-port and metabolism)、[G]:碳水化合物的运输和代谢(Carbohydrate transport and metabolism)等。根据结果分析可知,不同产地雪茄烟叶样品中涉及的COG功能种类基本一致,但功能的相对丰度有明显差异。
3讨论
本研究对云南普洱、德宏和临沧3个雪茄烟叶产地不同用途的烟叶表面微生物进行高通量测序分析,通过Alpha多样性分析、门分类水平和属分类水平微生物群落分析、功能预测等揭示了云南不同产地及用途烟叶表面微生物群落结构及功能。
本研究中,Alpha多样性分析结果表明,从烟叶用途来看,云南茄套烟叶具有更高的微生物群落多样性和丰富度,从产地来看,云南普洱烟叶的微生物群落多样性和丰富度总体较高;微生物群落结构分析结果表明,云南不同产地雪茄烟叶细菌相对丰度远高于真菌相对丰度,细菌对雪茄烟叶发酵的影响更加重要。细菌在发酵过程中主要使烟叶中的大分子物质转化为小分子,与挥发性香味成分有关,影响雪茄的吸食品质(张倩颖等,2020)。细菌在雪茄发酵过程中主要参与糖代谢、脂质代谢和氨基酸代谢3个代谢过程,而真菌主要依靠腐生作用降解木质素、纤维素和果胶以达到提高雪茄香气质量的作用(Zhang et al.,2023)。在门分类水平上,9种雪茄烟叶样品微生物优势菌门差异较小,主要为变形菌门和厚壁菌门,与田丽君等(2022)、郑天飞等(2022)对不同产地雪茄烟叶微生物群落及黄阔等(2023b)、Wu等(2023)对雪茄发酵过程中微生物群落结构变化的研究结果一致。变形菌门和厚壁菌门是植物的主要细菌类群,二者均可帮助根系吸收对植物有利的微量元素。变形菌门可调节土壤中的氮、碳、硫循环,提高植物生长速度,促进植物生长发育;厚壁菌门中芽孢杆菌为优势菌,可提高作物抵抗力,防治多种病害(刘京伟等,2021;唐杰等,2021)。在属分类水平上,不同产地及用途雪茄烟叶样品的优势菌属存在明显差异,茄衣的优势菌属主要有克雷伯杆菌属、假单胞菌属、不动杆菌属等,其中,克雷伯杆菌属是茄衣特有的相对丰度占比较高的优势菌属。研究发现,克雷伯杆菌属与香味成分呈正相关,特别是与β-大马酮、巨豆三烯酮、茄酮和苯乙醇等呈显著正相关,可极大提高卷烟香气质(李石头等,2023);假单胞菌属可降解烟碱,影响雪茄烟叶吸食劲头(徐慧等,2013);不动杆菌属不仅可有效抑制烟草黑胫病,还具有解磷解钾和烟碱降解的双重活性(孙明辉等,2015;刘天波等,2022)。泛菌属在临沧和普洱2个产地的茄芯烟叶中占据主导地位,在德宏产地茄芯烟叶中鲜少出现。泛菌属可降解烟叶中的类胡萝卜素等物质,生成香气物质,从而改善烟叶的香气质量(Zhao et al.,2015)。茄套烟叶的优势菌属更丰富且相对丰度占比相差不大,德宏和普洱2个产地的茄套烟叶微生物群落结构更相似,临沧产地茄套烟叶与其有明显差异。聚类分析也证明了上述结果,聚在同一分支上的烟叶样品群落结构较相似,无论是同一产地不同用途,还是同一用途不同产地的雪茄微生物群落结构均有差异,这可能是由雪茄烟叶土壤环境、气候条件、烟叶品种及栽培方式等因素不同而引起。此外,微生物生长环境不同也会导致其代谢活动产生差异,在雪茄烟叶发酵中发挥的作用也就不同,今后尚需深入研究。
本研究利用高通量测序技术对云南雪茄烟叶样品微生物功能进行预测分析,发现基于KEGG数据库二级通路的功能基因分析共富集到46条代谢通路,除全局和概览地图通路外,碳水化合物代谢和氨基酸代谢通路相对丰度占比较高。这2种代谢功能对于改善雪茄烟叶品质有重要作用,一方面,碳水化合物是形成香气物质的重要前提,如呋喃衍生物、简单的酮类和醛类等(徐伟等,2018;雷亚芳,2021);另一方面,氨基酸代谢中的氨基酸可与还原糖发生美拉德反应,形成多种含氮杂环化合物,与烟草香味相协调,与烟叶风味及品质密切相关(黎旺姐等,2016)。基于COG的功能注释分析,共注释到24种功能,功能基因相对丰度较高的依次为未知功能、氨基酸运输和代谢、转录、无机离子运输和代谢、碳水化合物的运输和代谢等,氨基酸运输和代谢主要参与氨基酸分解转化和蛋白质合成,为微生物提供必需的能量和碳源(刘超等,2023)。
结合雪茄烟叶微生物的功能预测结果,可有效筛选出对烟叶品质有改善作用的微生物,对于通过微生物发酵优化雪茄烟叶的工艺具有重要的实际应用价值。但功能预测具有不确定性,后续可通过宏转录组测序技术来深化对这些微生物功能的分析,以进一步提高预测的准确性和可靠性。这将为雪茄烟叶的微生物改良提供科学依据,并可能揭示新的微生物代谢途径和作用机制。
4结论
烟叶用途是影响云南雪茄烟叶微生物多样性的重要因素,烟叶产地的影响相对较小;不同用途的雪茄烟叶微生物多样性与注释基因功能无明显差异,而微生物群落丰富度以茄套烟叶最高。
参考文献(References):
陈栋,李猛,王荣浩,李林林,李秀妮,时向东.2019.国产雪茄茄芯烟叶研究进展[J].扬州大学学报(农业与生命科学版),40(1):83-90.[Chen D,Li M,Wang R H,Li L L,Li X N,Shi X D.2019.Progress of the domestic cigar filler tobacco[J].Journal of Yangzhou University(Agricultural and Life Science Edition),40(1):83-90.]doi:10.16872/j.cnki.1671-4652.2019.01.015.
陈音,孙贤,郑召君,蔡文,薛芳,刘元法,李东亮,刘路路.2023.加料发酵对茄芯烟叶化学成分及表面细菌多样性的影响[J].中国烟草学报,29(1):106-115.[Chen Y,Sun X,Zheng Z J,Cai W,Xue F,Liu Y F,Li D L,Liu L L.2023.Influences of feed fermentation on chemical com-positions and bacterial diversity of cigar filler tobacco[J].Acta Tabacaria Sinica,29(1):106-115.]doi:10.16472/j.chinatobacco.2021.064.
韩凤,林茂祥,章文伟,李巧玲,肖忠,谭秋生,杨毅,李品明.2021.多花黄精根腐病对根际土壤酶活性及真菌群落变化的影响[J].西南大学学报(自然科学版),43(4):53-61.[Han F,Lin M X,Zhang W W,Li Q L,Xiao Z,Tan Q S,Yang Y,Li P M.2021.Effects of Polygonatumcyrtone-ma root rot on rhizosphere soil enzyme activity and fungal community[J].Journal of Southwest University(Natural Science),43(4):53-61.]doi:10.13718/j.cnki.xdzk.2021.04.007.
黄阔,李栋,王彬,刘克建,陈宸,米强,王庚斗,马铭赛,史占东,孟庆华,范黎,叶长文.2023a.手工雪茄加工过程中细菌群落多样性与游离氨基酸含量的相关性分析[J].烟草科技,56(7):8-16.[Huang K,Li D,Wang B,Liu K J,Chen C,Mi Q,Wang G D,Ma M S,Shi Z D,Meng Q H,Fan L,Ye C W.2023a.Correlation between bacterial com-munity diversity and free amino acid content during hand-rolled cigar processing[J].Tobacco Scienceamp;Techno-logy,56(7):8-16.]doi:10.16135/j.issn 1002-0861.2022.0818.
黄阔,李栋,王彬,余君,刘克建,李青常,米强,孟庆华,范黎,叶长文.2023b.雪茄烟叶工业发酵过程中细菌群落多样性和结构变化[J].烟草科技,56(5):17-24.[Huang K,Li D,Wang B,Yu J,Liu K J,Li Q C,Mi Q,Meng Q H,Fan L,Ye C W.2023b.Variations of bacterial community diversity and structure of cigar tobacco during industrial fermentation[J].Tobacco Scienceamp;Technology,56(5):17-24.]doi:10.16135/j.issn 1002-0861.2022.0207.
雷亚芳.2021.不同酶制剂与香料处理对烟叶品质及微生物多样性的影响[D].杨凌:西北农林科技大学.[Lei Y F.2021.Effects of different enzyme preparations and spice treatments on the quality and microbial diversity of tobacco leaves[D].Yangling:Northwest Aamp;F University.]doi:10.27409/d.cnki.gxbnu.2021.000988.
黎旺姐,李勇,崔明昆,张刚,龚明.2016.烟草氨基酸代谢及其调控机制[J].安徽农业科学,44(21):15-19.[Li W J,Li Y,Cui M K,Zhang G,Gong M.2016.Amino acid metabolism and its regulation mechanism in tobacco plants[J].Journal of Anhui Agricultural Sciences,44(21):15-19.]doi:10.13989/j.cnki.0517-6611.2016.21.005.
李石头,潘凡达,黄晓玉,闫茗熠,田雨农,廖付,王辉,吴继忠.2023.基于宏基因组学的不同陈化时间烟草源功能微生物筛选[J].轻工学报,38(1):101-109.[Li S T,Pan F D,Huang X Y,Yan M Y,Tian YN,Liao F,Wang H,Wu J Z.2023.Screening of tobacco-derived functional micro-organisms with different aging time based on meta-genomics[J].Journal of Light Industry,38(1):101-109.]doi:10.12187/2023.01.012.
刘超,李奇,宋子洋,胡鹏,敬双怡,李卫平.2023.低温下磁性载体MBBR系统微生物群落特征和功能预测分析[J].环境科学,44(2):889-899.[Liu C,Li Q,Song ZY,Hu P,Jing S Y,Li W P.2023.Analysis of microbial community characteristics and function prediction of MBBR with mag-netic biocarriers at low temperature[J].Environmental Science,44(2):889-899.]doi:10.13227/j.hjkx.202203078.
刘福童,李茂森,陈敏,张赛,张福建,王生才,赵培炎,宋安东,方明,任天宝,刘国顺.2022.高碳基土壤修复肥对烤烟根际土壤细菌群落结构及烟叶产值的影响[J].河南农业大学学报,56(5):724-731.[Liu F T,Li M S,Chen M,Zhang S,Zhang F J,Wang S C,Zhao PY,Song A D,Fang M,Ren T B,Liu G S.2022.Effects of high carbon-based soil remediation fertilizer on bacterial community structure and output value of tobacco leaves in flue-cured tobacco rhizosphere soil[J].Journal of Henan Agricultural Univer-sity,56(5):724-731.]doi:10.16445/j.cnki.1000-2340.2022 0825.001.
刘慧,赵松超,武志勇,赵铭钦.2021.不同采收方式对雪茄烟上部叶晾制效果的影响[J].中国烟草学报,27(3):65-72.[Liu H,Zhao S C,Wu Z Y,Zhao M Q.2021.Effects of different harvesting methods on upper leaves air-curing of cigar[J].Acta Tabacaria Sinica,27(3):65-72.]doi:10.16472/j.chinatobacco.2020.t0060.
刘京伟,李香真,姚敏杰.2021.植物根际微生物群落构建的研究进展[J].微生物学报,61(2):231-248.[Liu J W,Li X Z,Yao M J.2021.Research progress on assembly of plant rhizosphere microbial community[J].Acta Microbio-logica Sinica,61(2):231-248.]doi:10.13343/j.cnki.wsxb.20200154.
刘天波,赵誉强,滕凯,周向平,肖艳松,蔡海林,肖志鹏,陈武,唐前君.2022.烟草疫霉拮抗细菌B44R-1的筛选及其生防效果[J].中国生物防治学报,38(6):1545-1552.[Liu T B,Zhao Y Q,Teng K,Zhou X P,Xiao Y S,Cai HL,Xiao Z P,Chen W,Tang Q J.2022.Screening and bio-control effect of antagonistic bacterium B44R-1 against Phytophthora parasitica[J].Chinese Journal of Biological Con-trol,38(6):1545-1552.]doi:10.16409/j.cnki.2095-039x.2022.06.012.
米其利,李雪梅,管莹,高茜,桂永发,朱洲海,夭建华.2016.高通量测序在食品微生物生态学研究中的应用[J].食品科学,37(23):302-308.[Mi Q L,Li X M,GuanY,Gao Q,Gui Y F,Zhu Z H,Yao J H.2016.Application of high-throughput sequencing in food microbial ecology:A review[J].Food Science,37(23):302-308.]doi:10.7506/spkx 1002-6630-201623049.
宋学茹,张立猛,卜令铎,黄智华,瞿兴,陈文华,张继来,苏友波.2022.云南不同产地醇化雪茄烟叶微生物群落差异研究[J].中国烟草科学,43(5):87-93.[Song X R,Zhang L M,Bu L D,Huang Z H,Qu X,Chen W H,Zhang J L,Su Y B.2022.Study on microbial community of alcoholized cigar leaves from different producing areas of Yunnan Province[J].Chinese Tobacco Science,43(5):87-93.]doi:10.13496/j.issn.1007-5119.2022.05.014.
孙明辉,孙会忠,李广良,朱金峰,陈冲.2015.1株兼有烟碱降解活性解磷菌的分离鉴定[J].基因组学与应用生物学,34(10):2176-2180.[Song M H,Sun H Z,Li G L,Zhu J F,Chen C.2015.Isolation and identification of a phospho-rus solubilizing strain with nicotine degradation activity[J].Genomics and Applied Biology,34(10):2176-2180.]doi:10.13417/j.gab.034.002176.
唐杰,陈知青,郭安南,裘琼芬.2021.不同作物根际土壤微生物的群落结构特征分析[J].核农学报,35(12):2830-2840.[Tang J,Chen Z Q,Guo A N,Qiu Q F.2021.Cha-racteristics of microbial community structure in the rhizo-sphere soil of different crops[J].Journal of Nuclear Agri-cultural Sciences,35(12):2830-2840.]doi:10.11869/j.issn.100-8551.2021.12.2830.
田丽君,荊永锋,郑卜凡,彭新辉,龚嘉蕾,吴涛,李正风,李振杰,田祥珅,周启运,龚嘉,黎娟.2022.浏阳洞库陈化烟叶微生物多样性分析[J].中国烟草学报,28(1):98-107.[Tian L J,Jing Y F,Zheng B F,Peng X H,Gong J L,Wu T,Li Z F,Li Z J,Tian X S,Zhou Q Y,Gong J,Li J.2022.Analysis of microbial diversity of aged tobacco leaves in Liuyang Cave[J].Acta Tabacaria Sinica,28(1):98-107.]doi:10.16472/j.chinatobacco.2020.T0088.
王琰琰,刘国祥,向小华,王俊,张瑞娜,佟英,李媛,戴培刚,张兴伟,吕洪坤.2020.国内外雪茄烟主产区及品种资源概况[J].中国烟草科学,41(3):93-98.[Wang YY,Liu G X,Xiang X H,Wang J,Zhang R N,Tong Y,Li Y,Dai P G,Zhang X W,LüH K.2020.Overview of main cigar pro-duction areas and variety resources at domestic and over-seas[J].Chinese Tobacco Science,41(3):93-98.]doi:10.13496/j.issn.1007-5119.2020.03.016.
吴丽君,张鸽,陈晓娜,张瑶,金永明,段如敏,邓帅军,白晓莉,王帆,张海波.2023.云南雪茄烟叶人工发酵过程中化学成分与细菌群落变化及其相关性分析[J].中国烟草学报,29(4):124-134.[Wu L J,Zhang G,Chen X N,Zhang Y,Jin Y M,Duan R M,Dang S J,Bai X L,Wang F,Zhang H B.2023.Changes in chemical composition and bacterial communities during fermentation of Yunnan cigar tobacco leaves and their correlation[J].Acta Tabacaria Si-nica,29(4):124-134.]doi:10.16472/j.chinatobacco.2022.T0220.
徐慧,党立志,杨根华,王明锋,夏建军,李青青,段焰青.2013.烟碱降解菌的筛选、鉴定及其降解性能的初步研究[J].云南大学学报(自然科学版),35(4):580-586.[Xu H,Dang L Z,Yang G H,Wang M F,Xia J J,Li Q Q,Duan Y Q.2013.A preliminary study on the screening,identification and degradation characteristics of nicotine degradation bacterium strain[J].Journal of Yunnan Uni-versity(Natural Sciences Edition),35(4):580-586.]doi:10.7540/j.ynu.20120414.
徐伟,葛阳阳,陈翠婷,马婷婷.2018.基于宏基因组技术分析传统红茶菌中菌群组成及其主要代谢通路[J].食品工业科技,39(5):119-123.[Xu W,Ge Y Y,Chen C T,Ma T T.2018.Microoraanism composition and main metabolic pathways analysis of traditional Kombucha by metage-nomic technology[J].Science and Technology of Food Industry,39(5):119-123.]doi:10.13386/j.issn 1002-0306.2018.05.023.
叶科媛,刘路路,卢瑞琳,向欢,刘仡,胡希,曾祥华,王俊.2022.不同成熟度和晾制方式对雪茄烟叶品质的影响[J].浙江农业科学,63(7):1584-1587.[Ye KY,Liu L L,Lu R L,Xiang H,Liu Y,Hu X,Zeng X H,Wang J.2022.Effect of maturity and air-curing methods on the quality of cigar tobacco leaves[J].Journal of Zhejiang Agricultural Sciences,63(7):1584-1587.]doi:10.16178/j.issn.0528-9017.20212990.
张倩颖,罗诚,李东亮,蔡文.2020.雪茄烟叶调制及发酵技术研究进展[J].中国烟草学报,26(4):1-6.[Zhang Q Y,Luo C,Li D L,Cai W.2020.Research progress in curing and fermentation technology for cigar tobacco leaf produc-tion[J].Acta Tabacaria Sinica,26(4):1-6.]doi:10.16472/j.chinatobacco.2019.339.
郑天飞,张倩颖,李东亮,张娟,堵国成.2022.不同产地雪茄烟叶的风味特征和微生物群落分析[J].河南农业科学,51(8):45-54.[Zheng T F,Zhang Q Y,Li D L,Zhang J,Du G C.2022.Analysis of flavor characteristics and micro-bial community of cigar tobacco leaves from different regions[J].Journal of Henan Agricultural Sciences,51(8):45-54.]doi:10.15933/j.cnki.1004-3268.2022.08.006.
郑天飞.2022.雪茄烟叶发酵过程中微生物群落结构和功能分析[D].无锡:江南大学.[Zheng T F.2022.Analysis of microbial community structure and function during fer-mentation of cigar tobacco leaves[D].Wuxi:Jiangnan Uni-versity.]doi:10.27169/d.cnki.gwqgu.2022.002338.
Ansari WA,Kumar M,Krishna R,Singh A,Zeyad M T,Tiwari P,Kumar S C,Chakdar H,Srivastava A K.2023.Influenceof rice-wheat and sugarcane-wheat rotations on microbial diversity and plant growth promoting bacteria:Insights from high-throughput sequencing and soil analysis[J].Mi-crobiological Research,278:127533.doi:10.1016/j.micres.2023.127533.
Blake B,Brady L I,Rouse N A,Nagy P,Tarnopolsky M A.2023.The efficacy of whole genome sequencing and RNA-Seq in the diagnosis of whole exome sequencing negative patients with complex neurological phenotypes[J].Journal of Pediatric Ggenetics,12(3):206-212.doi:10.1055/S-0041-1736610.
Chattopadhyay S,Smyth E M,Kulkarni P,Babik K R,Reid M,Hittle L E,Clark P I,Mongodin E F,Sapkota A R.2019.Little cigars and cigarillos harbor diverse bacterial commu-nities that differ between the tobacco and the wrapper[J].PLoS One,14(2):e0211705.doi:10.1371/journal.pone.02 11705.
Hu W R,Cai W,Zheng Z J,Liu Y F,Luo C,Xue F,Li D L.2022.Study on the chemical compositions and microbial communities of cigar tobacco leaves fermented with exo-genous additive[J].Scientific Reports,12(1):19182.doi:10.1038/S41598-022-23419-Y.
Li J J,Zhao Y Y,Qin Y Q,Shi H Z.2020.Influence of micro-biota and metabolites on the quality of tobacco during fer-mentation[J].BMC Microbiology,20(1):356.doi:10.1186/s 12866-020-02035-8.
Liu F,Wu Z Y,Zhang X P,Xi G L,Zhao Z,Lai M,Zhao M Q.2021.Microbial community and metabolic function analy-sis of cigar tobacco leaves during fermentation[J].Micro-biology Open,10(2):e1171.doi:10.1002/MBO3.1171.
Smyth E M,Chattopadhyay S,Babik K,Reid M,Chopyk J,Malayil L,Kulkarni P,Hittle L E,Clark P I,Sapkota A R,Mongodin E F.2019.The bacterial communities of little cigars and cigarillos are dynamic over time and varying storage conditions[J].Frontiers in Microbiology,10:2371.doi:10.3389/fmicb.2019.02371.
Wu Q Y,Peng Z,Pan Y,Liu L P,Li L L,Zhang J,Wang J.2023.Interaction analysis of tobacco leaf microbial com-munity structure and volatiles flavor compounds during cigar stacking fermentation[J].Frontiers in Microbiology,14:1168122.doi:10.3389/FMICB.2023.1168122.
Zhang Q,Kong G H,Zhao G K,Liu J,Jin H G,Li Z H,Zhang G H,Liu T.2023.Microbial and enzymatic changes in cigar tobacco leaves during air-curing and fermentation[J].Applied Microbiology and Biotechnology,107(18):5789-5801.doi:10.1007/S00253-023-12663-5.
Zhao Y,Zhong G F,Yang X P,Hu X M,Mao D B,Ma Y P.2015.Bioconversion of lutein to form aroma compounds by Pantoeadispersa[J].Biotechnology Letters,37(8):1687-1692.doi:10.1007/s 10529-015-1844-y.
(责任编辑王晖)

