多参数多区域MRI影像组学特征与临床信息联合模型可有效预测脑胶质瘤患者生存期
摘要:目的 探讨脑胶质瘤患者肿瘤亚区影像组学特征,评估其对患者生存期的预后价值。方法 对388 例胶质瘤患者的术前MRI 多序列影像和临床数据进行回顾性分析,从瘤周水肿区域、肿瘤核心区以及全肿瘤区域提取T1、T2、T1 加权对比增强(T1CE)、液体衰减反转恢复(FLAIR)序列的影像组学特征。将病例按照7∶3分为训练集(271例)和测试集(117例)。利用随机生存森林算法在训练集中筛选与总生存期相关的影像组学特征,并构建影像组学评分(Rad-score)。根据Rad-score将患者分为高、低风险组,使用Kaplan-Meier分析两组生存差异。建立瘤周水肿区、肿瘤核心区和全肿瘤区域的Cox比例风险回归模型,并通过五折交叉验证及受试者工作特征曲线下面积评估模型1年、3年生存率的预测效能,采用10例胶质瘤患者作外部验证。选择表现最优的模型进行生存期预测情况的列线图分析。结果 肿瘤核心区、瘤周水肿区和全肿瘤区域分别筛选出的影像组学特征数量分别为5、7、5,根据Rad-score,两风险组在训练集和测试集的总生存期存在差异(Plt;0.05)。单因素和多因素Cox分析显示,年龄、异柠檬酸脱氢酶状态和Rad-score是总生存期的独立影响因素。联合模型在训练集和测试集中的AUC表现优于单一Rad-score模型,其中全肿瘤模型的1年、3年生存率预测AUC分别为0.750、0.778(训练集),0.764、0.800(测试集)和0.938、0.917(外部验证集)。结论 基于术前多模态MRI影像组学特征与临床信息联合构建的预测模型能有效预测胶质瘤患者的生存期。
关键词:胶质瘤;影像组学;磁共振成像;机器学习;预后分析
脑胶质瘤是颅内最常见的原发性恶性肿瘤,约占所有恶性脑肿瘤的75%[1]。这类肿瘤具有高发病率、高侵袭性、高致死率、低治愈率等特点[2]。研究显示,通过手术、药物治疗、放化疗的胶质瘤患者的预后通常不理想,且具有高复发率和多种后遗症,包括视觉和运动障碍等[3]。如Ⅱ级的胶质瘤患者的中位生存期为5~15年,而Ⅳ级胶质母细胞瘤患者中位生存期则为15~17 月[4, 5]。因此,对胶质瘤患者进行早期的针对性治疗能有效提高其预后。
在临床实践中,多模态MRI 已成为评估胶质瘤的重要影像学检查方法之一。不同序列的MRI图像能够提供肿瘤的形态学、代谢特征以及微环境等多方面信息。通过对多模态MRI 图像的分析,可以更准确地评估胶质瘤的生物学特征,为临床诊断和治疗决策提供重要依据[6, 7]。影像组学是从医学图像中以高通量方式提取和分析大量图像特征的技术[8]。目前,多模态MRI影像组学研究已成为胶质瘤研究的热点,对胶质瘤的术前鉴别诊断、分级和分子分型等具有重要作用[9]。
尽管已有许多方法用于胶质瘤预后分析,但这些研究大多聚焦在肿瘤的核心部分,忽略了肿瘤周围非增强区域影响[10]。考虑到不同肿瘤区域的形态学和生物学特征不同,本文将重点提取肿瘤核心区(TC)、瘤周水肿区域(ED)以及全肿瘤区域(WT)的影像学特征,以更全面地分析肿瘤内部的异质性和复杂性,进而深入理解胶质瘤的生物学特性[11]。本研究尝试从不同肿瘤亚区提取特征,构建一个基于多模态MRI 影像组学特征的预后模型,以评估不同肿瘤亚区影像组学特征及相关临床信息在预后分析中的应用价值,从而为个体化治疗提供更精准的指导。
1 资料和方法
1.1 研究对象
本研究采用回顾性分析方法,研究对象为加州大学旧金山分校提供的弥漫性胶质瘤术前核磁共振成像数据集[12]的501例胶质瘤患者,病例资料来源于美国多家医院,患者图像及临床信息在癌症影像数据库中下载。研究资料包括患者性别、年龄、WHO肿瘤分级、异柠檬酸脱氢酶(IDH)基因状态、生存状态及生存时间,并进行双重数据输入检查和统计学方法检测异常值,确保数据的准确性和一致性。
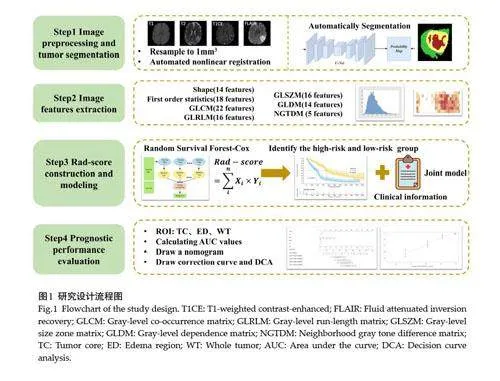
纳入标准:经组织病理学确认的脑胶质瘤患者;具有明确的WHO肿瘤分级(2021 年版)[13]和IDH基因检测结果;术前完成常规MRI检查;MRI影像中可清晰观察到瘤周水肿区和肿瘤核心区。排除标准:缺失任何MRI序列;MRI图像质量不佳;既往有脑肿瘤治疗史;缺乏必要的临床信息;缺少ED或TC肿瘤亚区。最终共纳入388例患者。根据留出法将数据集进行多次随机划分,重复进行实验评估;样本按7∶3 划分训练集和测试集的多次实验结果差异无统计学意义(Pgt;0.05)。因此,本实验按照7∶3将患者随机分为训练集(271例)和测试集(117例),并使用宾夕法尼亚大学提供的胶质瘤术前核磁共振成像数据集[14]的10例胶质瘤患者进行外部验证,验证模型的稳定性和泛化能力。本研究的流程图见图1。
1.2 MRI图像预处理与肿瘤分割
本实验数据集中的MRI图像已经过预处理。所有序列按照T2-FLAIR图像为标准进行自动非线性配准,并按照1 mm×1 mm×1 mm进行重采样,同时完成头骨剥离。图像处理完成后,采用2021年脑肿瘤分割挑战赛公开算法组成的集成模型进行自动分割。分割目标包括两个主要的肿瘤感兴趣区:肿瘤核心区和瘤周水肿区。自动分割完成后,两名具有超过15 年经验的神经放射科医生对分割结果进行手动校正,以确保分割的准确性和可靠性。
1.3 特征提取
本研究纳入T1、T2、T1CE、FLAIR四种MRI 序列图像,进行影像组学特征提取。利用Python 开源工具包Pyradiomics(https://pyradiomics. readthedocs. io/en/latest/)对已标定的ROI区域进行处理。在每个肿瘤区域,使用4种不同的滤波器进行分析,分别为原始图像、高斯拉普拉斯算子、小波、3D局部二值模式。每种图像类型提取以下7种组学特征:14个形状特征、18个一阶统计特征;22个灰度共生矩阵特征(GLCM)、16个灰度游程矩阵特征(GLRLM)、16个灰度区域大小矩阵特征(GLSZM)、14个灰度依赖性矩阵特征(GLDM)、5个邻域灰度差别矩阵特征(NGTDM)。每个MRI序列共提取出1470 个组学特征。此外,剔除所有方差为0 的特征,并对所有组学特征进行标准化处理,以消除由于特征尺度不同带来的影响。
1.4 影像组学评分的构建和模型的建立
经过数据预处理后,为减少无关和冗杂特征对结果的干扰并提高模型的准确性,筛选与预后显著相关的最佳特征,步骤如下:(1)通过Cox单因素分析筛选与生存显著相关的影像组学特征,设定显著性水平为Plt;0.05。(2)通过Spearman相关分析去除高度相关的冗余特征,对于相关性大于0.6的特征对,随机删除其中一个。(3)利用随机生存森林方法进一步筛选最佳特征。(4)使用Cox比例风险模型构建影像组学评分(Rad-score)。根据上述分别构建基于预后Rad-score、基于临床信息及其联合模型,并对训练集进行五折交叉验证。其中,Rad-score模型是按照筛选特征的系数权重进行线性拟合,Rad - score =Σin Xi × Yi (X代表筛选出来的特征,Y代表对应系数),通过公式计算出每个患者的Rad-score,建立Rad-score模型。联合模型包括Rad-score与具有显著差异的临床特征。进一步使用R语言的survminer包找到Rad-score的最佳阈值,并将该阈值作为截断值把患者分为低风险组和高风险组,分别在训练集和测试集对患者的生存率进行 Kaplan-Meier分析,评估Rad-score在预后的意义。
1.5 统计学方法
使用IBM SPSS Statistics 26.0和R 4.3.2软件进行统计分析。实验前进行检验效能分析,根据文献[15-17]和领域专家建议,假设预测模型受试者工作特征曲线下面积(AUC)为0.75,设定显著性水平为0.05,统计功效为0.95,计算得出所需的最小样本量为48。本研究训练集样本量为271,测试集样本量为117,确保了研究的稳健性和结果的可靠性。
计量资料符合正态分布,则采用均数±标准差表示,若不服从正态分布,则采用中位数(四分位数间距)表示;组间差异采用卡方检验进行比较,Plt;0.05为差异具有统计学意义。对瘤周水肿区、肿瘤核心区、全肿瘤区域分别计算3 种预测模型的AUC,评估模型1、3 年总生存期的预测效能。基于最佳模型,构建列线图显示联合模型个性化的1、3 年生存率。绘制校准曲线衡量模型预测结果与观测结果之间的一致性和评估模型的准确度;绘制决策曲线分析(DCA)评估模型的临床效用。
2 结果
2.1 临床资料分析
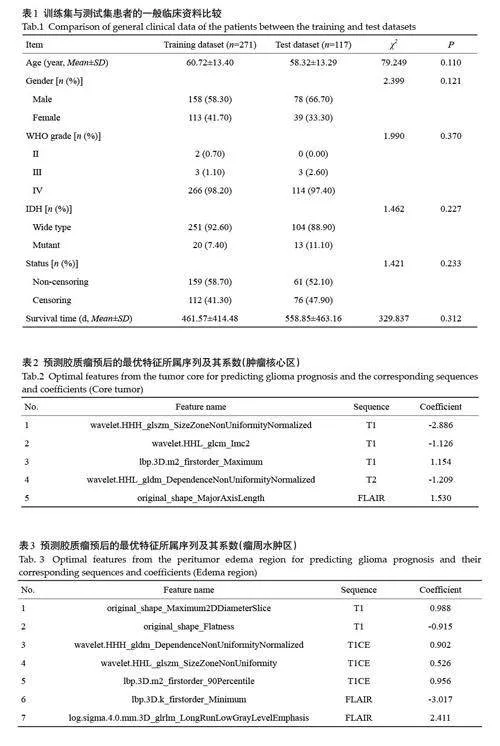
训练集和测试集的年龄、性别、WHO分级、IDH状态、生存状态、生存时间差异均无统计学意义(Pgt;0.05,表1)。
2.2 预后Rad-score的构建
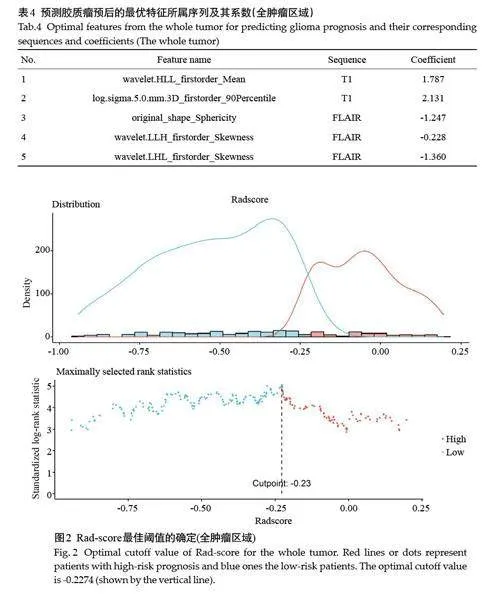
经RBF-Cox算法在肿瘤核心区(表2)、瘤周水肿区(表3)、全肿瘤区域(表4)分别筛选出5、7、5个与预后相关的非零特征。在全肿瘤区域中,T1模态下的wavelet.HLL_firstorder_Mean 和log. sigma. 5.0. mm. 3D_firstorder_90Percentile 特征对预测胶质瘤预后有显著影响。对原始图像分别沿x、y、z 方向分别采用高通、低通、低通滤波器进行卷积得到新的图像,计算新图像中的平均灰度强度得到wavelet.HLL_firstorder_Mean 特征。log. sigma. 5.0. mm. 3D_firstorder_90Percentile特征是对原始图像采用高斯拉普拉斯滤波器进行卷积,并统计第一阶统计量的90百分位数,该特征表示ROI高亮度的灰度值,胶质瘤浸润程度越严重,图像灰度值越高,患者预后越差。
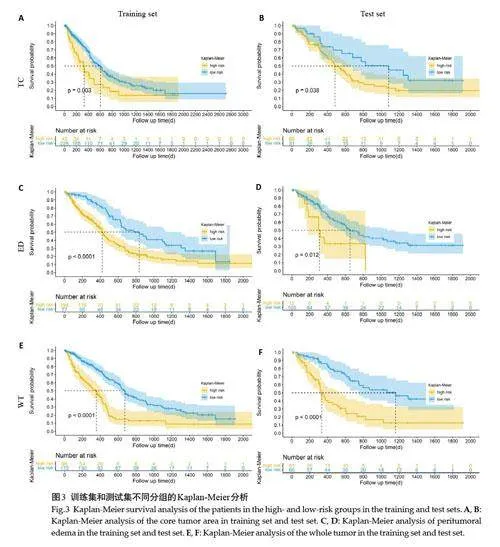
根据Rad-score 的截断值(TC:0.310;ED:-1.965;WT:-0.227)将患者分为高风险组和低风险组,图2为全肿瘤区域Rad-score最佳阈值确定。Kaplan-Meier生存曲线显示,高风险组的生存情况劣于低风险组(Plt;0.05)。Cox单因素分析结果显示,训练集的高风险组具有增加的死亡风险,预后更差[TC:HR=1.8476,95% CI:1.223~2.790;ED:HR=2.0794,95% CI:1.438~3.007;WT:HR=2.4858,95% CI:1.799~3.435]。以上结果在测试集得到验证[TC:HR=1.7206,95% CI:0.963~3.075;ED:HR=2.4585,95% CI:1.194~5.061;WT:HR=3.4030,95% CI:2.017~5.743](图3)。
2.3 模型的构建与效能评估
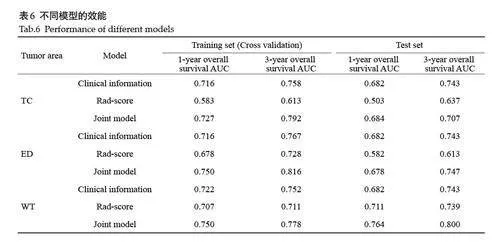
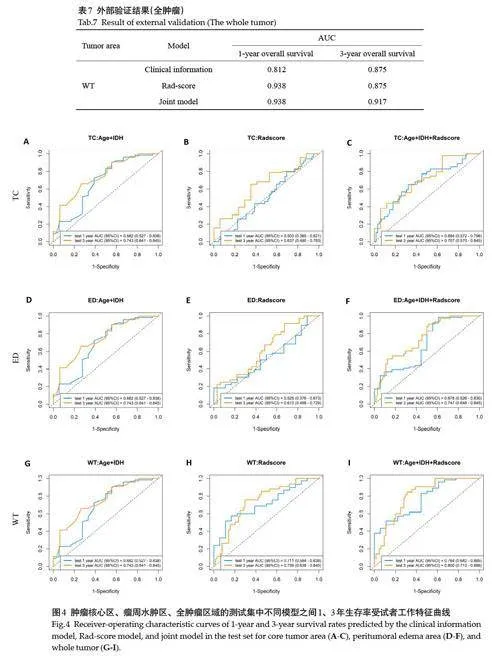
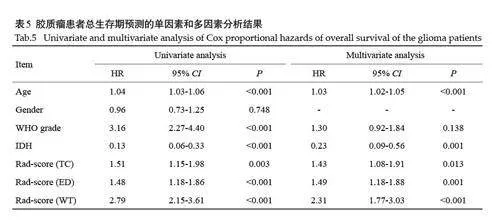
Cox单因素分析显示,年龄、WHO分级、IDH状态、Rad-score是影响OS的独立预后因素(Plt;0.001)。进一步Cox 多因素分析显示,年龄、IDH状态、Rad-score 是影响OS 的独立预后因素(Plt;0.05,表5)。基于这些因素,分别构建Rad-score 模型、临床信息模型及联合模型。在训练集和测试集中,预测3 年生存率的AUC均高于预测1年生存率AUC。特别是在瘤周水肿区和肿瘤核心区2个肿瘤亚区,临床信息模型预测1年、3年生存率的AUC均高于单一Rad-score模型(表6)。全肿瘤区域的联合模型预测效果最佳。在训练集中,1年、3年生存率的AUC分别为0.750 和0.778;在测试集中分别为0.764 和0.800;在外部验证的10 例胶质瘤数据集中,1年、3年生存率的AUC分别为0.938和0.917(表7);肿瘤核心区、瘤周水肿区、全肿瘤区域的不同模型在测试集中预测1年和3年生存率的受试者工作特征曲线(图4)。
2.4 基于最优预后模型构建列线图
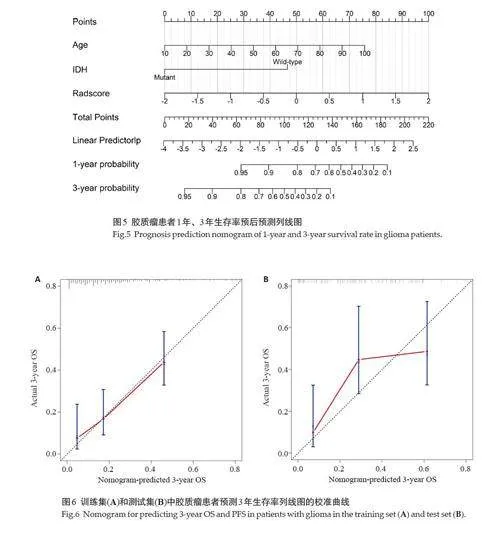
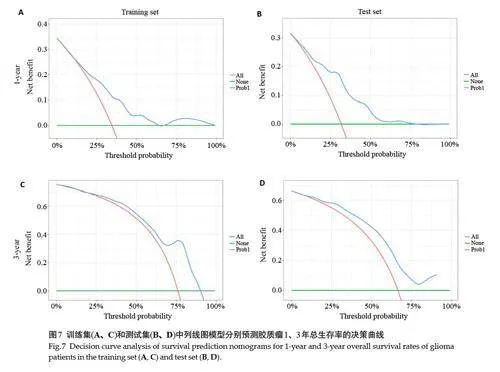
构建基于联合模型脑胶质瘤患者总生存期的预测列线图(图5),获得其生存概率。预测患者3年生存期为例,训练集和测试集的预测曲线均与理想情况下的黑色标准曲线高度吻合(图6)。DCA曲线显示在阈值大于0.25的情况下,所有模型均展示出良好的净收益(图7)。
3 讨论
本研究针对388例胶质瘤患者,从瘤周水肿区、肿瘤核心区和全肿瘤区提取了T1、T2、T1CE、FLAIR四个序列的影像组学特征,以预测患者的总生存期。通过结合随机生存森林与Cox风险比例回归方法,筛选与预后显著相关的特征,并构建Rad-score。将年龄和IDH状态这两项临床信息纳入预测模型,用于评估患者的1年和3年生存期,发现全肿瘤区域的模型表现出最佳的预测效能。在训练集中的AUC分别为0.750 和0.778,而在测试集中的AUC分别为0.764 和0.800。本研究证实,多模态MRI 影像组学特征能够在术前以非侵入性方式有效预测胶质瘤患者的生存期,从而为临床决策提供重要信息。
既往对胶质瘤影像组学特征提取大多选择整个肿瘤区域,如有研究将对比增强、T2-FLAIR和坏死部分的分割掩膜合并,从整个肿瘤提取放射组学特征[18, 19];对整个胶质瘤肿瘤提取组学特征作预后分析[20]。有研究从增强肿瘤区、肿瘤坏死区和瘤周水肿区中提取特征预测成人弥漫性胶质瘤患者中O6-甲基鸟嘌呤-DNA甲基转移酶启动子的甲基化状态[21];从整个肿瘤区域、瘤周水肿区等提取特征预测IDH状态[22]。针对这一现象,本研究重点探讨不同肿瘤亚区(ED、TC、WT)影像组学特征对胶质瘤预后的影响。
肿瘤核心区,包括肿瘤坏死区和增强肿瘤区,是脑胶质瘤生长速度快导致的中心区域缺血性坏死的结果[23, 24]。恶性胶质瘤在核磁共振成像中通常表现出明显的增强效应,已有研究表明瘤内特征是预测患者生存期的重要工具[25]。本研究将肿瘤坏死区和增强肿瘤区的特征结合起来,捕捉肿瘤核心区域的生物信息,并结合临床信息建立预后模型,该模型在测试集中的AUC分别为0.684和0.707。
由于肿瘤新生的毛细血管和通透性的增加,肿瘤压迫周围脑组织造成损伤,导致瘤周水肿区局部血管受限和液体积聚,在FLAIR图像上表现为高信号区域[26, 27]。胶质瘤患者术后复发率高,且约80%的复发都发生在瘤周水肿区。越来越多的研究开始关注瘤周水肿区异质性的重要性。例如,研究指出瘤周水肿区中存在高风险区域能为预后分析提供更有价值的信息[28];研究发现,基于T2WI序列距肿瘤边缘10 mm的瘤周区域建立的影像组学预测模型与临床信息结合,能够较准确地预测脑胶质瘤患者的预后情况[29]。因此,本研究中,瘤周水肿区被纳入ROI,并与临床独立危险因素一同构建预测模型,其训练集中的AUC分别为0.750和0.816,在测试集中的AUC分别为0.678 和0.747,显示出比肿瘤核心区更优的预后预测表现。
以往研究多集中在单一的影像组学[30-32]或临床信息[33, 34]分析。本研究从临床信息和影像组学两方面同时入手,尝试构建联合模型, 能够更加全面评估胶质瘤患者的总生存期。本研究在临床信息分析中发现,性别和WHO分级与胶质瘤患者的预后无显著性差异。然而,IDH状态和年龄[35]与预后显著相关。2016年,WHO在弥漫性神经胶质瘤的病理分类中首次引入IDH基因分型[36]。研究发现,IDH突变是预后良好的独立标志物[ 22, 37-39],进一步强调了IDH状态在胶质瘤预后评估中的重要性。本研究中,基于年龄和IDH构建的临床信息模型,在预测患者3年生存期方面表现良好,尤其在3个不同的肿瘤区域(肿瘤核心区、瘤周水肿区和全肿瘤)均显示出较高的预测性能。此外,本研究对ROI分别筛选出与预后相关的组学特征构建Rad-score可以在术前对胶质瘤患者进行风险分组,Rad-score 越大的患者预后越差,生存期越短。在全肿瘤区域中,纳入临床信息建立的联合模型预测患者1、3 年生存期比单一的肿瘤亚区模型、单一的Rad-score和临床信息模型优异。
本研究存在一定的局限性:首先,本研究为单中心回顾性设计,样本量相对较少;WHO根据胶质瘤的良恶性程度并结合生理学表现对进行胶质瘤分级,Ⅳ级属于偏恶性、高级别的肿瘤,实验中大部分样本为WHO分级Ⅳ级,实验样本选择偏倚可能会造成实验结果偏倚。因此,为提高研究结果的准确性,未来研究需要增加样本量,并扩展至多中心或前瞻性研究,以验证本研究的发现并确保影像组学特征的准确性和可重复性。其次,虽然本研究采用了机器学习技术,对少量临床指标进行分析,但结果表明还有提升空间。有研究显示,将影像组学与治疗方案、药物剂量等临床信息联合起来对模型性能提高有显著影响[40],下一步工作需将影像组学技术与深度学习结合,并纳入更多的临床变量以优化模型的预测效能。第三,本研究主要使用常规的T1、T2、T1CE、FLAIR序列来预测生存期,未来研究将采用更多与肿瘤微观结构相关的高级成像技术,如三维自旋回波序列、灌注加权成像、弥散加权成像[41]等,这可能有助于提供更多关于肿瘤生物学特性的信息。最后,本研究聚焦于术前影像学对生存期预测的价值,未包括术后影像学数据。术后影像的变化对于理解肿瘤的复发和进展具有重要意义,未来研究将纳入这些数据以完善预测模型。
参考文献:
[1] Ostrom QT, Cioffi G, Gittleman H, et al. CBTRUS statistical report:
primary brain and other central nervous system tumors diagnosed in
the United States in 2012-2016[J]. Neuro Oncol, 2019, 21(Suppl 5):
v1-10.
[2] Xu HS, Zhang AK, Han XY, et al. ITGB2 as a prognostic indicator
and a predictive marker for immunotherapy in gliomas[J]. Cancer
Immunol Immunother, 2022, 71(3): 645-60.
[3] 李绍山, 付 强, 秦 虎, 等. 脑胶质瘤在CT平扫及三期增强中的图像
表现特征分析[J]. 中国CT和MRI杂志, 2019, 17(7): 5-7.
[4] Rasmussen BK, Hansen S, Laursen RJ, et al. Epidemiology of
glioma: clinical characteristics, symptoms, and predictors of glioma
patients grade I-IV in the the Danish Neuro-Oncology Registry[J]. J
Neurooncol, 2017, 135(3): 571-9.
[5] Lin ZY, Yang RW, Li KS, et al. Establishment of age group
classification for risk stratification in glioma patients[J]. BMC
Neurol, 2020, 20(1): 310.
[6] Zhang BQ, Chang K, Ramkissoon S, et al. Multimodal MRI features
predict isocitrate dehydrogenase genotype in high-grade gliomas
[J]. Neuro Oncol, 2017, 19(1): 109-17.
[7] Ellingson BM, Bendszus M, Boxerman J, et al. Consensus
recommendations for a standardized Brain Tumor Imaging Protocol
in clinical trials[J]. Neuro Oncol, 2015, 17(9): 1188-98.
[8] Park YW, Kim S, Park CJ, et al. Adding radiomics to the 2021 WHO
updates may improve prognostic prediction for current IDHwildtype
histological lower-grade gliomas with known EGFR
amplification and TERT promoter mutation status[J]. Eur Radiol,
2022, 32(12): 8089-98.
[9] 杜 鹏, 耿道颖. 多模态MRI影像组学在胶质瘤精准诊疗中的研究进
展[J]. 国际医学放射学杂志, 2023, 46(6): 672-9.
[10]Bakas S, Akbari H, Pisapia J, et al. In vivo detection of EGFRvIII in
glioblastoma via perfusion magnetic resonance imaging signature
consistent with deep peritumoral infiltration: the φ -index[J]. Clin
Cancer Res, 2017, 23(16): 4724-34.
[11]Weller M, Weber RG, Willscher E, et al. Molecular classification of
diffuse cerebral WHO grade II/III gliomas using genome- and
transcriptome-wide profiling improves stratification of
prognostically distinct patient groups[J]. Acta Neuropathol, 2015,
129(5): 679-93.
[12]Calabrese E, Villanueva-Meyer JE, Rudie JD, et al. The university of
California San francisco preoperative diffuse glioma MRI dataset
[J]. Radiol Artif Intell, 2022, 4(6): e220058.
[13]Bale TA, Rosenblum MK. The 2021 WHO Classification of Tumors
of the Central Nervous System: an update on pediatric low-grade
gliomas and glioneuronal tumors[J]. Brain Pathol, 2022, 32(4):
e13060.
[14]Bakas S, Sako C, Akbari H, et al. The University of Pennsylvania
glioblastoma (UPenn-GBM) cohort: advanced MRI, clinical,
genomics, amp; radiomics[J]. Sci Data, 2022, 9(1): 453.
[15]邓景景. 生存分析模型风险预测能力评价方法及其应用研究[D].
南京: 东南大学, 2016.
[16]Kamarudin AN, Cox T, Kolamunnage-Dona R. Time-dependent
ROC curve analysis in medical research: current methods and
applications[J]. BMC Med Res Methodol, 2017, 17(1): 53.
[17]Heagerty PJ, Zheng Y. Survival model predictive accuracy and ROC
curves[J]. Biometrics, 2005, 61(1): 92-105.
[18]Foltyn-Dumitru M, Schell M, Rastogi A, et al. Impact of signal
intensity normalization of MRI on the generalizability of radiomicbased
prediction of molecular glioma subtypes[J]. Eur Radiol,
2024, 34(4): 2782-90.
[19]Foltyn-Dumitru M, Schell M, Sahm F, et al. Advancing noninvasive
glioma classification with diffusion radiomics: exploring the impact
of signal intensity normalization[J]. Neurooncol Adv, 2024, 6(1):
vdae043.
[20]Huang DC, Gao TY, Zhang Y, et al. A study on prognosis of diffuse
glioma based on clinical factors and magnetic resonance imaging
radiomics[J]. World Neurosurg, 2024, 186: e514-30.
[21]Usuzaki T, Takahashi K, Inamori R, et al. Identifying key factors for
predicting O6-Methylguanine-DNA methyltransferase status in
adult patients with diffuse glioma: a multimodal analysis of
demographics, radiomics, and MRI by variable Vision Transformer
[J]. Neuroradiology, 2024, 66(5): 761-73.
[22]Truong NCD, Bangalore Yogananda CG, Wagner BC, et al. Twostage
training framework using multicontrast MRI radiomics for
IDH mutation status prediction in glioma[J]. Radiol Artif Intell,
2024, 6(4): e230218.
[23]Markwell SM, Ross JL, Olson CL, et al. Necrotic reshaping of the
glioma microenvironment drives disease progression[J]. Acta
Neuropathol, 2022, 143(3): 291-310.
[24]Williams BJ, Frieboes H, Baxter M, et al. Metabolomic
differentiation of tumor core vs. edge in glioma via machine learning
[J]. Neurosurgery, 2024, 70(Supplement_1): 210.
[25]Zhou Y, Gu HL, Zhang XL, et al. Multiparametric magnetic
resonance imaging-derived radiomics for the prediction of diseasefree
survival in early-stage squamous cervical cancer[J]. Eur
Radiol, 2022, 32(4): 2540-51.
[26]Lemée JM, Clavreul A, Menei P. Intratumoral heterogeneity in
glioblastoma: don't forget the peritumoral brain zone[J]. Neurooncology,
2015, 17(10): 1322-32.
[27]Saadoun S, Papadopoulos MC, Davies DC, et al. Increased
aquaporin 1 water channel expression in human brain tumours[J].
Br J Cancer, 2002, 87(6): 621-3.
[28]Yang Y, Han Y, Zhao SJ, et al. Spatial heterogeneity of edema region
uncovers survival-relevant habitat of Glioblastoma[J]. Eur J Radiol,
2022, 154: 110423.
[29]侯秋阳, 叶成坤, 刘 畅, 等. 基于多参数磁共振瘤周区域的影像组学
模型在脑胶质瘤预后评估中的应用价值[J]. 安徽医科大学学报,
2024, 59(1): 154-61.
[30]卢明君, 屈耀铭, 马安东,等. 多模态MRI影像组学可预测弥漫性较
低级别胶质瘤的1p/19q 共缺失状态[J]. 南方医科大学学报, 2023,
43(6): 1023-8.
[31]Fan ZC, Zhang L, Yang GQ, et al. MRI radiomics for predicting poor
disease-free survival in muscle invasive bladder cancer: the results
of the retrospective cohort study[J]. Abdom Radiol, 2024, 49(1):
151-62.
[32]Ahrari S, Zaragori T, Zinsz A, et al. Application of PET imaging
delta radiomics for predicting progression-free survival in rare highgrade
glioma[J]. Sci Rep, 2024, 14(1): 3256.
[33]Ye LG, Gu LG, Zheng ZY, et al. An online survival predictor in
glioma patients using machine learning based on WHO CNS5 data
[J]. Front Neurol, 2023, 14: 1179761.
[34]Zhao R, Zhuge Y, Camphausen K, et al. Machine learning based
survival prediction in Glioma using large-scale registry data[J].
Health Informatics J, 2022, 28(4): 14604582221135427.
[35]李新宇, 尚洵杰, 夏 彤, 等. 原发性人脑胶质瘤的预后影响因素: 基
于SEER数据库的分析[J]. 中国临床神经外科杂志, 2021, 26(10):
764-8.
[36]Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health
Organization Classification of Tumors of the Central Nervous
System: a summary[J]. Acta Neuropathol, 2016, 131(6): 803-20.
[37]Sanson M, Marie Y, Paris S, et al. Isocitrate dehydrogenase 1 codon
132 mutation is an important prognostic biomarker in gliomas[J]. J
Clin Oncol, 2009, 27(25): 4150-4.
[38]张 宁, 马辉辉, 王 凡, 等. 脑胶质瘤患者 MGMT 启动子甲基化和
IDH1 突变与临床预后相关[J]. 基础医学与临床, 2021, 41(10):
1476-80.
[39]胡 哲,王玉红,刘晓龙, 等. 基于术前MRI图像构建影像组学与深度
学习的机器学习模型预测胶质瘤IDH-1 基因表达的研究[J]. 临床
神经外科杂志, 2024, 21(2): 187-92.
[40]Choi Y, Nam Y, Jang J, et al. Radiomics may increase the prognostic
value for survival in glioblastoma patients when combined with
conventional clinical and genetic prognostic models[J]. Eur Radiol,
2021, 31(4): 2084-93.
[41]Park CJ, Kim S, Han K, et al. Diffusion- and perfusion-weighted
MRI radiomics for survival prediction in patients with lower-grade
gliomas[J]. Yonsei Med J, 2024, 65(5): 283-92.
(编辑:林 萍)

