异功散通过调控脑水液代谢改善APP/PS1转基因小鼠的学习记忆能力


摘要:目的 观察异功散对APP/PS1小鼠学习记忆能力的影响,并从调控脑水液代谢系统探讨异功散抗痴呆的作用机制。方法将3 月龄雄性APP/PS1 转基因小鼠及同龄同背景野生型C57BL/6 小鼠随机分为4 组(8 只/组):对照组、模型组、多奈哌齐(1.67 mg/kg)组、异功散(7.5 g/kg)组。灌胃给予各组对应药物1次/d,1月后采用Morris水迷宫实验考察小鼠的学习记忆能力;HE染色观察海马皮层组织病理形态学变化;免疫组化染色、硫磺素S染色观察脑内淀粉样蛋白斑块数量变化;ELISA法检测脑组织和血清Aβ1-40和Aβ1-42含量;伊文思蓝法检测血脑屏障(BBB)通透性变化;免疫荧光共定位考察AQP4在星型胶质细胞上极化情况;Western blotting 观察血管内皮钙黏蛋白(VE-cadherin)、闭锁连接蛋白1(ZO-1)、闭合蛋白(Occludin)、β-淀粉样前体蛋白(APP)、β-分泌酶(BACE1)、胰岛素降解酶(IDE)、低密度脂蛋白受体相关蛋白1(LRP1)、晚期糖基化终末产物受体(RAGE)、水通道蛋白4 (AQP4)蛋白表达情况。结果 与对照组比较, APP/PS1小鼠第 5 天的逃避潜伏期显著延长(Plt;0.001),平台象限停留时间降低(Plt;0.05);海马和皮层神经细胞变性或坏死细胞数量增加且病理评分升高(Plt;0.001);Aβ阳性斑块明显升高以及硫磺素S荧光强度明显增强(Plt;0.05);脑组织和血清Aβ1-40、Aβ1-42含量升高(Plt;0.05);BBB通透性增加(Plt;0.01),RAGE蛋白表达上调(Plt;0.01)而VE-cadherin、LRP1、ZO-1、Occludin、AQP4 蛋白表达下调(Plt;0.05),且AQP4 在GFAP阳性细胞上表达的数量减少(Plt;0.05)。与模型组比较,异功散组小鼠第 5 天的逃避潜伏期缩短(Plt;0.001),平台象限停留时间增加(Plt;0.05)且平均游泳速度加快(Pgt;0.05);海马和皮层神经细胞变性或坏死细胞数量减少且病理评分降低(Plt;0.01);Aβ 阳性斑块减少以及硫磺素S荧光强度减弱(Plt;0.05);脑组织和血清Aβ1-40、Aβ1-42含量降低(Plt;0.05);维持了BBB通透性(Plt;0.01),RAGE蛋白表达下调(Plt;0.05),而VE-cadherin、LRP1、ZO-1、Occludin、AQP4蛋白表达上调(Plt;0.05),且AQP4在GFAP阳性细胞上表达的数量明显增加(Plt;0.01)。结论 异功散能够通过改善APP/PS1小鼠脑内神经细胞损伤、Aβ病变,调控脑水液代谢系统相关蛋白表达而改善学习记忆变化。
关键词:异功散;痴呆症;脑水液代谢系统;APP/PS1 小鼠;AQP4
津液是构成人体组织脏腑器官并维持其生理活动的基本物质[1],其活动由机体多个脏腑参与[2]。中医认为津液代谢异常形成的痰饮血瘀则是导致痴呆症核心病机-毒损脑络[3, 4]的必要条件,而脾脏则是引起津液代谢异常的关键。脾病则津液输布不足,髓海失充,令人善忘,或痰浊瘀血内生,神宫不职,令人健忘。故痴呆多与脾病有关[5],前人治疗经验强调调脾在痴呆症防治中的重要作用。
脑络是脑部津液代谢的通路,研究表明胶质淋巴系统是脑内物质代谢的关键途径[6],它可能是脑络的重要组成部分。外周血中的营养物质通过位于血脑屏障(BBB)上的转运蛋白或扩散进入脑组织,借助脑脊液(CSF)-间质液(ISF)对流对脑组织各种细胞正常活动所需物质进行补充,而各种神经细胞活动产生的代谢废物也随同CSF-ISF对流排入静脉[6]。因此,构成BBB的连接蛋白如血管内皮钙黏蛋白(VE-cadherin)、闭锁连接蛋白1(ZO-1)、闭合蛋白(Occludin)等[7],位于BBB的转运蛋白如低密度脂蛋白受体相关蛋白1(LRP1)、糖基化终产物受体(RAGE)等以及位于星形胶质细胞上控制CSF-ISF对流的关键蛋白水通道蛋白-4(AQP4)都是影响津液代谢的潜在因素。
异功散是调理脾胃的经典名方,方中药物均为治疗痴呆症的常用药物,不仅能调控津液,还具有“通血脉”(人参)、“通水道”(白术)、“通九窍,利百脉”(甘草)等功效,说明异功散可能具有通利水道和调控津液代谢而治疗痴呆症的作用。课题组前期研究发现异功散能够明显改善D-半乳糖诱导的快老化小鼠的学习记忆能力和脑神经细胞变性或坏死等病变[5],但其作用是否涉及调控脑津液代谢系统并不清楚。故本研究拟以APP/PS1转基因小鼠为研究载体,异功散干预后,从调控脑津液代谢系统角度考察异功散的作用机制,为从脾治疗痴呆症提供现代科学依据。
1 材料和方法
1.1 药物
异功散由本实验室自制,其中人参皂苷Rb1、白术内酯Ⅲ、橙皮苷、甘草苷和甘草酸含量分别为2.01、0.12、0.09、1.19、2.38 mg/g[5]。
1.2 实验动物
3月龄APP/PS1双转基因小鼠及同龄同背景野生型C57BL/6对照小鼠(18~22 g)[北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008,动物合格证号:110322220103372718、110322220103372672]。小鼠饲养于重庆市中药研究院实验动物研究所动物观察室,自由摄食、饮水,昼夜明暗交替时间为12 h,室内相对湿度为50%~60%,相对恒定温度为20~24 ℃。本动物实验经重庆市中药研究院实验动物伦理委员会审批(YHS2022-04)。
1.3 主要试剂
多奈哌齐(辽宁卫材药业有限公司);PVDF 膜(Millipore);ECL发光液(Solarbio);高效RIPA组织/细胞裂解液(Servicebio);BCA 蛋白定量试剂盒(Solarbio);Aβ1-42、Aβ1-40定量检测试剂盒(泉州睿信生物科技有限公司);抗-APP 抗体、抗-IDE抗体、抗-PS1 抗体、抗-LRP1抗体、抗-ZO-1抗体、抗-VE cadherin抗体、抗-GAPDH 抗体(Servicebio);抗-BACE1 抗体、抗-RAGE抗体、抗-Occludin抗体(武汉爱博泰克生物科技有限公司);抗-AQP4抗体(Cell Signaling Technology);硫磺素S(上海源叶生物科技有限公司)。
1.4 仪器
BSA224S型电子天平(北京赛多利斯科学仪器有限公司);Morris水迷宫视频分析系统(安徽正华仪器设备有限公司);JB-P5 型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);KE-5F-3D三维冷冻研磨仪(武汉赛维尔生物科技有限公司);M1324R高速冷冻离心机(深圳市瑞沃德生命科技有限公司);Read Max 1200 型光吸收全波长酶标仪(上海闪谱生物科技公司);Mini-PROTEAN Tetrasystem 电泳系统(BIO-RAD);WD-9423BC型化学发光成像系统(北京六一生物科技公司)。
1.5 方法
1.5.1 分组与给药 将3 月龄雄性 C57BL/6 小鼠与APP/PS1小鼠适应性喂养1周后,根据各小鼠的体质量随机分为对照组、模型组、多奈哌齐组(1.67 mg/kg)、异功散(7.5 g/kg[5])组,8只/组。药物组每天灌胃给予对应药物(给药体积10 mL/kg),对照组和模型组灌胃给予等体积纯水,1次/d,连续30 d。
1.5.2 行为学评价[5] 采用 Morris 水迷宫实验对各组小鼠进行行为学检测,以隐藏平台实验的逃避潜伏期,空间探索实验的平台象限停留时间、穿越平台象限和平均游泳速度为评价指标。
1.5.3 取材及样本制备 行为学评价后24 h,每组随机选取3 只小鼠,进行BBB通透性检测[8],其余小鼠眼球取血,分离血清并置于4 ℃保存,脱颈椎处死小鼠后,分取部分脑(包含海马和皮质)并用4%多聚甲醛固定,其余脑组织用锡箔纸包裹放置液氮中冷冻保存。
1.5.4 HE染色 将4%多聚甲醛固定的脑组织,进行常规HE染色处理,采集海马和皮层图像并对其损伤的神经细胞进行评分[9]。
1.5.5 Aβ 染色 按照1.5.4 HE染色方法将脑组织切成5 μm薄片后进行脱蜡处理,采用PBS清洗后再将切片浸入5% Triton-X-100 室温通透10 min,然后滴加10%山羊血清封闭30 min。滴加抗-Aβ 抗体孵育过夜(4 ℃),PBS 洗3 次然后滴加生物素化二抗,37 ℃孵育30 min。使用DAB试剂盒显色后用苏木精染色,PBS清洗后剂封片,显微镜下观察并记录Aβ斑块数量。
1.5.6 硫磺素(Thioflavin S)染色 按照1.5.4 HE染色方法将脑组织切成5 μm 薄片后进行脱蜡处理,放入0.25%高猛酸溶液中漂染20 min,水洗后在白液中漂洗2 min。水洗后放入封闭液中漂染20 min。水洗后置于0.25%醋酸液中漂洗5 s,水洗、凉干,滴加Thioflavin S染液染色3~5 min,依次用50%酒精和蒸馏水冲洗2次,甘油凝胶封裱并置于显微镜下观察被染色的淀粉样蛋白数量。
1.5.7 免疫荧光 按照1.5.4 HE染色方法将脑组织切成5 μm 薄片后进行脱蜡处理, PBS清洗后再将切片浸入5% Triton-X-100 室温通透10 min,然后滴加10%山羊血清封闭30 min。滴加抗-GFAP、抗-AQP4抗体孵育过夜(4 ℃),PBS 洗3次然后滴加生物素化二抗,37 ℃孵育30 min然后滴加DAPI室温孵育10 min;PBS清洗后使用抗荧光衰减封片剂封片。采集海马区图片并计AQP4在GFAP标识的阳性表达细胞中的数量。
1.5.8 Western blotting检测 称取适量包含海马和皮层的脑组织,加入适量裂解液进行冰浴匀浆,离心,收集上清液。二喹啉甲酸法(BCA)法检测蛋白浓度,其余按比例加上样缓冲液、混匀、加热变性后分装待测。采用SDS-PAGE进行电泳分离、转膜。5%胎牛血清封闭后孵 APP、BACE1、RAGE、LRP1、IDE、AQP4 和GAPDH抗体过夜(4 ℃)。孵育二抗后使用ECL超敏化学发光液显色,拍照后采用Quantity One分析并计算蛋白相对表达量。
1.5.9 ELISA检测 根据各试剂盒说明书要求制备脑组织样本匀浆液,然后按照说明书要求依次测量血清和脑组织Aβ1-42和Aβ1-40的含量。
1.6 统计学分析
采用 GraphPad Prism 9统计软件进行统计处理,计量数据以均数±标准差表示,Morris水迷宫隐藏平台实验的逃避潜伏期比较使用双因素方差分析,其余数据组间比较使用单因素方差分析,若方差齐采用Tukey多重比较分析,方差不齐则采用Tamhane T2多重比较分析。Plt;0.05为差异具有统计学意义。
2 结果
2.1 异功散对APP/PS1小鼠学习记忆能力的影响
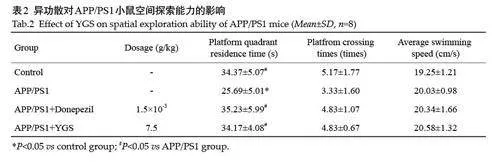
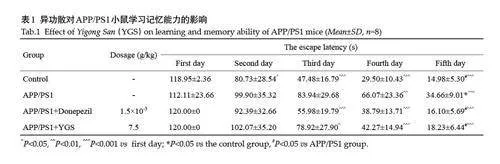
在隐藏平台实验中,随着训练时间的增加各组小鼠的逃避潜伏期均显著下降[F(4,140)=107.8,Plt;0.001],各组间小鼠逃避潜伏期差异也有统计学意义[F(3,140)=8.343,Plt;0.001]。与对照组比较,模型组小鼠第5天的逃避潜伏期明显增加(Plt;0.001);与模型组比较,异功散7.5 g/kg 组小鼠第5 天的逃避潜伏期明显缩短(Plt;0.001,表1)。
与对照组比较,模型组小鼠的平台象限累积时间和穿越平台象限次数均降低,其中平台象限累积时间差异具有统计学意义(Plt;0.05),而平均游泳速度差异无统计学意义(Pgt;0.05)。与模型组比较,异功散给药组小鼠的平台象限累积时间和穿越平台次数均升高,其中平台象限累积时间差异具有统计学意义(Plt;0.05),但游泳速度差异无统计学意义(Pgt;0.05,表2)。
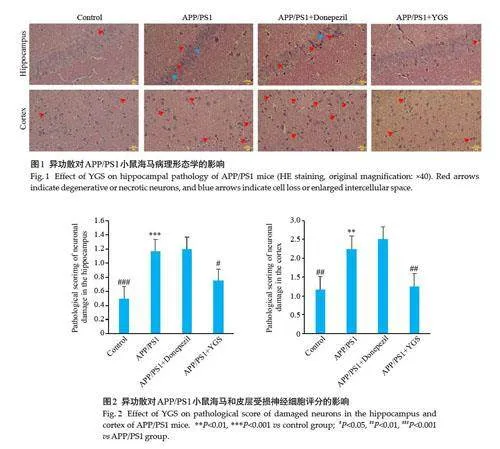
2.2 异功散对APP/PS1小鼠海马病理形态学的影响
对照组小鼠海马神经细胞排列整齐紧密,层次分明,细胞结构清晰可见,偶见个别变性或坏死细胞(红色箭头)。与对照组小鼠比较,模型组小鼠海马神经细胞散乱排列、部分细胞缺失、细胞间间隙变大(蓝色箭头)并可见神经细胞细胞核固缩、变性或死亡,病理评分明显升高(Plt;0.001);与模型组比较,异功散组小鼠海马神经细胞排列相对整齐、紧密,细胞结构清晰,偶可见个别神经细胞变性或死亡,病理评分均明显降低(Plt;0.01,图1、2)。
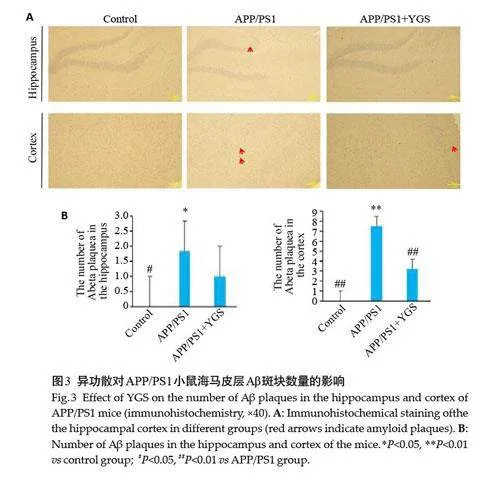
2.3 异功散对APP/PS1小鼠海马皮层Aβ斑块数量的影响
免疫组化结果显示,对照组小鼠的海马和皮层未见明显的淀粉样斑块沉积。与对照组比较,模型组小鼠海马(Plt;0.01)和皮层(Plt;0.05)均可见明显的阳性斑块;与模型组比较,异功散组小鼠海马和皮层的阳性斑块均明显减少,其中皮层差异具有统计学意义(Plt;0.01,图3)。
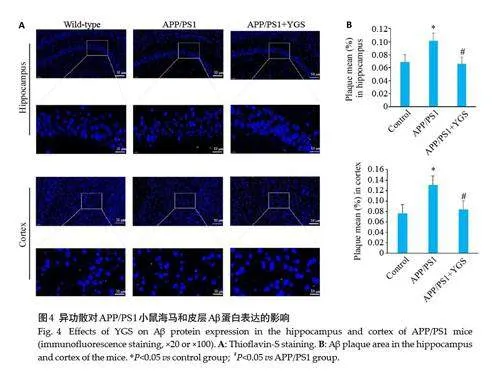
2.4 异功散对APP/PS1 小鼠海马皮层Aβ 蛋白表达的影响
硫磺素S染色结果显示,各组均有不同程度的阳性荧光斑点,与对照组比较,模型组海马和皮层硫磺素S的平均荧光强度均明显增强(Plt;0.05);与模型组比较,异功散组硫磺素S的平均荧光强度均减弱(Plt;0.05,图4)。
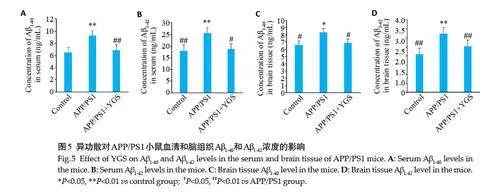
2.5 异功散对APP/PS1小鼠血清和脑组织Aβ1-40和Aβ1-42浓度的影响
与对照组比较,模型组小鼠脑组织和血清Aβ1-40和Aβ1-42的含量均明显升高(Plt;0.05);与模型组比较,异功散组小鼠脑组织和血清Aβ1-40和Aβ1-42的含量均明显下降(Plt;0.05,图5)。
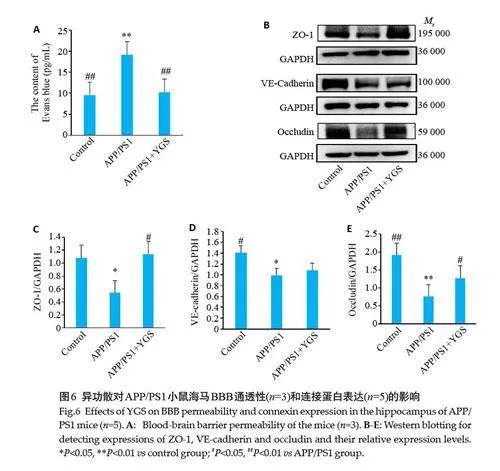
2.6 异功散对APP/PS1小鼠BBB通透性和连接蛋白表达的影响
与对照组比较,模型组小鼠脑组织中伊文思蓝的浓度显著升高(Plt;0.01),ZO-1、VE-cadherin 和Occludin的相对蛋白表达均降低,其中后两者差异具有统计学意义(Plt;0.05);与模型组比较,异功散组小鼠脑组织中的伊文思蓝浓度明显下降(Plt;0.01),ZO-1、VE-cadherin和Occludin的相对蛋白表达均升高, ZO-1和Occludin差异具有统计学意义(Plt;0.05,图6)。
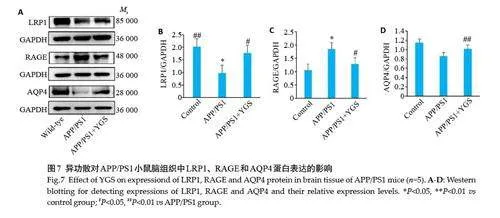
2.7 异功散对APP/PS1 小鼠脑组织中LRP1、RAGE和AQP4蛋白表达的影响
与对照组比较,模型组小鼠脑组织中LRP1 和AQP4 的相对蛋白表达均降低,其中前者差异具有统计学意义(Plt;0.05),RAGE 的相对蛋白表达显著升高(Plt;0.01)。与模型组比较,异功散组小鼠组织中LRP1和AQP4的相对蛋白表达均升高(Plt;0.05),而RAGE的相对蛋白则明显降低(Plt;0.05,图7)。
2.8 异功散对APP/PS1 小鼠脑组织中AQP4 极化的影响
免疫荧光染色显示,对照组小鼠脑内GFAP阳性表达细胞中坐落有较多的AQP4,模型组小鼠脑内GFAP阳性表达细胞较多但AQP4坐落较少,异功散组小鼠脑内GFAP 阳性表达细胞中有较多AQP4 坐落。与对照组比较,模型组小鼠海马和皮层中表达有AQP4 的GFAP 阳性细胞数量均明显降低(Plt;0.05)。与模型组比较,异功散组小鼠海马和皮层中表达有AQP4 的GFAP阳性细胞数量均明显升高(Plt;0.01,图8)。
2.9 异功散对APP/PS1 小鼠脑组织APP、PS1、BACE1和IDE蛋白表达的影响
与对照组比较,模型组小鼠脑组织中APP、PS1 和BACE1 的蛋白表达均明显上调(Plt;0.05),而IDE的蛋白表达显著下调(Plt;0.01)。与模型组比较,异功散组小鼠脑组织中APP、PS1 和BACE1 的蛋白表达均显著下调(Plt;0.01),IDE 的蛋白表达上调但差异无统计学意义(Pgt;0.05,图9)。
3 讨论
中医认为痰瘀聚集,久酿成毒,毒损脑络是痴呆症疾病演变的核心[3],而痰是津液的异常形态,即津液代谢异常可能是痴呆症的始动因素。Aβ是痴呆症主要类型阿尔茨海默病(AD)的特征性病理产物,在 AD症状前阶段或轻度认知障碍(MCI)阶段的就可检测到它的异常变化[10]。值得注意的是,有学者指出Aβ与痰邪具有密切相关性,如痰的产生和Aβ沉积、痰的趋下聚集特性和Aβ聚集、痰邪黏滞与Aβ沉积难消均具有相似性,并且两者均既是病理产物也是致病因素[11]。因此,Aβ的异常变化属于中医津液代谢异常(痰)范畴。本研究采用异功散灌胃干预1月后发现,异功散能够改善APP/PS1转基因小鼠学习能力下降及其海马皮层神经细胞损伤,下调其海马皮层Aβ蛋白表达和减少Aβ斑块数量,并降低血清和脑组织中Aβ1-42和Aβ1-40的含量。这提示异功散具体通过调节津液代谢异常而改善痴呆症的作用。
BBB是脑内外物质交换的重要生理屏障,也是脑津液代谢系统的重要组成。大量研究表明在MCI和早期AD患者海马、部分白质和灰质部位均可见BBB损伤[12,13],多种痴呆症模型动物如APP/PS1 转基因小鼠、D-半乳糖诱导的衰老模型小鼠、脂多糖诱导的认知下降小鼠等[8, 14-16]同样也存在明显BBB损伤。BBB重要组成—紧密连接(ZO-1 和Occludin 等)和粘附连接(VEcadherin等)能够限制外周血到达大脑物质的渗透从而防止神经炎症的发生[17]。本研究结果显示APP/PS1小鼠BBB通透性增加,且其脑组织的ZO-1、VE-cadherin和Occludin 蛋白表达下调,说明该小鼠存在BBB损伤,这与文献报道一致[14, 15]。异功散干预后能够明显降低APP/PS1小鼠的BBB通透性并上调ZO-1、VE-cadherin和Occludin的蛋白表达,提示异功散可能通过促进连接蛋白和黏附蛋白表达而改善BBB损伤。
BBB结构的损伤可直接影响位于BBB上的跨膜受体或蛋白如LRP1、RAGE、AQP4等的正常表达及物质交换。如AD动物模型和患者脑内内皮细胞RAGE的显著高表达可促进外周可溶性Aβ穿过BBB,引起血管内皮炎症应答、脑内皮NF-κB依赖性凋亡和抑制脑血流[18, 19];LRP1 的显著降低表达导致其内皮特异性sLRP1对血浆中Aβ的阻断作用[20, 21];AQP4的低表达不仅影响脑内Aβ清除还可加剧星形胶质细胞萎缩[22-24]。本研究中APP/PS1 小鼠脑组织中LRP1 和AQP4 蛋白表达明显下调而RAGE的蛋白表达明显升高,给予异功散干预后可明显逆转上述结果,提示异功散能够调控上述跨膜受体或蛋白的异常表达。同时,AQP4在血管周围间隙相邻的星形胶质胞终足上的表达(即AQP4 极化)是胶质淋巴系统功能正常运行所必须的关键调节点[6]。本研究中GFAP标记的星形胶质细胞和APQ4荧光共定位结果显示APP/PS1 小鼠海马和皮层区中AQP4在GFAP阳性表达细胞中表达数量均明显降低,而异功散能够明显增加AQP4 在GFAP 阳性表达细胞中表达数量,这同时异功散能够促进AQP4极化而维持胶质淋巴系统正常功能。
Aβ是由β-分泌酶(BACE1)切割β-淀粉样前体蛋白(APP)后形成可溶性胞外域β-N端片段及β-C端片段(CTFβ),CTFβ又被γ-分泌酶进一步加工成Aβ形式,如Aβ1–40和Aβ1–42[25, 26]。正常情况下产生的Aβ可通过上述转运体和胶质淋巴系统清除,也可经IDE降解。本研究发现异功散干预后,能够明显下调APP、PS1、BACE1的蛋白表达而上调IDE的蛋白表达。这提示异功散能够调控APP的异常代谢途径。
综上所述,本研究表明异功散能够明显改善APP/PS1小鼠的学习记忆能力、脑内神经细胞损伤和Aβ病变,这与其调控连接蛋白表达改善BBB通透性、调控BBB上表达的跨膜受体和蛋白表达、促进AQP4极化和调控APP代谢途径有关。
参考文献:
[1] 张景明, 陈震霖. 论津液与脏腑关系及其抗病御邪作用[J]. 中国中
医基础医学杂志, 2007, 13(1): 13-4.
[2] 陈路军, 孙智玲, 陈文静, 等. 从“ 津液代谢” 探讨变通小青龙汤在慢
性阻塞性肺疾病急性期的应用[J]. 中医药临床杂志, 2022, 34(10):
1811-4.
[3] 徐世军, 赵宜军, 张文生. 从中医脑络功能演变谈轻度认知障碍的病
机[J]. 中医杂志, 2011, 52(19): 1627-9.
[4] 田 恺, 张向宇, 牛博真, 等. 基于“ 毒损脑络” 理论中医脑病病因病机
和辨证施治的研究进展[J]. 中西医结合心脑血管病杂志, 2021, 19
(8): 1308-10.
[5] 魏江平, 赵子瑄, 曾 静, 等. 异功散调控CXCL12/CXCR4信号减少
谷氨酸释放改善衰老模型小鼠认知下降[J]. 中国中药杂志, 2023,
48(23): 6483-91.
[6] Mestre H, Kostrikov S, Mehta RI, et al. Perivascular spaces,
glymphatic dysfunction, and small vessel disease[J]. Clin Sci, 2017,
131(17): 2257-74.
[7] Mamtilahun M, Wei ZY, Qin C, et al. DL-3n-butylphthalide
improves blood-brain barrier integrity in rat after middle cerebral
artery occlusion[J]. Front Cell Neurosci, 2020, 14: 610714.
[8] Wei JP, Dai Y, Wen W, et al. Blood-brain barrier integrity is the
primary target of alcohol abuse[J]. Chem Biol Interact, 2021, 337:
109400.
[9] Shi ZS, Zhu LH, Li TT, et al. Neuroprotective mechanisms of
Lycium barbarum polysaccharides against ischemic insults by
regulating NR2B and NR2A containing NMDA receptor signaling
pathways[J]. Front Cell Neurosci, 2017, 11: 288.
[10]Gonneaud J, Arenaza-Urquijo EM, Mézenge F, et al. Increased
florbetapir binding in the temporal neocortex from age 20 to 60 years
[J]. Neurology, 2017, 89(24): 2438-46.
[11]吴东南, 刘 玲, 明淑萍, 等. 基于“Aβ异常沉积” 浅析中医“从痰论
治” 阿尔茨海默病[J]. 中华中医药杂志, 2019, 34(10): 4699-702.
[12]Yang AC, Vest RT, Kern F, et al. A human brain vascular atlas reveals
diverse mediators of Alzheimer’s risk[J]. Nature, 2022, 603(7903):
885-92.
[13]Montagne A, Barnes SR, Sweeney MD, et al. Blood-brain barrier
breakdown in the aging human hippocampus[J]. Neuron, 2015, 85
(2): 296-302.
[14]Wei JP, Qin LX, Fu Y, et al. Long-term consumption of alcohol
exacerbates neural lesions by destroying the functional integrity of
the blood-brain barrier[J]. Drug Chem Toxicol, 2022, 45(1): 231-8.
[15]Wang Q, Huang XM, Su YX, et al. Activation of Wnt/β-catenin
pathway mitigates blood-brain barrier dysfunction in Alzheimer's
disease[J]. Brain, 2022, 145(12): 4474-88.
[16]Hu MY, Li TM, Ma XM, et al. Macrophage lineage cells-derived
migrasomes activate complement-dependent blood-brain barrier
damage in cerebral amyloid angiopathy mouse model[J]. Nat
Commun, 2023, 14(1): 3945.
[17]Xie P, Kancherla K, Chandramohan S, et al. Involvement of single
nucleotide polymorphisms of junction adhesion molecule with small
vessel vascular dementia[J]. Aging Med, 2023, 6(4): 347-52.
[18]Yan SD, Chen X, Fu J, et al. RAGE and amyloid-beta peptide
neurotoxicity in Alzheimer's disease[J]. Nature, 1996, 382(6593):
685-91.
[19]Sagare A, Deane R, Bell RD, et al. Clearance of amyloid-beta by
circulating lipoprotein receptors[J]. Nat Med, 2007, 13(9): 1029-31.
[20]Lee J, Lee H, Lee H, et al. ANKS1A regulates LDL receptor-related
protein 1 (LRP1)‑mediated cerebrovascular clearance in brain
endothelial cells[J]. Nat Commun, 2023, 14(1): 8463.
[21]Kanekiyo T, Cirrito JR, Liu CC, et al. Neuronal clearance of
amyloid‑β by endocytic receptor LRP1[J]. J Neurosci, 2013, 33
(49): 19276-83.
[22]Burfeind KG, Murchison CF, Westaway SK, et al. The effects of
noncoding aquaporin-4 single-nucleotide polymorphisms on
cognition and functional progression of Alzheimer's disease[J].
Alzheimers Dement, 2017, 3(3): 348-59.
[23]Zeppenfeld DM, Simon M, Haswell JD, et al. Association of
perivascular localization of aquaporin-4 with cognition and
alzheimer disease in aging brains[J]. JAMA Neurol, 2017, 74(1):
91-9.
[24] Iliff JJ, Wang MH, Liao YH, et al. A paravascular pathway facilitates
CSF flow through the brain parenchyma and the clearance of
interstitial solutes, including amyloid Β[J]. Sci Transl Med, 2012, 4
(147): 147ra111.
[25]Galvão F Jr, Grokoski KC, da Silva BB, et al. The amyloid precursor
protein (APP) processing as a biological link between Alzheimer's
disease and cancer[J]. Ageing Res Rev, 2019, 49: 83-91.
[26]Rammes G. Molecular mechanism of Alzheimer’s disease[J]. Int J
Mol Sci, 2023, 24(23): 16837.
(编辑:林 萍)

