通塞颗粒阻抑巨噬细胞炎症反应改善大鼠慢性阻塞性肺疾病急性加重
摘要:目的 探讨通塞颗粒(TSG)阻抑巨噬细胞炎症反应改善慢性阻塞性肺疾病急性加重期(AECOPD)大鼠的作用机制。方法 24 只SD大鼠随机分为对照(Control)组、模型(Model)组、TSG组和莫西沙星+沙丁胺醇(MXF+STL)组,6 只/组。第1~8 周建立慢性阻塞性肺疾病(COPD)大鼠模型,第9周第3天,经鼻滴入肺炎克雷伯杆菌建立AECOPD大鼠模型。第9周的第1~2天和第4~7天,Control组和Model组给予生理盐水灌胃,TSG组和MXF+STL组分别给予TSG和MXF+STL灌胃,灌胃结束后处死大鼠。HE染色观察大鼠肺组织病理变化;检测肺组织白细胞介素IL-1β、IL-6、肿瘤坏死因子TNF-α、基质金属蛋白酶MMP2和MMP9 表达。采用脂多糖(LPS)刺激巨噬细胞MH-S,给予TSG含药血清及其代表成分干预,检测IL-1β、IL-6、TNF-α、环氧化酶COX-2 及诱导型一氧化氮合酶(iNOS)mRNA 水平,磷酸化P38(p-p38)、p-p62、微管相关蛋白1A/1B-轻链3(LC3)、Forkhead box O3(FoxO3a)及p-mTOR蛋白水平。结果 TSG显著改善AECOPD大鼠肺组织损伤与肺功能,包括降低支气管壁厚度、肺泡平均线性截距及上调平均肺泡数(Plt;0.05);TSG明显抑制AECOPD大鼠肺组织炎症因子IL-1β、IL-6、TNF-α及基质金属蛋白酶MMP2和MMP9表达水平(Plt;0.01)。TSG显著抑制脂多糖诱导的巨噬细胞炎症因子IL-1β、IL-6、TNF-α 及相关代谢酶COX-2、iNOS的表达(Plt;0.05)。血清药物化学联合网络药理鉴定了TSG含药血清10种化学成分,其对应466个靶点核心功能分析显示,TSG干预AECOPD可能与其主要成分木犀草素、槲皮素、贝母辛、贝母乙素等调控MAPK、mTOR、FoxO、自噬等有关。体外实验显示,木犀草素可以显著抑制LPS 诱导巨噬细胞炎症反应及相关信号如p-p38,调控自噬相关信号FoxO3a、mTOR,以及抑制自噬相关蛋白p-p62、LC3的表达(Plt;0.05)。结论 TSG抑制巨噬细胞炎症反应缓解AECOPD,其机制可能与调控p38、mTOR、FoxO3a信号及抑制自噬有关。
关键词:通塞颗粒;慢性阻塞性肺疾病急性加重期;巨噬细胞;炎症反应
慢性阻塞性肺疾病(COPD)是一种以持续性、进行性加重的气流受限为特征的慢性呼吸系统疾病[1]。急性加重(AE)COPD患者呼吸系统症状急性恶化是导致疾病迅速进展及患者死亡的重要原因[2]。巨噬细胞在机体防御、损伤修复、炎症反应等过程中发挥重要作用[3],其介导炎症反应及组织损伤是AECOPD剧烈炎症反应及肺组织损伤、肺功能下降的关键因素。研究发现,巨噬细胞在AECOPD患者肺组织大量聚集,且对有害物质如香烟烟雾更为敏感[4],可分泌多种炎症介质如肿瘤坏死因子TNF-α、白细胞介素IL-8 等[5],扩大炎症反应;肺组织巨噬细胞还产生高活性弹性蛋白酶如基质金属蛋白酶2、9、12[6],降解细胞外基质破坏肺泡结构加重肺气肿,且肺实质中巨噬细胞数量与肺气肿严重程度呈正相关。因此,抑制巨噬细胞炎症反应是改善AECOPD的有效途径。
中医药防治AECOPD具有较好疗效,可以明显减轻临床症状、缩短病程。AECOPD多在正虚的基础上感受外邪,虚实并存,以实为主,其中痰瘀互阻为关键病机,痰热壅肺为常见证候[7],治法当以清肺化痰、降逆平喘为基本原则[8]。据此拟定的通塞颗粒(TSG)方药具有清热涤痰活血、宣肺降气平喘、扶正虚、祛邪实之功效,辨证治疗能够改善患者临床症状,延缓肺功能下降速率,提高生活质量[9]。但其作用机制仍需进一步探究。中药复方口服入血众多成分与不同靶点结合在靶组织发挥多种药效;网络药理学可以系统分析中药成分群及其多靶点药理机制,从“多成分、多靶点和多途径”的角度阐释其多成分的作用机制。因此,通过中药复方的入血成分检测结合网络药效学分析可以有效揭示中药复方作用机制。本研究通过建立AECOPD模型大鼠和LPS诱导巨噬细胞炎症反应模型,借助TSG入血成分与网络药理学分析,探讨TSG抑制巨噬细胞炎症反应改善AECOPD作用机制。
1 材料和方法
1.1 材料
1.1.1 动物 SD大鼠24 只(雄性,6~8 周,体质量200~240 g),无特定病原体,购自北京维通利华实验动物技术有限公司,许可证号[SYXK(Yu)2020-004]。本研究通过河南中医药大学动物福利伦理审查委员会审查批准(伦理审批号:DWLL202003210)。
1.1.2 细胞 MH-S细胞购自中国科学院上海生命科学院细胞资源中心。
1.1.3 香烟与细菌 红旗渠过滤嘴香烟(烤烟型,焦油量10 mg,尼古丁量0.8 mg,烟气一氧化碳量11 mg)由中国烟草河南工业有限公司(河南郑州)供应。肺炎克雷伯杆菌(Kp,菌株编号:46117,中国医学细菌保藏管理中心)。
1.1.4 药物 盐酸莫西沙星片剂(MXF,拜尔)。硫酸沙丁胺醇片(STL,亚邦爱普森药业)。通塞颗粒(TSG,瑞龙制药)由10 种中草药组成,包括葶苈子、地龙、浙贝母、酒大黄、蜜麻黄、赤芍、矮地茶、人参、麦冬和石菖蒲。木犀草素(曼斯特)。
1.1.5 试剂 1640 高糖培养基(Solarbio);胎牛血清(Lonsera);PBS和10% SDS-PAGE凝胶试剂盒(雅酶)。LC3(稀释比例1∶1000), p-p62(稀释比例1∶1000), p-p38(稀释比例1∶1000), Fox3a(稀释比例1∶1000), p-mTOR(稀释比例1∶1000)和GAPDH抗体,以及辣根过氧化物酶标记的山羊抗兔IgG Ⅱ抗(Proteintech);HiScript IIQ RT superMix for qPCR、ChamQ blue universal SYBRqPCR Master Mix(诺唯赞);LPS(Sigma)。
1.2 方法
1.2.1 慢阻肺急性加重期大鼠模型的建立及治疗 将24只大鼠随机分为对照组(Control)、模型组(Model)、通塞颗粒组(TSG)和阳性对照组(MXF+STL),n=6。第1~8周将大鼠暴露于香烟烟雾[(3000±500)×10−6,2次/d,30 min/次]和肺炎克雷伯杆菌(6×108 CFU/mL)以建立COPD大鼠模型[10]。第9 周第3 天,采用大鼠气管内滴注肺炎克雷伯杆菌(6×1014 CFU/mL),建立AECOPD大鼠模型。第9周第1~2天和第4~7天,对照组和模型组给予生理盐水灌胃,通塞颗粒组给予通塞颗粒中药8.01 g/(kg·d),西药组给予MXF36 mg/(kg·d)+STL1.08 mg/(kg·d)[11]。大鼠用药剂量按照以下公式计算:
Drat=Dhuman×(Krat/Khuman )×(Wrat/Whuman )2/3。D:剂量;K:体型指数,K=A/W2/3 (A:表面积/m2,W:体质量/kg)。在第10周的第1天,使用2%戊巴比妥(40 mg/kg)麻醉后处死大鼠。
1.2.2 肺组织病理学及免疫组化分析 采用4%中性甲醛固定左肺,梯度脱水,72 h后进行石蜡包埋,切片并进行HE染色。通过光学显微镜(奥林巴斯)观察支气管和肺泡的病理变化,并使用摄影系统进行拍摄。利用Adobe Photoshop CC 中的计数工具计算平均肺泡数(MAN, mm²)和肺泡的平均线性截距(MLI,μm)。使用CaseViewer软件测量支气管壁厚度(BWT,mm)、支气管壁面积(BWA, mm²)与内周长(BWIC,μm)之比。通过免疫组化检测法检测肺组织中基质金属蛋白酶MMP-2、MMP-9,及白细胞介素IL-1β、IL-6、肿瘤坏死因子TNF-α的表达。在×200倍视野下,使用CaseViewer软件随机选取每张肺组织切片的6 个肺泡及气道视野进行拍摄,并通过Image-Pro Plus 6.0 分析阳性表达区域。6 个肺泡及气道视野拍摄使用Image-Pro Plus 6.0分析阳性表达区域。
1.2.3 细胞培养及处理 巨噬细胞MH-S细胞在37 ℃、5% CO2 的培养箱中,使用含有10% 胎牛血清的RPMI 1640培养基进行培养。将MH-S细胞以9×105/孔接种于35 mm的培养皿中,待细胞密度达80%后,分别给予TSG含药血清及不同代表活性成分作用3 h后,加入LPS诱导作用24 h。
1.2.4 实时荧光定量PCR 使用TRIzol(Invitrogen)从MH-S 细胞中提取RNA。采用HiScript Ⅱ Q RTSuperMix 将所提取的RNA 逆转录为cDNA。在QuantStudio 6 Flex 实时荧光定量PCR 仪上,使用ChamQ Universal SYBR Green qPCR Master Mix 和相应的引物进行扩增反应。本实验所使用的引物包括IL-1β、IL-6、TNF-α、COX-2和iNOS。
1.2.5 Western blotting 使用RIPA裂解液提取MH-S细胞总蛋白,并使用BCA蛋白测定试剂盒测定蛋白浓度。蛋白变性后每组各取20 μL样本进行SDS-PAGE电泳,采用湿转法将目标蛋白转移至PVDF膜上。在室温条件下,使用10%脱脂奶粉室温封闭1 h。4 ℃条件下孵育一抗p-p38、LC3、FoxO3a、p-p62、mTOR 和GAPDH过夜。洗膜后室温孵育二抗1h。洗膜后使用成像系统(Bio-Rad)曝光显影,使用Image j进行分析。
1.2.6 网络药理学分析 采用UPLC-Q/TOF-MS/MS分析TSG含药血清所含成分,通过Swiss Target 数据库(http://www.swisstargetprediction.ch/)和PharmMapper数据库(http://lilab-ecust. cn/pharmmapper/index.html)筛选成分潜在靶点,STRING数据库(https://string-db.org/)考察蛋白质相互作用(PPI)网络及靶点相关KEGG通路,使用Cytoscape 3. 9. 1可视化结果数据[12]。
1.2.7 统计学分析 实验结果均以均数±标准差表示。使用SPSS 23.0进行统计学分析。采用单因素方差分析进行组间比较,符合方差齐性的采用LSD,方差不齐的数据采用Dunnett's T3 法。Plt;0.05 为差异有统计学意义。
2 结果
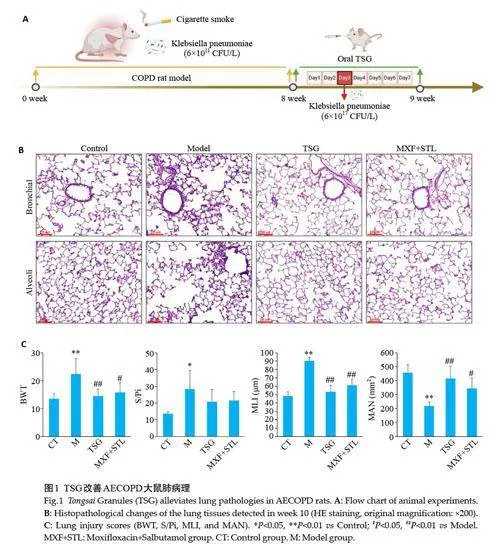
2.1 TSG改善AECOPD大鼠肺组织病变
Control 组大鼠肺组织未见明显病理改变;Model组大鼠肺组织可见明显气道壁增厚,肺泡壁断裂融合及炎性细胞浸润;TSG组和MXF+STL组大鼠肺组织病理损伤均明显减轻。与Control 组比,Model 组大鼠支气管壁厚度和肺泡平均线性截距显著升高,平均肺泡数显著降低(Plt;0.05);与Model组比较,TSG组和MXF+STL组BWT和MLI显著降低,MAN显著升高(Plt;0.05,图1)。
2.2 TSG改善AECOPD大鼠的肺部炎症
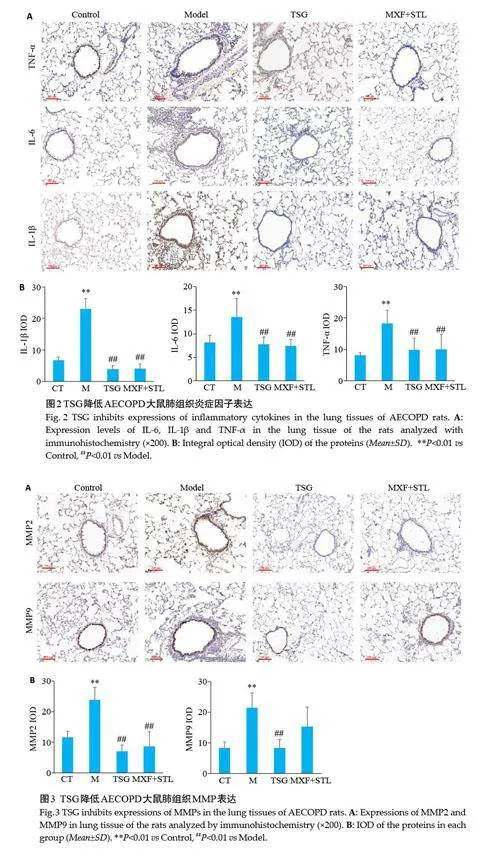
与Control 组相比,Model 组大鼠肺组织IL-1β、IL-6、TNF-α表达显著升高(Plt;0.01)。与Model 组相比,TSG 组和MXF+STL 组大鼠肺组织IL-1β、IL-6、TNF-α表达显著降低(Plt;0.01,图2)。
2.3 TSG减少AECOPD大鼠肺组织MMP表达
与Control 组比较,Model 组大鼠肺组织MMP-2和MMP-9 水平显著升高(Plt;0.01)。与Model组比较,TSG 组大鼠肺组织MMP-2 和MMP-9 水平显著降低(Plt;0.05,图3),MXF+STL组大鼠肺组织MMP-2 水平显著降低(Plt;0.01),MMP-9水平变化无统计学意义。
2.4 TSG含药血清抑制巨噬细胞炎症反应
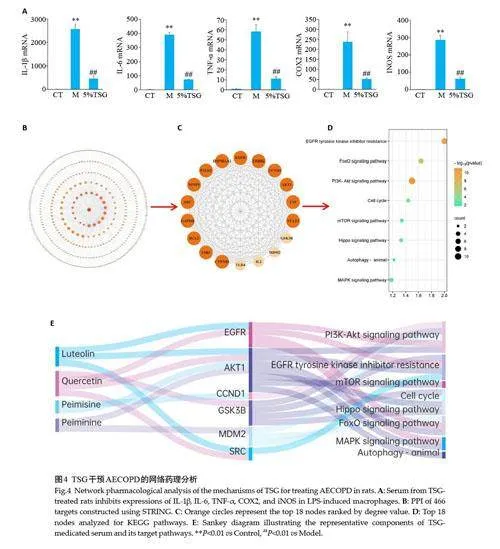
与空白组比较,LPS可以显著上调巨噬细胞IL-1β、IL-6、TNF-α、COX2、INOS 的mRNA 表达;与模型组比较,5%TSG含药血清可以抑制LPS 诱导巨噬细胞IL-1β、IL-6、TNF‑α、COX2、INOS mRNA 表达水平(Plt;0.01,图4A)。
2.5 TSG干预AECOPD的网络药理学分析
通过UPLC-Q-Extractive-Orbitrap MS 鉴定TSG含药血清化学成分10种,检索数据库获得10种化合物对应的466个靶点并构建PPI网络,对degree≥100的18个核心节点进行KEGG通路富集分析发现,TSG含药血清中木犀草素、槲皮素、贝母辛、贝母乙素等成分调控多种生物过程,包括PI3K-Akt、EGFR、mTOR、FoxO、MAPK、自噬等(图4B、C)。
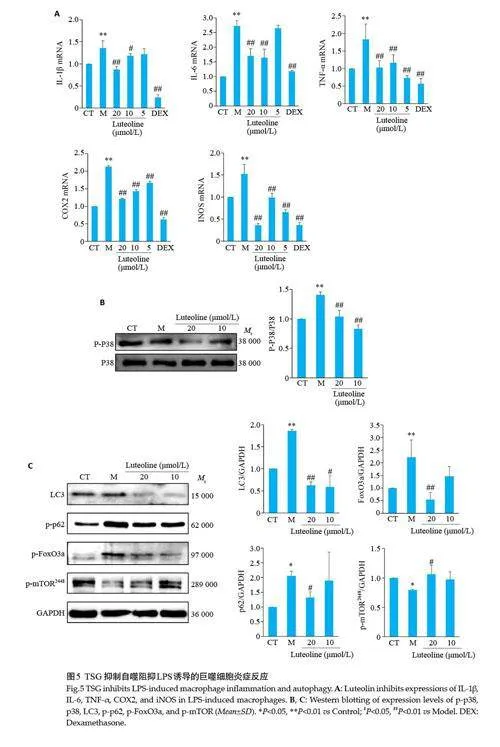
2.6 TSG入血代表成分抑制巨噬细胞炎症反应
与Control 组相比,Model 组细胞IL-1β、IL-6、TNF-α、COX2和iNOS mRNA均显著升高(Plt;0.01);与Model组比较,TSG代表组分木犀草素(20、10、5 μmol/L)可显著降低IL-1β、IL-6、TNF‑α、COX2 和iNOS 的mRNA水平(Plt;0.05,图5A)。与Control组比较,Model组细胞p-p38蛋白水平显著升高(Plt;0.01);与Model组比较,TSG代表组分木犀草素(20、10 μmol/L)可显著降低p-p38蛋白水平(Plt;0.01,图5B)。
2.7 TSG入血代表成分抑制巨噬细胞自噬
与Control 组比较,Model 组细胞LC3、p-62、p-FoxO3a 蛋白水平均显著升高(Plt;0.05),p-mTOR蛋白水平显著降低(Plt;0.05);与Model组比较,TSG入血代表组分木犀草素(20,10 μmol/L)可显著降低LC3、p-62、p-FoxO3a蛋白水平(Plt;0.05),升高p-mTOR蛋白水平(Plt;0.05,图5C)。
3 讨论
COPD是一种严重危害公众健康的重大疾病[13],急性加重是加速病情进展并导致患者死亡的重要原因[14-16]。目前的主要治疗措施包括抗菌药、支气管扩张剂和糖皮质激素等,能够改善症状和肺功能,减轻气道炎症[17-19],但也存在诸多不良反应,并且反复使用易产生抗药性且极易复发,增加医疗成本[20]。本团队针对AECOPD痰热壅肺证拟定的TSG辨证治疗能够改善患者的临床症状,延缓肺功能下降速率,提高生活质量。本研究发现TSG可以改善AECOPD模型大鼠的肺功能及肺组织损伤[11],下调基质金属蛋白酶MMP-2、MMP-9以减轻组织损伤,降低肺组织炎症因子水平以抑制炎症反应[12],这表明TSG可以有效改善AECOPD大鼠。
巨噬细胞介导炎症反应及其引发的组织损伤是造成AECOPD患者剧烈炎症反应、肺组织损伤以至肺功能快速下降的主要因素[21]。已有研究显示,巨噬细胞在AECOPD患者的的气道、肺实质、破损肺泡壁、肺泡灌洗液及痰液中的比例显著升高[4],并且通过分泌多种炎症介质以扩大炎症反应[22],还产生高活性基质金属蛋白酶2、9 等,降解细胞外基质破坏肺泡结构,进一步导致肺功能下降[23]。本研究发现,AECOPD大鼠肺组织炎症反应明显,包括炎细胞大量浸润、炎症因子TNF-α、IL-1β、IL-6 明显升高;肺组织基质金属蛋白酶如MMP-2、MMP-9也显著升高。而TSG干预后可以明显抑制炎症反应及基质金属蛋白酶的表达;此外TSG含药血清可以直接抑制LPS诱导巨噬细胞炎症反应,包括降低TNF-α、IL-1β、IL-6、COX-2 及iNOS表达。因此,TSG可以有效抑制巨噬细胞炎症反应及AECOPD大鼠肺组织炎症反应。
中药复方多经过口服给药入血到达靶组织发挥相应的药效,因此,有效成分如原形成分、代谢产物及机体产生的应激性成分主要存在血清[24-26];本研究采用TSG含药血清可以明显抑制巨噬细胞炎症反应,这表明TSG含药血清的化学成分是TSG抗炎的有效成分,因此通过分析口服给药后血清中成分能够发现TSG体内直接作用物质。本研究采用液质联用技术鉴定了TSG含药血清10种化学成分,这些成分可能通过多靶点、多途径发挥其药效;本研究进一步采用网络药理学分析了TSG 10种化学成分对应466个靶蛋白,继而构建466个靶点PPI 网络并分析其核心靶点生物学功能,揭示了TSG主要通过木犀草素、槲皮素、贝母辛、贝母乙素等调控AECOPD 相关信号及生物过程如自噬、PI3K、mTOR、FoxO、MAPK和Hippo发挥作用。FoxO转录因子家族包括FoxO1、FoxO3、FoxO4和FoxO6[27],通过调节自噬相关基因(如LC3、Beclin-1等)的表达[28],调控自噬维持细胞内环境稳定[29, 30];AECOPD患者肺组织中FoxO3 的表达显著增加,自噬水平也显著升高[31, 32]。mTOR信号是细胞生长、增殖、代谢和存活的关键调控者[33],其可以调节自噬相关蛋白调控自噬发生[34];AECOPD患者肺组织中mTORC1 的活性显著下降[35],自噬过程被显著激活。MAPK是调控炎症反应的关键信号[36, 37],p38 MAPK的激活是上调AECOPD患者气道上皮细胞和巨噬细胞的促炎细胞因子表达的关键信号[11]。自噬和炎症反应在AECOPD中的相互关系尤为复杂且密切。自噬作为一种细胞保护机制,在AECOPD的病理过程中可能具有双重作用[38-40]:一方面,通过清除受损细胞器和蛋白质,减轻细胞损伤和炎症反应[41];另一方面,自噬过度活跃可导致细胞、线粒体死亡及损伤,释放炎症介质,激活炎症小体,进一步激活NF-κB等信号增强炎症反应[42]。本研究发现,TSG入血成分木犀草素可显著抑制LPS诱导巨噬细胞中MAPK和FoxO信号活化,显著抑制自噬蛋白LC3B的表达,同时上调pmTOR的表达。因此,TSG抑制巨噬细胞炎症反应可能与抑制MAPK和FoxO信号通路,激活mTOR有关。
综上所述,TSG可有效减轻AECOPD大鼠肺组织病变,抑制自噬,抑制炎症反应,可能与MAPK、mTOR、FoxO信号通路相关。本研究为TSG的临床应用提供理论依据。
参考文献:
[1] Ferrera MC, Labaki WW, Han MK. Advances in chronic obstructive
pulmonary disease[J]. Annu Rev Med, 2021, 72: 119-34.
[2] Ritchie AI, Wedzicha JA. Definition, causes, pathogenesis, and
consequences of chronic obstructive pulmonary disease
exacerbations[J]. Clin Chest Med, 2020, 41(3): 421-38.
[3] Barnes PJ. Alveolar macrophages as orchestrators of COPD[J].
COPD, 2004, 1(1): 59-70.
[4] Barnes PJ. Inflammatory mechanisms in patients with chronic
obstructive pulmonary disease[J]. J Allergy Clin Immunol, 2016,
138(1): 16-27.
[5] Zheng JT, Shi Y, Xiong LX, et al. The expression of IL-6, TNF-α,
and MCP-1 in respiratory viral infection in acute exacerbations of
chronic obstructive pulmonary disease[J]. J Immunol Res, 2017,
2017: 8539294.
[6] Russell RE, Thorley A, Culpitt SV, et al. Alveolar macrophagemediated
elastolysis: roles of matrix metalloproteinases, cysteine,
and serine proteases[J]. Am J Physiol Lung Cell Mol Physiol, 2002,
283(4): L867-73.
[7] 余学庆, 李建生, 李 力. 慢性阻塞性肺疾病(COPD)中医证候分布规
律研究[J]. 河南中医学院学报, 2003, 18(4): 44-6.
[8] 李建生, 余学庆. 慢性阻塞性肺疾病中医分期分级防治策略[J]. 中
医杂志, 2019, 60(22): 1895-9.
[9] 李建生, 李素云, 马利军, 等. 通塞颗粒治疗老年慢性阻塞性肺疾病
(COPD)急性加重期的临床疗效评价[J]. 河南中医学院学报, 2003,
18(5): 35-8.
[10]Li Y, Li SY, Li JS, et al. A rat model for stable chronic obstructive
pulmonary disease induced by cigarette smoke inhalation and
repetitive bacterial infection[J]. Biol Pharm Bull, 2012, 35(10):
1752-60.
[11] Tao LY, Lu XF, Fu ZJ, et al. Tong Sai Granule improves AECOPD
via regulation of MAPK-SIRT1-NF‑κB pathway and cellular
senescence alleviation[J]. J Ethnopharmacol, 2023, 314: 116622.
[12]魏焱鑫, 魏 毓, 刘新光, 等. 通塞颗粒对AECOPD大鼠气道上皮屏
障及EGFR/ERK通路的影响[J]. 中国病理生理杂志, 2023, 39(12):
2204-13.
[13]Venkatesan P. GOLD COPD report: 2024 update[J]. Lancet Respir
Med, 2024, 12(1): 15-6.
[14]Soler-Cataluña JJ, Martínez-García MA, Román Sánchez P, et al.
Severe acute exacerbations and mortality in patients with chronic
obstructive pulmonary disease[J]. Thorax, 2005, 60(11): 925-31.
[15]Mannino DM, Buist AS. Global burden of COPD: risk factors,
prevalence, and future trends[J]. Lancet, 2007, 370(9589): 765-73.
[16]Zhu BF, Wang YF, Ming J, et al. Disease burden of COPD in China:
a systematic review[J]. Int J Chron Obstruct Pulmon Dis, 2018, 13:
1353-64.
[17]许 硕, 刘 欣, 袁太文, 等. 布地奈德联合特布他林治疗慢性阻塞性
肺疾病急性加重期的疗效观察[J]. 中国医院用药评价与分析,
2016, 16(8): 1033-4, 1035.
[18]杨振英, 王亚坤, 周礼清, 等. 糖皮质激素类联合肾上腺素能β激动
剂对慢性阻塞性肺疾病急性加重期患者的疗效分析[J]. 安徽医药,
2018, 22(1): 151-5.
[19]Vermeersch K, Gabrovska M, Aumann J, et al. Azithromycin during
acute chronic obstructive pulmonary disease exacerbations requiring
hospitalization (BACE). A multicenter, randomized, double-blind,
placebo-controlled trial[J]. Am J Respir Crit Care Med, 2019, 200
(7): 857-68.
[20]Vollenweider DJ, Jarrett H, Steurer-Stey CA, et al. Antibiotics for
exacerbations of chronic obstructive pulmonary disease[J].
Cochrane Database Syst Rev, 2012, 12: CD010257.
[21]Strzelak A, Ratajczak A, Adamiec A, et al. Tobacco smoke induces
and alters immune responses in the lung triggering inflammation,
allergy, asthma and other lung diseases: a mechanistic review[J]. Int
J Environ Res Public Health, 2018, 15(5): 1033.
[22]杨泽辉, 陈晓东, 张 强. 慢性阻塞性肺疾病患者血清及肺泡巨噬细
胞相关细胞因子水平变化[J]. 中国慢性病预防与控制, 2014, 22(2):
238-40.
[23]Barnes PJ. Cellular and molecular mechanisms of asthma and COPD
[J]. Clin Sci: Lond, 2017, 131(13): 1541-58.
[24]赵建荣, 李晓玫. 中药复方物质基础研究的现状与进展[J]. 中草药,
2003, 34(11): 963-6, 1010.
[25]郭立民, 王长云, 顾谦群, 等. 中药复方效应物质基础研究方法及其
发展趋势[J]. 中成药, 2007, 29(1): 118-21.
[26]张雯霞, 冯 敏, 苗雨露, 等. 中药血清药物化学的应用现状概述[J].
药物评价研究, 2019, 42(7): 1448-53.
[27]Santos BF, Grenho I, Martel PJ, et al. FOXO family isoforms[J].
Cell Death Dis, 2023, 14(10): 702.
[28]Zhang Y, Yu WP, Chang WG, et al. Light chain amyloidosis-induced
autophagy is mediated by the Foxo3a/beclin-1 pathway in
cardiomyocytes[J]. Lab Invest, 2023, 103(2): 100001.
[29]Fitzwalter BE, Thorburn A. FOXO3 links autophagy to apoptosis
[J]. Autophagy, 2018, 14(8): 1467-8.
[30]Audesse AJ, Dhakal S, Hassell LA, et al. FOXO3 directly regulates
an autophagy network to functionally regulate proteostasis in adult
neural stem cells[J]. PLoS Genet, 2019, 15(4): e1008097.
[31]Racanelli AC, Choi AMK, Choi ME. Autophagy in chronic lung
disease[M]//Progress in Molecular Biology and Translational
Science. Amsterdam: Elsevier, 2020: 135-56.
[32]Lv XX, Li K, Hu ZW. Chronic obstructive pulmonary disease and
autophagy[M]// Autophagy: Biology and Diseases. Singapore:
Springer, 2020: 559-67.
[33]Saxton RA, Sabatini DM. mTOR signaling in growth, metabolism,
and disease[J]. Cell, 2017, 169(2): 361-71.
[34]Kim YC, Guan KL. mTOR: a pharmacologic target for autophagy
regulation[J]. J Clin Invest, 2015, 125(1): 25-32.
[35]Huang QS, Yang HJ, Zhang CT, et al. Xiaoqinglong decoction
protects the lungs of AECOPD mice through the AMPK/mTOR
signaling pathway[J]. Evid Based Complement Alternat Med, 2020,
2020: 9865290.
[36]Kaminska B. MAPK signalling pathways as molecular targets for
anti-inflammatory therapy: from molecular mechanisms to
therapeutic benefits[J]. Biochim Biophys Acta, 2005, 1754(1/2):
253-62.
[37]Park MY, Ha SE, Kim HH, et al. Scutellarein inhibits LPS-induced
inflammation through NF‑κB/MAPKs signaling pathway in
RAW264.7 cells[J]. Molecules, 2022, 27(12): 3782.
[38]Yoshizaki T, Kusunoki C, Kondo M, et al. Autophagy regulates
inflammation in adipocytes[J]. Biochem Biophys Res Commun,
2012, 417(1): 352-7.
[39]Levine B, Kroemer G. Autophagy in the pathogenesis of disease[J].
Cell, 2008, 132(1): 27-42.
[40]朱紫亨, 郑佳昆, 冯淬灵. 自噬在肺部慢性炎症性疾病中的作用[J].
西南医科大学学报, 2024, 47(2): 176-179.
[41]Yang S, Li FY, Lu SY, et al. Ginseng root extract attenuates
inflammation by inhibiting the MAPK/NF‑κB signaling pathway
and activating autophagy and p62-Nrf2-Keap1 signaling in vitro and
in vivo[J]. J Ethnopharmacol, 2022, 283: 114739.
[42]Matsuzawa-Ishimoto Y, Hwang S, Cadwell K. Autophagy and
inflammation[J]. Annu Rev Immunol, 2018, 36: 73-101.
(编辑:经 媛)

