高原低氧暴露导致小鼠脾脏组织脂代谢发生紊乱的分子机制


摘要:目的 探究高原低氧致使小鼠脾脏组织脂代谢发生紊乱的分子机制。方法 本研究以C57BL/6 雄性小鼠脾脏组织为对象,随机分为两组,5 只/组:平原常氧组(PSC组),饲养于海拔400 m;高原低氧组(HST组) ,饲养于海拔4200 m,构建30 d的低氧动物模型。通过脂质组学分析脂类代谢产物的变化,采用液相色谱-质谱联用(LC-MS)技术对脾脏组织进行代谢组学分析,筛选差异代谢物,并对其进行KEGG富集注释分析和KEGG通路分析,进一步通过转录组测序筛选出差异基因。最后,运用生物信息学分析将代谢组学和转录组学联合,重点关注了类固醇激素的生物合成、花生四烯酸代谢和嘌呤代谢通路中差异代谢物的上游靶基因。通过RT-qPCR检测11β-羟化类固醇脱氢酶1(HSD11B1)、类固醇5α还原酶1(SRD5A1)、前列腺素-内过氧化物合酶 1(PTGS1)、造血前列腺素D合成酶(HPGDS)、黄嘌呤脱氢酶(XDH)、嘌呤核苷磷酸化酶(PNP)、次黄嘌呤鸟嘌呤-磷酸核糖基转移酶(HPRT)、胞外5′-核苷酸酶(NT5E)的mRNA的表达量,通过Western blotting 检测HSD11B1、SRD5A1、XDH、PNP、HPRT的蛋白表达量。结果 脂质组学富集到41种差异脂类代谢物,通过代谢组学和转录组学联合分析,发现差异代谢物和差异基因显著富集于类固醇激素的生物合成、花生四烯酸代谢和嘌呤代谢。与平原常氧组相比,高原低氧组的差异代谢物肾上腺甾酮、雄甾酮、前列腺素D2、前列腺素J2、黄嘌呤、黄嘌呤碱、尿酸的表达量显著上调(Plt;0.05),且代谢物上游的关键基因HSD11B1、SRD5A1、PTGS1、HPGDS、XDH、PNP、HPRT、NT5E 的mRNA 表达量显著上调或下调(Plt;0.05),差异蛋白HSD11B1、SRD5A1、XDH、PNP、HPRT的表达量上调或下调(Plt;0.05)。结论 高原低氧通过影响类固醇激素的生物合成、花生四烯酸代谢、嘌呤代谢三条通路来致使小鼠脾脏组织脂代谢发生紊乱。
关键词:脂代谢;高原低氧;代谢组学;转录组学;脾脏;脂质组学
高原地区特殊的低压、低氧环境会引起动脉氧分压降低,导致机体组织器官处于低氧状态。目前关于高原低氧的动物研究大多依赖于低压氧舱模拟环境,无法准确反映在真实高海拔环境中所经历的生理和病理变化[1, 2]。脾脏是哺乳动物重要的免疫器官[3],具有免疫调节和免疫监视的功能[4]。持续的低氧可引起脾脏组织的结构和功能发生改变[5]。研究发现脾脏与血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇的含量密切相关[6],然而,低氧如何胁迫脾脏发生脂代谢紊乱,诱导小鼠脾脏组织损伤有待深入研究。因此本研究重点关注了脾脏组织,并通过代谢组学和转录组测序联合分析低氧刺激脾脏脂代谢紊乱的具体分子机制,为低氧脾脏损伤疗法提供新的研究思路。
1 材料和方法
1.1 实验动物
实验选用6~8周龄SPF级C57BL/6雄性小鼠(动物许可证号:SYXK2020-005),将小鼠随机分成2组,5只/组。平原常氧组(PSC组),饲养于海拔400 m;高原低氧组(HST组)饲养于海拔4200 m。在饲养过程中保持温度18 ℃~22 ℃,湿度45%~55%,其他条件一致,30 d 后无菌采集小鼠脾脏组织置于液氮冻存备用。本研究已通过青海大学伦理委员会审查(伦理审批号:2020-15)。
1.2 主要试剂
RT-qPCR试剂盒、逆转录试剂盒(Takara);荧光定量PCR 仪(Roche);动物全蛋白提取试剂盒(SangonBiotech);SDS-PAGE 凝胶制备试剂盒(30% 制胶液(29∶1)、1.5 mol/L Tris(PH8.8)、1.0 mol/L Tris(PH6.8)、PAGE胶凝固剂、10%SDS、PAGE胶促凝剂)(Solarbio);快速封闭液(Servicebio);ECL显影液(Thermo Fisher)。
1.3 脾脏指数鉴定
对小鼠空腹称取体质量后,无菌取出小鼠脾脏组织进行称量。计算公式:脾脏指数=脾脏质量(g)/体质量(g)×100%。
1.4 代谢组学分析
非靶向代谢组学采用高分辨质谱检测技术,可以较多地检测到样本中的分子特征峰。结合mzCloud、mzVault和MassList数据库,对其分子特征峰进行匹配和鉴定,尽可能多的鉴定到脾脏中的代谢物,使其反映的总代谢物的信息程度最大。其分析采用metabolon软件,通过比较对照代谢物的保留时间和质谱去鉴定样品成分。同时使用质谱库NIST02和Golm代谢组数据库鉴定样品的代谢化合物(http://csbdb. mpimpgolmmpgde/csbdb/gmd/gmd.html)。
1.4.1 代谢物提取 取100 mg 液氮冻存的脾脏组织样本置于EP管中研磨,向管中加入80%甲醇水溶液500 μL,通过涡旋震荡后冰浴静置5 min,然后4 ℃,15 000 g离心20 min;取其上清加质谱级水稀释甲醇至含量为53%;后4 ℃,15 000 g离心20 min,收集上清通过LC-MS分析。
1.4.2 代谢物KEGG通路富集 京都基因与基因组百科全书(KEGG)是分子水平的数据库资源,其运用高通量数据库来了解细胞、生物体和生态系统的高级功能和效用。采用clusterProfiler(3.4.4)分析计算KEGG通路中显著差异代谢物(SMDs),即Plt;0.05视为显著富集。富集结果以KEGG通路为单位,通过超几何检验找出所有鉴定到的代谢物和差异代谢物中富集的通路。通过通路KEGG富集确定SMDs参与的主要生化代谢和信号转导途径。借助超几何检验方法可以得到通路富集的P值,KEGG通路(P-value≤0.05,|log2FC|≥0)为在差异代谢物中显著富集。
1.5 转录组测序
通过Trizol 法提取小鼠脾脏中总RNA,对总RNA建库,然后将总RNA 中纯化的mRNA 通过Fragmentation Buffer中用二价阳离子随机打断逆转录为cDNA,纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选370~420 bp左右的cDNA,进行PCR 扩增并再次使用AMPure XPbeads纯化PCR产物,最终获得文库。
文库构建完成后,使用Qubit2.0 Fluorometer 进行初步定量,稀释文库至1.5 ng/μL,随后使用Agilent2100 bioanalyzer 对文库的insert size进行检测,当其符合预期后,RTq-PCR对文库有效浓度进行准确定量(文库有效浓度高于2 nmol/L),以保证文库质量。
1.6 转录代谢联合分析
将转录组测序与非靶向代谢组分析得到差异表达基因(DEGs)和SMDs基于皮尔森相关系数进行相关性分析,以度量差异基因与差异代谢物之间的关联程度。将得到的所有DEGs 和SMDs 同时向KEGG通路数据库映射,获得它们的共同的通路信息,确定DEGs 和SMDs共同参与的主要生化和信号转导途径。
1.7 RT-qPCR与Western blotting实验
从脾脏组织提取的RNA逆转为cDNA后,以β-Actin为内参,上样以10 μL反应体系(TB Green® Premix ExTaq™ II 5 μL,RNase Free H2O 3.2 μL,cDNA 1 μL,前后引物各0.4 μL)。采用2-ΔΔCt法分析RT-qPCR检测结果,引物序列详见表1。取小鼠脾脏1/3 组织提取蛋白,调整上样浓度为30 μg/孔,使用蛋白标准品(BCA)试剂盒对提取的蛋白进行浓度测定。随后经SDS-PAGE凝胶电泳(120V 1 h)、转膜(200 mA 50 min)、快速封闭液封闭(10 min)、洗膜、加入一抗4 ℃孵育过夜、加入羊抗兔(1∶10 000)或羊抗鼠(1∶2000)二抗(室温孵育1 h)、洗膜后用ECL化学发光液进行显色,通过凝胶成像系统观察,GraphPad Prism 8.4.0软件分析蛋白相对表达量。
1.8 脂质组学
基于非靶向脂质组学分析平台UPLC-Orbitrap 质谱系统,脂质鉴定与数据预处理结合软件(ThermoScientific),并基于质谱仪(Orbitrap)生成的高分辨率高质量精度数据,通过子离子、母离子和中性丢失扫描的鉴别算法,实现系统地、可靠地脂质定性分析。
1.9 统计学方法
用SPSS 18.0软件和GraphPad Prism 8.4.0软件,通过两个独立样本t检验对数据进行统计学分析,数据以均数±标准差表示,以Plt;0.05表示差异具有统计学意义。
2 结果
2.1 小鼠脾脏指数测定
在高原低氧暴露30 d后,与PSC组相比,HST组小鼠体质量显著减轻(Plt;0.0001),小鼠脾脏质量显著减少(Plt;0.001),脾脏指数降低(Plt;0.05,表2)。
2.2 脂质组学数据分析
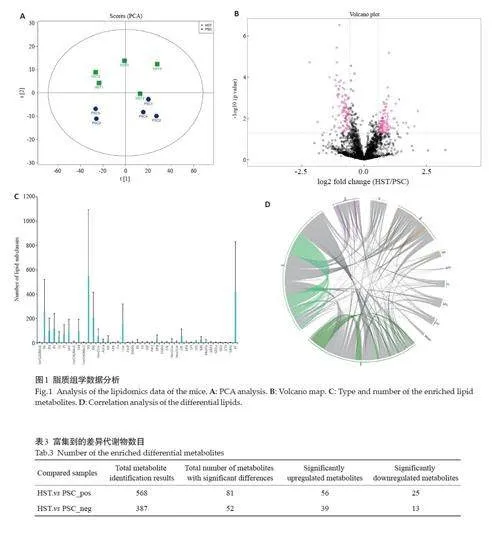
对脂质进行PCA分析(图1A),结果显示组内表达一致,组间差异较大,实验数据稳定可靠。以FCgt;1.5或FClt;0.67,Plt;0.05为阈值筛选差异脂质分子(图1B),结果显示有65个脂质分子表达显著上调,106个脂质分子表达显著下调。对脂质分子进行亚分类(图1C),发现共富集到41 中脂质亚类,其中显著富集到磷脂酰乙醇胺、神经酰胺、磷脂酰甘油、甘油三脂、甘油二脂等脂质亚类。对磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰甘油、聚碳酸酯、磷脂酰肌醇、鞘磷脂、鞘氨醇进行相关性分析(图1D),帮助衡量显著性差异脂质分子之间的相关密切程度,进一步了解生物状态变化过程中脂质分子、亚类之间的相互关系。
2.3 代谢组学数据分析
基于LC-MS 技术共检测到955 种差异代谢物(表3),其中正离子代谢物568 种,负离子代谢物387种,显著上调的代谢物总数95 种,显著下调的代谢物总数38 种(设定阈值为VIPgt;1.0,FCgt;1.5 或FClt;0.667且Plt;0.05)。从小鼠的Z-score(标准分数)可以发现小鼠同一水平面上代谢物的相对含量的高低,发现相比于PSC组,HST组代谢物尿酸,黄嘌呤、前列腺素D2、前列腺素J2等得分高(图2)。
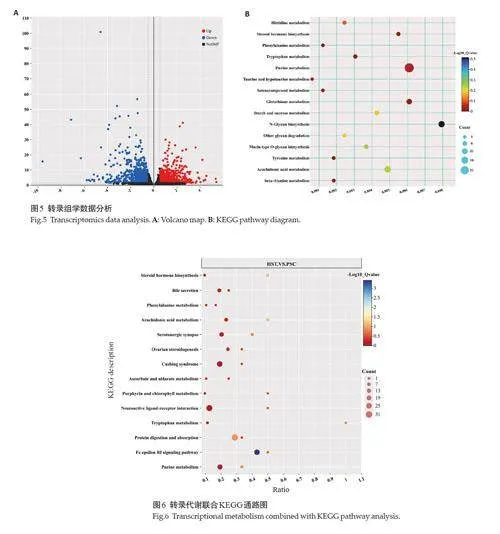
将SMDs映射到KEGG通路二级注释富集分析中,发现主要富集在新陈代谢的脂代谢、氨基酸代谢和核苷酸代谢(图3A)。其前20条显著富集信号通路(图3B),结果显示,SMDs 在嘌呤代谢、类固醇激素的生物合成和花生四烯酸代谢等脂代谢相关信号通路中高度富集,进一步通过脂质分类注释发现差异代谢物主要是固醇脂类、脂肪酸类和甘油磷脂类(图4)。
2.4 转录组测序数据分析
与PSC 组比较,在HST 组中共鉴定出2293 个DEGs(|log2FC|≥0.5 和P-adjustlt;0.05),其中1259 个显著上调,1034个显著下调,分别占DEGs总数的54.91%和45.09%(图5A)。进一步将DEGs进行KEGG富集分析,富集到178 个信号通路(Plt;0.05),显著富集的前15条KEGG信号通路绘制图,结果发现DEGs在脂代谢相关通路类固醇激素的生物合成、花生四烯酸代谢和嘌呤代谢信号通路中富集(图5B)。
2.5 代谢组学和转录组测序联合分析
对DEGs和SMDs进行皮尔森相关性分析,将得到的所有DEGs和SMDs同时向KEGG通路数据库映射,获得它们的共同的通路信息(图6),其显著富集于神经活性配体-受体相互作用、库欣综合征、卵巢类固醇激素生成、花生四烯酸代谢和嘌呤代谢等信号通路。
2.6 类固醇激素的生物合成、花生四烯酸代谢和嘌呤代谢通路分析及验证
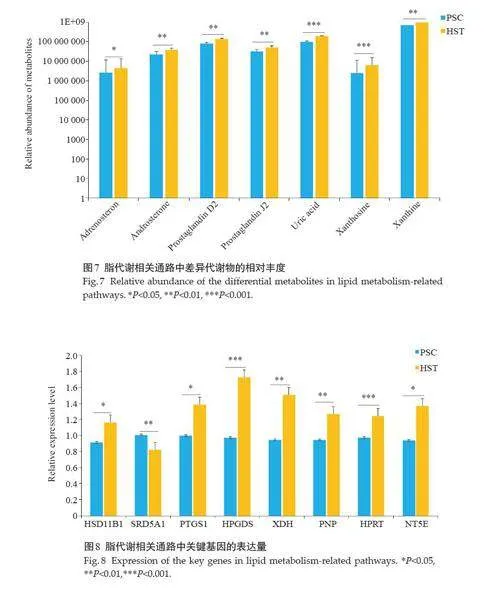
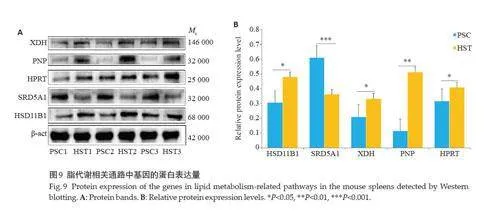
代谢组学结果发现,低氧处理下代谢物肾上腺甾酮、雄甾酮、前列腺素D2、前列腺素J2、黄嘌呤、黄嘌呤碱、尿酸显著上调(Plt;0.05,图7)。随后通过RT-qPCR验证HSD11B1、PTGS1、HPGDS、XDH、PNP、HPRT、NT5E 的mRNA 表达水平,结果提示低氧暴露下HSD11B1、PTGS1、HPGDS、XDH、PNP、HPRT、NT5E的mRNA 表达水平显著上调(Plt;0.05),SRD5A1 的mRNA 表达水平显著下调(Plt;0.05,图8)。通过Western blotting验证HSD11B1、SRD5A1、HPRT、PNP、XDH的蛋白表达水平(图9),结果与基因表达水平一致。
3 讨论
低氧刺激可以致使脂质代谢发生紊乱[7],体质量和脏器指数[8]是评估机体健康状态的重要指标,本研究在小鼠低氧暴露30d后脾脏指数下降,提示HST组小鼠在低氧刺激后,其健康状态受到一定影响。随后通过脂质组学富集到41种差异脂类代谢物,包括磷脂酰乙醇胺、聚碳酸酯、甘油三脂、甘油二脂、磷脂酰丝氨酸和神经酰胺等,提示低氧环境下小鼠脾脏脂代谢发生紊乱。课题组前期研究发现低氧暴露下小鼠脾脏组织中IL-1β、IL-6、IL-12、IL-18、INF-γ和TNF-α等炎性因子的表达水平上调[9],推测低氧暴露可能通过引发脾脏组织炎性反应致使脂代谢发生紊乱,为了明确高原低氧胁迫下小鼠脾脏组织发生脂代谢改变的分子机制,本研究通过代谢组学和转录组学联合KEGG富集分析发现低氧暴露下SMDs和DEGs显著富集于类固醇激素的生物合成、花生四烯酸代谢和嘌呤代谢3 条代谢通路。因此本研究对3 条通路中的差异基因HSD11B1、SRD5A1、PTGS1、HSPGD、XDH、PNP、HPRT、NT5E 进行mRNA表达量检测,对HSD11B1、SRD5A1、HPRT、PNP、XDH进行蛋白表达检测。
类固醇激素的生物合成过程需要各种酶协调表达,在生物的生殖发育、性别分化及维持机体内稳态等方面发挥着重要作用,同时类固醇激素的生物活性在外周组织中受到高度调节。本研究发现,低氧可以通过上调HSD11B1 的mRNA 和蛋白表达水平,同时下调SRD5A1的mRNA和蛋白表达水平从而引起脾脏脂质代谢异常。HSD11B1 存在于人类的多种组织器官中[10, 11],参与与机体的糖皮质激素生成[12]。有研究发现HSD11B1表达上调可以通过炎症因子干扰素γ和肿瘤坏死因子α促进机体糖皮质激素代谢发生改变[13]。提示低氧可能通过上调HSD11B1的表达参与机体炎症反应进而促进脾脏脂代谢发生。SRD5A1基因编码一种通过将睾酮转化为5α-二氢睾酮(DHT)来调节类固醇水平的酶,其催化各种类固醇的产生[14, 15]。据报道,抑制SRD5A1的表达可以通过 PI3K/Akt/mTOR通路促进多发性骨髓瘤细胞凋亡和自噬[16],本研究发现SRD5A1在低氧刺激下表达下调,其与下游代谢物雄激素产生密切相关,二者之间呈负相关,但目前文献中并未给出SRD5A1 与雄激素之间的关系[17]。推测低氧刺激可能通过下调SRD5A1来促使雄激素增多,进而影响脾脏脂代谢。花生四烯酸(AA)是n-6系列的多不饱和脂肪酸,AA在生物体内主要以磷脂的形式存在于细胞上[18]。人体的大多数组织都有AA代谢,它在机体的生理和病理状态中发挥着重要作用。在本研究中,两组学联合分析发现AA参与脾脏的低氧反应,说明AA代谢通路可以发挥一系列的生理作用。研究发现,PTGS1和 HPGDS与炎症代谢产物前列腺素D2 和前列腺素J2 生成密切相关[19, 20],同时PTGS1和HPGDS表达上调可以促进炎症反应的发生[21, 22]。本研究发现低氧刺激下AA代谢通路中PTGS1 和HPGDS 的mRNA含量表达上调,课题组前期对HPGDS进行蛋白含量测定,其表达较PSC组上调[23],提示低氧可能通过上调PTGS1和 HPGDS的表达来促使炎症反应发生,进而引起脾脏脂代谢发生改变。在本项研究中发现,低氧刺激下嘌呤代谢通路的最终产物尿酸表达上调,尿酸是黄嘌呤和次黄嘌呤降解代谢的氧化产物,尿酸增高会影响体内代谢稳定,引起脂代谢异常[24]。因此,本研究对嘌呤代谢通路中的差异基因XDH、PNP、HPRT、NT5E进行检测,发现低氧刺激下表达均上调,由于嘌呤核苷酸参与了多种细胞过程,因此嘌呤代谢与机体病理和生理状态有关[25]。有研究发现,XDH、NT5E、HPRT和PNP作为嘌呤代谢通路中的差异基因,均与尿酸生成成正相关[1, 26, 27]。现代医学认为尿酸-氧化应激-炎症损伤之间密切相关,而高水平尿酸又可导致脂代谢紊乱[28]。本研究发现低氧刺激通过上调XDH、PNP、HPRT、NT5E的表达来使代谢物尿酸表达增多,进而促进脾脏脂代谢的发生。
综上所述,高原低氧刺激致使脾脏组织脂代谢发生紊乱[29],通过代谢组学和转录组学联合KEGG富集分析发现低氧暴露下SMDs 和DEGs 显著富集于类固醇激素的生物合成、花生四烯酸代谢和嘌呤代谢3条代谢通路。对这3 条代谢通路分析发现,相比于PSC组,HST组中差异代谢物肾上腺甾酮、雄甾酮、前列腺素D2、前列腺素J2、黄嘌呤、黄嘌呤碱、尿酸的表达量显著上调,且代谢物上游基因HSD11B1、PTGS1、HPGDS、XDH、PNP、HPRT、NT5E 的mRNA 表达量显著上调,HSD11B1、HPRT、PNP、XDH蛋白表达上调,SRD5A1的mRNA和蛋白表达水平下调。因此,高原低氧主要通过影响这3 条代谢通路基因表达来致使脾脏脂代谢发生紊乱,这将为进一步探索高原低氧环境对脾脏组织损伤疗法提供新的研究思路。
参考文献:
[1] Griffith JA, King RD, Dunn AC, et al. Maternal nano-titanium
dioxide inhalation exposure alters placental cyclooxygenase and
oxidant balance in a sexually dimorphic manner[J]. Adv Redox Res,
2024, 10: 100090.
[2] Hillman TC, Idnani R, Wilson CG. An inexpensive open-source
chamber for controlled hypoxia/hyperoxia exposure[J]. Front
Physiol, 2022, 13: 891005.
[3] Ning C, Xiao WG, Liang Z, et al. Melatonin alleviates T-2 toxininduced
oxidative damage, inflammatory response, and apoptosis in
piglet spleen and thymus[J]. Int Immunopharmacol, 2024, 129:
111653.
[4] Bronte V, Pittet MJ. The spleen in local and systemic regulation of
immunity[J]. Immunity, 2023, 56(5): 1152.
[5] Yang WP, Li JY, Hu JN, et al. Hypobaric hypoxia induces iron
mobilization from liver and spleen and increases serum iron via
activation of ghrelin/GHSR1a/MAPK signalling pathway in mice
[J]. Sci Rep, 2023, 13(1): 20254.
[6] 郑 琴, 罗 俊, 章德林, 等. 基于糖代谢、脂代谢和能量代谢探讨脾脏
与阿尔茨海默病的关系[J]. 中国实验方剂学杂志, 2020, 26(5):
178-85.
[7] Naryzhnaya NV, Derkachev IA, Kurbatov BK, et al. Decrease in
infarct-limiting effect of chronic normobaric hypoxia in rats with
induced metabolic syndrome is associated with disturbances of
carbohydrate and lipid metabolism[J]. Bull Exp Biol Med, 2023,
174(6): 723-7.
[8] Fu Q, Han Y, Li B, et al. Organ index of immunological and antitumor
effect of intratumor injection of penicillin sodium combined
with chemotherapy drug for tumor-bearing mice[J]. J Clin Oncol,
2020, 38(15_suppl): e16134.
[9] 王嘉阳, 胡 英, 许玉珍, 等.高原低氧抑制PPAR通路诱导小鼠脾脏
铁死亡发生[J].中国免疫学杂志,2024,[Epub ahead of print].
[10]Baker ME. Evolutionary analysis of 11beta-hydroxysteroid
dehydrogenase-type 1, -type 2, -type 3 and 17beta-hydroxysteroid
dehydrogenase-type 2 in fish[J]. FEBS Lett, 2004, 574(1/2/3):
167-70.
[11] Poinot H, Dupuychaffray E, Arnoux G, et al. Activation of
endogenous glucocorticoids by HSD11B1 inhibits the antitumor
immune response in renal cancer[J]. Oncoimmunology, 2024, 13
(1): 2286820.
[12] Johannsen ML, Poulsen LC, Mamsen LS, et al. The intrafollicular
concentrations of biologically active cortisol in women rise abruptly
shortly before ovulation and follicular rupture[J]. Hum Reprod,
2024, 39(3): 578-85.
[13]Huang PQ, Li YH, Xu CC, et al. HSD11B1 is upregulated
synergistically by IFNγ and TNFα and mediates TSG-6 expression
in human UC-MSCs[J]. Cell Death Discov, 2020, 6: 24.
[14]Bar-Sadeh B, Pnueli L, Keestra S, et al. Srd5a1 is differentially
regulated and methylated during prepubertal development in the
ovary and hypothalamus[J]. J Endocr Soc, 2023, 7(10): bvad108.
[15]Shaw IW, Kirkwood PM, Rebourcet D, et al. A role for steroid 5
alpha-reductase 1 in vascular remodeling during endometrial
decidualization[J]. Front Endocrinol, 2022, 13: 1027164.
[16]Dou RJ, Qian JJ, Wu W, et al. Suppression of steroid 5α-reductase
type I promotes cellular apoptosis and autophagy via PI3K/Akt/
mTOR pathway in multiple myeloma[J]. Cell Death Dis, 2021, 12
(2): 206.
[17]Tanaka S, Miki Y, Hashimoto C, et al. The role of 5α-reductase type
1 associated with intratumoral dihydrotestosterone concentrations in
human endometrial carcinoma[J]. Mol Cell Endocrinol, 2015, 401:
56-64.
[18]袁成凌, 姚建铭, 余增亮. 花生四烯酸及其代谢物的生物学作用[J].
中国药物化学杂志, 2000, 10(1): 75-8.
[19]Vinothkumar K, Chanda S, Singh VK, et al. EVI1 upregulates
PTGS1 (COX1) and decreases the action of tyrosine kinase
inhibitors (TKIs) in chronic myeloid leukemia cells[J]. Int J
Hematol, 2023, 117(1): 110-20.
[20]Ouyang L, Qiu DJ, Fu X, et al. Overexpressing HPGDS in adiposederived
mesenchymal stem cells reduces inflammatory state and
improves wound healing in type 2 diabetic mice[J]. Stem Cell Res
Ther, 2022, 13(1): 395.
[21]Plaza-Díaz J, Robles-Sánchez C, Abadía-Molina F, et al. Adamdec1,
Ednrb and Ptgs1/Cox1, inflammation genes upregulated in the
intestinal mucosa of obese rats, are downregulated by three probiotic
strains[J]. Sci Rep, 2017, 7(1): 1939.
[22]Kern K, Pierre S, Schreiber Y, et al. CD200 selectively upregulates
prostaglandin E2 and D2 synthesis in LPS-treated bone marrowderived
macrophages[J]. Prostaglandins Other Lipid Mediat, 2017,
133: 53-9.
[23]Guo YJ, Yong S, Xu YZ, et al. Integrative analysis of proteomics and
metabolism reveals the potential roles of arachidonic acid
metabolism in hypoxia response in mouse spleen[J]. Molecules,
2022, 27(22): 8102.
[24]王平平. 妊娠期血尿酸水平变化与妊娠期女性母体代谢的关系分析
[J]. 检验医学与临床, 2021, 18(13): 1943-5.
[25]王文强, 李忠信, 孙 萌, 等. 黄嘌呤代谢在肿瘤发展治疗中的研究进
展[J]. 按摩与康复医学, 2021, 12(18): 95-6, 封3.
[26] Justyna S, Ewa R, Arkadiusz C, et al. The ATP-dependent pathways
and human diseases[J]. Cur Med Chem, 2022, 30(11): 1232-55.
[27]Du XH, Moore J, Blank BR, et al. Orally bioavailable smallmolecule
CD73 inhibitor (OP-5244) reverses immunosuppression
through blockade of adenosine production[J]. J Med Chem, 2020,
63(18): 10433-59.
[28]王骆冰, 吴 锋, 詹恬恬, 等. 复方降尿酸方联合碳酸氢钠片治疗痛风
性肾病临床疗效及对脂代谢、肾功能的影响分析[J]. 四川中医,
2024,42(3): 136-40.
[29] Jiang X, Stockwell BR, Conrad M. Ferroptosis: mechanisms,
biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22(4):
266-82.
(编辑:经 媛)

