基于UPLC—Q—TOF—MS技术的牛血清白蛋白诱导过敏反应的代谢组学研究
顾媛媛+张丹丹+冯程+王宇+陈大忠+王艳宏


[摘要]运用代谢组学技术,研究牛血清白蛋白诱导过敏反应大鼠与正常生理状态大鼠尿液中内源性物质代谢的变化,筛选出与过敏反应相关的潜在生物标志物,进而分析其代谢通路,探讨过敏反应的代谢机制。采用牛血清白蛋白诱导大鼠发生过敏反应为模型,检测大鼠血清中组胺和类胰蛋白酶的含量,对大鼠肺和气管的组织形态学进行观察,通过UPLC-Q-TOF-MS技术对过敏反应模型组和空白对照组大鼠尿液进行代谢组学分析,采用主成分分析(PCA)和偏最小二乘辨别分析
(PLS-DA)的方法,观察2组大鼠尿液的代谢轮廓差异,筛选出差异代谢物。模型组和对照组的代谢谱图存在明显差异,并筛选出与过敏反应相关的14个差异代谢物,4条主要代谢通路。该文建立了基于UPLC-Q-TOF-MS技术进行牛血清白蛋白诱导过敏反应的大鼠尿液代谢组学研究方法,推测牛血清白蛋白诱导过敏反应的作用机制可能涉及异黄酮、叶酸的生物合成,色氨酸代谢、烟酸和烟酰胺代谢等过程,为进一步探索代谢组学在药物过敏反应研究中的应用奠定了基础。
[关键词]牛血清白蛋白; 生物标志物; 代谢组学; 过敏反应
[Abstract]The metabonomic techniques were used to study the changes in endogenous metabolites between urines of rats in normal physiological conditions and bovine serum albumin induced allergic reactions, identify potential biomarkers associated with allergic reactions, and then analyze the metabolic pathways and the metabolic mechanisms of allergic reactions. The bovine serum albumin-induced allergic reactions in rats were adopted as a model to detect histamine and tryptase in rat serum and observe the issue morphology of lungs and trachea in rats. UPLC-Q-TOF-MS was applied in metabonomic analysis on urines between control group and allergic reaction model group. Principal component analysis(PCA) and partial least squares discriminant analysis(PLS-DA) were applied to observe the differences in metabolic profiling between urines of the two groups and select differential metabolites. There were significant differences in metabolism spectrum between the model group and the control group. Totally 14 differential metabolites and 4 major metabolic pathways were screened out. The metabonomic research method for urines of rats with bovine serum albumin-induced allergic reactions based on UPLC-Q-TOF-MS was established in this study. It was speculated that the mechanism of bovine serum albumin-induced allergic reactions may involve biosynthesis of isoflavone and folic acid and metabolism of tryptophan, nicotinic acid and nicotinamide. It lays a foundation for further exploration of the application of metabolomics in drug allergy reaction studies.
[Key words]bovine serum albumin; biomarker; metabolomics; allergic reaction
doi:10.4268/cjcmm20162123
過敏反应又称变态反应,是指机体受同一抗原再次刺激后产生的一种异常或病理性免疫反应,主要表现为生理功能紊乱和组织损伤。过敏反应是临床常见的不良反应,大多数药物都有可能引起过敏反应,严重影响人类的健康,其危害不容忽视。随着新药涌现、药物的不合理应用等原因,药物过敏反应发生率一直居高不下。尤其是中药注射剂在临床的广泛应用,其不良反应(ADR)报道也逐年增加,尤以过敏反应事件较多。然而过敏反应机制并未完全明确[1-3]。
代谢组学是一种后基因时代的全新组学技术,以生物体内低相对分子质量物质的动态规律变化。是从整体观出发,以机体代谢组学变化为载体,以时空动态性和全局性观点,全面解析疾病对机体的影响[4-6]。
本试验应用代谢组学技术,以牛血清白蛋白诱导大鼠产生过敏反应动物模型为研究对象,分析过敏反应引起的机体代谢状态和内源性小分子代谢物的变化,通过比较这些代谢物的变化情况,寻找与过敏反应密切相关的生物标记物和代谢通路,进而探讨过敏反应的代谢机制,为中药注射剂的临床安全应用奠定基础。
1 材料与方法
1.1 仪器与试剂 美国Waters AcquityTM UPLC液相色谱仪(包括四元梯度泵,在线真空脱气机,自动进样器,二极管阵列检测器,柱温箱);美国Micromass Q-TOF microTM四极杆-飞行时间质谱(电喷雾离子源-正、负离子扫描方法-Lockspray);色谱柱为ACQUITY UPLCTM BEH C18色谱柱(2.1 mm×50 mm,1.7 μm,Waters Corp,Milford USA);KDC-160 HR高速冷冻离心机(科大创新股份有限公司中佳分公司);酶标仪(赛默飞世尔中国上海仪器有限公司);超低温冰箱(Thermo);KQ5200 E超声波清洗器(昆山市超声仪器有限公司);JA 2003精密电子天平(上海良平仪器厂)。
牛血清白蛋白BSA(美国,Sigma公司);0.9%氯化纳注射液(中国浙江都邦药业股份有限公司);大鼠血清组胺检测试剂盒(中国上海蓝基生物科技有限公司);胰蛋白(中国北京索莱宝科技有限公司);色谱级乙腈(美国Fisher公司),屈臣氏蒸馏水(中国广州屈臣氏食品有限公司),色谱级甲酸(中国天津科密欧化学试剂有限公司),亮氨酸-脑啡肽(美国Sigma公司)。
1.2 动物分组与造模 健康SD雄性大鼠(SPF级),体重(200±20) g,由黑龙江中医药大学药物安全性评价中心提供,动物使用编号SYXK(黑)2013-012。给予标准饲料和饮用水,且控制室内温度为(22±1) ℃、相对湿度40%~50%。12 h蔽光,12 h光照,自由饮水饮食,每只大鼠单独代谢笼正常饲养适应1周后开始试验。
16只大鼠随机分为空白对照组和模型组,大鼠腹腔注射致敏,隔日1次,连续注射3次。于首次致敏后第14天和第21天对大鼠进行尾静脉注射激发给药,对照组给予同样体积的0.9%氯化钠注射液,即刻至30 min观察大鼠出现的体征表现。每组给药情况为空白对照组:致敏给予生理盐水1.0 mL/只,激发给予生理盐水2.0 mL/只;模型组:致敏给予0.6%的BSA,1.0 mL/只,激发给予2.4%的BSA,2.0 mL/只[7-8]。
1.3 生化指标检测 按大鼠Histamine ELISA检测试剂盒说明书进行操作,检测大鼠血清组胺含量。采用专属性底物法检测类胰蛋白酶。
1.4 组织病理学检查 于最后一次收集完尿液,将大鼠麻醉,取固定部位肺和气管组织,置于4%多聚甲醛液中固定,常规脱水透明、浸蜡、包埋、切片、HE染色、脱水、透明、封片,普通光学显微镜下观察病理组织学改变。
1.5 样本的预处理与UPLC-Q-TOF-MS分析条件[9-11] 于每次给药第2天7:00—8:00收集每只大鼠12 h内的尿样,13 000 r·min-1(4 ℃)离心15 min,过0.22 μm微孔滤膜后进樣检测。第14天和第21天给药激发后30 min于眼静脉丛采血,室温放置30 min,3 000 r·min-1离心15 min,分离血清,置于-80 ℃冰箱中保存备用。
色谱条件:ACQUITY UPLCTM BEH C18色谱柱(2.1 mm×50 mm,1.7 μm,Waters Corp,Milford USA);流动相A为乙腈,B为0.1%甲酸水,梯度洗脱,0~8 min,2%~40% A,8~10 min,40%~98% A,10~13 min,98%~100% A;柱温40 ℃;流速0.3 mL·min-1。
质谱条件:美国Micromass Q-TOF microTM四极杆-飞行时间质谱系统,电喷雾电离源(ESI),采用正负离子扫描检测;脱溶剂温度为350 ℃,锥孔流速为20 L·h-1;毛细管电压正离子扫描为 1 300 V,负离子扫描为 1 500 V;样品锥孔电压60 V;提取锥孔电压5.0 V;离子源温度为110 ℃;碰撞能30 V;碰撞气为氩气;准确质量校正采用亮氨酸-脑啡肽溶液(556.277 1[M+H]+,554.261 5[M-H]-),扫描范围m/z 100~1 500。
1.6 数据处理 目前,代谢组学海量数据处理是通过现代化学信息学和生物统计学领域的新方法对获得的多维复杂数据进行降维和信息挖掘[12]。将空白对照组和模型组大鼠尿液代谢轮廓数据导入Markerlynx软件进行色谱峰识别以及峰匹配,并采用PCA对获得的多维复杂数据进行降维处理,同时采用偏最小二乘-判别分析(PLS-DA)方法对获得的复杂数据进行统计分析。对差异性代谢物进行二级质谱分析,解析生物标志物及相关的代谢通路。
2 结果
2.1 宏观体征 在3次致敏过程中模型组大鼠与空白对照组的一般情况无明显差异,尾静脉激发给药后,模型组大鼠均出现了明显的精神萎糜、活动减少、哮喘、痉挛等过敏反应症状,但无动物死亡;而空白对照组大鼠无明显的过敏反应症状。
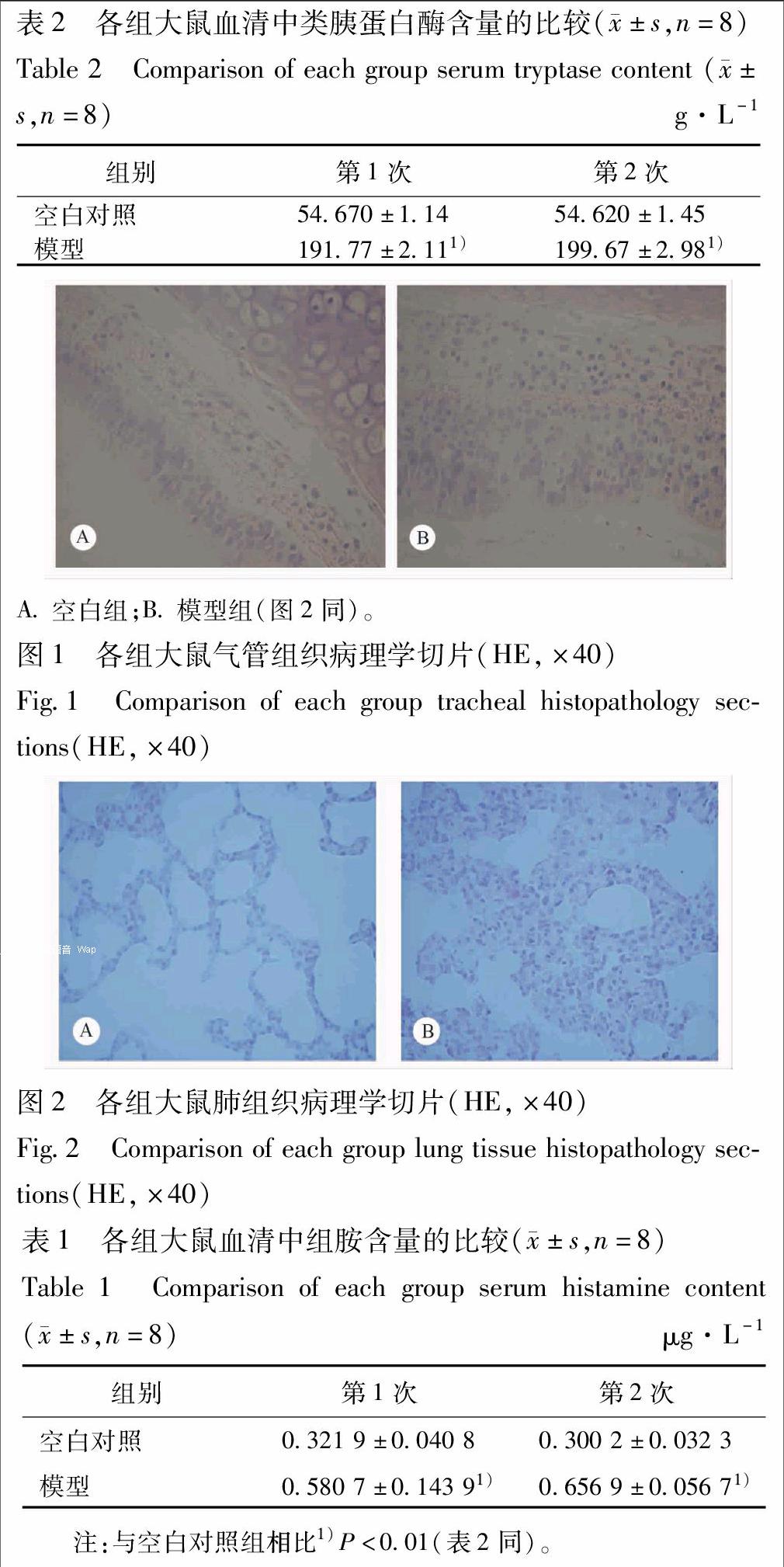
2.2 生化指标和病理切片 与空白对照组进行比较,模型组大鼠组胺和类胰蛋白酶含量增加,且均具有显著性差异(P<0.01),具体见表1,2。
细胞层完整,固有层可见胶原纤维和弹性纤维,可见血管、淋巴管以及淋巴组织。软骨环完整。模型组气管黏膜层和黏膜下层增厚,大部分假复层纤毛上皮细胞和固有层消失,细胞嗜碱性增强,见图1。
空白对照组肺组织结构完好;模型组肺动脉血管见有扩张淤血,大部分肺泡组织不张,肺泡隔增厚,有散在的炎细胞,见图2。
2.3 大鼠尿液UPLC-TOF-MS代谢轮廓和整体表征 2组大鼠第2次激发给药后12 h尿液代谢产物利用ESI正离子模式分别采集对照组和模型组大鼠尿液样本数据,得到尿液样本的BPI图。在优化的分析条件下,正负离子扫描模式13 min的有效洗脱时间内获得较好的分离和响应效果,结果见图3,4。
2.4 数据分析 对尾静脉第2次激发后12 h大鼠尿液进行检测分析,用Markerlyns XS软件进行数据降维和质谱矩阵信息的获取,进行Pareto模式的PCA,采用OPLS-DA对2组尿液代谢物组进行分析,得到反应组间变化的Scores plot,见图5,6。在正、负离子扫描模式下,2组聚类分组明显,代谢物表型差异显著,表明模型组内源性代谢物的含量发生了很大变化,说明给予牛血清白蛋白后大鼠正常生理代谢紊乱,从代谢物组变化的角度可证明牛血清白蛋白诱导过敏反应模型造模成功。
2.5 表征过敏反应标志物的筛选及结构鉴定 对空白组和模型组大鼠尿液进行OPLS-DA分析,对VIP>2的差异变量进行色谱峰提取并积分,进行非参数t检验,筛选P<0.05的数据变量得到有意义的生物标志物,对其进行结构解析,确定内源性生物标记物。采用MS/MS测定标记物的精确信息,得到测定误差范围内相应的可能的化学物分子式;通过分子式及相对分子质量在HMDB及KEGG等检索数据库进行检索,结合MS/MS选出可能的1种或几种化合物,最终通过色谱保留行为以及MS/MS数据来确定标记物的化学结构,在正离子检测模式下,初步鉴定了8个生物标记物的结构,在负离子检测模式下,初步鉴定了6个生物标记物的结构,具体见表3,4,分别为mahanimbinine,15-oxo-lipoxin A4,3-methyldioxyindole, isopentenyladenine-9-N-glucoside serinyl-valine, 7, 8-dihydroneopterin, 1-methylguanosine, norcotinine, 2′-hydroxydaidzein, 4, 6-dihydroxyquinoline,N-nitrosothialdine, alanyl-hydroxyproline, pterin, nicotinamide riboside。将鉴定出的标志物输入MPetA数据库中,构建分析代谢通路,见表3,4。
3 讨论
经前期试验摸索,从宏观体征、生化指标和肺、气管的病理指标判断,过敏反应动物模型造模成功,本研究进一步运用代谢组学方法结合UPLC-MS分析技术,研究过敏反应大鼠尿液中小分子内源性代谢物的变化规律,并筛选出贡献大的且有差异的特征性标志物,初步判定14个生物标记物[13],在对这些标记物的研究发现15-oxo-lipoxin A4是脂氧素衍生物。脂氧素(LXS)和阿司匹林触发脂氧素(ATL)是由花生四烯酸产生的促炎脂质衍生的介质,在结构、形式和功能上区别于许多其他促炎脂质衍生的介质[14]。脂氧素A4(LXA4)引发细胞反应,并通过激活特异受体ALX调节白细胞在体内的运输,通過花生四烯酸(AA2)衍生的类二十烷酸,包括前列腺素(PG)和白三烯(LTs),对发挥局部免疫过敏和炎症反应具有重要作用。在本次试验中发现模型组5-氧代脂氧素A4有增加趋势,表明大鼠体内5-氧代脂氧素A4代谢发生紊乱,推测大鼠可能产生免疫应激反应,在过敏反应发生的同时,也伴随着炎症的产生。
7,8-dihydroneopterin是通过用γ干扰素在刺激人单核细胞衍生的巨噬细胞产生,曾在病毒感染和自身免疫性疾病人体体液中发现。该试验模型组大鼠尿液中7,8-dihydroneopterin有上调趋势,推测大鼠可能产生免疫应激反应。
3-methyldioxyindole是乙醛脱氢酶的一个代谢物,在代谢中形成,是主要的尿代谢物。有学者认为,3-甲基吲哚的体内氧化产物是色氨酸的代谢产物,通过在结肠中的细菌产生的[15]。
4,6-dihydroxyquinoline是在单胺氧化酶的作用下转化而来,是5-羟色氨酸的代谢通路转化而来,5-羟色氨酸是5-羟色胺的前体物质,查阅文献[13]发现5-羟色胺能促进下丘脑释放神经递质的作用,故说明下丘脑神经递质的分泌被抑制。
pterin涉及到叶酸的生物合成通路,在此通路中pterin因主要合成叶酸而呈下调趋势。叶酸的抗氧化应激作用引起活性氧化基因(自由基、过氧化物等)的产生和抗氧化防御之间的失衡。最近有报道发现,过敏性反应和氧化应激分子存在十分重要的关系。过敏性反应时,肥大细胞激活后,刺激免疫系统(immune system),可以激活肥大细胞的活性氧(ROS),体内产生的有害物质,并通常作为氧化剂。
综上所述,本试验通过对特征性生物标志物进行分析,发现并鉴定了14个潜在生物标志物,并且呈现一定的上调或下调趋势,这些生物标志物主要与异黄酮、叶酸的生物合成,色氨酸、烟酸和烟酰胺的代谢等通路相关。通过对所述标志物的代谢轨迹变化,探讨过敏反应的产生、发展过程,进而从机体代谢通路异常来初步了解牛血清白蛋白诱导过敏反应的代谢机制。下一步笔者将对其他生物标志物与过敏反应的具体联系进行深入研究,为避免药物的过敏反应提供理论支持。
[参考文献]
[1]Rajan T V. The gell-coombs classification of hypersensitivity reactions a re-interpretation[J]. Trends Immunol, 2003, 24(7): 376.
[2]Simons F E,Ardusso L R,Bilò M B,et al.World allergy organization guidelines for the assessment andmanagement of anaphylaxis[J]. Ann Allergy Asthma Immunol, 2011, 4(2):13.
[3]Uetreeht J.Role of animal models in the study of drug-indueed hypersensitivity reactions[J]. AAPS J, 2006, 7(4): 914.
[4]Nicholson J K, Lindon J C, Holmes E. "Metabonomics": understanding the metabolic responses of living systems topathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J]. Xenobiotica, 1999, 29(11): 1181.
[5]Kristin E P,Craig E L,Cynthia K L. Development of tissue-targeted metabonomics: part 1. Analytical considerations[J]. J Pharm Biomed Anal, 2008, 46(4): 737.
[6]Fiehn O. Combining genomics, metabolome analysis, and biochemical modeling to understand metabolic networks[J]. Comp Funct Genom, 2001, 2(3): 155.
[7]吴公平,王蓉蓉,田洪,等.过敏反应动物模型的代谢组学研究[J]. 中国现代医学杂志,2011, 21(23): 2847.
[8]徐国良,张卓辉,张增珠,等.双黄连注射剂过敏症动物模型的研究[J]. 中国临床药理学与治疗学, 2008, 13(2):154.
[9]刘双梅,李桂林,汤晓丽,等.甲基莲心碱对2 型糖尿病模型大鼠作用的代谢组学研究[J].中国药理学通报, 2012, 28 (4): 490.
[10]袁琳,白永生,周明眉,等.2型糖尿病大鼠的尿液代谢组学改变[J].中国实验动物学报,2011,19(2): 111.
[11]王蓉蓉,刘晓娟,蒋秋桃,等.基于超高效液相色谱-四极杆飞行时间串联质谱的急性过敏反应代谢组学研究[J].药物分析杂志,2013, 33(7): 1127.
[12]卢芳,杨晓丹,井月娥,等.基于代谢组学的刺五加多糖对大鼠心脏内源性物质代谢的影响[J].中藥材,2011, 21(23):2847.
[13]张爱华,孙晖,周小航,等.基于方证代谢组学的金匾肾气丸治疗肾阳虚证的研究[C]. 成都:第十一届全国博士生学术年会,2013.
[14]胡珊,毛应启梁,王彦青. 脂氧素在炎症中作用的研究进展[J].国际药学研究杂志, 2011, 38
(2):109.
[15]Dong H, Yan G L, Han Y. UPLC-Q-TOF/MS-based metabolomic studies on the toxicity mechanisms of traditional Chinese medicine Chuanwu and the detoxification mechanisms of Gancao, Baishao, and Ganjiang[J]. Chin J Nat Med, 2015, 13(9): 687.
[16]孙玄.大鼠尿液中蝶呤类化合物及氨基酸分析新方法的研究[D].南昌:南昌大学,2015.
[责任编辑 曹阳阳]