光对植物黄酮类化合物的影响研究进展
潘俊倩+佟曦然+郭宝林
[摘要]黄酮类化合物是植物中普遍存在的一类次生代谢产物,对植物自身起着非常重要的作用,光保护和抗氧化是主要作用,因此光照对黄酮类化合物的生物合成的影响十分显著。该研究从光强和光质2个方面综述了近年来光照对植物中黄酮类化合物含量的影响,以及简要概述了光作用于黄酮代谢上游关键酶苯丙氨酸解氨酶(PAL)和查尔酮合酶(CHS)的特点。
[关键词]黄酮类化合物; 光强; 光质; 苯丙氨酸解氨酶; 查尔酮合酶
[Abstract]As an important secondary metabolites of medicinal plant, flavonoids plays a very important role on itself including light protection and antioxidant. Light is one of the important environmental factors which impacts the secondary metabolites of plant and has a significant impact on biological synthesis of flavonoids. This paper reviews the recent progress of the effects of light on flavonoids on the plants focusing from light intensity and light quality, and summarizes briefly functions of the phenylalanine ammonia lyase (PAL) in plant secondary metabolism and the upstream key enzyme chalcone synthase (CHS) in flavonoid biosynthetic pathway.
[Key words]flavonoids; light intensity; light quality; PAL; CHS
doi:10.4268/cjcmm20162103
光是植物生命活动中最重要的环境因子之一,它不但是植物生长发育的能量来源,而且作为信号因子调控植物的生长发育。光同样对大多数植物次生代谢产物的合成产生影响。黄酮类化合物(flavonoids)是广泛存在植物中的一类重要的次生代谢产物,本文从光强和光质2个方面综述了近年来光对植物黄酮类化合物的影响,并对光照下黄酮类化合物合成途径的分子机制进行简要概述。
1 黄酮类化合物及其生物合成途径
黄酮类化合物(flavonoids)指2个具有酚羟基的苯环(A环和B环)通过一个三碳链相互连结而成的一系列化合物。可分为下列几类:黄酮(flavone)、黄酮醇(flavonol)、黄烷酮(二氢黄酮,flavanone,dihydroflavone)、黄烷酮醇(二氢黄酮醇,flavanonol,dihydroflavonol)、异黄酮(isoflavone)、异黄烷酮(二氢异黄酮,isoflavanone)、查尔酮(chalcone)、橙桐(aurone)、黄烷(flavan)、黄烷醇(flavanol)、黄烷-3,4-二醇(flavan-3,4-diol)、花青素(anthocyanidin)等。黄酮类化合物在植物生長发育过程中行使着十分重要的生理功能,如花青素主要呈现花、果实和叶片的颜色。黄酮醇类可以促进花粉萌发和花粉管生长,异黄酮类可以有效地限制外源微生物的生长,在生物间相互作用中担任重要角色等[1-2]。它们共同具有抵御紫外线、抗菌、拒食、引诱昆虫、抗氧化等方面的功能。其中抵御紫外线和抗氧化功能是与光照直接相关的。
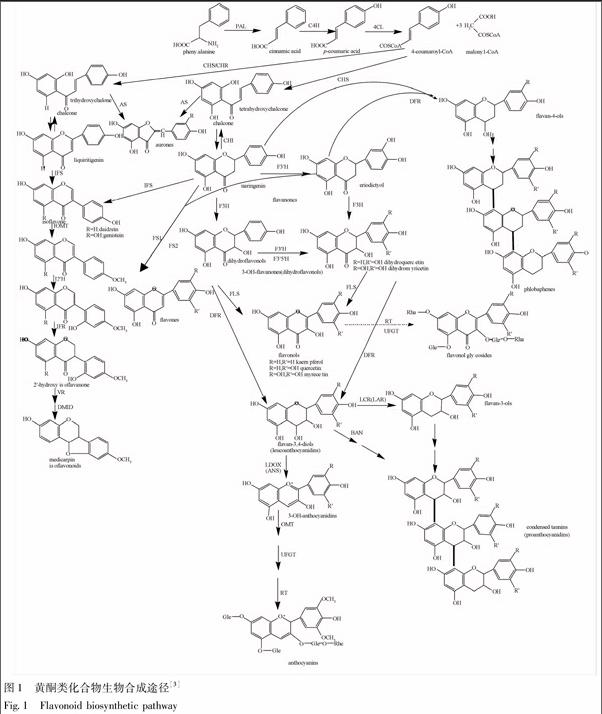
黄酮类化合物的生物合成途径在植物次生代谢中研究得较为透彻,其代谢途径见图1。
黄酮类在植物细胞中的合成主要是在细胞质中合成、在不同的膜系统间进行转运,有囊泡介导和膜转运蛋白介导2个转运假说,最后贮存在液泡中[4]。在各种细胞、组织和器官均发现黄酮类化合物的分布,集中分布的部位可能是合成部位、功效部位,也可能只是贮存部位,但细胞、组织、器官间的转运尚没有报道[5]。
2 光强对黄酮类化合物的影响
光对植物花青素合成的作用和调控已有学者进行过归纳总结[6]。本文着重于总结近年来植物中其他黄酮类化合物随光强的变化。光强实验研究多采用荧光灯或遮阴网等方式设置不同的光强梯度。
Koyama等[7]研究了赤霞珠葡萄Vitis vinifera幼果发育不同时期光照处理对黄酮类化合物合成的影响。对照组幼果完全暴露在日光下,第2组为从开花期开始用避光盒一直遮阴到处理结束,第3组为从开花期开始用避光盒遮阴14 d,随后一直处于日光暴露下直到处理结束。处理17 d的结果是:对照组黄酮醇的含量分别是第2组和第3组的6.7,2倍; 处理49 d的结果是,对照组黄酮醇的含量分别是第2组和第3组的6,1.7倍。Ferreres等[8]研究光强对长春花Catharanthus roseus中黄酮类化合物的影响,结果表明:高光强下槲皮素-3-O-(2,6-二-O-鼠李糖基)半乳糖苷、山柰酚-3-O-(2,6-二-O-鼠李糖基)半乳糖苷、山柰酚-3-O-(2,6-二-O-鼠李糖基)半乳糖基-7-O-六碳糖苷含量分别比低光强升高了90.7%,98.9%,60.9%。Tattini等[9]使得女贞Ligustrum vulgare一年生植株在6月第3周生长在100%,35%,6%自然光照下(存在紫外线),研究表明随光照强度的增强叶肉细胞中槲皮素和木犀草素衍生物的积累增多,处理2个月后100%光照下,女贞叶中,槲皮素3-O-芸香糖苷的浓度分别是35%,6%光强下的1.5,23倍,木犀草素7-O-葡萄糖苷分别是1.2,14倍。Agati 等[10]研究发现女贞一年生植株在紫外线不存在时(用铝箔纸去除),处理6周后,100%光照下,女贞叶中槲皮素3-O-葡萄糖苷和木犀草素7-O-葡萄糖苷的浓度分别是30%光照下的7倍和4倍。Deng 等[11]以青钱柳Cyclocarya paliurus 20 d龄实生苗为材料,采用光强度分别为100%,50%,15%的太阳辐照处理3个月,结果表明,100%光照下,山柰酚的含量分别为50%,15%光强下的4.3,6.2倍,槲皮素的含量分别是3.5,4.6倍,异槲皮苷的含量分别是3.6,8.4倍,可以看出各黄酮化合物的含量随着光照强度的增强而升高。上述研究表明,这些植物体内黄酮类化合物的含量随着光照强度的增强,其含量也会逐渐升高。在上述所有研究中,涉及多个化合物时,它们对光强的响应是一致的,但是梁琼等[12]用遮阴方法研究光强对阴生植物箭叶淫羊藿Epimedium sagittatum中几种黄酮类成分的影响,虽然发现这几种具有相同母核结构的化合物对光照的强度处理的响应有所不同,但是其4种化合物总含量在高光强下较高。高光强为200~650 μmol·m-2·s-1,低光强为60~160 μmol·m-2·s-1。不同光环境种植4年后发现朝藿定A和B(epimedin A,B)的含量高光强同低光强相比高出215.7%,269.2%,而淫羊藿苷(icariin)和朝藿定C(epimedin C)却比低光强下低16.2%,78.6%。高光强下这4种化合物总含量比低光强下增加了22.2%。同样,在Neugart等[13]对温室中强光400 μmol·m-2·s-1和弱光100 μmol·m-2·s-1下甘蓝Brassica oleraceavar.sabellica叶中黄酮类化合物的变化,得到了类似的研究结果,发现处理12周后,强光处理下,虽然槲皮素葡萄糖苷类化合物增加,山柰酚葡萄糖苷类化合物含量降低,但是强光下总黄酮的含量比弱光下高出了23.9%。
可是在关于银杏的研究中,得到的结论有所不同。朱灿灿等[14]发现在生长初期,遮阴有利于银杏叶中黄酮的积累,而在快速生长期和生长末期,全光照反而有利于其积累。以二年生银杏苗为材料,从当年4月份进行不同的光处理,第1组是自然光照,第2,3,4组处理的光照强度分别为全光照的80%,60%,40%,分别在当年5,6,7,8,9,10月份采集叶片测定其中黄酮类化合物槲皮素、山柰酚以及异鼠李素含量,发现槲皮素和山柰酚结果一致,表现为在5月份时,随着光强的减弱,含量先下降后上升,第2,3组低于第1组,而第4组高于第1组。6月份之后,则表现出第1组含量均大于其他遮阴组。而异鼠李素,在5—8月,第1组含量均大于其他遮阴组,而在9—10月,不同光照之间没有差异。总黄酮醇苷在5月份第4组含量高于第1组,在6—10月,1组含量均大于其他遮阴组。何丙辉等[15]发现遮阴有利于银杏叶中黄酮的积累。他将银杏Ginkgo biloba四年生苗分成3组,进行不同的光照处理2个月,第1组是自然光照,第2,3组处理的光照强度分别为全光照的71%,51.5%。结果第3组槲皮素、芦丁含量分别是第1组的4.14,3.06倍。第2组槲皮素、芦丁含量分别是1组的1.14,1.41倍。关于银杏的2种不同的结果,可能跟植株年龄以及生长期有关。
总之,对于大多数植物,随着光强的增加,其体内黄酮类化合物的含量也增加。需要说明的是:上述的研究报道中不少是采用了在室外进行自然光加遮荫调节光强度的方法,这种实验设计由于未考虑紫外光的作用,可能导致结果的解读存在一定的偏差。
3 光质对黄酮类化合物的影响
光质对植物的生长发育至关重要,它除了作为一种能源控制光合作用,还作为一种触发信号影响植物的生长(称为光形态建成)。光信号被植物体内不同的光受体感知,即光敏素、蓝光/近紫外光受体(隐花色素)、紫外光受体。不同光质触发不同光受体,进而影响植物的光合特性、生长发育、抗逆和衰老以及植物的次生代谢活动等。
3.1 可见光中不同波段的光对黄酮类化合物的影响 研究者采用荧光灯或者不同颜色的滤光膜来获得一定波段的光,进而研究不同光质对黄酮类化合物的影响,发现可见光中,一般来说,短波段光(如蓝光)促进而长波段光(如红光)抑制黄酮类化合物的积累。
Thwe等[16]用不同波长的LED灯处理芽长为2 cm苦荞Fagopyrum tataricum苗:红色(660 nm),蓝色(470 nm)以及对照白色,光强均为50 μmol·m-2·s-1,在处理2,4,6,8,10 d后,HPLC测定苦荞芽中芦丁、矢车菊素3-O-芸香糖苷的含量,发现芽中最大芦丁含量出现在蓝光处理4 d后,是红光和白光处理的1.16,1.05倍,这时矢车菊素3-O-芸香糖苷的含量蓝光下是红光和白光10.7,2.7倍,而矢车菊素3-O-芸香糖苷的含量最大出现在蓝光处理10 d后,是红光和白光处理的10.63,2.83倍,这时,芦丁含量蓝光下是红光和白光的1.1,1倍。文中对黄酮代谢途径中基因的表达量进行测定的结果表明,蓝光主要通过促进黄酮合成上游基因的表达,有利于苦荞芽中黄酮类化合物的积累。Ouzounis等[17]研究补充蓝光(400~500 nm)光强和光照时间对绿色莴苣Lactuca sativa cv. “Batavia”和红色莴苣L. sativa cv. “Lollo Rossa”2种莴苣的影响,实验将刚刚长出2~3片新叶的2种莴苣放在5种光环境下进行培养,Ⅰ组为对照组(不补充蓝光),Ⅱ组为早上6:00—8:00补充45 μmol·m-2·s-1的蓝光(1B 06-08),Ⅲ组为从晚上9:00到第2天6:00补充45 μmol·m-2·s-1的蓝光(1B 21-08),Ⅳ组为从下午5:00到下午7:00补充80 μmol·m-2·s-1的蓝光(2B 17-19),Ⅴ组为从下午5:00到下午7:00补充45 μmol·m-2·s-1的蓝光(1B 17-19)。处理2月后,HPLC测量叶中矢车菊素-3-O-6-丙二酰葡萄糖苷,槲皮素葡萄糖醛酸苷,槲皮素丙二酰葡萄糖苷含量,发现绿色莴苣中,各类化合物在不同处理下几乎没有差异。而在红色莴苣中,Ⅳ组和Ⅴ组光照时间一致,光强不同,同对照相比,Ⅳ组和Ⅴ组中以上各化合物的含量分别是1组的1.11,1.16;1.31,1.21;1.31,1.23倍,说明增强蓝光光强可以促进黄酮的积累。Ⅱ,Ⅲ,Ⅴ组光强一致,光照时间不一样,同对照相比,Ⅱ,Ⅲ,Ⅴ组以上各化合物的含量分别是Ⅰ组的1.13,1.11,1.16;1.53,1.31,1.21;1.62,1.38,1.23倍。说明在黎明前补充蓝光,增强蓝光光强可以显著增加红色莴苣中黄酮类化合物的含量,而绿色莴苣中没有此现象,可能是因为红色莴苣中花青素含量高,其合成上游基因表达较高的缘故。
综上,已有的结果表明,当研究部位为叶时,短波段光如蓝光促进黄酮类化合物的积累,长波段光如红光抑制其积累。而关于光质对植物根中黄酮类化合物的影响研究较少。
3.2 紫外线辐射对黄酮类化合物的影响 紫外线占据了7%的太阳光,它刺激植物产生不同的反应。通常来说,紫外线辐射分为3个波段:UVC(200~280 nm),UVB(280~320 nm),UVA(320~400 nm)。每个波段有不同的能量和不同的生态显著性。其中,UVA和UVB穿透能力较强,它们可以穿透臭氧层到平流层,因此可能会损害植物。植物抗UV辐射的能力,或适应UV辐射增强的能力,大多数与其所含的黄酮类化合物如黄酮、黄酮醇、花青素等对紫外线的吸收有关。研究表明,在紫外线辐射下植物体内黄酮类化合物的含量升高。Arcas[18]发现酸橙Citrus aurantium在经过紫外线辐射后,柚皮苷,橘皮素,川陈皮素,橙黄酮的含量增加。Ramakrishna等[19]发现在大麦Hordeum vulgare中,增加UVB辐射黄酮类化合物增加。UVB辐射还可以增强挪威云杉Picea aspoerata中黄酮醇胺的浓度[20]。UV(300~400 nm)使得白桦Betula platyphylla树和葡萄叶产生黄酮醇[21],等等。这些黄酮类化合物起着紫外线滤过的作用,从而保护相关组织免受损害。Daniel等[22]研究UVC照射下与不照射(对照)下黑豆Phaseolus vulgaris发了芽的种皮里面的黄酮成分含量情况,发现UVC照射下,在 5,10,15,20 h 后,种皮中杨梅黄酮、杨梅黄酮-3-O-葡萄糖苷含量分别是对照组的0.8,1.27;1,1.4;1.63,3.6;1.01,1倍。槲皮素、槲皮素-3-O-葡萄糖苷含量分别是对照的1,2.17;1.95,2;1.5,2;1.17,2.14倍。山柰酚,山柰酚-3-O-葡萄糖苷的含量分别是对照的2.5,4;2,2.4;5.6,1.96;3.01,1倍。UVC照射显著提高了黑豆中黄酮类化合物的含量。Kolb等[23]发现紫外线辐射可以促使葡萄中槲皮素和山柰酚衍生物的含量增加。将在缺乏紫外線的温室中遮阴培养的葡萄放在室外3个不同的光照条件(Ⅰ, Ⅱ, Ⅲ)下培养7 d,Ⅰ是可见光+UVA+UVB,Ⅱ是可见光+UVA,Ⅲ是可见光,HPLC测定黄酮化合物的含量。同Ⅰ组相比,Ⅱ组、Ⅲ组总紫外线辐射分别减少了2%,10%。结果表明:在室外培养第7天,I组槲皮素衍生物和山柰酚衍生物含量分别是Ⅱ组和Ⅲ组的2,2.8和3,4倍。从紫外线强度以及所含化合物含量的变化可以看出UVB所起的作用大于UVA。Ryan等 [24]使野生型矮牵牛Mitchell petunia 3种株系生长在3种环境下,3种株系为MP(野生)、LC(将玉米黄酮调节基因转入用于提高花青素含量的转基因株系)、AFLS(可以构建反义黄酮醇合成酶,降低黄酮醇含量的转基因株系),3种环境为正常周围环境、缺乏UVB(-UVB)环境和增加了25%UVB(+UVB)辐射的环境,HPLC测定3种株系叶中总黄酮醇的含量。结果表明:在处理第29天,对于3种株系,从-UVB到+UVB,幼叶中总黄酮醇的含量不断增大,UVB诱导总黄酮醇的含量增加了50%。在第39天,MP和LC幼叶中总黄酮醇的含量增加了100%,250%,而在AFLS中变化不明显。随着处理时间增长老叶总黄酮醇含量一直变化不大,直到第53天,3种株系老叶在+UVB处理下总黄酮醇含量微微增加。Tang等[25]研究UVB辐射对一年生黄芩叶中各种黄酮类化合物的影响,Ⅰ组为正常生长环境(对照),Ⅱ组为低光强UVB组(L-UVB,313 nm,15 μmol·m-2·s-1),Ⅲ组为高光强UVB组(H-UVB,313 nm,42 μmol·m-2·s-1),处理135 d后,发现叶片中,Ⅱ组、Ⅲ组均没有显著提高黄芩苷和鸢尾苷的含量,而Ⅲ组野黄芩苷的含量是Ⅰ组和Ⅱ组的1.22,1.65倍。说明,UVB辐射可促进黄芩叶中部分黄酮含量。对于葡萄、矮牵牛、黄芩来说,当紫外线辐射强度逐渐增大时,植物体内黄酮类化合物的含量会不断增加。强紫外线辐射有利于其体内黄酮类化合物的积累。
对于苦荞来说,紫外线缺乏和紫外线增强下其体内黄酮类化合物的含量呈现降低的趋势。Kreft等[26]研究UVB对苦荞芦丁积累的影响,Ⅰ组为UVB增强组(模拟17%的臭氧损耗);Ⅱ组为UVB减少组(使用聚酯薄膜定位在植物80 cm以上完全切断UVB);对照组为正常辐射。结果表明:不管在植株的叶、茎和花中,对照组中测得的芦丁含量都是最高的。在叶、茎和花中,对照组测得的芦丁浓度分别是Ⅰ组和Ⅱ组的1.4,1.2;2,1.5;1.2,1.04倍。表明增加或者减少UVB辐射,芦丁的含量都会下降。
当紫外线辐射强度发生变化时(从紫外线缺乏、弱紫外线、正常环境紫外线到强紫外线),随着紫外线辐射强度的增加,不同植物中黄酮类化合物的含量对紫外线的响应不同。从已有的研究结果来看,光质对于药用植物中黄酮类化合物的影响比较复杂。由于臭氧层的衰竭,到达地球表面的紫外辐射越来越多。紫外辐射可以刺激植物体内光保护机制的形成以及光形态建成从而使得植物可以抵御外界环境压力。近些年,越来越多的人报道紫外辐射对次生代谢机制的影响,特别是黄酮类化合物。研究者通过讨论黄酮类化合物在光保护中的功能,除了直接吸收紫外线外,强调其清除活性氧(ROS)的能力,也备受关注,并且提出了一个模型,即黄酮类在多余的光胁迫下含量增加可以清除过氧化氢和产生单线态氧,从而避免了程序性细胞死亡[27]。
4 光对黄酮类化合物影响的机制研究
光对植物体内黄酮类化合物的影响应该是光照调控了黄酮合成的酶基因的表达,如苯丙氨酸解氨酶 (PAL)、肉桂酸-4-羟基化酶 (C4H)、4-香豆酸辅酶A连接酶(4CL)、查尔酮合成酶 (CHS)、查尔酮异构酶 (CHI)、黄烷酮-3-羟化酶(F3H)和黄酮醇合成酶(FLS)等的含量和活性提高,从而增加黄酮类化合物含量。最近,Zoratti等[28]对水果中光调控黄酮合成的分子机制着重从转录因子如MYB类调控基因表达等方面进行了详细总结。PAL活性主要受紫外光调节,CHS基因表达产生mRNA也受到蓝光、紫外光的调节,对光的响应较其他酶显著,因此本研究就光照下植物中黄酮类化合物合成途径中关键酶PAL和CHS的变化进行总结。
4.1 光对黄酮类化合物合成途径中PAL的影响 PAL广泛存在于各种植物和少数微生物中,是植物体内黄酮类化合物等次生代谢产物的关键酶和限速酶。光强和光质会对植物体内PAL活性以及基因的表达产生影响。光诱导同黑暗条件相比可以促进植物体内PAL活性以及基因表达的升高,对不同植物来说,随着光强变化,PAL活性变化不一致。蓝光诱导PAL活性升高,红光则起抑制作用。Pacheco等[29]在研究不同光强及光质对树胡椒叶片中PAL活性的影响,120 d后发现全光照的50%,70%的处理下PAL活性几乎没有差异,是全光照下的2.5倍。而蓝色遮阴网处理下是红色遮阴网处理下的3.06倍。说明,遮阴以及蓝光处理有利于PAL活性增加。赵德修等[30]研究光强及光质对水母雪莲Saussurea medusa愈伤组织中黄酮合成及PAL活性的影响,选用了0,20,30,60,90 μmol·m-2·s-1的不同光强进行连续光照培养,结果显示随着光强的增加,PAL活性升高,当光照为60 μmol·m-2·s-1时,PAL活性是暗培养的4.4倍。同黑暗条件相比,其他光照条件下黄酮含量较高。不同光质下(60 μmol·m-2·s-1)连续光照培养16 d发现蓝光诱导PAL活性升高,而红光条件下PAL活性比黑暗下低得多。
4.2 光照对黄酮类化合物合成途径中CHS的影响 CHS是黄酮类化合物生物合成的第一个步骤催化丙二酰基辅酶A的3个乙酸基和对羟苯丙烯酰辅酶的一个乙酸基的缩合,产生查尔酮,并释放3个CO2。它是一个相对分子质量为42~45 kDa的二聚体,具有2个独立的活性中心,其功能结构域由Cys164,His303,Asn336,Phe215组成。光强和光质对植物体内CHS的活性以及基因的表达产生影响。一般情况下随着光强的增大植物体内CHS活性升高。Leyva等[31]以拟南芥叶片为材料发现在光强增大时植物体内花青素含量增高,并且以葡萄糖醛酸酶活性的变化为指标证实了CHS作为苯丙烷类代谢的关键酶其CHS基因的表达是上调的。短波段光如蓝光、紫外光等可以促进CHS基因的表达。对拟南芥的研究表明紫外線、蓝光均能刺激CHS基因的表达,使得查尔酮合酶增加,进而使黄酮含量增加[32-33]。同样,Fuglevand等在拟南芥突变体中也发现了紫外光和蓝光共同诱导可以使得CHS基因转录增强,从而使得CHS基因表达增强[34-36]。
综上,已有的研究主要从植株和组培物方面进行光照对PAL和CHS的研究,但迄今为止,关于光对植物黄酮类化合物生物合成途径中其他酶的研究较少,需要以后对多种植物进行深入研究。
5 讨论与展望
综上,光强和光质都对药用植物的次生代谢产物黄酮类化合物的积累产生影响。光强对于不同植物黄酮类化合物的影响不同,随着光强的增大多数植物黄酮类化合物含量增加。光质影响的一般情况是短波段的光可以促进黄酮物质的积累,长波段的光抑制黄酮物质的积累,但是目前的研究主要是集中在对叶、果实器官的研究,而对根中黄酮类化合物的研究较少,这应该得到关注,因为很多常用药用植物的主要药用部位是根,如黄芩、甘草,这也可能是较为复杂的问题,根对光照响应的生理和次生代谢可能是直接的,也可能是间接的,次生代谢产物也可能在地上部分合成后转移到根,虽然器官间黄酮类化合物的转移尚无直接的证据,本研究没有涉及地下器官影响的研究文献。
紫外线对植物中黄酮类化合物影响的研究是当前研究的热点,一般认为,紫外辐射的增强可诱导植物产生较多的黄酮等紫外吸收物质,增强抗氧化能力,减少紫外辐射对植物自身的伤害。目前主要集中在UVB对植物黄酮类影响的研究,而UVA和UVC对植物中黄酮物质的研究较少。研究表明,蓝光和紫外光可以调节关键酶基因的表达,如促进次生代谢关键酶苯丙氨酸解氨酶(PAL)和黄酮代谢上游关键酶查尔酮合酶(CHS)等酶的合成。迄今黄酮类成分合成的下游酶基因与光的关系的研究较少。
除了上述所述尚待深入的方面,目前的多数研究对植物材料的处理仅限于很短时间,最长的是采用UVB辐射黄芩叶135 d,对于多数药用植物来说,从种植到采收往往是一段很长的过程,因此研究长期光照对植物黄酮类化合物的影响,不仅可以探索植物在整个生长期的需光特性,同时也为最后提高产量提供一定的理论指导。而且研究光强作用的时候,室外的自然光包括了紫外线,遮阴手段不仅减弱了光强,同时也减弱了紫外线,不能区别可见光和紫外光各自的作用。
今后研究光对黄酮类化合物作用可以考虑在下列方面开展。光对于同一种植物不同器官黄酮类化合物积累,包括根;研究具有不同穿透能力的长波段UVA和短波段UVC对植物中黄酮类化合物的影响;强光对黄酮类化合物的影响;光对植物整个生长过程的黄酮化合物积累各个过程期的影响;光对黄酮类化合物合成途径中下游基因以及酶作用的研究以及了解黄酮在植物体内的功能机制,如抗氧化的机制。此外需要注意的是,实验设计的精准化,可以在室内采用LED芯片光源实现光强以及光质的精准控制。最后,在研究清楚一系列光强及光质等对植物整个生长期生长以及黄酮类化合物含量的影响后,就可以在生产上针对植物不同生长期的需光特性,采用调光设计,定向和最大量获得黄酮类化合物的产量,并揭示黄酮类化合物生物合成与光这一环境因子相互作用的内部规律。
[参考文献]
[1]Jaakola L, Hohtola A. Effect of latitude on flavonoid biosynthesis in plants[J]. Plant Cell Environ,2010, 33(8): 1239.
[2]Guo J, Han W, Wang M. Ultraviolet and environmental stresses involved in the induction and regulation of anthocyanin biosynthesis: a review[J]. Afr J Biotechnol,2008, 7(25): 4966.
[3]Winkel-Shirley B. Biosynthesis of flavonoids and effects of stress[J]. Curr Opin Plant Biol,2002, 5(3): 218.
[4]Zhao J, Dixon R A. The ′ins′ and ′outs′ of flavonoid transport[J]. Trends Plant Sci,2010, 15(2): 72.
[5]Erich Grotewold. The science of flavonoids[M]. Columbus: Springer Science Business Media, Inc., 2006:123.
[6]唐杏姣. 光照對菊花花青素苷合成与呈色的作用[D]. 北京:北京林业大学, 2012.
[7]Koyama K, Ikeda H, Poudel P R, et al. Light quality affects flavonoid biosynthesis in young berries of Cabernet Sauvignon grape[J]. Phytochemistry,2012, 78: 54.
[8]Ferreres F, Figueiredo R, Bettencourt S, et al. Identification of phenolic compounds in isolated vacuoles of the medicinal plantCatharanthus roseus and their interaction with vacuolar class Ⅲ peroxidase: an H2O2 affair [J]. J Exp Bot,2011, 62(8): 2841.
[9]Tattini M, Galardi C, Pinelli P, et al. Differential accumulation of flavonoids and hydroxycinnamates in leaves ofLigustrum vulgare under excess light and drought stress[J]. New Phytol,2004, 163(3): 547.
[10]Agati G, Biricolti S, Guidi L, et al. The biosynthesis of flavonoids is enhanced similarly by UV radiation and root zone salinity inL. vulgareleaves[J]. J Plant Physiol,2011, 168(3): 204.
[11]Deng B, Shang X, Fang S, et al. Integrated effects of light intensity and fertilization on growth and flavonoid accumulation inCyclocarya paliurus[J]. J Agr Food Chem,2012, 60(25): 6286.
[12]Liang Q, Wei G Y, Chen J J, et al. Variation of medicinal components in a unique geographical accession of horny goat weedEpimedium sagittatum Maxim. (Berberidaceae)[J]. Molecules,2012, 17(11): 13345.
[13]Neugart S, Krumbein A, Zrenner R. Influence of light and temperature on gene expression leading to accumulation of specific flavonol glycosides and hydroxycinnamic acid derivatives in Kale (Brassica oleraceavar.sabellica) [J]. Front Plant Sci,2016, 7: 326.
[14]朱燦灿. 银杏叶次生代谢产物的环境诱导机制及其调控[D]. 南京:南京林业大学,2010.
[15]何丙辉, 钟章成. 不同环境胁迫下银杏构件种群药用成分变化的研究[J]. 西南农业大学学报, 2003, 25(1): 7.
[16]Thwe A A, Kim Y B, Li X, et al. Effects of light-emitting diodes on expression of phenylpropanoid biosynthetic genes and accumulation of phenylpropanoids inFagopyrum tataricum sprouts[J]. J Agric Food Chem,2014, 62(21): 4839.
[17]Ouzounis T, Razi Parjikolaei B, Fretté X, et al. Predawn and high intensity application of supplemental blue light decreases the quantum yield of PSⅡ and enhances the amount of phenolic acids, flavonoids, and pigments inLactuca sativa[J]. Front Plant Sci,2015, 6: 19.
[18]Arcas M C, Bot′1a J M, Ortuo A M, et al. UV irradiation alters the levels of flavonoids involved in the defence mechanism ofCitrus aurantium fruits againstPeniillium digitatum[J]. Eur J Plant Pathol,2000, 106: 617.
[19]Ramakrishna A, Ravishankar G A. Influence of abiotic stress signals on secondary metabolites in plants[J]. Plant Signal Behav,2011, 6(11): 1720.
[20]Fischbach R J, Kossmann B, Panten H, et al. Seasonal accumulation of ultraviolet-B screening pigments in needles of Norway spruce (Picea abies (L.) Karst.)[J]. Plant Cell Environ,1999, 22(1): 27.
[21]Tegelberg R, Julkunen-Tiitto R, Aphalo P J. Red: far-red light ratio and UV-B radiation: their effects on leaf phenolics and growth of silver birch seedlings[J]. Plant Cell Environ,2004, 27(8): 1005.
[22]Daniel G F, Delia S G, Sergio O S, et al. Effect of germination and UV-C radiation on the accumulation of flavonoids and saponins in black bean seed coats[J]. Cereal Chem,2014, 91(3): 276.
[23]Kolb C A, Kser M A, Kopeck J, et al. Effects of natural intensities of visible and ultraviolet radiation on epidermal ultraviolet screening and photosynthesis in grape leaves[J]. Plant Physiol,2001, 127(3): 863.
[24]Ryan K G, Markham K R, Bloor S J, et al. UVB radiation induced increase in quercetin: kaempferol ratio in wild-type and transgenic lines of Petunia[J]. Photochem Photobiol,1998, 68(3): 323.
[25]Tang W T, Fang M F, Liu X, et al. Simultaneous quantitative and qualitative analysis of flavonoids from ultraviolet-B radiation in leaves and roots ofScutellaria baicalensis Georgi using LC-UV-ESI-Q/TOF/MS[J]. J Anal Methods Chem,2014, 2014: 643879.
[26]Kreft S, Strukelj B, Gaberscik A, et al. Rutin in buckwheat herbs grown at different UV-B radiation levels: comparison of two UV spectrophotometric and an HPLC method[J]. J Exp Bot,2002, 53(375): 1801.
[27]Agati G, Brunetti C, Di Ferdinando M, et al. Functional roles of flavonoids in photoprotection: new evidence, lessons from the past[J]. Plant Physiol Biochem,2013, 72: 35.
[28]Zoratti L, Karppinen K, Luengo Escobar A, et al. Light-controlled flavonoid biosynthesis in fruits[J]. Front Plant Sci,2014, 5: 534.
[29]Pacheco F V, Alvarenga I C A, Junior P M R, et al. Growth and production of secondary compounds in monkey-pepper (Piper aduncum L.) leaves cultivated under altered ambient light[J]. Aust J Crop Sci,2014, 8(11): 1510.
[30]赵德修, 李茂寅, 邢建民, 等. 光质、光强和光期对水母雪莲愈伤组织生长和黄酮生物合成的影响[J]. 植物生理学报, 1999, 25(2): 127.
[31]Leyva A, Jarillo J A, Salinas J, et al. Low temperature induces the accumulation of phenylalanine ammonia-lyase and chalcone synthase mRNAs ofArabidopsis thaliana in a light-dependent manner[J]. Plant Physiol,1995, 108(1): 39.
[32]Yamazaki Y, Suh D Y, Sitthithaworn W, et al. Diverse chalcone synthase superfamily enzymes from the most primitive vascular plant,Psilotum nudum[J]. Planta, 2001, 214(1): 75.
[33]Wade H K, Bibikova T N, Valentine W J, et al. Interactions within a network of phytochrome, cryptochrome and UV-B phototransduction pathways regulate chalcone synthase gene expression inArabidopsis leaf tissue[J]. Plant J,2001, 25(6): 675.
[34]Fuglevand G, Jackson J A, Jenkins G I. UV-B, UV-A, and blue light signal transduction pathways interact synergistically to regulate chalcone synthase gene expression inArabidopsis[J]. Plant Cell,1996, 8(12): 2347.
[35]Batschauer A, Rocholl M, Kaiser T, et al. Blue and UV-A light-regulatedCHS expression inArabidopsis independent of phytochrome A and phytochrome B[J]. Plant J,1996, 9(1): 63.
[36]Jenkins G I. UV and blue light signal transduction inArabidopsis[J]. Plant Cell Environ, 1997,20(6): 773.
[責任编辑 吕冬梅]