新疆维吾尔族和汉族大学生尿液代谢轮廓差异分析
宋培培等
摘 要 以新疆两个主要世居民族(维吾尔族和汉族)大学生人群尿样为研究对象,采用气相色谱-质谱联用技术对35名维吾尔族和37名汉族大学生人群尿样进行分析,考察两民族大学生尿液代谢轮廓间的差异。采用正交信号校正-偏最小二乘法判别分析结果表明, 维吾尔族和汉族大学生人群尿样代谢轮廓存在着明显差异,聚类明显。实验发现和鉴定出9种差异代谢物,其中7种为内源性代谢物,2种为外源性代谢物。研究表明,相关代谢组学研究可从源头避免或减少非疾病因素引入的差异变量,除年龄、性别等因素外,还需充分考虑族别因素的影响。
关键词 代谢组学; 气相色谱-质谱; 维吾尔族; 汉族; 尿液
1 引 言
代谢组学作为系统生物学的重要组成部分,已成为继基因组学、转录组学、蛋白质组学之后兴起的一个新的组学研究热点[1,2]。在疾病代谢组学研究中,采样环节起着举足轻重的作用,生物样本的代表性与所鉴定出的相关疾病生物标志物的可靠性与准确性有着直接关系。众多因素影响着生物样本中代谢物的组成与含量,如饮食习惯、外界压力、抽烟与否以及参加锻炼频率与强度等,导致代谢组学研究结果有极大的可变性[3~9]。在动物实验中,通过严格控制外部生理条件,可最大化降低或消除这些因素的影响。但对人类相关疾病组学研究过程中,该方法并不可行。如Saito等[4]研究了血液基质、年龄和性别对高加索人种代谢物轮廓的影响,证实这些因素均会导致个体间代谢物在种类和数量的不同;Lenz等[5]发现,由于英国和瑞典健康人群饮食和文化不同,导致尿液轮廓间存在差异,在瑞典健康人群中,Trimethy-lamine N-oxide含量高于英国健康人群;Dumas等[6]发现,由于饮食、基因和肠道微生物因素,日本、芝加哥和中国的健康人群的尿液轮廓存在差异。上述研究表明,人种、饮食文化等差异会对生物样本中代谢物的组成与含量产生较大影响。新疆地理环境和自然生态条件复杂,民族分布及其生活方式独特,地方性高发病种类繁多,并且表现出一定的民族性[10,11]。这除与民族遗传等基因因素相关外,民族文化和饮食习惯的差异也是导致这种现象的一个重要原因。为深入研究新疆地方性高发病,在进行相关代谢组学研究过程中,就必须充分考虑族别因素的影响。基于此,本研究以新疆两个人口最多的世居民族维吾尔和汉族为对象,采用气相色谱-质谱联用技术(GC-MS)对这两个民族健康大学生尿样进行分析,探索由于族别因素导致的尿液轮廓间差异,并通过生物统计学方法发现和鉴别两个人群尿样中差异代谢物,为新疆多发性疾病早期诊断与相关标志物的筛选提供参考。
2 实验部分
2.1 仪器与试剂
QP2010 Ultra GC-MS (日本Shimadzu公司),Coulter Avanti J-25 高速冷冻离心机(美国Beckman公司)。
N,O-双(三甲基硅烷基)乙酰胺(BSTFA, 98%,Aladdin 试剂);三甲基氯硅烷(TMCS)、甲氧基胺盐酸盐(98%,Alfa Aesar试剂);吡啶(分析纯,北京化工厂),十二酸(色谱纯,上海试剂一厂)。
2.2 样品处理
2.2.1 样品收集
于新疆大学收集35例(男18、女17)维吾尔族和37例(男16、女21)汉族的大学生晨起尿样,年龄19~28岁,志愿者身体健康,一星期之内未服用任何药物,24 h内未饮用含咖啡因的饮品。72例样本收集后,在2 h内进行处理,4℃下3000 g离心10 min,除去固形物,上清液置于-80℃保存。
2.2.2 样品前处理 尿样在室温下解冻混合均匀,取200 μL上清液,按体积比1∶4加入冷丙酮800 μL,4℃静置5 h,沉淀蛋白;在4℃下12000 g离心15 min,取上清液,冷冻真空干燥。在残留干燥物中加入34 μL 15 g/L 甲氧胺盐酸盐,无水吡啶为复溶液,涡旋5 min充分溶解后,加入7 μL 5 mg/mL月桂酸标准溶液(内标物),另加34 μL衍生化试剂(BSTFA∶TMCS=99∶1)超声振荡5 min,使之充分反应。37℃衍生30 min,缓慢升温至65℃, 衍生化反应结束,冷却至室温后进行GC-MS分析。
为检验仪器和分析方法的重现性和稳定性,本实验使用质量控制(Quality control, QC)样品,QC样品由每例样品各取适量混合而得,样品检测过程中,每检测7个样品后运行1次QC样品,以衡量系统的稳定性。
2.3 色谱-质谱条件
Rxi-5Sil MS色谱柱(30 m×0.25 mm×0.25 μm);进样口温度,280℃;分流比,100∶1;载气,99.999%高纯He,1.0 mL/min;色谱柱温度,初始温度60℃,保持2 min,以10℃/min由60℃提升至80℃,再以25℃/min升至160℃,以10℃/min升至280℃,保持2 min;进样量,0.1 μL。
EI离子源:温度200℃;电子能量,70 eV;扫描方式,全扫描模式,扫描范围m/z 50~600。谱库:Wiley 229.L, Wiley 7.L和NIST 08.L。
2.4 数据处理
GC-MS产生的原始数据首先采用GC-MS Solution软件进行预处理,以斜率1000 min,半峰宽为2进行基线校正和自动峰值检测;以内标月桂酸为标准进行归一化处理后, 将数据导入SIMCA-P 11.5 Demo和 17.0 SPSS软件进行多维统计分析。
3 结果与讨论
3.1 生物统计学分析
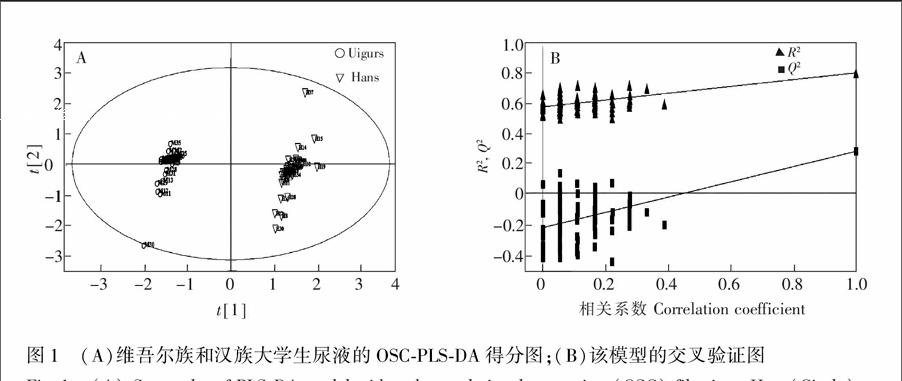
采用SIMCA-P 11.5 Demo软件对所得数据进行正交信号校正-偏最小二乘法判别分析(Orthogonal signal correction filtered partial least-squares discriminant analysis, OSC-PLS-DA)。如图1A所示,维吾尔族和汉族大学生尿样聚类明显,两组样本达到了良好分离(模型参数R2X=0.691,Q2(cum)=0.333),说明两组尿样轮廓间存在显著差异。为了检验模型重现性是否良好和模型中的数据是否过拟合,避免监督性学习方法获得分类结果的偶然性,每个模型都经过100次内交叉验证(Cross validation,CV),结果见图1B。CV以R2和Q2回归线与y轴的截距值作为标准衡量模型是否过拟合。本次实验结果中Q2
为负值(0.232),证实所建模型不存在过拟合,模型有效,预测能力良好[12],可应用于维吾尔族和汉族大学生尿样的聚类分析。
3.2 差异代谢物筛选
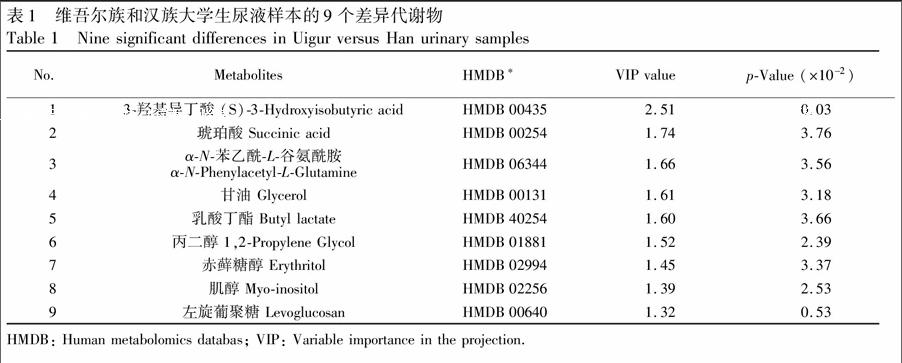
在OSC滤噪的PLS-DA模型中Variable importance in the projection (VIP) 是一种广泛使用的变量挑选方法[12],VIP间接反映了代谢物和所研究样本之间的关系。本研究以VIP>1[13]和显著性t检验p<0.05为标准对代谢物进行了筛选,共鉴定出9种代谢物在维吾尔族和汉族大学生尿液中存在显著性差异,所得结果按VIP由大到小列于表1。
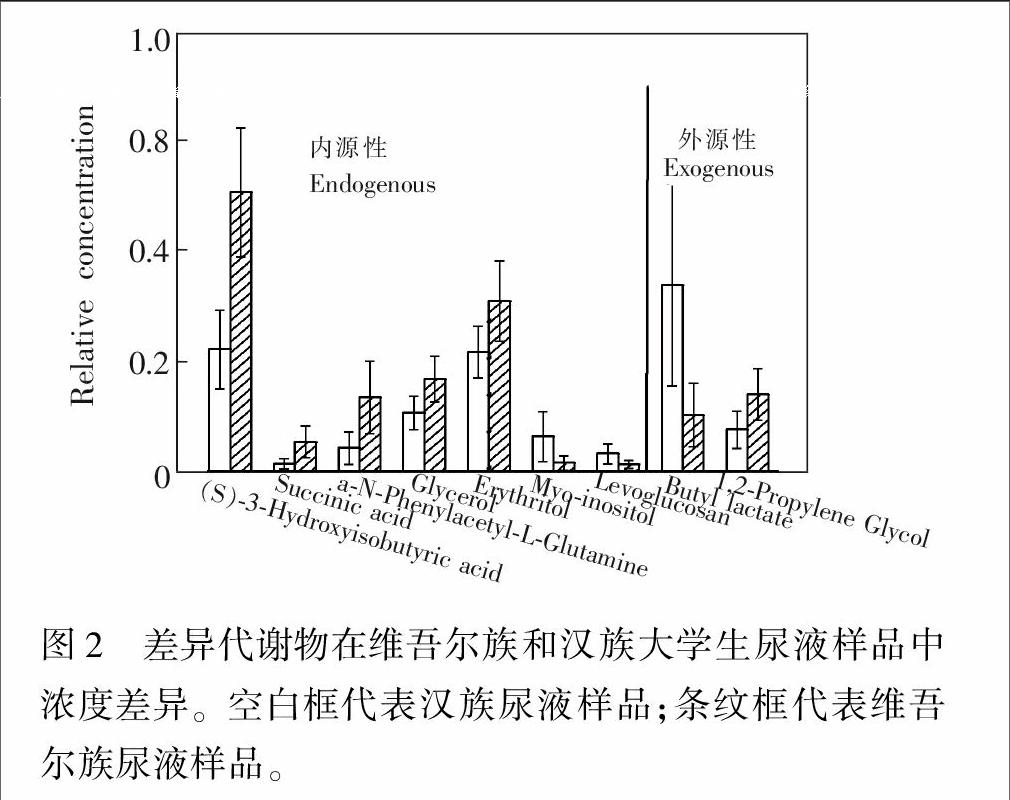
为进一步验证所鉴定的差异代谢物的可靠性,分别通过人类代谢组学数据库(Human metabolomics databas,HMDB)、代谢物二级质谱数据库(Metabolite and tandem MS databas,METLIN)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)等数据库对9种差异代谢物进行检索,结果发现,它们均为尿液代谢物,进一步验证了实验结果的可靠性。其中7种差异代谢物为内源性物质(图2),主要涉及碳水化合物代谢、氨基酸代谢和三羧酸循环代谢途径。它们在两组尿样中的变化趋势也并不相同,有升有降,而尿液中内源性物质的含量与饮食文化或基因等因素有着直接或间接的关系。乳酸丁酯和丙二醇为外源性代谢物,它们含量的高低与摄入的食物或香精有直接关系。上述结果表明,维吾尔族和汉族健康大学生人群尿样中存在着多种差异代谢物,导致这种现象的原因与民族文化,特别是饮食文化的差异有关。
特别需要说明的是,在两组尿样中,α-N-苯乙酰-L-谷氨酰胺在维吾尔族大学生尿液样本中含量明显高于汉族大学生,其过度表达预示着患有肝脾气虚症的可能性更高[14]。但在本实验过程中所采集的尿液样本均来自于年轻的健康大学生人群,α-N-苯乙酰-L-谷氨酰胺含量偏高并不能说明维吾尔族大学生比汉族人群患有肝脾气虚症的可能性更高,可能只是与民族文化和传统或民族基因间差异有关,而且新疆实际情况也与这一可能性相反,乙肝携带率汉族高于维吾尔族[11]。上述实际结果说明民族文化和传统或民族基因的差异也会导致不同族别人群尿液样本中代谢物的种类和含量存在着差异,会严重干扰相关疾病生物标志物的发现和鉴定。
References
1 Huang Z Z, Chen Y J, Hang W, Gao Y, Lin L, Li D Y, Xing J C, Yan X M. Metabolomics, 2013, 9(1): 119-129
2 Theodoridis G, Gika H G, Wilson I D. Mass. Spectrom. Rev., 2011, 30(5): 884-906
3 Lenz E M, Bright J, Wilson I D, Morgan S R, Nash A F P. J. Pharm. Biomed. Anal., 2003, 33(5): 1103-1115
4 Saito K, Maekawa K, Pappan K L, Urata M, Ishikawa M, Kumagai Y, Saito Y. Metabolomics, 2014, 10(3): 402-413
5 Lenz E, Bright J, Wilson I, Hughes A, Morrisson J, Lindberg H, Lockton A. J. Pharm. Biomed. Anal., 2004, 36(4): 841-849
6 Dumas M E, Maibaum E C, Teague C, Ueshima H, Zhou B, Lindon J C, Nicholson J K, Stamler J, Elliott P, Holmes E, Chan Q. Anal. Chem., 2006, 78(7): 2199-2208
7 Psihogios N G, Gazi I F, Elisaf M S, Seferiadis K I, Bairaktari E T. NMR Biomed., 2008, 21(3): 195-207
8 Slupsky C M, Rankin K N, Wagner J, Fu H, Chang D, Weljie A M, Saude E J, Lix B, Adamko D J, Shah S, Greiner R, Sykes B D, Marrie T J. Anal. Chem., 2007, 79(18): 6995-7004
9 Zhang S, Liu L, Steffen D, Ye T, Raftery D. Metabolomics, 2012, 8(2): 323-334
10 LI Lin-Lin, MAO Xin-Min, ZHANG Yue-Ming, RAN Xin-Jian, NU Li-Man, ZHOU Kang, DU Jing-Yu, YANG Yong-Xin, WU Li-Ya, BAI Li, KA De-Er, WANG Sai-Gang, LIN Ren-Yong, LI Nian-Dong. Chin. J. Endocrinol. Metab., 2005, 21(2): 141-142.
李琳琳, 毛新民, 张月明, 冉新建, 努丽曼, 周 康, 杜景玉, 杨永新, 邬利娅, 白 丽, 卡德尔, 王赛刚, 林仁勇, 李念东. [HTK]中华内分泌代谢杂志, 2005, 21(2): 141-142
11 MAO Ying, GU Jia-Yi, DU Shou-Hong, XIANG Yang. Mod Prevent. Med., 2014, 41(20): 3778-3789
毛 英, 顾佳怡, 杜守洪, 向 阳. [HTK]现代预防医学, 2014, 41(20): 3778-3789
12 Mahadevan S, Shah S L, Marrie T J, Slupsky C M. Anal. Chem., 2008, 80(19): 7562-7570
13 Chong I G, Jun C H. Chem. Intell. Lab. Syst., 2005, 78(1): 103-112
14 Zhang A H, Sun H, Han Y, Yuan Y, Wang P, Song G C, Yuan X X, Zhang M, Xie N, Wang X J. Analyst, 2012, 137(18): 4200-4208

