基于特征化定量心电图策略分析小鼠心脏电生理固有稳态制式


摘要:目的 高分辨定量剖析生理状态下小鼠心脏电生理本底稳态属性。方法 随机选取成年C57BL/6小鼠22只(雌雄1∶1),采用无麻醉法固定小鼠四肢,自主呼吸下通过灵敏十二导联电生理采集器(ECGsqa)记录心电波形,包括小鼠特征性P波、R波及ST波,应用LabScribe软件读取与量化心前区V3导联上单一心动周期内高分辨时程参数与振幅参数,使用独立样本t检验比较组间差异,联合皮尔逊相关检验与简单线性回归绘制雌雄心电参数拟合散点图,按相关性强弱区分共享与独特关联对参数,从而揭示定量关联网络概貌。结果 ECGsqa分析共识别与量化14个特征型心电参数,28.6%的组间差异具有统计学意义。与雄组相比,雌组R波与ST波的振幅与速率均更高(Plt;0.05)。在初级关联分析所鉴定的51个关联对中,关联阳性群占比为47.1%,其中涵盖雌雄共有(29.2%)、雄特有(29.2%)与雌特有(41.7%)三大关联组。关联对二阶聚类分析发现,雌雄心脏各波形电压的振幅-速率关联对处于普遍稳定强相关水平(Plt;0.01),而雄组心电特征展现出房-室互联模式,以及雌组心电特征展现独特心房电导系统质量依赖模式。关联群组分布网络特征显示,雌雄各自特有关联参数与共有关联参数之间具有一定程度串联模式。结论 本研究聚焦雌雄小鼠天然心脏电信号的可被精确识别的数理特征,发现心电波重要特征参数的内在关联网络,揭示心房与心室电传导系统内部联结特征及其性别差异性,可为心血管生理与病理的纵深机制探索提供潜在适用的电稳态制式参照。
关键词:心脏电生理;定量心电策略;P 波;R波;ST波
心脏疾病为全球人口高发病率和死亡率病种[1],其中心律失常与心脏病情进展、康复、恶化及猝死密切相关[2, 3]。临床上针对房颤、房扑、室速及室颤等常见心律失常的药物及射频消融治疗尽管已是常规,但仍不可避免无效作用以及心脏和心外(如神经体液激活等)副作用[4, 5]。心脏电生理本身结构的系统定量研究一直鲜有报道,导致心脏电传导精细工作模式探索很大程度仍处于模糊阶段,也是电生理学当前缺少基础纵深机制认知的突出症结[6]。
心电图(ECG)技术主要通过体表心电信号采集器及电脑软件连续捕获心脏单个心动周期电活动变化,为心律失常、缺血性心脏病、药物心脏安全性评价等核心检测手段[7]。尽管临床上关于ECG波形信号诊断的经验共识早已形成,但由于定量分析占诊断权重比例普遍低下,加之心电真实个体差异因素潜在复杂,结果判读很大程度带有主观性与模糊性[2, 8]。因此,厘清心脏电生理参数成员之间的内部关联特征,形成清晰的数理概貌网络图式,有利于促进ECG未知精细调控新机制探索,并为心律失常创新精准化防治提供新方法。
在国内外心电研究中,繁育周期较短的啮齿类动物(如C57BL/6 小鼠)ECG特征(包括P波、R波及ST波)与人体十分相近,为重要心电研究对象[9]。研究发现,影响小鼠ECG基本波形的生物因素可包括性别、遗传背景以及常规ECG采集过程中麻醉药物应用,且人体亦具有类似属性[10-12],这提示哺乳动物正常心电模式可能依赖于特定未知自稳程序。值得注意的是,此类基础研究可能部分受限于小动物心电采集器类型等级,绝大多数仅使用ECG肢导联信号作简波形分析,而对空间上更物理接近心脏位置且无潜在骨骼肌电叠加干扰的胸导联信号(临床上肢胸导联互补协助诊断)未予匹配探讨,尚未见对小鼠固定单个胸导联特征心电波进行以生物因素或模式为导向的定量分析。
本课题组前期通过采用自主建立小鼠清醒状态下ECG单胸导联信号高分辨定量分析新策略(ECGsqa),明确了他莫昔芬(肿瘤与基因编辑常用药物)急性期作用雌性小鼠心脏的电抑制量效谱学[13]。该研究为心电精细数理研究提供新颖方法依据。本研究采用ECGsqa路径量化比较同窝成年雌雄小鼠心电时程与振幅参数,结合线性相关分析识别关联水平,并按关联强弱度进行串并联特征重构,旨在系统挖掘尚未报道心电数组的共性与差异关联网络,从而在特征化电信号水平创新解构小鼠心脏电生理固有稳态制式,为心律失常发生发展机制及精准防治研究提供新的基线参考。
1 材料和方法
1.1 材料
成年野生型C57BL/6J小鼠(12~14周龄)购自广东省医学实验动物中心,动物实验已获广东省人民医院伦理委员会批准(伦理批号:KY-Q-2022-356-01),严格遵循实验动物福利原则。新型高灵敏小动物12导联心电图系统(IX-ECG12-SA)、匹配LabScribe分析软件购自iWorx,主要包括生理信号采集器、信号针电极以及快速分析模块。
1.2 方法
1.2.1 小鼠清醒心电数据采集 随机选取同窝饲养小鼠(雌∶雄=1∶1),采用平板仰卧位固定小鼠四肢与头颈部,于其平躺清醒状态(无任何麻醉)下轻柔操作接入胸前区浅表导联(V3,心前区映射心室电活动代表导联)电极,其尖端位于胸骨左缘第4与第5肋间中点。应用电脑LabScribe软件采集窗操作快速捕获小鼠平稳心电信号,记录0.5~1 min稳定波形数据并单独命名文件保存。数据采集完成后,移除小鼠所有电极导联并确保无皮下出血后松绑安返,确保实验结束后小鼠后续正常饲养。
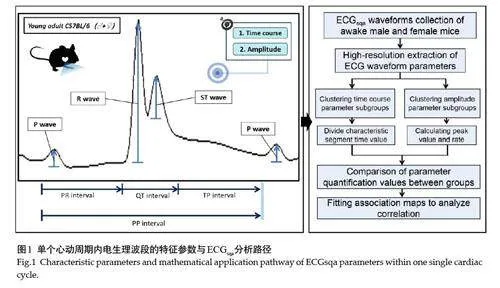
1.2.2 心电形数转换及差异分析 应用LabScribe 软件读波窗操作,对胸导联V3 通道连续5 个循环轨迹取平均相,测量包括高分辨心房去极化P波、心室去极化R波及复极化ST融合波。按时程定义量化X轴向上时间参数,包括心率(HR)、PP间期(心动周时)、PR间期(房室传导)、QT间期(室内传导)与TP间期(静息期);按波幅定义量化Y轴向上振幅参数,包括P波振幅、R波振幅与ST波振幅(图1)[22]。本文HR读值为软件自动识别与测算QRS 波(指示一个心动周期)的每分钟出现个数(bpm)。通过P波起始至波峰区段的振幅与时程比值计算P波传导速率(mV/ms),指代心房去极化初始平均速率(ADV,心房肌电活动重要特征指标)[23, 30]。通过R波(小鼠V3导联Q波不明显)起始至波峰区段振幅与时程的比值计算R波传导速率(mV/ms),指代心室去极化初始平均速率(VDV, 心室肌电活动重要特征指标)[24, 25]。由于小鼠S波与T波融合为ST波,在此ST波振幅定义为R波后向下的第一个波谷作起点到其随后波峰为止这一段电信号的振幅读值。通过GraphPad Prism 9.0软件对获得心电参数读值作柱状图可视化及差异化分析。
1.2.3 心电量化参数关联比对 通过GraphPad Prism9.2.0 软件对所获得定量化心电参数交互匹配,绘制散点图与趋势线,计算相关系数及线性关系程度,检验参数之间的相似性和差异性,按关联强弱对参数进行聚类分析,明确电传的数学特征。主成分分析可以将多个相关参数转化为少数几个无关的主成分,从而降低参数维度并提取主要信息。
1.3 统计学方法
前期研究表明[13],小鼠ECGsqa参数(包括时程与振幅)定量分析所用组内样本量范围为5~8只,由于本研究新增ST 波振幅值预实验组内离群值发生概率为50%,推算本研究每组小鼠个数满足统计学所需合理范围为10~16,结合95%置信区间参考与实验动物3R原则(替代、减少和优化)考量,推定本研究雌雄每组样本量为11 只。
采用GraphPad Prism 9.2.0 软件进行统计学分析,计量数据以均数±标准差表示,对同一心电参数进行性别组间双尾Welch's t检验,采用单线性回归及皮尔逊相关分析检验参数间线性关联水平。Plt;0.05为差异具有统计学意义。
2 结果
2.1 心电性别特征定量谱兼具保守性与差异性
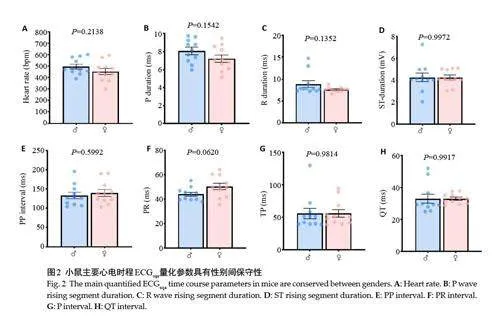
完整分析22只小鼠的ECG数据,所有时程与振幅基线参数在性别组之间均具有可比性。两种性别下心电时程量化值,包括整体心率、波段时程及间期参数的均值与分布未见明显组间差异(图2)。与雄性小鼠比较,雌性小鼠房室特征波形(包括P波、R波及ST波)的振幅与导速量化值具有更高读值水平特征,其中R与ST波具有显著性差异(Plt;0.05,图3)。
2.2 心电波幅与导速之间存在明显线性相关特征
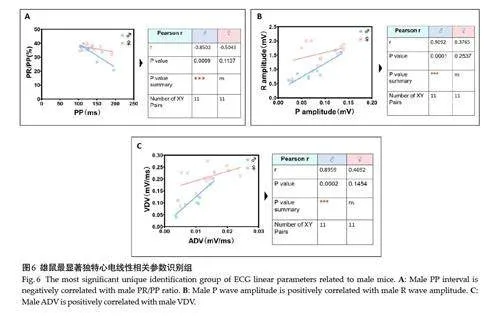
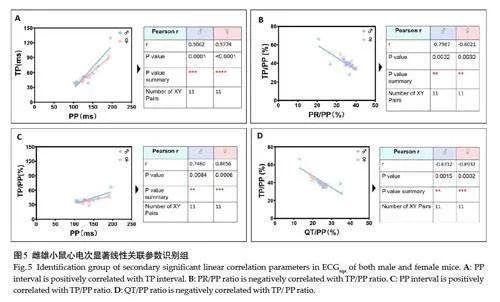
在定量测量读值基础上,进一步关联分析51个心电拟合参数对,包括无显著线性相关参数对27个(53.0%),至少存在一组显著线性相关参数对24个(47.1%)。其中,雌雄共同识别线性最相关(Pearson rgt;0.95,Plt;0.0001)参数对为3项,均为正相关,分别为房室特征波形(包括P、R及ST波)电压振幅及其速率(图4);次相关显著水平(Pearson r=0.75~0.91,Plt;0.01)参数对为4 项,即PP间期分别正关联TP间期与TP/PP占比、TP/PP占比分别负关联PR/PP占比及QT/PP占比(图5)。
2.3 雄鼠独特心电生理模式依赖房-室协同制式
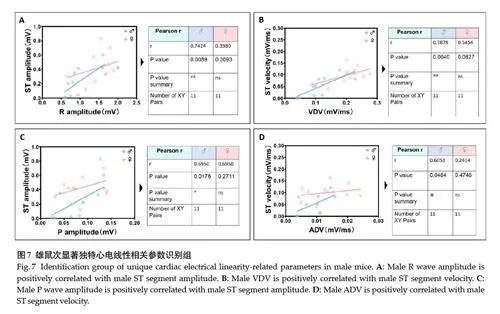
雄性组独有线性最相关(Pearson rgt;0.85,Plt;0.001)参数对为3 项,分别为PP间期负关联PR/PP占比、P波振幅正关联R波振幅、以及ADV正关联VDV(图6);次相关显著水平(Pearson r=0.61~0.79,Plt;0.05)参数对为4 项,即ST波振幅分别正关联R波振幅与P波振幅、及ST波速率分别正关联ADV与VDV(图7)。
2.4 雌鼠独特心电生理模式依赖房量轴向制式
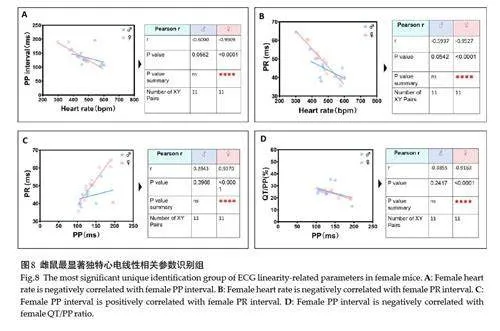
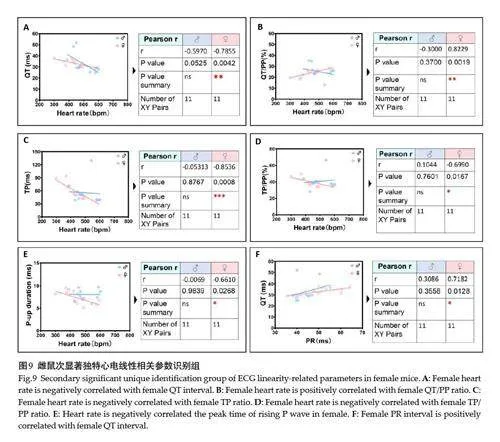
雌性组特有线性最相关(Pearson rgt;0.92,Plt;0.0001)参数对为4项,分别为心率分别负关联PP间期与PR间期、及PP间期分别正关联PR间期与负关联QT/PP占比(图8);次相关显著水平(Pearson r=0.70~0.85,Plt;0.05)参数对为6项,即心率分别负关联QT间期、TP间期、TP/PP占比和P波上升期时程、心率正关联QT/PP占比、以及PR间期正关联QT间期(图9)。
2.5 强关联参数集成网络重构映射心电活动稳态征貌
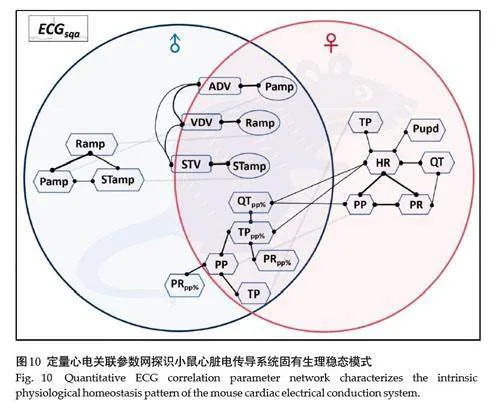
通过拟合上述雌雄ECGsqa性别共享及差异强关联数组,构建出年轻成年小鼠心电生理内部运转动力学模组,表征房室电信号在系统稳态下的相互作用模态(图10)。在交叉共享区域中,联结网拟合出2个特征模块,分别为速率偶联振幅模块(VAm)与时程亚群互联模块(TSm)。VAm分析发现,电速率组分(即ADV、VDV与STV)之间形成的子域与振幅参数之间的子域共同组成雄电组关联特征网络。TSm分析发现,部分电时程参数(包括QTpp%、TPpp%、PP与TP)与其他偶联时程参数(包括HR、PR、QT与Pupd)组成雌电组特有关联网络,以HR为中心轴尤为特征显著(图10)。
3 讨论
心功能的调节主要发生在负责各腔室收缩的心肌细胞动力学水平上,而心肌组织原位电活动真实过程则是心肌细胞群兴奋-收缩偶联直接反映的物理关键[14, 15]。研究显示[16],心律失常发生的风险与作为原因的ECG参数自身(如PR间期的读值之于房颤)而非心肌大小的改变密切相关,进一步证实心电活动数理规律为心功能稳态认知的重要独立手段[2, 5]。此外,心电数学模型已颇有演变历史[17],也新近发展了测量值分布校准法[18]、跨物种运算符法[19]、机电耦合模型[20]等。然而,复杂的ECG数据之间相关程度剖析很大程度仍不清晰。本文精细定量分析清醒状态下ECG时程与振幅这两类核心电学特征参数,识别心肌去极化与复极化过程中未被揭晓的高分辨定量特征,以新视角揭示了心脏电活动存在确凿内部联结方式,阐明心脏房室动作电位基线水平的性别共性及独特制式,有助于深入了解兴奋-收缩偶联潜在的生理与病理机制。
已有研究对心电参数的性别差异与生物学功能的分析,一是集中在全基因组关联方面,如PR间期的房室传导多基因倾向性[21]、QT间期的心血管病特征多效性关联[22]、T波振幅与时程的心脏运动反应性复极化兴奋改变[26]等;二是集中在心血管病危险因素识别方面,如ECG测量值与死亡率之间关联的风险比评估[27]、ECG-超声心动图的心室功能障碍和重构评价[28]等。值得注意的是,这些被群体统计识别的心电参数在与个体指标之间的外部关联度存在不同性别偏向,而这些具有性别偏向的心电参数多为本文心电稳态共性(而非性别独特)关联网络中的特征参数子集,提示特定病理条件可能造成心电参数关联网络适应性重塑。因此,病理因素下,性别相关的心电参数化特征应予以进一步定量关联探讨。
有研究报道ECG参数改变(即电稳态失调)可作为无性别区分下心血管病风险评估的一个独立因素,如P波长时程与较高体重指数相关[29]、P波参数组可靠预测心房心肌病发生[30]、房颤P波改变可由多基因变异(如遗传多态性[31])或单基因表达操纵(如转录因子FOG2过表达[32])导致。此类房性心电参数改变相关因素的心脏病理学关联匹配一定程度补充了心血管病机理认知,但同样存在对心电特征参数缺乏深入剖析数联关系以提高电活动精准度的局限性。此外,心律失常发生率的降低可能与体力活动相关,而与吸烟与饮酒无关[33];敲除节律基因Bmal1未影响小鼠心电昼夜节律,但导致与心率无关的QT间期延长[34]。这就一定意义上呼应了本文强调的心电传导系统内部固有稳态特征,而本文详实的电参数(包括读值与百分比)的定量关联网络则为深入机理探索提供了清晰且可用的图鉴范式。
精确、精细、全面描述异常心脏功能和心肌病相关表型有助于现有心律失常陈旧基础研究以及防诊治路径优化。例如,R波振幅读值与左后分支传导束阻滞发生率的关联度可能为心律失常性左心室心肌病的新表型[35]、QRS波时程读值与遗传突变基因的关联度较好解析了扩张型心肌病的致病机制[36]、P波参数特征式细量化参数可用于房性心律失常预测模型[37]与药物测试新技术[38]的研发。此外,有研究发现,心脏细胞谱的复杂性及其沿血管轴变化的解剖结构突出强调心房与心室之间区别于骨骼肌的不同细胞亚群网络[39],而负责电生理稳态的细胞类型和配对基因程序的研究明确了整个心肌细胞发育过程中的基因与电生理关系[41],这为心脏电生理稳态的功能定量谱学,特别是本研究中性别差异性与保守性的遗传与表观遗传机制探究铺垫分子生物学基础。
本研究通过ECGsqa定量模型靶向生理心电参数的内部数联特征,率先识别出基线心电波内部振幅与导速之间密切交互关联制式,明确天然心电生理可被量化的子属性。有报道发现,心房P波离散度量化值与P波上升期达峰时间与高血压新发房颤密切相关,可作为预测疾病发生的特征指标对[41]。这表明,非生理条件下心房电导重塑具有潜在心功能指向性数联谱。此外,一项心律失常再同步治疗回顾性研究发现,QRS时限和左束支传导阻滞这两个ECG参数亦可被波形定量分析策略予以客观区分化识别,相关亚组变化程度适用于疗法分层评价[42]。这进一步表明,病理与治疗相关心室电导重塑可能同样具有主动调节心功能适应性改变的生物学作用。一项QRS波形量化重建研究发现[43],QRS波群组分参数值差异关联心脏病理进程,为心血管疾病死亡预测潜在新指标群。
先天性心脏病心律失常研究表明,通过求和、减法、乘法或除法以创建不同索引的方法,可对胸导联R波和S波参数进行数学组合建库,并结合对应临床数据进行心律失常预测指标挖掘,进而发现RV1+RV3可准确区分右室结构性心脏病心律失常不同类型[44]。基于窦性心律心电图算法的研究发现,RV1读值与法洛四联症患者室性心律失常密切相关,为潜在独立预测参数因子,可促进特定无创疗法风险分层评估策略制定[45]。由此可见,以心电量化指标为轴心的心功能数联网络,特别是特定关联参数/组合形成的数理模型,可明确心电内部稳态复杂调控的分子生物学节点,而本研究基于特征化定量心电图策略所提供雌雄小鼠时空二向参数关联谱可为此方向基础研究提供直接基线比对参考。
综上所述,通过特征化分类心电参数并进行性别间定量化比对,可实现针对小鼠心电生理波形新颖关联性系统分析,包括去极化与复极化模式切换比较的心电特征定量谱、波幅与导速数学偶联特征以及雌性共性特性关联参数的稳态贡献等。未来相关研究可在此基础上,进一步扩大样本量、拓展动物与人体心电研究范围,深入剖析心电内在关数理征貌与数联网络,为心脏电生理机制精准化探索,包括进一步阐明心电生理稳态与心律失常发生发展的精细生物学规律,提供潜在重要的基础理论与前沿方法学参照。
参考文献:
[1] Martin SS, Aday AW, Almarzooq ZI, et al. 2024 heart disease and
stroke statistics: a report of US and global data from the American
heart association[J]. Circulation, 2024, 149(8): e347-60.
[2] Goette A, Auricchio A, Boriani G, et al. EHRA White Paper:
knowledge gaps in arrhythmia management-status 2019[J].
Europace, 2019, 21(7): 993-4.
[3] Thomas RJ. Cardiac rehabilitation-challenges, advances, and the
road ahead[J]. N Engl J Med, 2024, 390(9): 830-41.
[4] Kowey PR, Naccarelli GV. Antiarrhythmic drug therapy: where do
we go from here?[J]. Circulation, 2024, 149(11): 801-3.
[5] Nogami A, Kurita T, Abe H, et al. JCS/JHRS 2019 guideline on nonpharmacotherapy
of cardiac arrhythmias[J]. J Arrhythm, 2021, 37
(4): 709-870.
[6] Kingma J, Simard C, Drolet B. Overview of cardiac arrhythmias and
treatment strategies[J]. Pharmaceuticals, 2023, 16(6): 844.
[7] Fye WB. A history of the origin, evolution, and impact of
electrocardiography [J]. Am J Cardiol, 1994, 73(13):937-49.
[8] Jahmunah V, Oh SL, Wei JKE, et al. Computer-aided diagnosis of
congestive heart failure using ECG signals‑A review[J]. Phys Med,
2019, 62: 95-104.
[9] Oestereicher MA, Wotton JM, Ayabe S, et al. Comprehensive ECG
reference intervals in C57BL/6N substrains provide a generalizable
guide for cardiac electrophysiology studies in mice[J]. Mamm
Genome, 2023, 34(2): 180-99.
[10]Obergassel J, O'Reilly M, Sommerfeld LC, et al. Effects of genetic
background, sex, and age on murine atrial electrophysiology[J].
Europace, 2021, 23(6): 958-69.
[11]Haq KT, Cooper BL, Berk F, et al. The effect of sex and age on ex
vivo cardiac electrophysiology: insight from a guinea pig model[J].
Am J Physiol Heart Circ Physiol, 2023, 324(1): H141-54.
[12]Ahmadi P, Afzalian A, Jalali A, et al. Age and gender differences of
basic electrocardiographic values and abnormalities in the general
adult population; Tehran Cohort Study[J]. BMC Cardiovasc Disord,
2023, 23(1): 303.
[13]Xie M, Zhu SJ, Liu G, et al. A novel quantitative
electrocardiography strategy reveals the electroinhibitory effect of
tamoxifen on the mouse heart[J]. J Cardiovasc Transl Res, 2023, 16
(5): 1232-48.
[14] Jia BZ, Qi YT, Wong-Campos JD, et al. A bioelectrical phase
transition patterns the first vertebrate heartbeats[J]. Nature, 2023,
622(7981): 149-55.
[15]Levin M. Bioelectric signaling: Reprogrammable circuits
underlying embryogenesis, regeneration, and cancer[J]. Cell, 2021,
184(8): 1971-89.
[16]Gajendragadkar PR, von Ende A, Ibrahim M, et al. Assessment of
the causal relevance of ECG parameters for risk of atrial fibrillation:
a Mendelian randomisation study[J]. PLoS Med, 2021, 18(5):
e1003572.
[17]Amuzescu B, Airini R, Epureanu FB, et al. Evolution of
mathematical models of cardiomyocyte electrophysiology[J]. Math
Biosci, 2021, 334: 108567.
[18]Lawson BAJ, Drovandi CC, Cusimano N, et al. Unlocking data sets
by calibrating populations of models to data density: a study in atrial
electrophysiology[J]. Sci Adv, 2018, 4(1): e1701676.
[19]Morotti S, Liu C, Hegyi B, et al. Quantitative cross-species
translators of cardiac myocyte electrophysiology: model training,
experimental validation, and applications[J]. Sci Adv, 2021, 7(47):
eabg0927.
[20]Mazhar F, Bartolucci C, Regazzoni F, et al. A detailed mathematical
model of the human atrial cardiomyocyte: integration of
electrophysiology and cardiomechanics[J]. J Physiol, 2024, 602
(18): 4543-83.
[21]Ntalla I, Weng LC, Cartwright JH, et al. Multi-ancestry GWAS of
the electrocardiographic PR interval identifies 202 loci underlying
cardiac conduction[J]. Nat Commun, 2020, 11(1): 2542.
[22] van Duijvenboden S, Ramírez J, Young WJ, et al. Genomic and
pleiotropic analyses of resting QT interval identifies novel loci and
overlap with atrial electrical disorders[J]. Hum Mol Genet, 2021, 30
(24): 2513-23.
[23]Liu G, Iden JB, Kovithavongs K, et al. In vivo temporal and spatial
distribution of depolarization and repolarization and the illusive
murine T wave[J]. J Physiol, 2004, 555(Pt 1): 267-79.
[24]Rodrigues JC, McIntyre B, Dastidar AG, et al. The effect of obesity
on electrocardiographic detection of hypertensive left ventricular
hypertrophy: recalibration against cardiac magnetic resonance[J]. J
Hum Hypertens, 2016, 30(3): 197-203.
[25] de Coster M, Demolder A, de Meyer V, et al. Diagnostic accuracy of
R-wave detection by insertable cardiac monitors[J]. Pacing Clin
Electrophysiol, 2020, 43(5): 511-7.
[26]Ramírez J, van Duijvenboden S, Young WJ, et al. Common genetic
variants modulate the electrocardiographic tpeak-to-tend interval
[J]. Am J Hum Genet, 2020, 106(6): 764-78.
[27]Yogasundaram H, Zheng YG, Ly E, et al. Relationship between
baseline electrocardiographic measurements and outcomes in
patients with high-risk heart failure: insights from the VerICiguaT
Global Study in Subjects with Heart Failure with Reduced Ejection
Fraction (VICTORIA) trial[J]. Eur J Heart Fail, 2023, 25(10):
1822-30.
[28]Mayourian J, la Cava WG, Vaid A, et al. Pediatric ECG-based deep
learning to predict left ventricular dysfunction and remodeling[J].
Circulation, 2024, 149(12): 917-31.
[29]Ardissino M, Patel KHK, Rayes B, et al. Multiple anthropometric
measures and proarrhythmic 12-lead ECG indices: a Mendelian
randomization study[J]. PLoS Med, 2023, 20(8): e1004275.
[30]Chen LY, Ribeiro ALP, Platonov PG, et al. P wave parameters and
indices: a critical appraisal of clinical utility, challenges, and future
research-a consensus document endorsed by the international society
of electrocardiology and the international society for holter and
noninvasive electrocardiology[J]. Circ Arrhythm Electrophysiol,
2022, 15(4): e010435.
[31]Young WJ, Lahrouchi N, Isaacs A, et al. Genetic analyses of the
electrocardiographic QT interval and its components identify
additional loci and pathways[J]. Nat Commun, 2022, 13(1): 5144.
[32]Broman MT, Nadadur RD, Perez-Cervantes C, et al. A genomic link
from heart failure to atrial fibrillation risk: FOG2 modulates a TBX5/
GATA4-dependent atrial gene regulatory network[J]. Circulation,
2024, 149(15): 1205-30.
[33]Frimodt-Mamp;#xf; ller EK, Soliman EZ, Kizer JR, et al. Lifestyle
habits associated with cardiac conduction disease[J]. Eur Heart J,
2023, 44(12): 1058-66.
[34]Gottlieb LA, Larsen K, Halade GV, et al. Prolonged QT intervals in
mice with cardiomyocyte-specific deficiency of the molecular clock
[J]. Acta Physiol, 2021, 233(1): e13707.
[35]Calò L, Crescenzi C, Martino A, et al. The diagnostic value of the 12-
LeadECGin arrhythmogenic LeftVentricularCardiomyopathy: novel
ECG signs[J]. JACC Clin Electrophysiol, 2023, 9(12): 2615-27.
[36]Nam JM, Lim JE, Ha TW, et al. Cardiac-specific inactivation of
Prdm16 effects cardiac conduction abnormalities and
cardiomyopathy-associated phenotypes[J]. Am J Physiol Heart Circ
Physiol, 2020, 318(4): H764-77.
[37]Karakayali M, Artac I, Omar T, et al. Assessment of the efficacy of
the electrocardiographic P-wave peak time in predicting atrial high
rate episode in patients with cardiac implantable electronic devices
[J]. J Electrocardiol, 2023, 80: 40-4.
[38]Hennis K, Rötzer RD, Rilling J, et al. In vivo and ex vivo
electrophysiological study of the mouse heart to characterize the
cardiac conduction system, including atrial and ventricular
vulnerability[J]. Nat Protoc, 2022, 17(5): 1189-222.
[39] Litviňuková M, Talavera-López C, Maatz H, et al. Cells of the adult
human heart[J]. Nature, 2020, 588(7838): 466-72.
[40]Li Q, Lin ZW, Liu R, et al. Multimodal charting of molecular and
functional cell states via in situ electro-sequencing[J]. Cell, 2023,
186(9): 2002-17. e21.
[41] Jagannatha GNP, Antara IMPS, Kosasih AM, et al. P-wave peak
time and P-wave dispersion in surface electrocardiography as initial
predictors of new-onset atrial fibrillation in early-onset hypertension
[J]. Hypertens Res, 2024, 47(1): 137-48.
[42]Feeny AK, Rickard J, Trulock KM, et al. Machine learning of 12-
lead QRS waveforms to identify cardiac resynchronization therapy
patients with differential outcomes[J]. Circ Arrhythm
Electrophysiol, 2020, 13(7): e008210.
[43]Hnatkova K, Andršová I, Novotný T, et al. QRS microfragmentation
as a mortality predictor[J]. Eur Heart J, 2022, 43(40):
4177-91.
[44]Chen N, Wang L, Jiao JC, et al. RV1+RV3 index to differentiate
idiopathic ventricular arrhythmias arising from right ventricular
outflow tract and aortic sinus of Valsalva: a multicenter study[J]. J
Am Heart Assoc, 2024, 13(7): e033779.
[45]Wallet J, Kimura Y, Blom NA, et al. The R″ wave in V1 and the
negative terminal QRS vector in aVF combine to a novel 12-lead
ECG algorithm to identify slow conducting anatomical isthmus 3 in
patients with tetralogy of Fallot[J]. Europace, 2023, 25(6): euad139.
(编辑:林 萍)

