LncRNA MAGI2-AS3通过靶向调控miR-1269a/PTEN/AKT通路增强非小细胞肺癌对顺铂化疗的敏感性



摘要:目的 研究lncRNA MAGI2-AS3对非小细胞肺癌顺铂耐药的影响及其分子机制。方法 采用qRT-PCR 检测MAGI2-AS3和miR-1269a在顺铂敏感细胞(A549,H1299)和顺铂耐药细胞(A549/DDP,H1299/DDP)中的表达差异。采用慢病毒敲低A549和H1299 中的MAGI2-AS3 的表达,过表达A549/DDP 和H1299/DDP 中的MAGI2-AS3 并加入20 μmol/L 顺铂(DDP)处理。A549/DDP 和H1299/DDP 细胞实验分组为:OE-NC组,OE-MAGI2-AS3 组,OE-NC+DDP 组,OE-MAGI2-AS3+DDP 组,A549和H1299 细胞实验分组为:sh-NC组,sh-MAGI2-AS3 组,sh-NC+DDP组,sh-MAGI2-AS3+DDP组。CCK-8 和细胞克隆形成实验检测细胞存活率,流式细胞术和Western blotting分别检测细胞凋亡率和蛋白表达量,划痕实验和Transwell检测细胞EMT变化。通过网站GEPIA 、StarBase 和miRDB预测MAGI2-AS3、miR-1269a 和PTEN之间的靶向关系,并采用荧光素酶报告基因实验和RIP实验验证。采用miR-1269a mimic和pcDNA3.1-PTEN进行Rescue实验。结果 MAGI2-AS3 在肺癌组织中的表达显著低于正常癌旁组织(Plt;0.05)且与患者不良预后相关(Plt;0.05)。A549/DDP和H1299/DDP中的MAGI2-AS3表达量显著低于A549和H1299(Plt;0.01)。干扰MAGI2-AS3可以显著促进顺铂处理前、后A549和H1299细胞的存活及EMT进程(Plt;0.01),同时降低顺铂诱导的细胞凋亡(Plt;0.005)。过表达MAGI2-AS3可以显著抑制顺铂处理前、后A549/DDP和H1299/DDP细胞存活与EMT 进程(Plt;0.01),同时提升顺铂诱导的细胞凋亡(Plt;0.005)。MAGI2-AS3 与miR-1269a 结合在一起,miR-1269a 与PTEN 3'UTR结合。在A549/DDP细胞内MAGI2-AS3 通过靶向吸附miR-1269a 促进PTEN的表达并下调AKT磷酸化从而抑制顺铂刺激下细胞的EMT进程(Plt;0.01)、促进顺铂诱导的A549/DDP细胞凋亡(Plt;0.01)。结论 LncRNA MAGI2-AS3通过靶向调控miR-1269a/PTEN/AKT信号轴增强非小细胞肺癌对顺铂化疗的敏感性。
关键词:LncRNA MAGI2-AS3;miR-1269a;非小细胞肺癌;顺铂耐药
肺癌是一种严重威胁人类健康的恶性肿瘤。据2020 年最新统计数据显示,肺癌在各肿瘤类型中致死率最高[1],每年全球约180万人死于肺癌,并且其发生率也极高(11.4%),位于第2位。肺癌从组织学类型上可以分为两大类:小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。而非小细胞肺癌是最常见的类型,占肺癌患者的85%左右,其5年生存率低于15%[2]。目前针对非小细胞肺癌的有效治疗药物非常有限,顺铂是临床上治疗非小细胞肺癌常用的一线化疗药物[3],然而顺铂化疗耐药仍然是导致非小细胞肺癌复发和治疗效果差的主要原因[4],因此,研究顺铂耐药发生的机制并寻找针对顺铂耐药的靶分子对于临床上非小细胞肺癌的治疗至关重要。
LncRNAs 即长链非编码RNA,是一类长度大于200 nt 但是不编码蛋白的RNA分子。大量研究表明LncRNA在肿瘤的发生、发展和化疗耐药中发挥重要的作用[5, 6]。例如LncRNA FOXD3-AS1 通过调控miR-127-3p和MDM2促进非小细胞肺癌化疗抵抗[7];敲低肺腺癌细胞中Linc00173 后可以促进顺铂抵抗的发生[8];在非小细胞肺癌中通过抑制LncRNA SNHG14可以增强其对顺铂药物的敏感度[9]。LncRNA MAGI2-AS3是一种位于染色体7q21.11 上的新型lncRNA,已有文献证明lncRNA MAGI2-AS3可以抑制肝癌、卵巢癌、乳腺癌、胃癌、头颈癌等多种肿瘤的发展过程[10]。例如:lncRNA MAGI2-AS3 通过靶向miR-374b-5p/SMG1 信号通路抑制肝癌细胞增殖和迁移[11];lncRNA MAGI2-AS3通过miR-106a-5p/RAB31轴抑制去势抵抗性前列腺癌的增殖和迁移[12];lncRNA MAGI2-AS3 通过与miR-142-3p相互作用上调STAM抑制肾透明细胞癌的肿瘤进展[13]。但是LncRNA MAGI2-AS3对非小细胞肺癌顺铂耐药的作用尚未见报道。在本研究中,我们深入研究了MAGI2-AS3 在非小细胞肺癌顺铂耐药生物学过程中的作用,并揭示其分子机制。本研究为临床上克服非小细胞肺癌顺铂耐药提供了理论基础和科学依据。
1 材料和方法
1.1 材料
血清(Gibco),1640培液(凯基生物),RIPA裂解液和5×SDS蛋白上样缓冲液(碧云天生物公司),转染试剂脂质体3000(Thermo Fisher Scientific),过表达和干扰MAGI2-AS3的慢病毒(GenePharma),pCDNA3.1和pCDNA3.1-PTEN质粒(Genechem),miR-1269a mimic和miR-1269a Inhibitor(锐博生物),CCK8 试剂(诺唯赞),细胞内总RNA提取试剂TRIzol 和细胞核细胞质RNA分离提取试剂盒(Invitrogen),miRNA提取试剂盒(Omega),逆转录试剂盒和荧光定量PCR 试剂盒(Takara)。pmirGLO载体(Promega),Magna RIP RNA结合蛋白免疫沉淀试剂盒(Millipore)。AnnexinVFITC/PI凋亡检测试剂盒(凯基生物),荧光素酶报告基因实验检测试剂盒(碧云天),结晶紫(索莱宝),抗体Bax、N-cadherin、Vimentin、PTEN、β-Actin和HPR羊抗兔二抗购买自武汉爱博泰克生物公司,Bcl-2、Ecadherin、p-AKT、AKT(Cell Signaling Technology),Cleaved caspase-3 (Abcam),Transwell 小室插件(康宁公司),顺铂(Sigma)。
1.2 方法
1.2.1 细胞培养 本研究中使用的人源顺铂敏感型非小细胞肺癌细胞株A549、HCC827、NCI-H1299和人正常肺上皮细胞BEAS-2B均购自中国科学院细胞库。人源顺铂耐药型非小细胞肺癌细胞株A549/DDP购自江苏凯基生物公司,顺铂耐药细胞系H1299/DDP由本实验室前期采用顺铂药物浓度递增培养法构建。所有细胞均采用含10%血清的1640培养液,放置于含5%二氧化碳,37 ℃恒温培养箱进行培养。
1.2.2 细胞系构建 A549/DDP、H1299/DDP 细胞系中过表达MAGI2-AS3,实验分组为:OE-NC、OE-MAGI2-AS3。A549、H1299 细胞系干扰MAGI2-AS3 的表达,实验分组为:sh-NC、sh-MAGI2-AS3。将对数生长期的各组细胞接种于6 孔板内,细胞贴壁后,每孔分别加入30 μL携带过表达或干扰MAGI2-AS3基因及其阴性对照的慢病毒悬液,72 h后加入嘌呤霉素持续筛选1周,采用定量PCR检测MAGI2-AS3 表达。即获得稳定过表达MAGI2-AS3及其对照组的A549/DDP、H1299/DDP细胞系,稳定干扰MAGI2-AS3 及其对照组的A549、H1299细胞系。
1.2.3 CCK-8实验 将对数生长期的各组A549、H1299细胞和A549/DDP、H1299/DDP细胞接种到96孔板内,每孔5000个细胞,给予20 μmol/L顺铂药物刺激,实验分组为:A549/DDP与H1299/DDP细胞系:OE-NC、OEMAGI2-AS3、OE-NC+DDP、OE-MAGI2-AS3+DDP。A549 与H1299 细胞系:sh-NC、sh-MAGI2-AS3、sh-NC+DDP、sh-MAGI2-AS3+DDP。培养48 h后,每孔加入10 μL的CCK-8试剂37 ℃孵育2 h,采用多功能酶标仪在450 nm检测吸光度值(A450 nm),最后统计分析各组细胞存活率。细胞存活率计算公式为:
1.2.4 细胞克隆形成实验 实验分组与CCK-8 实验相同。将对数生长期的各组A549细胞和A549/DDP细胞接种到6 孔板内,每孔接种500 个,按照上述CCK-8 实验分组处理。之后细胞持续培养2 周后,将培液弃掉,PBS清洗2次后,加入结晶紫染色15 min。拍照后统计细胞克隆数目。
1.2.5 划痕实验 实验分组与CCK-8 实验相同。对数生长期的各组细胞接种到6孔板内,细胞长满皿底后用枪头划痕,PBS清洗后加入新的无血清的培养基,放入37 ℃培养箱中继续培养,分别于0 h和24 h用倒置显微镜(OLYMPUS)拍照记录划痕愈合情况。采用ImageJpro Plus 软件统计分析细胞相对迁移率。
1.2.6 细胞凋亡实验 检测MAGI2-AS3 对顺铂诱导的NSCLC细胞凋亡的影响实验分组与CCK8 实验相同。转入miR-1269a mimic 进行Rescue 实验,实验分组为:OE-NC+DDP、OE-MAGI2-AS3+DDP、OEMAGI2-AS3+miR-NC+DDP、OE-MAGI2-AS3+miR-1269a mimic+DDP。同时转入miR-1269a mimic 和pcDNA3.1-PTEN质粒进行Rescue 实验,实验分组为:OE-NC+DDP 组、OE-MAGI2-AS3+DDP 组、OEMAGI2-AS3+miR-1269a mimic+DDP组、OE-MAGI2-AS3+miR-1269a mimic+pcDNA3.1-PTEN+DDP 组。将对数生长期的各组A549细胞和A549/DDP细胞接种到6孔板内,按照分组处理后收集细胞,PBS清洗2次,离心后弃上清,加入500 μL binding buffer重悬细胞,之后分别加入5 μL AnnexinV FITC试剂和5 μL PI 试剂,充分混匀后避光孵育20 min,采用流式细胞仪(BD)检测细胞凋亡率。
1.2.7 Western blotting实验 实验分组与细胞凋亡实验相同。将对数生长期的各组细胞接种到6孔板内,按照上述分组处理细胞,之后加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,将细胞放置到冰上裂解30 min,裂解完成后收集裂解液,加入5×SDS蛋白上样缓冲液,混匀后放置到金属浴内95 ℃变性5 min。采用SDS-PAGE 凝胶电泳,之后将蛋白转移到PVDF 膜上,然后用5 %脱脂奶封闭1 h,TBST缓冲液清洗3次后孵育一抗,4 ℃过夜。TBST清洗后室温孵育二抗2 h,最后涂上ECL化学发光液,放到全自动成像分析系统里成像。采用ImageJ软件定量分析蛋白表达量。
1.2.8 Transwell实验 实验分组与细胞凋亡实验相同。将基质胶用无血清培养基稀释,取100 μL基质胶加入小室底部,于37 ℃放置2 h,待基质胶凝固后,在小室内加入200 μL含有8万个细胞的无血清培养基,在小室外24孔板内每孔加入500 μL 15%血清的培液,37 ℃培养24 h后,将小室取出,用PBS清洗后,加入4%多聚甲醛固定15 min;之后采用结晶紫染色10 min,用蒸馏水漂洗后,放置于倒置显微镜下进行拍照并统计分析各组细胞侵袭率。
1.2.9 细胞转染 实验分组分别为:miR-NC、1269amimic、Inh-NC、miR-1269a inhibitor;pCDNA-3.1,pCDNA-3.1-PTEN,将对数生长期的A549/DDP细胞接种于6 孔板,之后将质粒与脂质体3000 试剂和300 μL无血清培液混匀,室温孵育5 min后均匀滴加到6孔板内,轻轻晃匀后放置于培养箱内,6 h后更换培液,转染24 h后即可进行后续实验。
1.2.10 qRT-PCR实验 实验分组与细胞转染实验相同,分别用TRIzol试剂提取细胞内总的RNA,采用miRNA试剂盒提取细胞内的miRNA,采用细胞核细胞质RNA分离提取试剂盒分离提取核质中的RNA。之后采用逆转录试剂盒将RNA逆转录成cDNA。按照实时荧光定量PCR试剂盒说明书进行配制PCR反应体系,将其放置于荧光定量PCR仪(Applied Biosystems)内进行检测。PCR所采用的引物均由通用生物公司合成,序列如表1所示:
1.2.11 荧光素酶报告基因实验 将携带野生型和突变型的MAGI2-AS3 序列的pmirGLO 载体分别与miR-1269a mimic 及mimic NC 在脂质体3000 的作用下共转染到细胞内,实验分组为:MAGI2-AS3-WT+mimic NC、MAGI2-AS3-WT+miR-1269a mimic、MAGI2-AS3-MUT+mimic NC、MAGI2-AS3-MUT+miR-1269a mimic。将携带野生型和突变型PTEN-3'UTR序列的pmirGLO载体分别与miR-1269a mimic及mimic NC 共转染到细胞内,实验分组为:PTENWT+mimic NC、PTEN-WT+miR-1269a mimic、PTENMUT+mimic NC、PTEN-MUT+miR-1269a mimic。48 h后采用荧光素酶报告基因实验试剂盒和多功能酶标仪检测结果。
1.2.12 RNA免疫共沉淀实验(RIP) 使用Magna RIPRNA结合蛋白免疫沉淀试剂盒进行RIP实验。细胞采用含有蛋白酶抑制剂和RNA酶抑制剂的RIPA裂解液进行裂解,离心后将上清液与含有抗Ago2抗体或阴性对照抗IgG 磁珠的缓冲液孵育过夜。免疫共沉淀的RNA 经磁珠纯化后,qRT-PCR 检测MAGI2-AS3 和miR-1269a 的相对富集情况。实验分组为:Input 组、IgG组,AGO组。
1.2.13 生物信息学分析 利用GEPIA 数据库(http://gepia.cancer-pku.cn/)分析肺癌组织和癌旁正常组织中MAGI2-AS3的表达差异,MAGI2-AS3与PTEN表达水平的相关性,以及MAGI2-AS3 与肺癌患者预后的关系。通过StarBase 数据库(http//starbase.sysu.edu.cn/)预测分析MAGI2-AS3与miR-1269a的靶向结合序列。利用miRDB 数据库(https://mirdb. org/)预测分析miR-1269a与PTEN的靶向结合序列。
1.3 统计学分析
使用GraphPad Prism 6.0进行统计分析,采用excel作图,计量资料以均数±标准差表示,组间差异使用t检验进行分析。Plt;0.05即被认为差异有统计学意义。
2 结果
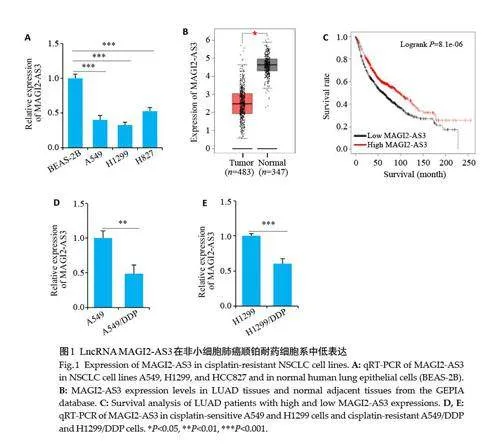
2.1 LncRNA MAGI2-AS3在非小细胞肺癌顺铂耐药细胞系中低表达
qRT-PCR 实验结果(图1A)显示,MAGI2-AS3 在非小细胞肺癌细胞(A549、H1299、HCC827)中的表达量显著低于人正常肺上皮细胞BEAS-2B(Plt;0.001)。GEPIA 数据库的分析结果同样表明在肺癌组织中MAGI2-AS3 的表达水平相对于正常癌旁组织显著降低(Plt;0.05,图1B)。此外,肺癌患者生存预后分析结果表明MAGI2-AS3表达越低肺癌患者的预后越差(Plt;0.05,图1C)。qRT-PCR结果显示MAGI2-AS3 在顺铂耐药细胞系A549/DDP、H1299/DDP 中的表达量显著低于顺铂敏感细胞系A549和H1299(Plt;0.01,图1D、E)。
2.2 LncRNA MAGI2-AS3增强非小细胞肺癌对顺铂化疗的敏感性
通过慢病毒感染细胞系后,qRT-PCR检测结果显示在A549/DDP、H1299/DDP 细胞中OE-MAGI2-AS3组的MAGI2-AS3表达量显著高于对照组OE-NC(图2A、E,Plt;0.001)。在A549和H1299细胞中sh-MAGI2-AS3组的MAGI2-AS3 表达量显著低于对照组sh-NC(图2B、F,Plt;0.01)。在A549/DDP和H1299/DDP细胞中与对照组相比过表达MAGI2-AS3 后显著抑制顺铂处理前、后细胞存活(Plt;0.01,图2C、G、I、J),相反在A549和H1299 细胞中(图2D、H~J),与对照组相比干扰MAGI2-AS3 后显著提升顺铂处理前、后细胞存活率(Plt;0.01)。在A549 和H1299 细胞内干扰MAGI2-AS3后可以显著降低顺铂诱导的细胞凋亡(Plt;0.005,图2K、L),相反在A549/DDP和H1299/DDP细胞内,过表达MAGI2-AS3 后可以显著提升顺铂诱导的细胞凋亡(Plt;0.001)。在A549/DDP 细胞内过表达MAGI2-AS3后可以显著增加顺铂处理前、后细胞促凋亡相关蛋白Bax、Cleaved caspase3的表达(Plt;0.01,图2M~P),同时显著降低抗凋亡蛋白Bcl-2的表达(Plt;0.01)。
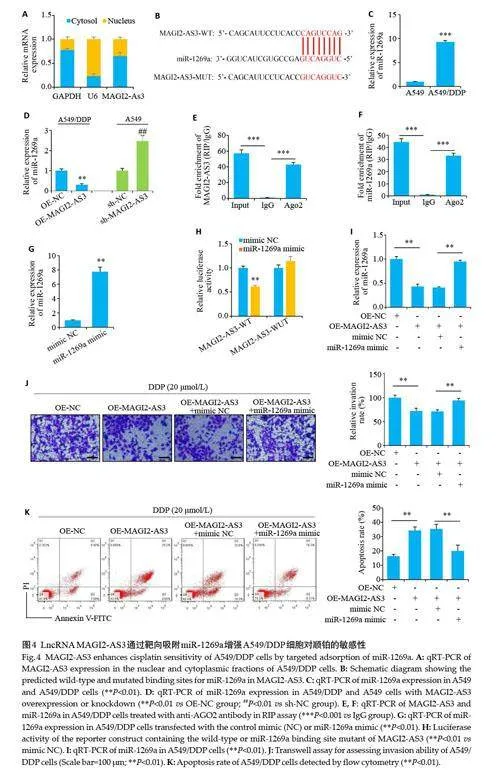
2.3 LncRNA MAGI2-AS3 抑制非小细胞肺癌EMT进程
与对照组相比过表达MAGI2-AS3 可以显著抑制顺铂处理前、后A549/DDP和H1299/DDP细胞的迁移、侵袭能力(Plt;0.01,图3A、C、E、F、I)。相反干扰MAGI2-AS3 的表达可以显著增强顺铂处理前、后A549 细胞的迁移、侵袭能力(Plt;0.01,图3B、D、G、H、J)。过表达MAGI2-AS3 后可以显著增加顺铂处理前、后A549/DDP 细胞内上皮细胞标志蛋白E-cadherin 的表达(Plt;0.01,图3K~N),同时显著降低间充质细胞标志蛋白Ncadherin、Vimentin 的表达(Plt;0.01)。以上结果表明过表达MAGI2-AS3显著抑制顺铂耐药细胞系A549/DDP和H1299/DDP的EMT进程。
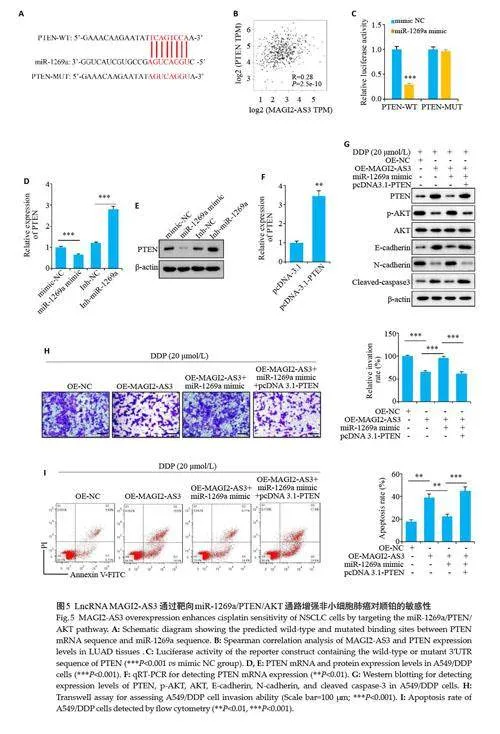
2.4 LncRNA MAGI2-AS3通过靶向吸附miR-1269a增强非小细胞肺癌对顺铂的敏感性。
细胞核质RNA分离提取后进行的PCR实验结果显示MAGI2-AS3 在细胞核、质中均有分布(图4A)。StarBase网站预测结果表明MAGI2-AS3与miR-1269a直接结合(图4B)。qRT-PCR的结果显示在A549/DDP细胞内miR-1269a的表达显著高于A549细胞系(图4C,Plt;0.005),并且在A549/DDP 细胞内过表达MAGI2-AS3 显著抑制miR-1269a 的表达(Plt;0.01);相反在A549 细胞内干扰MAGI2-AS3 显著促进miR-1269a的表达(Plt;0.01)。RIP实验结果表明在A549/DDP细胞内MAGI2-AS3 与miR-1269a 相互结合在一起(图4E、F,Plt;0.005)。在A549/DDP细胞内转入miR-1269a mimic后与对照组相比miR-1269a mimic 组细胞内miR-1269a表达显著提升(图4G,Plt;0.01)。相对于对照组,miR-1269a 过表达后携带野生型MAGI2-AS3 载体的荧光素酶活性显著被抑制(Plt;0.01,图4H),而对突变型MAGI2-AS3 载体的荧光素酶活性没有影响。通过在过表达MAGI2-AS3 的A549/DDP 细胞内转入mimicmiR-1269a,qRT-PCR(图4I)、Transwell(图4J)和凋亡实验(图4K)均显示在A549/DDP细胞内过表达MAGI2-AS3 后显著抑制miR-1269a 的表达和细胞侵袭能力(Plt;0.01)、显著提升顺铂诱导的细胞凋亡率(Plt;0.01),转入miR-1269a mimic 后miR-1269a 的表达量和细胞侵袭能力显著回升(Plt;0.01)、顺铂诱导的细胞凋亡率显著下降(Plt;0.01)。以上结果表明LncRNA MAGI2-AS3 通过靶向吸附miR-1269a 增强A549/DDP 细胞对顺铂的敏感性。
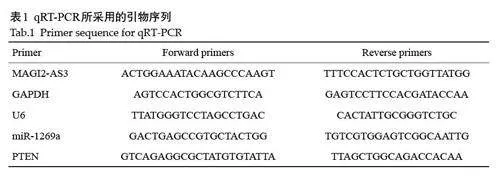
2.5 LncRNA MAGI2-AS3 通过靶向miR-1269a/PTEN/AKT 通路增强非小细胞肺癌对顺铂的敏感性。
通过miRDB网站预测miR-1269a 的靶基因,发现miR-1269a 与PTEN 3'-UTR区域结合(图5A),GEPIA数据库的分析结果表明在肺癌组织中MAGI2-AS3 的表达与PTEN的表达成正相关(Plt;0.01,图5B)。相对于阴性对照组miR-1269a 过表达后携带PTEN-WT载体的荧光素酶活性显著被抑制(Plt;0.005,图5C),而miR-1269a对PTEN-MUT的荧光素酶活性没有影响。qRTPCR和Western blotting结果显示,在A549/DDP细胞内相对于mimic NC组过表达miR-1269a显著抑制PTEN的mRNA和蛋白表达,而对于对照组(Inh-NC)干扰miR-1269a显著促进PTEN的mRNA和蛋白表达(图5D、E)。A549/DDP在顺铂刺激下,过表达MAGI2-AS3 显著促进PTEN、E-cadherin、Cleaved caspase3 的表达,且抑制p-AKT、N-cadherin 的表达;当过表达miR-1269a 后MAGI2-AS3对这些蛋白的作用显著被削弱;而相比于DDP+OE-MAGI2-AS3+miR-1269a mimic 组,DDP+OE-MAGI2-AS3+miR-1269a mimic+pcDNA3.1-PTEN组的PTEN、E-cadherin、Cleaved caspase3 表达量显著回升,p-AKT、N-cadherin的表达显著降低(图5C)。顺铂刺激下,A549/DDP细胞内过表达MAGI2-AS3 后显著抑制细胞的侵袭能力并且显著提升顺铂诱导的细胞凋亡(Plt;0.01,图5H、I);当过表达miR-1269a 后MAGI2-AS3 对细胞侵袭的抑制作用和对凋亡的促进作用显著被削弱(Plt;0.01);相比于DDP+OE-MAGI2-AS3+miR-1269a mimic 组,DDP+OE-MAGI2-AS3+miR-1269a mimic+pcDNA3.0-PTEN 组的细胞侵袭能力显著降低并且细胞凋亡率显著回升(Plt;0.01)。
3 讨论
本研究首次发现MAGI2-AS3 在顺铂耐药A549/DDP 和H1299/DDP 细胞内的表达量显著低于顺铂敏感型A549 和H1299 细胞系,此外MAGI2-AS3 在肺癌组织中的表达量显著低于正常癌旁组织,生存分析结果表明MAGI2-AS3的表达量越低患者的生存时间越短。根据这些结果我们推测MAGI2-AS3 很可能在非小细胞肺癌顺铂耐药进程中发挥着重要的调控作用。CCK8、细胞克隆形成实验结果表明过表达MAGI2-AS3 可以显著降低顺铂作用下A549/DDP 和H1299/DDP细胞的存活率,干扰MAGI2-AS3可以显著提升顺铂作用下A549 和H1299 细胞的存活率。此外凋亡检测结果表明过表达MAGI2-AS3 可以显著提升顺铂诱导A549/DDP和H1299/DDP的凋亡,干扰MAGI2-AS3可以降低顺铂诱导A549 和H1299 细胞的凋亡。我们初步确定过表达MAGI2-AS3 可以增强A549/DDP 和H1299/DDP对顺铂的敏感性。
细胞上皮-间充质转化 (EMT) 是指细胞失去上皮样细胞极性逐渐转变成间充质细胞的特性。EMT发生时细胞间的粘附性降低并且细胞迁移侵袭能力增强,此外上皮样细胞标志E-cadherin、ZO-1等蛋白的表达量显著降低,而间充质标志N-cadherin、Vimentin 等蛋白的表达量显著增高[14],大量研究表明肿瘤细胞EMT进程促进顺铂耐药的发生[15, 16],MAGI2-AS3对NSCLC细胞EMT进程的影响目前没有人报道,我们的研究结果表明MAGI2-AS3 过表达显著抑制顺铂处理前、后A549/DDP 和H1299/DDP 细胞的迁移侵袭能力,并且Western blot 结果表明在A549/DDP 细胞内过表达MAGI2-AS3 后可以显著增加E-cadherin 的表达,同时显著降低N-cadherin、Vimentin 的表达,这些结果表明MAGI2-AS3显著抑制A549/DDP细胞的EMT进程,基于此我们猜测MAGI2-AS3 可能通过抑制A549/DDP细胞EMT进程增强其对顺铂化疗的敏感性,但具体的机制有待进一步深入研究。文献报道细胞质中的LncRNA 通常可以靶向吸附miRNA来发挥生物学调控作用[17],我们发现 MAGI2-AS3 在细胞质内有分布,StarBase预测结果、RIP实验和双荧光素酶报告基因实验的结果同时证明了在A549/DDP 细胞内,MAGI2-AS3 与miR-1269a 结合在一起。miR-1269a 在多种肿瘤细胞中高表达且促进肿瘤的增殖和转移等恶性发展进程[18, 19]。我们的研究结果发现在A549/DDP细胞内,miR-1269a 的表达显著高于A549 细胞系。过表达MAGI2-AS3 后可以显著降低A549/DDP 细胞内miR-1269a的水平,同时显著抑制细胞的侵袭能力,并且显著提升顺铂诱导的细胞凋亡率,但是转入miR-1269amimic后细胞侵袭能力显著回升,顺铂诱导的凋亡率也显著降低。以上结果表明MAGI2-AS3 通过靶向吸附miR-1269a 增强A549/DDP 细胞对顺铂的敏感性。PTEN即第10号染色体缺失的磷酸酶及张力蛋白同源基因,是细胞内一种重要的抑癌基因,PTEN通过去磷酸化三磷酸肌醇(PIP3)抑制AKT的活化[20, 21]。AKT信号通路异常激活与非小细胞肺癌顺铂耐药的发生密切相关[22],研究表明在NSCLC 中一些miRNA 通过与PTEN的3'-UTR区域结合靶向抑制PTEN表达从而激活AKT 通路导致顺铂耐药的发生[23-25]。我们通过miRDB网站预测miR-1269a的靶基因,发现miR-1269a的碱基序列与PTEN 3'-UTR区域结合,同时GEPIA网站的分析结果表明在肺癌组织中MAGI2-AS3 的表达与PTEN的表达呈正向关,这提示我们miR-1269a很可能直接与PTEN 3'-UTR区域结合抑制PTEN表达。荧光素酶报告基因实验结果、qPCR和Western 结果表明在A549/DDP 细胞内miR-1269a 靶向抑制PTEN的转录水平、蛋白水平表达。我们的实验结果表明在A549/DDP细胞内,MAGI2-AS3通过靶向吸附miR-1269a促进PTEN 的表达,抑制AKT 磷酸化。通过转入pcDNA3.1-PTEN质粒后进行的回复实验进一步证明MAGI2-AS3 通过靶向调控miR-1269a/PTEN/AKT 信号轴抑制顺铂刺激下细胞的EMT进程、促进顺铂诱导的细胞凋亡。
综上所述,本研究证明过表达lncRNA MAGI2-AS3能够有效地抑制NSCLC顺铂耐药细胞的EMT进程和细胞存活,并且显著提升NSCLC顺铂耐药细胞凋亡率。LncRNA MAGI2-AS3 通过靶向调控miR-1269a/PTEN/AKT信号轴增强A549/DDP 细胞对顺铂的敏感性。本研究阐明了lncRNA MAGI2-AS3逆转非小细胞肺癌顺铂耐药的具体分子机制,为临床上克服非小细胞肺癌顺铂耐药提供了新的思路和实验依据。
参考文献:
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:
GLOBOCAN estimates of incidence and mortality worldwide for 36
cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[2] Herbst RS, Morgensztern D, Boshoff C. The biology and
management of non-small cell lung cancer[J]. Nature, 2018, 553
(7689): 446-54.
[3] Pan XF, Chen Y, Shen YZ, et al. Knockdown of TRIM65 inhibits
autophagy and cisplatin resistance in A549/DDP cells by regulating
miR-138-5p/ATG7[J]. Cell Death Dis, 2019, 10(6): 429.
[4] Kryczka J, Kryczka J, Czarnecka-Chrebelska KH, et al. Molecular
mechanisms of chemoresistance induced by cisplatin in NSCLC
cancer therapy[J]. Int J Mol Sci, 2021, 22(16): 8885.
[5] Lin J, Liao SS, Liu ZW, et al. LncRNA FGD5-AS1 accelerates cell
proliferation in pancreatic cancer by regulating miR-520a-3p/
KIAA1522 axis[J]. Cancer Biol Ther, 2021, 22(3): 257-66.
[6] Peng Y, Tang DH, Zhao M, et al. Long non-coding RNA: a recently
accentuated molecule in chemoresistance in cancer[J]. Cancer
Metastasis Rev, 2020, 39(3): 825-35.
[7] Zeng ZL, Zhao GF, Zhu HK, et al. LncRNA FOXD3-AS1 promoted
chemo-resistance of NSCLC cells via directly acting on miR-127-3p/
MDM2 axis[J]. Cancer Cell Int, 2020, 20: 350.
[8] Tao XY, Li Y, Fan SQ, et al. Downregulation of Linc00173 increases
BCL2 mRNA stability via the miR-1275/PROCA1/ZFP36L2 axis
and induces acquired cisplatin resistance of lung adenocarcinoma
[J]. J Exp Clin Cancer Res, 2023, 42(1): 12.
[9] Jiao PF, Hou JN, Yao MY, et al. SNHG14 silencing suppresses the
progression and promotes cisplatin sensitivity in non-small cell lung
cancer[J]. Biomedecine Pharmacother, 2019, 117: 109164.
[10]Liu KX, Cheng C, Li R, et al. Roles of lncRNA MAGI2-AS3 in
human cancers[J]. Biomedecine Pharmacother, 2021, 141: 111812.
[11]Yin Z, Ma TT, Yan JH, et al. LncRNA MAGI2-AS3 inhibits
hepatocellular carcinoma cell proliferation and migration by
targeting the miR-374b-5p/SMG1 signaling pathway[J]. J Cell
Physiol, 2019, 234(10): 18825-36.
[12]Yang G, Li T, Liu JY, et al. lncRNA MAGI2-AS3 suppresses
castration-resistant prostate cancer proliferation and migration via
the miR-106a-5p/RAB31 axis[J]. Genomics, 2023, 115(2): 110599.
[13]Yang RW, Chen ZD, Ao S, et al. LncRNA MAGI2-AS3 inhibites
tumor progression by up-regulating STAM via interacting with miR-
142-3p in clear cell renal cell carcinoma[J]. Cell Signal, 2024, 113:
110954.
[14]Luo J, Yao JF, Deng XF, et al. 14, 15-EET induces breast cancer cell
EMT and cisplatin resistance by up-regulating integrin αvβ3 and
activating FAK/PI3K/AKT signaling[J]. J Exp Clin Cancer Res,
2018, 37(1): 23.
[15]Han ML, Zhao YF, Tan CH, et al. Cathepsin L upregulation-induced
EMT phenotype is associated with the acquisition of cisplatin or
paclitaxel resistance in A549 cells[J]. Acta Pharmacol Sin, 2016, 37
(12): 1606-22.
[16]Ashrafizadeh M, Zarrabi A, Hushmandi K, et al. Association of the
epithelial-mesenchymal transition (EMT) with cisplatin resistance
[J]. Int J Mol Sci, 2020, 21(11): 4002.
[17]Wang F, Zu YW, Zhu SB, et al. Long noncoding RNA MAGI2-AS3
regulates CCDC19 expression by sponging miR-15b-5p and
suppresses bladder cancer progression[J]. Biochem Biophys Res
Commun, 2018, 507(1/2/3/4): 231-5.
[18]Bu PC, Wang LH, Chen KY, et al. MiR-1269 promotes metastasis
and forms a positive feedback loop with TGF-Β[J]. Nat Commun,
2015, 6: 6879.
[19]Guo CX, Shi HM, Shang YL, et al. LncRNA LINC00261
overexpression suppresses the growth and metastasis of lung cancer
via regulating miR-1269a/FOXO1 axis[J]. Cancer Cell Int, 2020,
20: 275.
[20]Haddadi N, Lin YG, Travis G, et al. PTEN/PTENP1: 'Regulating the
regulator of RTK-dependent PI3K/Akt signalling', new targets for
cancer therapy[J]. Mol Cancer, 2018, 17(1): 37.
[21]Worby CA, Dixon JE. PTEN[J]. Annu Rev Biochem, 2014, 83:
641-69.
[22]张 雨, 陆红玲, 徐 刚. PI3K/AKT通路在非小细胞肺癌顺铂耐药中的
作用[J]. 中国肺癌杂志, 2014, 17(8): 635-42.
[23]Shi L, Zhu WL, Huang YY, et al. Cancer-associated fibroblastderived
exosomal microRNA-20a suppresses the PTEN/PI3K-AKT
pathway to promote the progression and chemoresistance of nonsmall
cell lung cancer[J]. Clin Transl Med, 2022, 12(7): e989.
[24]Sun BT, Hu NJ, Cong D, et al. MicroRNA-25-3p promotes cisplatin
resistance in Non-small-cell lung carcinoma (NSCLC) through
adjusting PTEN/PI3K/AKT route[J]. Bioengineered, 2021, 12(1):
3219-28.
[25]Xing SJ, Qu Y, Li CY, et al. Deregulation of lncRNA-AC078883.3
and microRNA-19a is involved in the development of
chemoresistance to cisplatin via modulating signaling pathway of
PTEN/AKT[J]. J Cell Physiol, 2019, 234(12): 22657-65.
(编辑:吴锦雅)

