分泌型PD-1抗体可提高c-Met CAR-T细胞对胰腺癌细胞的杀伤作用

摘要:目的 设计并制备能够分泌PD-1抗体和靶向c-Met的CAR-T细胞,以消除肿瘤对CAR-T细胞的免疫抑制作用,从而提高CAR-T细胞对胰腺癌的治疗效果。方法 采用Kaplan-Meier Plotter、GEPIA和Timer2.0生物信息学数据库,分析c-Met在胰腺癌中的表达、生存期及免疫浸润。免疫组化检测胰腺癌临床样本c-Met和PD-L1表达,流式细胞术验证胰腺癌细胞Aspc-1 c-Met和PD-L1表达通过基因编辑将PD-1分泌型抗体和HIS标签连接至2代c-Met CAR分子后,构建PD-1/c-Met CAR质粒并包被慢病毒,慢病毒感染至活化T细胞内,通过流式细胞技术检测CAR-T阳性率和细胞亚群;Western blotting检测分泌型PD-1抗体在细胞上清液中的存在;体外功能试验中,通过LDH释放实验检测CAR-T对靶细胞的杀伤效率,CCK-8检测靶细胞存在下PD-1抗体对CAR-T增殖的促进作用。ELISA检测PD-1/c-Met CAR-T和c-Met CAR-T活化后细胞因子的分泌量。结果 生信分析结果显示,胰腺癌组织c-Met表达高于正常组织(Plt;0.01);c-Met表达水平与胰腺癌患者生存期呈负相关(Plt;0.01)。c-Met的表达可能与多种免疫细胞浸润成正相关。免疫组化结果显示,胰腺癌c-Met和PD-L1 表达均高于癌旁组织(Plt;0.01);流式细胞术结果显示,Aspc-1细胞c-Met和PD-L1表达量为90.7%和57.7%,琼脂糖凝胶电泳显示成功制备四代PD-1/c-Met CAR分子;流式细胞术和Western blotting显示,成功构建PD-1/c-Met CAR-T且PD-1抗体可顺利分泌。体外功能验证中LDH结果显示,PD-1/c-Met CART对肿瘤细胞杀伤效率在效靶比为20:1 时高于c-Met CAR-T(Plt;0.01);CCK-8 实验结果显示,靶细胞刺激72 h 后增殖效率高于c-Met CAR-T(Plt;0.01); ELISA结果显示,PD-1/c-Met CAR-T分泌的细胞因子IL-2和TNF-α高于c-Met CAR-T(Plt;0.01)。结论 PD-1抗体分泌型c-Met CAR-T可成功构建,并在体外胰腺癌细胞上显示出优于c-Met CAR-T肿瘤杀伤效率和增殖效率。
关键词:嵌合抗原受体T细胞;c-Met;PD-1 分泌型抗体;胰腺癌
胰腺癌在胰腺恶性肿瘤中占比达90%以上[1],胰腺癌发病率在恶性肿瘤中排名第7[2],存活率极低[3]。传统手术及放化疗等手段不能有效提高患者的生存时间[4,5],亟需探索出有效的治疗手段。近年来嵌合抗原受体T细胞疗法(CAR-T)在癌症治疗领域备受关注,针对急性淋巴细胞白血病的CD19 特异性CAR-T 已被批准用于临床[6],但在实体瘤领域CAR-T研究尚需探索出合适的肿瘤相关性抗原[7],并克服肿瘤微环境及物理屏障[8-10]。
c-Met是肝细胞生长因子(HGF)受体,异常激活激可启动下游通路通路从而调控癌细胞的增殖、侵袭和迁移。c-MET的异常表达与肺癌、乳腺癌、膀胱癌、胃癌等肿瘤的预后不良相关,据报道,在胰腺癌患者中,c-MET的高表达表达与患者生存期降低[11]相关。有研究表明,c-MET异常激活与吉西他滨疗法[12]的耐药性、肿瘤迁移[13]及胰腺癌中血管生成因子[14]的分泌均成正相关,c-MET靶向药的临床前试验证明使用HGF/c-MET抑制剂可降低癌细胞分泌TGF-β,从而增加CD4+T细胞浸润。故c-Met是有效的胰腺癌治疗的肿瘤标志物。
本课题组前期研究发现,c-Met是CAR-T治疗部分实体瘤安全有效的靶点[15, 16],但第2代CAR-T对靶细胞的杀伤过程中常伴随不同程度的效应细胞耗竭现象。PD-(L)1、CTLA-4 和TIM-3 等抑制性免疫分子可通过上调衰竭表型抑制T细胞免疫应答[17-19],PD‑1/PD‑L1轴是‑已知的免疫检查点抑制剂通路。其中T细胞表面的PD-1 分子与肿瘤细胞表面PD-L1 结合产生抑制信号,阻止T细胞活化,使肿瘤细胞逃脱免疫系统[20, 21]的监控,目前阻断PD-(L)1 通路的抑制剂已普遍应用于临床[22, 23]。因此提出假设,利用检查点阻断可以通过克服免疫抑制性分子来提高CAR-T的治疗效果[24, 25]。现阶段将PD‑1/PD‑L1 通路阻断与CAR-T相结合的方式主要为:将PD‑1/PD‑L1抗体与肿瘤相关性抗原串联表达;在CAR-T的基因中敲除CAR-T的PD-1位点。这两种方式的缺点在于CAR-T胞外区同时结合两个细胞,空间构造可能不匹配,以及敲除PD-1和构建CAR-T的阳性率不能完全重合。考虑到输注人体后CAR-T细胞运输到肿瘤局部,PD-1阻断scFvs将被局部递送到疾病部位,从而最大限度地减少与免疫检查点阻断相关的毒性。目前PD-1 分泌型抗体结合在CAR分子上的研究较少,且尚未见应用于胰腺癌治疗中的报道。
本研究为突破目前胰腺癌免疫治疗疗效不佳的局限,验证胰腺癌c-Met和PD-1抗体联合治疗适用性,探讨PD-1分泌型抗体能否提高c-Met CAR-T对胰腺癌的有效肿瘤抑制作用。本研究在前期2 代c-Met CAR-T的基础上设计第4代PD-1抗体分泌型c-Met CAR-T,验证了胰腺癌细胞上c-Met和PD-L1的高表达,在胰腺癌细胞模型中探索了PD-1 抗体是否可以被CAR-T稳定分泌并提高其抗肿瘤活性。本研究将为胰腺癌的免疫检查点阻断与CAR-T疗法联合运用提供实验基础。
1 材料和方法
1.1 材料
Aspc-1 细胞(中国科学院细胞库),人淋巴细胞分离液(索莱宝),白细胞介素2(IL-2,北京同立海源生物),鼠抗人CD3-APC、CD4-PE、CD8-Per/Pc5.5、c-Met-FITC和PD-L1-PE抗体(赛默飞),RPMI 1640 培养基、胎牛血清(Gibco),CD3/CD28激活抗体、Retronectin浓缩液(吉凯基因),限制性内切酶、LDH释放试剂盒(碧云天)。CCK-8 试剂(BIOSHARP),ELISA试剂盒(上海酶联生物)。
1.2 方法
1.2.1 生物信息学分析 通过GEPIA数据库比较肿瘤组织与正常组织之间c-Met蛋白的表达,比较文献中常见CAR-T的胰腺癌靶点与c-Met的特异性。检查c-Met在每个病理阶段的表达差异(基因表达交互式分析)(http://gepia. cancer-pku. cn/);采用在线工具Kaplan-Meier Plotter(www.kmplot.com)评估c-Met 表达对肺癌预后价值的影响,采用Kaplan-meier 生存曲线分析c-Met 对肺癌患者的总生存率(OS)、首次进展生存期(FP)和进展生存期(PPS),分析c-Met与各特定病理阶段生存期的相关性;使用在线资源数据库Timer2.0(HTTP://timer.cistrome.org/),通过免疫关联模块中的基因分析免疫细胞(B细胞、CD8+T淋巴细胞、CD4+T淋巴细胞、巨噬细胞、中性粒细胞和树突状细胞)c-Met表达与浸润丰度之间的相关性。
1.2.2 免疫组织化学染色 取本院病理科诊断的一线导管腺癌标本25例为实验组,术前均未接受放疗或化疗,蜡块包埋、切片。另外取25 例胰腺癌癌旁组织作为对照组。石蜡切片在二甲苯中脱烃,用梯度乙醇浓度复水。3%过氧化氢浸泡15 min阻断内源性过氧化物酶活性,2%Triton X-100孵育惊醒抗原修复,封闭,按说明书比例稀释一抗、二抗完成孵育,DAB显色剂显色,苏木素复染,梯度乙醇脱水后二甲苯透明2次,封片。
1.2.3 外周血PBMC提取及CAR-T制备 取健康志愿者外周血10 mL,加等量生理盐水稀释后缓慢滴入1.2 倍体积淋巴细胞分离液上层,500 g室温离心30 min,缓升缓降。吸取离心所得中间位置PBMC白膜层,PBS洗涤3次,使用含IL-2的10%胎牛血清1640完全培养基培养。置于CD3/CD28预包备板中激活48 h,获得活化T细胞。
调节活化T 细胞浓度为1×106/mL,150 μL 置于retronectin 预包被的48 孔板,按MOI 值为5 加入慢病毒,并加入终体积0.04 倍的慢病毒感染增强试剂polybrene。慢病毒感染8 h后,补充等体积完全培养基。48 h后荧光显微镜观察感染情况。CAR-T细胞严格计数传代,浓度控制在0.5~1.5/mL。
1.2.4 慢病毒构建 通过专利查找获得靶向 c-Met的抗体ScFv序列及分泌型靶向PD-1的抗体ScFv序列。第2 代c-Met CAR结构由c-Met ScFv、CD8α铰链区及跨膜区、4-1BB共刺激信号、CD3ζ链胞内信号结构域组成。第4 代c-Met/PD-1 CAR 分子在c-Met CAR 结构内插入分泌型靶向PD-1 的抗体ScFv 序列,将第2 代c-Met CAR 和四代c-Met/PD-1 CAR 分子分别插入GV401载体(吉凯基因),完成慢病毒载体构建。
将第2代c-Met CAR和第4代c-Met/PD-1 CAR慢病毒重组载体在大肠杆菌中转化扩增。按质粒提取试剂盒说明书从大肠杆菌中稳定抽提目的质粒。目的质粒分别同VSVG、PSPAX2 质粒以三质粒法按4∶3∶2 的比例转染293 T 细胞,并加入2.5 倍质粒体积的Lipofectamin 2000转染试剂。转染3 d后超速离心法浓缩慢病毒,25 000 r/min,2 h。以非靶点CD19 CAR分子包装的慢病毒作为阴性对照(此步骤由上海吉凯基因完成)。
1.2.5 c-Met/PD-1 CAR-T 细胞检测 流式细胞术检测CAR-T阳性率,由于GV401载体携带eGFP标记基因,可使用流式细胞仪FICT通道测量CAR-T感染效率。收集第2代c-Met CAR-T和第4 代c-Met/PD-1 CAR-T各2×105个,收集阴性对照CD19 CAR-T和空白对照活化T细胞各2×105个,PBS洗涤3次后,流式细胞仪上机检测。
Western blotting检测第4代c-Met/PD-1 CAR-T的PD-1抗体分泌情况,由于分泌型PD-1抗体后携带HIS标签并与之形成融合蛋白,可通过检测细胞上清液中HIS标签验证PD-1抗体的分泌。取培养24 h后的细胞上清,离心后去除沉淀,PAGE胶电泳分离蛋白质,将目的相对分子质量蛋白质转移到PVDF膜上,5%脱脂奶粉封闭1 h,鼠抗人HIS一抗4 ℃孵育过夜,洗涤后兔抗鼠HRP偶联二抗孵育2 h,滴加显色液,ECL曝光显影。
流式细胞术检测CAR-T细胞亚群分布,收集第2代c-Met CAR-T和第4代c-Met/PD-1 CAR-T各2×105个,收集阴性对照CD19 CAR-T和空白对照活化T细胞各2×105个,PBS洗涤后,每组分别加入5 μL的APC-CD3、PE-CD4和Pre-PC5.5- CD8抗体,同时利用活化T细胞设置3种抗体单阳管调节电压,4 ℃避光孵育30 min,使用流式细胞仪进行检测。所有数据使用Flowjo V12分析。
1.2.6 CAR-T 细胞体外增殖检测 1×104高表达c-Met与PD-L1 的胰腺癌细胞Aspc-1 与1×104效应细胞共培养24、48、72 h,终体积200 μL。培养结束后洗去悬浮T细胞及不贴壁的癌细胞碎片,培养基补充至终体积200 μL。同时设置同等数量共培养不洗涤孔,所有孔分别加入0.1倍体积CCK-8试剂,37 ℃避光孵育2 h,酶标仪检测各测量孔OD值,同时检测各效应细胞初始(培养0 h)OD 值。分组如下:实验组①:c-Met CAR-T+Aspc-1 细胞;实验组②:c-Met/PD-1 CAR-T+Aspc-1 细胞;Control组①:CD19 CAR-T+Aspc-1细胞;Control组②:活化T细胞+Aspc-1细胞。每组各时间点细胞数量=1×104×(OD未洗涤孔-OD洗涤孔)/OD0 h效应细胞。
1.2.7 CAR-T细胞体外抗肿瘤效应检测 采用乳酸脱氢酶释放试剂盒检测CAR-T细胞的细胞毒性。按CCK-8试验分组将各组效应细胞与靶细胞于2%马血清1640培养基中共孵育6 h,终体积为200 μL。靶细胞Aspc-1数量恒定为1×104个,各组按梯度效靶比(1∶1、5∶1、10∶1和20∶1)分别添加效应细胞,设置分别设置靶细胞、效应细胞自然释放孔、靶细胞最大释放孔和空白孔,共培养结束前1 h 靶细胞最大释放孔加入20 μL LDH 释放试剂。按说明书要求配置检测液,将120 μL细胞上清液和60 μL检测液混合置于新的96 孔板中,室温孵育30 min,酶标仪检测各孔OD值。公式如下:
杀伤效率% =(OD共培养孔-OD效应细胞自然释放孔-OD靶细胞自然释放孔+OD空白孔)/(OD靶细胞最大释放孔-OD效应自然释放孔)。
采用酶联免疫吸附法检测靶细胞存在下,效应细胞释放细胞因子IL-2、TNF-α和IFN-γ的量,按CCK-8 实验分组,各组分别于96孔板中添加1×106效应细胞和1×106 Aspc-1 细胞,共培养24 h,培养体系:5%胎牛血清+95% 1640 培养基,终体积200 μL。离心取细胞上清液,分别稀释5 倍后按ELISA试剂盒说明书分别检测IL-2、TNF-α和IFN-γ 3种细胞因子浓度。
1.3 统计学分析
采用SPSS 23.0软件进行统计分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析,计数资料表示为百分比。以Plt;0.05为差异有统计学意义,所有实验均独立重复3次。
2 结果
2.1 c-Met和PD-L1在胰腺癌中的表达
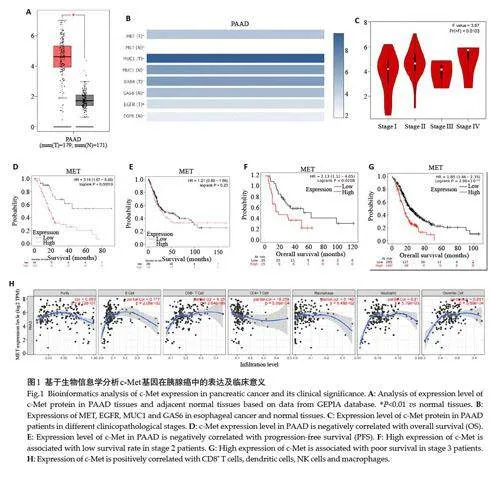
GEPIA数据库分析显示,c-Met蛋白在胰腺癌组织中的表达高于邻近正常组织(图1A,Plt;0.01)。对人类蛋白质图谱数据库的分析表明,与c-Met 相比,其他常见的胰腺癌CAR-T靶点,在正常组织中的表达更高,即特异性更低(图1B)。PAAD组织的c-Met蛋白表达水平与患者病理分期无相关性(图1C,Pgt;0.01)。
采用Kaplan-meier Plotter 数据库评估患者c-Met蛋白表达水平与预后的关系,统计结果显示,c-Met高表达水平与患者OS相关,且胰腺癌组织c-Met表达水平越高,胰腺癌患者的OS越短(图1D,Plt;0.01),但在RFS中差异无统计学意义(图1E,Pgt;0.01)。c-Met mRNA的增加与2期和3期胰腺癌患者总生存期的改善显著相关(图1F~G,Plt;0.05)。
TIMER 数据库分析c-Met 与免疫浸润程度的相关性,结果显示,胰腺癌患者c-Met mRNA的表达与CD4+T 细胞(R=0.259,Plt;0.01)、CD8+T 细胞(r=0.35,Plt;0.01)、巨噬细胞(r=0.1.42,Plt;0.01)、树突状细胞(r=0.261,Plt;0.01)和中性粒细胞(r=0.21,Plt;0.01)均成正相关(图1 H)。
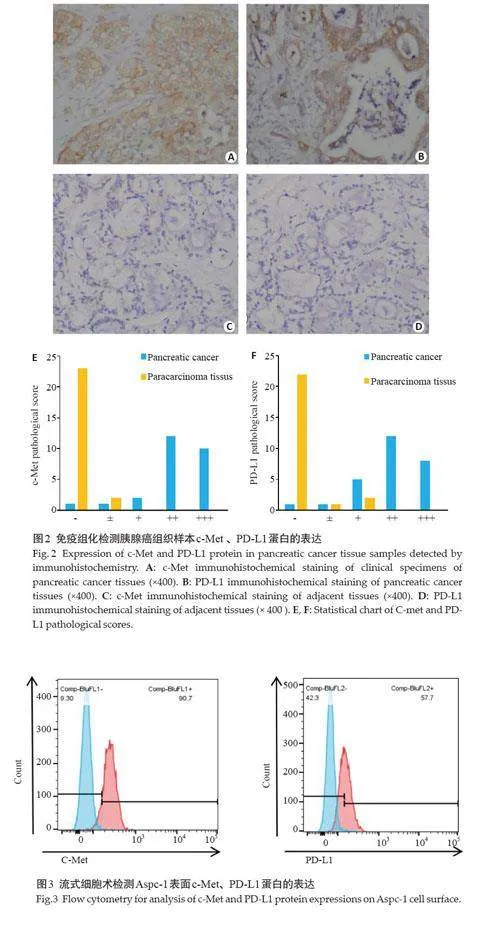
免疫组化检测结果显示,22例标本中病理c-Met表达评分均在++以上,其中10例评分+++,12例评分++,正常胰腺组织病理评分23例均为-,2例为±。25例标本中病理PD-L1表达评分均在+以上,其中8例评分+++,12例评分++,5例评分+正常胰腺组织病理评分22例为-(图2)。
流式细胞术检测显示,Aspc-1细胞PD-L1和c-Met的表达率分别为90.7%和57.7%(图3)。支持将c-Met作为胰腺癌治疗靶点的可能性,并验证Aspc-1 中表达较多PD-L1,可能存在PD-1/PD-L1通路抑制。
2.2 第2 代c-Met CAR-T 和第4 代c-Met/PD-1 CAR-T制备
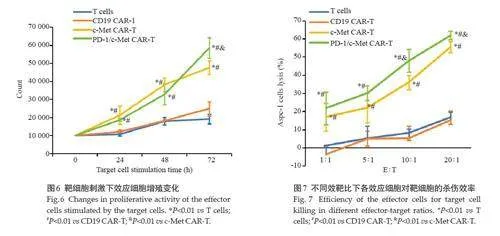
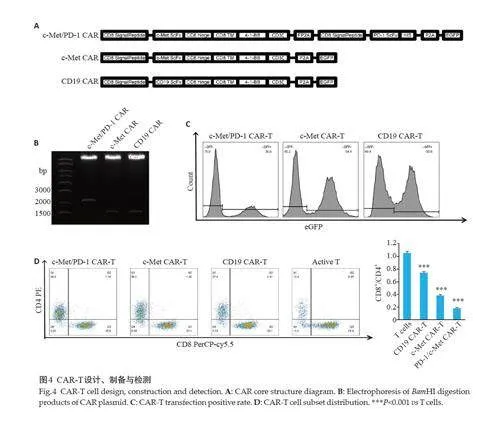
构建包含抗人c-Met抗体、铰链和跨膜结构域、细胞内4-1BB共刺激结构域和CD3ζ激活结构域的第2代抗c-Met CAR。本研究使用FP2A元件作为c-Met CAR和分泌序列之间的连接,然后使用his标签,制备用于分泌抗pd1 scFv的c-Met CAR,所有目的序列与EGFP荧光报告基因结合,以评估转导效率(图4A),酶切验证质粒构建成功(图4B)。利用三质粒法和高速离心法包被并浓缩慢病毒。慢病毒感染活化T细胞后成功制备第2代c-Met CAR-T、第4 代c-Met/PD-1 CAR-T 和阴性对照CD19 CAR-T。流式细胞术检测各CAR-T细胞阳性率,结果显示四代c-Met/PD-1 CAR-T阳性率为30%,第2 代c-Met CAR-T阳性率为54.8%,CD19 CAR-T阳性率为50.6%(图4C)。
免疫印记结果显示,PD-1/c-Met CAR-T上清液中存在PD-1 抗体,但活化T细胞、CD19 CAR-T和c-MetCAR-T 细胞上清液中未检测到PD-1抗体的分泌。流式细胞术显示,慢病毒感染前T细胞CD4+亚群占比13.4%,CD8+亚群占比74.9%,慢病毒感染后CD19 c-Met CAR-TCD4+亚群占比27.4%,CD8+亚群占比66.1%;c-MetCAR-T CD4+亚群占比39.1%,CD8+亚群占比53.1%;PD-1/c-Met CAR-T CD4+亚群占比48.0%,CD8+亚群占比45.8%。慢病毒感染后CD8+T 细胞亚群均减少,CD4+T细胞亚群均增加(图4D)。
Western blotting 结果显示,PD-1/c-Met CAR-T上清液中存在HIS标记的PD-1 抗体,相对分子质量符合预期(图5), 且c-Met CAR-T、CD19 CAR-T和活化T细胞上清液均未检测到表达。
2.3 PD-1分泌型抗体可有效提高CAR-T的增殖效率
CCK-8增殖实验结果显示,在24、48、72 h时c-MetCAR-T和PD-1/c-Met CAR-T的细胞数量远高于活化T细胞和CD19 CAR-T,但在24、48 h 时c-Met CAR-T和PD-1/c-Met CAR-T的细胞增殖速度无显著差异,72 h时靶细胞刺激下PD-1/c-Met CAR-T显示出高于c-MetCAR-T的细胞增殖数量(Plt;0.01,图6)。
2.4 PD-1 抗体分泌型CAR-T 表现较强的肿瘤杀伤效率
LDH释放实验检测结果显示,效应细胞对肿瘤的杀伤率随效靶比的升高而增加,在设置的1∶1 5∶1 10∶120∶1 效靶比下c-Met CAR-T 和PD-1/c-Met CAR-T 的癌细胞杀伤率远高于活化T 细胞和CD19 CAR-T,在10∶1 和20∶1 效靶比下PD-1/c-Met CAR-T显示出高于c-Met CAR-T的靶细胞杀伤效率(Plt;0.01,图7)。
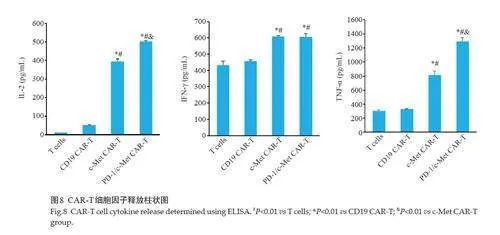
2.5 PD-1抗体分泌型CAR-T表现较强的细胞因子分泌
ELISA结果显示,c-Met CAR-T和PD-1/c-Met CART的3种细胞因子分泌量均高于活化T细胞和CD19 CAR-T;IL-2分泌量PD-1/c-Met CAR-T(501.762±4.407 pg/mL)高于c-Met CAR-T(393.069±15.554 pg/mL)。TNF‑α的分泌量c-Met CAR-T(817.287±54.021 pg/mL)低于PD-1/c-Met CAR-T(1295.985±56.595 pg/mL)。IFN‑γ的分泌量c-Met CAR-T(609.277±4.001pg/mL)和 PD-1/c-Met CAR-T(605.495±19.285 pg/mL)无明显差异(图8)。
3 讨论
免疫疗法在肿瘤治疗领域蓬勃发展,其中CAR-T疗法和免疫检查点抑制剂是研究热点[26]。如何使CAR-T细胞避开实体瘤的免疫逃逸,更好地发挥单克隆抗体在肿瘤治疗中的作用,是亟待解决的问题。本研究将CAR-T疗法与免疫检查点抑制剂疗法联合构建PD-1/c-Met CAR-T,在体外和体内实验中均表现出良好的抗肿瘤活性。
本研究旨在通过重塑肿瘤微环境来增强CAR-T疗法对实体肿瘤的治疗效果。在前期研究中已证明靶向c-Met的CAR-T可用于肺癌、结肠癌和卵巢癌等实体瘤的治疗,并取得了较好的疗效,但实验过程中发现CART在靶细胞刺激下出现短暂24~48 h高速增殖后,显示出明显的细胞凋亡。通过文献分析和流式细胞术检测推测可能是免疫检查点抑制作用导致T细胞凋亡,目前PD-1/PD-L1 检查点阻断联合的CAR-T的形式包括共表达嵌合开关受体[27]或敲除CAR-T细胞基因组内PD-1分子[28]。与单独表达CAR的T细胞相比,以上方法均已被证明可以提高抗肿瘤效率、细胞因子分泌水平,并增强CAR-T增殖。然而,这种保护作用仅限于CAR-T细胞本身,但肿瘤微环境内的其余淋巴细胞仍存在PD-1/PD-L1 介导的抑制;除此之外PD-1Scfv 或PD-L1 Scfv与目的抗原Scfv串联的细胞外结构域[28],但空间构象很难满足同时结合免疫细胞(PD-1)和肿瘤细胞(肿瘤相关抗原),或同时串联两个肿瘤细胞(分别结合PD-L1和肿瘤相关抗原)。鉴于CAR-T 细胞分泌的PD -1 阻断scFvs 能够与除CAR-T 之外的其他免疫细胞结合,故PD-1 Scfv的局部分泌可能保护内源性抗肿瘤免疫细胞并抑制表达靶抗原的肿瘤生长。目前PD-1分泌型抗体仅被用于加强EGFR[29]、GPC3[30]和TREM2[31]特异性CAR-T,尚未有c-Met CAR-T结合PD-1分泌型抗体的抗肿瘤效应报道。
本研究将PD-1 分泌型scFv 插入c-Met CAR分子后,使其随c-Met CAR分子的表达而分泌,PD-1 scFv抗体进入TME,可与T细胞表面的PD-1 抗原结合,阻断PD-1/PD-L1 通路。与传统PD-1 scFv 直接表达在CAR-T 表面和PD-1 敲除不同,PD-1 抗体表面表达CAR-T细胞必须出现CAR-T与T细胞、CAR-T与癌细胞的结合才能发挥作用,直接敲除或下调CAR-T 细胞的PD-1基因要考虑二次慢病毒感染的效率和T细胞反复感染后的生存状态;使用分泌型PD-1 scFv的优势在于CAR-T细胞识别c-Met后发挥作用,且作用几乎局限于招募到肿瘤附近的CAR-T细胞自身,可以较大程度地避免全身炎症反应的出现,这也是当下将PD-1阻断引入CAR-T疗法中的新方法。
本研究通过慢病毒的包装和T细胞的转导,获得了能够分泌PD-L1 抗体的c-Met CAR-T细胞,并通过生物信息学和临床样本病理检测验证了PD-1和c-Met在胰腺癌中的表达和在肿瘤进程中的临床意义,证明胰腺癌适合作为PD-1/c-Met CAR-T的治疗对象;本研究在体外功能验证实验中,在不同效靶比下检测到PD-1/c-Met CAR-T的杀伤活性显著高于c-Met CAR-T,且PD-1/c-Met CAR-T 分泌的IL-2 和TNF- α 显著高于c-MetCAR-T细胞。同时,在靶细胞Aspc-1存在下,与c-MetCAR-T细胞相比,PD-1/c-Met CAR-T细胞具有更高的增殖速度。
通过慢病毒法制备PD-1/c-Met CAR-T 阳性率小于c-Met CAR-T,为保证阳性率对抗肿瘤细胞实验的影响,本实验均用活化体细胞将c-Met CAR-T阳性率稀释到PD-1/c-Met CAR-T水平。由于慢病毒载体整体载荷量较低,超过5 kb的插入片段可能会引起感染后表达量下降和病毒滴度降低。为解决慢病毒载量的技术问题后期或可使用 CRISPR/CAS9 或转座子技术改进[32, 33],此两种方法的优势除了能够携带更长更复杂的目的基因外还能定点插入CAR分子。如CRISPR/CAS9可在TRAC位点插入CAR,构建CAR-T的同时还能切除移植物抗宿主病主要识别受体,达到构建通用型CAR-T的目的,进一步解决CAR-T治疗只能使用来源于自体的T细胞的特点。但CRISPR/CAS9和转座子基因编辑技术均需使用电转方法构建CAR-T,电穿孔法较慢病毒法对细胞的破坏性更强,如何提高电穿孔后T细胞的存活效率或将成为另一个研究热点。
参考文献:
[1] Karunakaran M, Barreto SG. Surgery for pancreatic cancer: current
controversies and challenges[J]. Future Oncol, 2021, 17(36):
5135-62.
[2] Klein AP. Pancreatic cancer epidemiology: understanding the role of
lifestyle and inherited risk factors[J]. Nat Rev Gastroenterol
Hepatol, 2021, 18(7): 493-502.
[3] Cai J, Chen HD, Lu M, et al. Advances in the epidemiology of
pancreatic cancer: trends, risk factors, screening, and prognosis[J].
Cancer Lett, 2021, 520: 1-11.
[4] Kokkinos J, Ignacio RMC, Sharbeen G, et al. Targeting the
undruggable in pancreatic cancer using nano-based gene silencing
drugs[J]. Biomaterials, 2020, 240: 119742.
[5] Zhao YR, Tang JJ, Jiang K, et al. Liquid biopsy in pancreatic cancer
- Current perspective and future outlook[J]. Biochim Biophys Acta
Rev Cancer, 2023, 1878(3): 188868.
[6] Sterner RC, Sterner RM. CAR-T cell therapy: current limitations
and potential strategies[J]. Blood Cancer J, 2021, 11(4): 69.
[7] Maalej KM, Merhi M, Inchakalody VP, et al. CAR-cell therapy in
the era of solid tumor treatment: current challenges and emerging
therapeutic advances[J]. Mol Cancer, 2023, 22(1): 20.
[8] Ma S, Li XC, Wang XY, et al. Current progress in CAR-T cell
therapy for solid tumors[J]. Int J Biol Sci, 2019, 15(12): 2548-60.
[9] Liu GN, Rui W, Zhao XQ, et al. Enhancing CAR-T cell efficacy in
solid tumors by targeting the tumor microenvironment[J]. Cell Mol
Immunol, 2021, 18(5): 1085-95.
[10]Marofi F, Motavalli R, Safonov VA, et al. CAR T cells in solid
tumors: challenges and opportunities[J]. Stem Cell Res Ther, 2021,
12(1): 81.
[11] Zhu GH, Huang C, Qiu ZJ, et al. Expression and prognostic
significance of CD151, c-Met, and integrin alpha3/alpha6 in
pancreatic ductal adenocarcinoma[J]. Dig Dis Sci, 2011, 56(4):
1090-8.
[12]Hage C, Rausch V, Giese N, et al. The novel c-Met inhibitor
cabozantinib overcomes gemcitabine resistance and stem cell
signaling in pancreatic cancer[J]. Cell Death Dis, 2013, 4(5): e627.
[13]Bauer TW, Somcio RJ, Fan F, et al. Regulatory role of c-Met in
insulin-like growth factor-I receptor-mediated migration and
invasion of human pancreatic carcinoma cells[J]. Mol Cancer Ther,
2006, 5(7): 1676-82.
[14]Hill KS, Gaziova I, Harrigal L, et al. Met receptor tyrosine kinase
signaling induces secretion of the angiogenic chemokine interleukin-
8/CXCL8 in pancreatic cancer[J]. PLoS One, 2012, 7(7): e40420.
[15]Min JT, Long CR, Zhang L, et al. C-Met specific CAR-T cells as a
targeted therapy for non-small cell lung cancer cell A549[J].
Bioengineered, 2022, 13(4): 9216-32.
[16]闵静婷, 张 露, 龙赤荣, 等. 靶向c-Met 的嵌合抗原受体T细胞制备
及其对非小细胞肺癌的杀伤作用[J]. 中华肿瘤杂志, 2023, 45(4):
322-9.
[17]Darwish IA, Alahmad W, Vinoth R. Novel ultrasensitive automated
kinetic exclusion assay for measurement of plasma levels of soluble
PD-L1, the predictive and prognostic biomarker in cancer patients
treated with immune checkpoint inhibitors[J]. Heliyon, 2024, 10
(10): e31317.
[18]Qiu JY, Cheng ZL, Jiang Z, et al. Immunomodulatory precision: a
narrative review exploring the critical role of immune checkpoint
inhibitors in cancer treatment[J]. Int J Mol Sci, 2024, 25(10): 5490.
[19]Xu XY, Xie TX, Zhou MX, et al. Hsc70 promotes anti-tumor
immunity by targeting PD-L1 for lysosomal degradation[J]. Nat
Commun, 2024, 15(1): 4237.
[20]Lemoine J, Ruella M, Houot R. Born to survive: how cancer cells
resist CAR T cell therapy[J]. J Hematol Oncol, 2021, 14(1): 199.
[21]Norberg SM, Hinrichs CS. Engineered Tcell therapy for viral and
non-viral epithelial cancers[J]. Cancer Cell, 2023, 41(1): 58-69.
[22]Kashiwada T, Takano R, Ando F, et al. Lysosomal degradation of PDL1
is associated with immune-related adverse events during anti-PDL1
immunotherapy in NSCLC patients[J]. Front Pharmacol, 2024,
15: 1384733.
[23]Li CC, Zhang Z, Cai QF, et al. Peripheral CX3CR1+ T cells
combined with PD-1 blockade therapy potentiates the anti-tumor
efficacy for lung cancer[J]. Oncoimmunology, 2024, 13(1):
2355684.
[24]Andreu-Saumell I, Rodriguez-Garcia A, Mühlgrabner V, et al. CAR
affinity modulates the sensitivity of CAR-T cells to PD-1/PD-L1-
mediated inhibition[J]. Nat Commun, 2024, 15(1): 3552.
[25]赵 琳, 王 菁, 杨金龙, 等. 分泌PD-1单链抗体的MesoCAR-T细胞
治疗非小细胞肺癌的体内外研究[J]. 复旦学报: 自然科学版, 2022,
61(4): 405-16.
[26]Li YT, Sharma A, Schmidt-Wolf IGH. Evolving insights into the
improvement of adoptive T-cell immunotherapy through PD-1/PDL1
blockade in the clinical spectrum of lung cancer[J]. Mol Cancer,
2024, 23(1): 80.
[27]Prosser ME, Brown CE, Shami AF, et al. Tumor PD-L1 costimulates
primary human CD8+ cytotoxic T cells modified to
express a PD1: CD28 chimeric receptor[J]. Mol Immunol, 2012, 51
(3/4): 263-72.
[28]Cherkassky L, Morello A, Villena-Vargas J, et al. Human CAR T
cells with cell-intrinsic PD-1 checkpoint blockade resist tumormediated
inhibition[J]. J Clin Invest, 2016, 126(8): 3130-44.
[29]Zhu HF, You YP, Shen ZM, et al. EGFRvIII-CAR-T cells with PD-1
knockout have improved anti-glioma activity[J]. Pathol Oncol Res,
2020, 26(4): 2135-41.
[30]Li DZ, Qin J, Zhou T, et al. Bispecific GPC3/PD-1 CAR-T cells for
the treatment of HCC[J]. Int J Oncol, 2023, 62(4): 53.
[31]Chen J, Zhu TC, Jiang GM, et al. Target delivery of a PD-1-TREM2
scFv by CAR-T cells enhances anti-tumor efficacy in colorectal
cancer[J]. Mol Cancer, 2023, 22(1): 131.
[32]Metanat Y, Viktor P, Amajd A, et al. The paths toward non-viral
CAR-T cell manufacturing: a comprehensive review of state-of-theart
methods[J]. Life Sci, 2024, 348: 122683.
[33]Cappabianca D, Pham D, Forsberg MH, et al. Metabolic priming of
GD2 TRAC-CAR Tcells during manufacturing promotes memory
phenotypes while enhancing persistence[J]. Mol Ther Methods Clin
Dev, 2024, 32(2): 101249.
(编辑:林 萍)

