参芪调肾方减轻慢阻肺肺肾气虚证大鼠气道炎症的机制:基于铁死亡途径
摘要:目的 基于核因子E2相关因子2(Nrf2)/溶质载体家族7成员11(SLC7A11)/谷胱甘肽过氧化物酶4(GPX4)途径探讨参芪调肾方(SQTSF)调控铁死亡减轻COPD肺肾气虚证病证结合大鼠气道炎症的作用。方法 48 只SD大鼠随机分为对照组(CON)、模型组(MOD)、SQTSF低、中、高剂量组(SQTSF-L、SQTSF-M、SQTSF-H)和氨茶碱组(APL),n=8。除对照组外,其余大鼠构建COPD肺肾气虚证模型,并从第30天开始灌胃SQTSF和APL。观察各组大鼠的体质量、抓力变化、肺功能、肺组织病理、肺泡灌洗液(BALF)炎性因子、肺组织氧化应激水平、铁离子代谢情况、肺组织细胞和线粒体超微结构以及Nrf2/SLC7A11/GPX4信号通路和铁死亡相关基因和蛋白的表达。结果 与CON组比较,MOD组大鼠表现出皮毛枯黄脱落、对刺激反应迟钝,精神萎顿、嗜睡喜聚成堆闭目静卧等明显的气虚神疲表现;体质量和抓力明显下降(Plt;0.05);第0.1秒用力呼气量(FEV0.1)、用力肺活量(FVC)、FEV0.1/FVC、Cdyn明显降低(Plt;0.05);肺组织表现出明显的炎性浸润和肺气肿,支气管、血管周围和肺泡炎症评分、肺组织平均内衬间隔(MLI)、肺泡破坏指数(DI)明显上升,平均肺泡数(MAN)明显降低(Plt;0.05);BALF中IL-1β、TNF-α、IL-6、IL-13明显上升(Plt;0.05);肺组织ROS、MDA明显上升,GSH明显下降(Plt;0.05);肺组织Fe2+和总铁离子明显上升(Plt;0.05);透射电镜(TEM)观察发现MOD组大鼠肺组织细胞表现出线粒体外膜破裂,线粒体嵴消失等铁死亡特征性改变;肺组织Nrf2、GPX4、SLC7A11 明显下降,酰基辅酶A合成酶长链家族成员4(ACSL4)明显上升(Plt;0.05);与MOD组比较,SQTSF能明显改善各项指标的病理改变,且作用效果优于APL组(Plt;0.05)。结论 SQTSF能有效改善COPD肺肾气虚病证结合模型大鼠气道炎症和氧化应激,其机制可能与调控Nrf2/SLC7A11/GPX4信号通路抑制铁死亡有关。
关键词:慢性阻塞性肺疾病;参芪调肾方;Nrf2/SLC7A11/GPX4;铁死亡;气道炎症
慢性阻塞性肺疾病(COPD)是一种持续性、进行性气流受限为特征的疾病,与气道对有害气体/颗粒的异常炎症反应密切相关[1]。我国是全球COPD发病率最高的国家之一,40岁和60岁以上人群COPD患病率分别为13.7%和27%,患病总人数近1 亿人,致残率和病死率高,防治形势严峻[2]。气道炎症是COPD稳定期病情进展和急性加重的关键驱动因素[3],但如何有效中断COPD气道炎症发展,延缓疾病进展,降低病死率和提高生活质量仍是医学界待攻克的难点。铁死亡是一种铁依赖性和脂质过氧化驱动的新型程序性细胞死亡(PCD)方式,在慢阻肺气道炎症中的作用越来越受到学者的关注。近期研究表明,吸烟、生物燃料烟雾诱导的气道上皮细胞铁死亡并释放损伤相关分子模式(DAMPs)导致气道炎症等一组特殊基因调控[4]。核因子红细胞系2相关因子2(Nrf2)是调控细胞氧化还原稳态和炎症的关键转录因子,可通过调控溶质载体家族7成员11(SLC7A11)/谷胱甘肽过氧化物酶4(GPX4)途径维持细胞内氧化还原稳态,参与调控铁死亡[5]。因此,调控Nrf2/SLC7A11/GPX4 通路表达可能是抑制COPD细胞铁死亡发生改善气道炎症的关键环节。
COPD归属中医学“肺胀”范畴,肺肾气虚证是COPD稳定期临床最常见的证型[6,7]。参芪调肾方(SQTSF)(发明专利号:ZL 2022 1 0325914.X)是国医大师韩明向针对COPD稳定期肺肾气虚证“气虚-痰阻-血瘀”核心病机拟定的临床验方,具有补肺益肾,化痰祛瘀之效。前期临床观察发现,该方可以有效改善COPD肺肾气虚证患者临床症状、减少急性加重次数,延缓肺功能下降,提高运动耐量和生存质量。尽管疗效确切,但作用机制尚不明确。本文通过构建COPD肺肾气虚证大鼠模型,以Nrf2/SLC7A11/GPX4 通路调控铁死亡为切入点,探讨SQTSF改善COPD肺肾气虚模型大鼠气道炎症的潜在作用机制,为该方防治COPD提供科学依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 SPF 级雄性SD大鼠48 只,鼠龄6~8周,体质量200~220 g,饲养于安徽中医药大学标准动物房,相对湿度(55±5)%,室温(23±2) ℃,自由进食、饮水。本研究经安徽中医药大学伦理审查委员会批准(伦理批号:AHTCM-rats-2021087)。
1.1.2 试剂与仪器 脂多糖(LPS,Sigma);苏木素染液、醇溶伊红染液(ebiogo);大鼠白细胞介素-1β(IL-1β)ELISA试剂盒、大鼠肿瘤坏死因子α(TNF-α)ELISA试剂盒、大鼠IL-6 ELISA试剂盒、大鼠IL-13 ELISA试剂盒(武汉基因美);活性氧检测试剂盒(碧云天);GSH、MDA 检测试剂盒(南京建成生物);Fe2+检测试剂盒(Elabscience);总铁离子检测试剂盒(南京建成生物);PBS(Hyclone);Nrf2(ImmunoWay Biotechnology);SLC7A11(Affinity);GPX4、ACSL4(BOSTER)。流式细胞仪(BECKMAN),酶标仪(雷杜),紫外可见分光光度计(上海菁华科技仪器有限公司),离心机(安徽嘉文),漩涡混合器(其林贝尔仪器制造公司),抓力检测仪(南京苏测计量仪器有限公司),AniRes 2005动物肺功能仪(北京贝兰博科技有限公司),-80℃电冰箱(Panasonic)。
1.2 研究方法
1.2.1 参芪调肾方药液制备 SQTSF草药(人参10 g、炙黄芪20 g、山萸肉12 g、桃仁10 g、益智仁10 g、白芥子6 g、陈皮6 g、玉竹6 g、肉桂3 g)购自安徽省中医院草药房,在0.83 L蒸馏水(1/10,w/v)中浸泡60 min,大火煮沸后,慢火煎煮90 min。后将提取液通过4 层纱布过滤,残渣浸泡于0.664 L(1/8,w/v)蒸馏水中,大火煮沸后,慢火煎煮40 min,通过再次过滤,合并两次煎煮液进行浓缩备用。
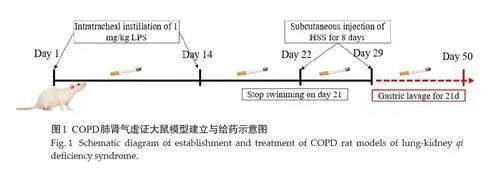
1.2.2 模型构建与分组给药 将48只SD大鼠适应性喂养后随机分为对照组(CON)、模型组(MOD)和SQTSF低剂量组(SQTSF-L),SQTSF 中剂量组(SQTSF-M),SQTSF高剂量组(SQTSF-H),氨茶碱组(APL)效果是高剂量组,氨茶碱组(APL),8只/组。除CON组外,其余大鼠采用烟熏联合气管滴注LPS再施加强迫游泳及背部注射氢化可的松法复制COPD肺肾气虚证大鼠模型。根据课题组前期造模方案[8],依据“劳则气耗”原则,采用强迫游泳疲劳法构建肺气虚模型,大鼠每天烟熏前置于(43±1) ℃、水深35 cm,内壁光滑的恒温水槽中强迫游泳,当大鼠出现自然下沉时,从水槽取出,60%大鼠出现下沉后,动物全部取出,1 次/d,持续21 d;游泳结束后,擦拭干水分,置于烟熏箱内,采用10 支香烟进行烟熏,1 次/d,每次烟熏45 min,共烟熏48 d,其中第1、14 天在乙醚麻醉的状态下通过改良的长针头往每只大鼠气管滴入200 μL LPS(1 mg/mL),当天不烟熏。在以上模型的基础上于第22天在大鼠背部皮下连续注射氢化可的松琥珀酸钠0.3 mL/ d(25 mg/mL),1次/d,共注射8 d,以抑制肾上腺皮质功能[9,10]。以上模型复合构建COPD肺肾气虚证病证结合大鼠模型。补益肺肾药物SQTSF从第30 天开始给药,每日造模2 h 后给药,连续灌胃给药21 d。具体分组处理方式(图1),CON组:10 mL/(kg·d)灌胃生理盐水;模型组:10 mL/(kg·d)灌胃生理盐水;SQTSF-L 组:3.74 g/(kg·d)灌胃给药;SQTSF-M:7.47 g/(kg·d)灌胃给药;SQTSF-H 组:14.94 g/(kg·d)灌胃给药;APL组:27 mg/(kg·d)灌胃给药。
1.2.3 大鼠体质量和抓力检测 每周称取大鼠体质量,并运用大鼠体质量系数[(实验后体质量/实验前体质量)×100-100]评价各组大鼠体质量变化程度[11]。参考Wang等[12]的研究方法测量大鼠的水平抓力,重复测量3次,取平均值作为测量结果。
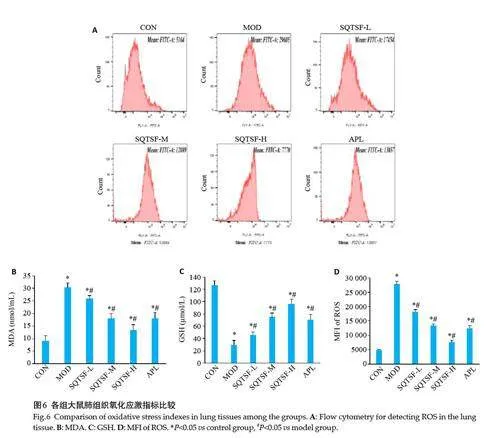
1.2.4 肺功能检测 SD大鼠予3%戊巴比妥钠(3 mg/100 g)进行腹腔注射麻醉进行肺功能检测,使用AniRes2005 分析系统,测定0.1 s 用力呼气容积(FEV0.1)、用力呼气容积占用力呼气肺活量(FVC)、FEV0.1/FVC和肺动态顺应性(Cdyn),并记录各参数值。
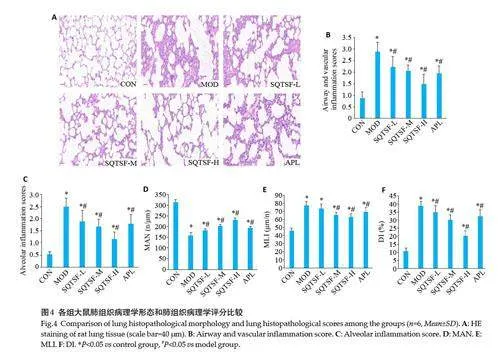
1.2.5 苏木素-伊红(HE)病理染色 将固定的肺组织进行石蜡包埋、切片、HE染色。显微镜下观察HE染色情况,并对支气管周围/血管周围炎症、肺泡炎症和肺气肿病理程度进行评价。支气管周围炎症、血管周围炎症和肺泡炎症根据周围区域炎症细胞浸润的存在和强度进行炎症评分和半定量分析。其中支气管和血管周围的炎症评分按以下参数进行[13]:无炎症反应,0分;偶有炎性细胞脱落,1分;大部分支气管和血管周围有薄层炎性细胞(1~5细胞厚度),2分;大部分支气管和血管周围有厚层炎性细胞(gt;5细胞厚度),3分。肺泡炎症评分按以下参数进行[14]:正常细胞,0分;少量炎性细胞浸润,1分;炎细胞环gt;1层细胞深,2分;炎细胞环gt;2~4层细胞深,3分;炎细胞环gt;4层细胞深,4分。肺气肿程度采用肺平均内衬间隔(MLI)、平均肺泡数(MAN)和肺泡破坏指数(Dl)进行评价。在10×10倍镜视野下采集4个视野,避开大血管和支气管进行评估。在每张图像正中心画“×”,计数通过交叉线的肺泡间隔数(Ns)和每个视野内肺泡数(Na),测得“×”线总长度(L)和每个视野面积(S),然后分别计算MLI=L/Ns(衡量肺泡间隙的扩大)、MAN=Na/S(衡量平均肺泡密度)和DI=D/(D+N)×100%(衡量肺泡结构破坏情况)。
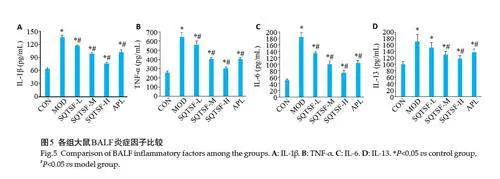
1.2.6 ELISA检测BALF炎症因子 取大鼠BALF,4 ℃条件下4000 r/min离心10 min(r=16 cm),分离BALF上清样品,按照ELISA试剂盒操作说明书检测各组大鼠BALF上清炎症因子IL-13、IL-1β、TNF-α、IL-6的含量。
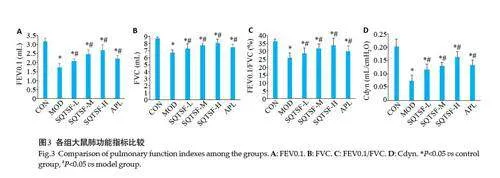
1.2.7 肺组织氧化应激指标检测 取各组大鼠小块组织研磨成单细胞悬液,通过细胞筛网,加入浓度为10 μmol/L DCFH-DA 500 μL,37 ℃孵育20 min,使探针和细胞充分作用,并设置不染色的细胞作为阴性细胞对照。PBS 洗细胞2 次,去除未进入细胞内的DCFH-DA,上流式细胞仪检测ROS 表达强度。其次取适量保存的肺组织,制备组织匀浆后,分别严格按试剂盒要求进行样本检测准备,然后采用酶标仪分别于530 nm 和405 nm 处测定各组大鼠肺组织MDA、GSH的水平。
1.2.8 铁离子代谢检测 取适量保存的肺组织,制备组织匀浆后分别严格按试剂盒要求进行样本检测准备,然后采用酶标仪分别于593 nm和520 nm处检测肺组织Fe2+和总铁离子的水平。
1.2.9 透射电镜(TEM)观察细胞铁死亡 取适量肺组织,用2%戊二醛(0.1 mol/L磷酸缓冲液)固定,分级乙醇脱水,然后环氧树脂固定,超薄切片,醋酸铀酰和柠檬酸铅染色后用TEM观察各组大鼠肺组织细胞形态、线粒体形态等超微结构,并采集图像。
1.2.10 Western blotting 检测铁死亡相关蛋白表达 提取各组大鼠肺组织总蛋白,BCA法测定蛋白浓度,蛋白变性后,经电泳、转移、封闭、抗体孵育、洗膜,ECL发光检测Nrf2、SLC7A11、GPX4、ACSL4及GAPDH蛋白表达,使用Image J软件进行半定量分析。
1.2.11 统计学方法 使用SPSS 26.0和EXCEL 2021 进行统计学分析和图表制作。数据符合正态分布,计量资料数据以均数±标准差表示,多组间比较用ANOVA分析;非正态分布数据运用Kruskal-Wallis分析。以Plt;0.05表示差异具有统计学意义。
2 结果
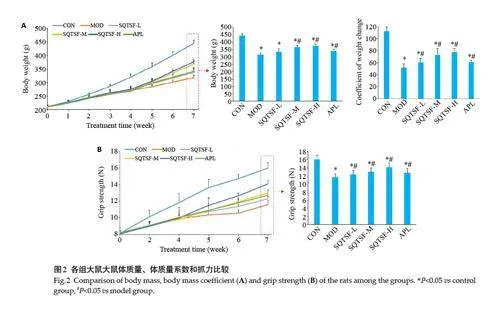
2.1 参芪调肾方对模型大鼠体质量和抓力的影响
与CON组比较,MOD组大鼠表现出明显的皮毛枯黄脱落、对刺激反应迟钝,精神萎顿、嗜睡,蜷缩拱背,喜聚成堆闭目静卧,进食饮水减少,舌暗淡等气虚神疲表现。同时,体质量和抓力增长缓慢,第7周明显MOD组体质量、体质量系数和抓力低于对照组(Plt;0.05);与模型组比较SQTSF 各给药组大鼠气虚神疲表现明显改善,且体质量和抓力明显上升,且呈现一定的剂量依赖性,第7周SQTSF-H组大鼠体质量、体质量系数和抓力明显高于MOD组(Plt;0.05);且SQTSF-H组的作用效果明显优于APL组(Plt;0.05,图2)。
2.2 参芪调肾方对模型大鼠肺功能的影响
与CON组比较,MOD组大鼠FEV0.1、FVC、FEV0.1/FVC、Cdyn 明显下降(Plt;0.05,图4);与模型组比较,SQTSF 各给药FEV0.1、FVC、FEV0.1/FVC、Cdyn 明显上升,呈现一定的剂量依赖性,且SQTSF-H 组FEV0.1、FVC、Cdyn的作用效果明显优于APL组(Plt;0.05,图3)。
2.3 参芪调肾方对模型大鼠肺组织病理的影响
CON组大鼠肺组织HE染色显示肺泡结构基本正常,间隔未见明显炎性细胞浸润和渗出,支气管粘膜完整,纤毛排列整齐。模型组大鼠肺泡明显扩大,肺泡壁多处断裂,相融合形成肺大泡,伴有大量炎性细胞浸润;支气管和血管管壁周围可见大量炎性细胞浸润,上皮细胞肿胀变性,胞质呈空泡,支气管腔有大量脱落坏死的上皮细胞和炎性渗出物;以上病理表现均符合COPD的肺部病理改变(图4A)。SQTSF给药组大鼠肺组织的病理表现较模型组均有明显改善。对肺组织病理表现进行半定量评价,与CON组比较,MOD组大鼠支气管、血管周围和肺泡炎症评分以及肺气肿相关的MLI和DI明显升高,MAN 明显下降(Plt;0.05);与模型组比较,SQTSF给药组大鼠支气管、血管周围和肺泡炎症评分以及MLI和DI明显下降,MAN明显上升,呈现剂量依赖性,且SQTSF-H组MAN、MLI和DI的改善作用明显优于APL组(Plt;0.05,图4B~F)。
2.4 参芪调肾对模型大鼠BALF炎症因子的影响
与CON 组比较,MOD 组大鼠BALF 炎症因子IL-1β、TNF-α、IL-6、IL-13 明显上升(Plt;0.05);与MOD组比较,SQTSF各给药组大鼠BALF中IL-1β、TNF-α、IL-6、IL-13 明显下降(Plt;0.05),呈现剂量依赖性,且SQTSF-H组BALF 中炎症因子的改善作用明显优于APL组(Plt;0.05,图5)。
2.5 参芪调肾方对肺组织氧化应激的影响
与CON组比较,MOD组大鼠肺组织ROS和MDA明显上升、GSH明显下降(Plt;0.05);与MOD组比较,SQTSF 各给药组大鼠肺组织ROS 和MDA明显下降,GSH明显上升,呈现剂量依赖性,且SQTSF-H组大鼠肺组织ROS、MDA和GSH的改善效果明显优于APL组(Plt;0.05,图6)。
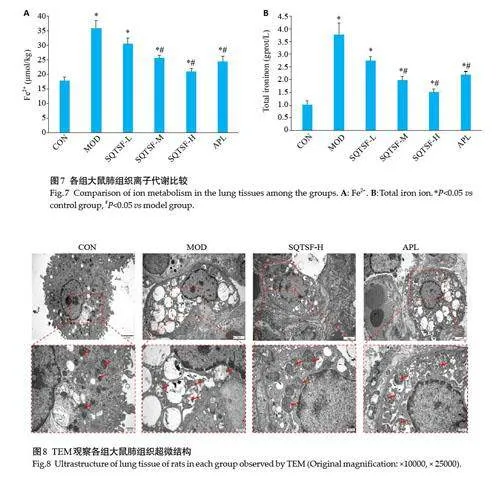
2.6 肺组织离子代谢的影响
与CON组比较,MOD组大鼠肺组织Fe2+和总铁离子明显上升(Plt;0.05);与MOD组比较,SQTSF各给药组大鼠肺组织Fe2+和总铁离子明显下降,呈现剂量依赖性,且SQTSF-H组大鼠肺组Fe2+和总铁离子的改善效果明显优于APL组(Plt;0.05,图7)。
2.7 TEM观察肺组织超微结构
TEM观察各组大鼠肺组织超微结构,CON组线粒体结构完整正常;MOD组大鼠肺组织细胞胞质出现空泡、细胞膜断裂,线粒体损伤,线粒体外膜破裂,线粒体嵴消失等铁死亡特征性改变,SQTSF-H组上述特征性改变表现明显改善(图8)。
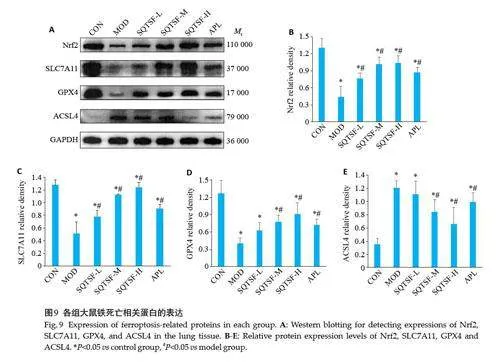
2.8 参芪调肾方对模型大鼠肺组织铁死亡相关蛋白的影响
与CON 组比较,MOD 组大鼠肺组织Nrf2、SLC7A11、GPX4明显下降,ACSL4明显上升(Plt;0.05)。与MOD 组比较,SQTSF 各给药组大鼠肺组织Nrf2、SLC7A11、GPX4明显上升,ACSL4明显下降(Plt;0.05),呈现一定的剂量依赖性,且SQTSF-H组大鼠肺组织Nrf2、SLC7A11、GPX4、ACSL4表达改善明显优于APL组(Plt;0.05,图9)。
3 讨论
COPD的发病机制复杂,其中气道炎症被认为是核心病理特征之一,与COPD疾病进展和死亡率相关,是COPD稳定期病情进展和恶化的关键驱动因素[15]。如何抑制COPD气道炎症是COPD临床治疗需要突破的瓶颈,亦是COPD防治的重要途径。近年来,铁死亡作为一种新型的细胞程序性死亡方式,因其在氧化应激和炎症反应中的重要角色而备受关注。铁死亡主要通过脂质过氧化和铁依赖性细胞损伤来实现,其在COPD气道炎症中的作用越来越受到学者的关注。
肺肾气虚证“气虚-痰阻-血瘀”病机相互交织,由此陷入恶性循环,抵御外邪能力减弱,是COPD稳定期急性加重和病情进展的重要因素[16]。SQTSF组方高度契合COPD稳定期肺肾气虚证“气虚-痰阻-血瘀”核心病机,具有补肺益肾,化痰祛瘀之效,能有效改善慢阻肺稳定期患者临床症状、减少急性加重次数和程度、延缓肺功能下降和提高运动耐量。方中人参、黄芪培补肺肾之气,益肺固表,共为君药。药理学研究表明人参有效成分人参皂苷Rb1可通过抑制铁死亡,减轻氧化应激和炎症发挥神经保护作用[17];黄芪有效成分黄芪甲苷IV可通过Nrf2/SLC7A11/GPX4 轴调节铁死亡保护PM2.5诱导的肺部炎症[18]。益智仁,温肾固元;山萸肉,补肾涩精,二药共为臣药。白芥子,温肺祛痰,利气通络;陈皮,理气健脾,行气化痰;桃仁,活血祛瘀,止咳平喘,三药专主COPD稳定期气虚而痰瘀互结之病机。研究表明陈皮有效成分橙皮苷可以通过增强Nrf2 的表达和抑制NF-κB通路来抑制氧化应激依赖性的铁死亡[19]。肉桂,下行而补肾元,散寒邪而利气,少佐加强温肾之功;玉竹质润,一方面加强肺的润降之能,一方面防止诸药温燥偏性,共为佐使。Nrf2/SLC7A11/GPX4 途径是铁死亡调控的重要信号通路之一[20]。本研究以Nrf2/SLC7A11/GPX4 信号通路调控铁死亡为切入点,利用COPD肺肾气虚证病证结合模型大鼠探讨SQTSF改善气道炎症的潜在分子机制,为SQTSF防治COPD提供科学依据。
慢性气道炎症、粘液分泌、气道重塑和肺气肿等是COPD的重要病理指征,也是评价COPD动物模型构建成功的重要标准[21]。本研究在前期研究的基础上通过烟熏LPS+力竭游泳+背部皮下注射氢化可的松琥珀酸钠复合病因因素构建COPD肺肾气虚证模型,并给予SQTSF进行干预。结果发现MOD组大鼠肺组织病理切片表现出气道管壁增厚,气道粘膜下腺体增生,气道、血管和肺泡周围大量炎性细胞浸润、肺泡明显扩大、肺泡壁多处断裂等明显的COPD病理特征;同时发现支气管/血管周围和肺泡炎症评分以及肺气肿相关评分MLI和DI 明显上升,MAN明显下降。肺功能是COPD诊断、进展、预后及治疗反应的重要指标,本研究MOD组大鼠FEV0.1、FVC、FEV0.1/FVC、Cdyn 显著下降,表明大鼠肺功能明显降低,气道阻力增高、肺顺应性下降,有气流受限和气道阻塞。细胞因子在COPD的发生发展中发挥了重要作用[22]。本研究模型大鼠肺部表现出明显的炎性浸润,且BALF中促炎因子IL-1β、TNF-α、IL-6、IL-13明显升高。同时模型组小鼠表现出对刺激反应迟钝,精神萎顿、蜷缩拱背,喜聚成堆闭目静卧以及存在鼠体质量和抓力增长缓慢。以上表现符合COPD肺肾气虚证病证结合大鼠模型病理表现。APL 临床常被用于COPD稳定期患者,可松弛支气管平滑肌,且具有一定抗炎作用,研究表明APL能有效减轻COPD大鼠肺实质和气道炎症[23,24]。本研究发现APL和SQTSF干预后上述病理改变均有明显改善,且改善效果明显优于APL组,说明SQTSF改善COPD气道炎症病理改变的效果确切可靠,探索其改善COPD气道炎症相关机制具有重要意义。
铁死亡是一种铁依赖性和脂质过氧化驱动的新型PCD方式,过量ROS和脂质过氧化物的蓄积是铁死亡的重要生化特征;线粒体变小、嵴减少、膜密度增加和膜破裂增加是其典型微观形态特征[25]。铁死亡的机制主要受SLC7A11、GPX4、ACSL4 等一组特殊基因调控。细胞不稳定铁池(LIP)和脂质过氧化产物的蓄积是铁死亡的典型标志特征之一[26]。细胞外的Fe3+通过转铁蛋白受体摄取到细胞质被还原成Fe2+并释放到LIP,胞内铁储存蛋白可与铁离子结合形成稳定的金属蛋白复合物,是把控铁的氧化还原的开关;当细胞内“铁过载”,Fe2+与过氧化物发生芬顿反应产生大量的ROS导致脂质过氧化损伤[27]。GPX4是铁死亡调控的关键物质,能够将有毒的磷脂氢过氧化物转化为无毒的醇脂,减少细胞的氧化损伤,在阻断细胞铁死亡中起关键作用[28]。谷胱甘肽(GSH)是GPX4发挥该功能所必需辅助因子,GPX4通过将GSH转化成氧化型谷胱甘肽,参与清除磷脂过氧化物的过程,在维持细胞内氧化还原平衡方面起着至关重要的作用[29]。当GPX4 活性降低时,ROS、脂质过氧化产物MDA无法及时被清除而蓄积是驱动铁死亡的重要因素[23]。本研究发现MOD组大鼠肺组织ROS、MDA、Fe2+、总铁离子明显上升、GSH 明显下降,而SQTSF能有效改善上述指标,且疗效明显。提示COPD肺肾气虚证模型构建的复合病因因素烟熏+LPS+力竭游泳+背部皮下注射氢化可的松琥珀酸钠可诱导COPD肺肾气虚证大鼠肺组织氧化应激和铁死亡,引发炎症反应,而SQTSF对模型大鼠肺组织氧化应激和铁死亡有明显的抑制作用。研究表明铁死亡在COPD气道炎症的发生发展密切相关,SQTSF能抑制肺组织细胞铁死亡和氧化应激。
正常生理条件下,System Xc-逆向转运蛋白系统将胞外胱氨酸输入胞质,然后被还原为半胱氨酸,进而转化为GSH,增加GPX4活性发挥氧化作用[30]。SLC7A11是System Xc-系统的特异性轻链亚基,可作为拮抗铁死亡的调节剂,维持细胞氧化还原稳态,当SLC7A11会导致GSH消耗,进而下调GPX4,导致铁依赖性脂质过氧化物积累引起的细胞/亚细胞膜损伤;在正常生理条件下,GPX4和SLC7A11共同维护细胞的氧化还原平衡,抑制脂质过氧化所致的细胞铁死亡[31]。Nrf2是调控细胞氧化还原稳态和炎症的关键转录因子,SLC7A11 是其下游靶基因,研究表明Nrf2 可通过调控SLC7A11/GPX4 途径维持细胞内氧化还原稳态,参与调控铁死亡[32]。与之相反,ACSL4 则通过ATP依赖性方式将辅酶A酯化为多不饱和脂肪酸,通过催化花生四烯酸转化成乙酰辅酶A,形成易被氧化的膜磷脂促进细胞铁死亡的发生[33]。因此,GPX4、SLC7A11和ACSL4作为铁死亡过程的关键酶,通常被认为是铁死亡活动的重要标志,分别反向和正向调节铁死亡[34]。本研究结果表明MOD组大鼠肺组织Nrf2、GPX4、SLC7A11 明显下降,ACSL4明显上升(Plt;0.05),且MOD组大鼠肺组织透射电镜观察到肺组织细胞存在细胞质出现空泡、细胞膜断裂,线粒体损伤,线粒体外膜破裂,线粒体嵴消失等明显的细胞铁死亡特征。与MOD组比较,SQTSF各给药组大鼠肺组织Nrf2、GPX4、SLC7A11 明显上升,ACSL4明显下降(P<0.05),表明SQTSF 可能是通过Nrf2/SLC7A11/GPX4信号通路抑制铁死亡改善COPD气道炎症。
综上所述,SQTSF 可通过调控Nrf2/SLC7A11/GPX4信号通路,降低氧化应激水平,抑制铁死亡,从而改善COPD 大鼠气道炎症,初步揭示了SQTSF 防治COPD的潜在分子机制。
参考文献:
[1] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组, 中国医师协会呼
吸医师分会慢性阻塞性肺疾病工作委员会. 慢性阻塞性肺疾病诊治
指南(2021 年修订版) [J]. 中华结核和呼吸杂志, 2021, 44(3):
170-205.
[2] Wang C, Xu JY, Yang L, et al. Prevalence and risk factors of chronic
obstructive pulmonary disease in China (the China Pulmonary
Health[CPH]study): a national cross-sectional study[J]. Lancet,
2018, 391(10131): 1706-17.
[3] Qin HY, Li MD, Xie GF, et al. Associations among S100A4,
sphingosine-1-phosphate, and pulmonary function in patients with
chronic obstructive pulmonary disease[J]. Oxid Med Cell Longev,
2022, 2022: 6041471.
[4] Yoshida M, Minagawa S, Araya J, et al. Involvement of cigarette
smoke-induced epithelial cell ferroptosis in COPD pathogenesis[J].
Nat Commun, 2019, 10(1): 3145.
[5] Xu Y, Li YT, Li JX, et al. Ethyl carbamate triggers ferroptosis in liver
through inhibiting GSH synthesis and suppressing Nrf2 activation
[J]. Redox Biol, 2022, 53: 102349.
[6] 杨勤军, 童佳兵, 王传博, 等. 基于肺气虚证四级分度理论探讨“以证
统病”的肺病管理模式[J].中华中医药杂志, 2022, 37(9): 5467-70.
[7] 李建生, 余学庆. 慢性阻塞性肺疾病中医分期分级防治策略[J]. 中
医杂志, 2019, 60(22): 1895-9.
[8] 王成阳, 李泽庚.六味补气胶囊对COPD肺气虚证大鼠JAK/STAT通
路、MMPs/TIMP的影响[J].中华中医药杂志, 2014, 29(5): 1384-90.
[9] 张 伟, 张心月, 邵雨萌. 中医药对各型慢性阻塞性肺疾病大鼠核因
子κB和γ-谷氨酰半胱氨酸合酶表达的影响[J]. 中国中西医结合杂
志, 2007, 27(5): 426-30.
[10]杨勤军.补肺益肾法治疗COPD稳定期系统评价及参芪调肾方调控
巨噬细胞极化改善气道炎症机制研究[D].安徽中医药大学, 2023.
[11]陈进成, 刘建勋, 林成仁, 等. 基于“劳则气耗” 理论研究气虚证动物
模型的建立方法[J]. 中国中药杂志, 2018, 43(11): 2177-83.
[12]Wang H, Sorenson EJ, Spinner RJ, et al. Electrophysiologic findings
and grip strength after nerve injuries in the rat forelimb[J]. Muscle
Nerve, 2008, 38(4): 1254-65.
[13]Ridzuan N, Zakaria N, Widera D, et al. Human umbilical cord
mesenchymal stem cell-derived extracellular vesicles ameliorate
airway inflammation in a rat model of chronic obstructive
pulmonary disease (COPD)[J]. Stem Cell Res Ther, 2021, 12(1): 54.
[14]Yao CW, Piao MJ, Kim KC, et al. Cytoprotective effects of 6'-Ogalloylpaeoniflorin
against ultraviolet B radiation-induced cell
damage in human keratinocytes[J]. In Vitro Cell Dev Biol Anim,
2014, 50(7): 664-74.
[15]Celli BR, Locantore N, Yates J, et al. Inflammatory biomarkers
improve clinical prediction of mortality in chronic obstructive
pulmonary disease[J]. Am J Respir Crit Care Med, 2012, 185(10):
1065-72.
[16]栾哲宇, 李小娟, 李 杨, 等. 基于“ 伏邪” 理论探讨慢阻肺稳定期的
病机与治疗[J]. 中医药学报, 2022, 50(5): 55-8.
[17]Zhang M, Lin W, Tao XY, et al. Ginsenoside Rb1 inhibits ferroptosis
to ameliorate hypoxic-ischemic brain damage in neonatal rats[J].
Int Immunopharmacol, 2023, 121: 110503.
[18]Wang X, Wang Y, Huang D, et al. Astragaloside IV regulates the
ferroptosis signaling pathway via the Nrf2/SLC7A11/GPX4 axis to
inhibit PM2.5-mediated lung injury in mice[J]. Int
Immunopharmacol. 2022, 112: 109186.
[19]Zhu J, Sun RP, Yan C, et al. Hesperidin mitigates oxidative stressinduced
ferroptosis in nucleus pulposus cells via Nrf2/NF-κB axis to
protect intervertebral disc from degeneration[J]. Cell Cycle, 2023,
22(10): 1196-214.
[20]Yu W, Liu WD, Xie D, et al. High level of uric acid promotes
atherosclerosis by targeting NRF2-mediated autophagy dysfunction
and ferroptosis[J]. Oxid Med Cell Longev, 2022, 2022: 9304383.
[21]Fricker M, Deane A, Hansbro PM. Animal models of chronic
obstructive pulmonary disease[J]. Expert Opin Drug Discov, 2014,
9(6): 629-45.
[22]Barnes PJ. New anti-inflammatory targets for chronic obstructive
pulmonary disease[J]. Nat Rev Drug Discov, 2013, 12(7): 543-59.
[23]王丽静, 罗百灵, 李秀英, 等. 乙酰化组蛋白H4及组蛋白去乙酰基酶
2 在慢性阻塞性肺疾病大鼠肺组织中的表达及氨茶碱的抗炎作用
[J]. 中华结核和呼吸杂志, 2010, 33(1): 67-8.
[24]王 胜, 熊玲玲, 邓 雪, 等. 氨茶碱和辛伐他汀对慢性阻塞性肺疾病
大鼠气道炎症和气道黏液高分泌的影响[J]. 中南大学学报: 医学
版, 2016, 41(1): 37-43.
[25] Jin X, Tang JR, Qiu XY, et al. Ferroptosis: emerging mechanisms,
biological function, and therapeutic potential in cancer and
inflammation[J]. Cell Death Discov, 2024, 10(1): 45.
[26]Chen X, Kang R, Kroemer G, et al. Organelle-specific regulation of
ferroptosis[J]. Cell Death Differ, 2021, 28(10): 2843-56.
[27]Wu PY, Zhang XY, Duan DY, et al. Organelle-specific mechanisms
in crosstalk between apoptosis and ferroptosis[J]. Oxid Med Cell
Longev, 2023, 2023: 3400147.
[28]Xue Q, Yan D, Chen X, et al. Copper-dependent autophagic
degradation of GPX4 drives ferroptosis[J]. Autophagy, 2023, 19(7):
1982-96.
[29]Nagasaki T, Schuyler AJ, Zhao JM, et al. 15LO1 dictates glutathione
redox changes in asthmatic airway epithelium to worsen type 2
inflammation[J]. J Clin Invest, 2022, 132(1): e151685.
[30]Yang WS, Stockwell BR. Ferroptosis: death by lipid peroxidation
[J]. Trends Cell Biol, 2016, 26(3): 165-76.
[31]Liu X, Chen C, Han D, et al. SLC7A11/GPX4 inactivation-mediated
ferroptosis contributes to the pathogenesis of triptolide-induced
cardiotoxicity[J]. Oxid Med Cell Longev, 2022, 2022: 3192607.
[32] Jiang XJ, Stockwell BR, Conrad M. Ferroptosis: mechanisms,
biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22(4):
266-82.
[33]Liang ZW, Wu Q, Wang HL, et al. Silencing of lncRNA MALAT1
facilitates erastin-induced ferroptosis in endometriosis through miR-
145-5p/MUC1 signaling[J]. Cell Death Discov, 2022, 8(1): 190.
[34]赵 敏, 张金融, 华江环, 等.基于SLC7A11/GPX4通路调控铁死亡探
讨左归丸对环磷酰胺所致卵巢早衰大鼠的影响[J].中国实验方剂学
杂志, 2024, 30(17): 60-6.
(编辑:经 媛)

