抑制Yes相关蛋白通过抑制上皮间质转化减轻CCl4诱导的小鼠肝纤维化
摘要:目的 探索Yes相关蛋白(YAP)可否通过调控上皮间质转化影响肝纤维化的发生发展。方法 将8周龄C57BL/6小鼠18只随机分为对照组、肝纤维化模型组和YAP抑制剂维替泊芬干预组,6只/组。肝纤维化模型采用四氯化碳(CCl4)溶液腹腔注射8周造模;维替泊芬干预组在CCl4基础上第7~9周采用维替泊芬腹腔注射干预。HE染色、Masson染色、肝脏生化学检测观察小鼠肝脏纤维化程度;转录组、蛋白组学测序及联合生信分析探明肝纤维化过程中上皮间质转化通路是否受YAP调控;免疫组化染色和Western blotting 检测YAP及上皮间质转化关键基因E-cadherin、N-cadherin、Twist等表达变化。采集健康体检、慢性乙型肝炎、乙肝肝硬化患者血清各60例,酶联免疫吸附法检测其中YAP、N-cadherin、Vimentin、Twist血清表达水平。C57BL/6小鼠24只随机分为对照组、肝纤维化模型组、Twist抑制剂干预组和Twist抑制剂与YAP激动剂共同干预组,6只/组。HE染色、Masson染色、网状纤维染色观察小鼠肝脏纤维化程度,Western blotting检测各组α-SMA、YAP和Twist表达变化。结果 小鼠肝组织病理学结果提示肝纤维化小鼠与对照组相比肝小叶结构破坏、假小叶形成,维替泊芬干预组纤维间隔变性,部分小叶结构恢复。随肝纤维化发生,血浆ALT、AST水平显著升高(Plt;0.01),维替泊芬干预组肝功能改善(Plt;0.01)。采用肝组织转录组、蛋白组测序及联合分析找到在肝纤维化形成和维替泊芬干预过程中同时在mRNA和蛋白水平差异表达的基因,发现了N-cadherin和Twist在3 组间差异具有统计学意义(Plt;0.05),并进行PPI 分析显示YAP 与E-cadherin、N-cadherin 存在关联。免疫组化和Westernblotting结果提示N-cadherin、Twist、Vimentin随肝纤维化形成升高,E-cadherin在肝纤维化组织中表达下降(Plt;0.01)。抑制YAP可下调肝组织N-cadherin、Twist蛋白表达(Plt;0.01)。慢性乙型肝炎患者血清YAP、N-cadherin、Vimentin和Twist水平均随肝炎及肝硬化发生升高,在APRIgt;0.5或FIB-4gt;1.45患者中显著升高(Plt;0.01)。血清YAP在健康对照、肝炎、肝硬化患者中平均水平分别为4.09、5.69和5.36 ng/mL(Plt;0.01),其与N-cadherin、Vimentin、Twist水平均呈显著正相关,相关系数分别为0.626、0.435、0.526。采用Harmine抑制小鼠肝组织Twist表达,并在Harmine基础上予以YAP激动剂XMU-MP-1干预,肝组织病理学结果提示抑制Twist使肝纤维化小鼠肝组织炎症及纤维化程度减轻,同时激活YAP表达可再次加重胶原纤维沉积。Western blotting检测结果提示Harmine下调肝纤维化小鼠肝组织中α-SMA、YAP及Twist蛋白表达,同时激活YAP使肝组织α-SMA和YAP表达升高(P=0.079,Plt;0.05)。结论 上皮间质转化是肝纤维化发生的重要机制之一,抑制YAP可通过减少上皮间质转化发生减轻肝纤维化。
关键词:肝纤维化;Yes 相关蛋白;上皮间质转化;血清标志物
根据2023 年全球疾病负担更新,全球每年有200万人死于慢性肝病[1]。病毒性肝炎、药物性肝损伤、代谢性肝病及自身免疫性肝病等各种病因均可引起长期慢性损伤,诱发肝脏反复损伤修复,形成肝纤维化,并最终发展成难以逆转的肝硬化[2]。最新数据显示全球有1.23亿肝硬化患者[3]。1990~2017年,全球肝硬化病例增加了74.5%,非酒精性脂肪性肝炎成为肝硬化的主要病因,乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)相关肝硬化病例正在减少[4, 5]。而我国HBV、HCV相关肝硬化发病率在全球仍占据首位。无症状期肝硬化可持续数月至数年,一旦进入失代偿期常出现各种并发症,导致患者频繁住院,患者的生活质量受损,若不及时肝移植具有较高死亡率[6,7]。在肝硬化基础上叠加病毒、药物或酒精等促进肝损伤的因素或合并其他并发症,尤其细菌感染,可导致肝脏和肝外器官衰竭,增加死亡率[8]。西医治疗肝纤维化的方法包括抗病毒药物、皮质酮类药物、保肝药物、人工肝支持治疗等,抗病毒药物一定程度上可逆转早期肝纤维化,但疗效低、耐药明显、副作用大[9]。肝纤维化的发生机制涉及多种细胞和信号通路,因此有效抗纤维化方案可能需要针对两种或多种策略的联合治疗。
Hippo通路及其效应物Yes相关蛋白(YAP)已被确定为啮齿动物肝星状细胞(HSC)激活和肝纤维化形成的关键调节因子[10, 11]。YAP在细胞增殖、凋亡、迁移、分化和侵袭等过程中均发挥重要作用[12, 13],参与各种肝脏疾病的发生发展。研究证实转化生长因子(TGF-β)/Smad、Hedgehog、Wnt/β-catenin 等通路与YAP/具有PDZ 结合基序的转录辅激活因子(TAZ)信号通路形成一个复杂的交互网络,共同影响肝纤维化的发生与发展[14-16]。上皮间质转化(EMT)指贴壁上皮细胞获得间质细胞的特点、迁移及侵袭能力增强的生物学过程。EMT过程以维持细胞极性、形态的E-钙黏蛋白(E-cadherin)缺失,间质细胞标志物包括N-钙黏蛋白(N-cadherin)、α-平滑肌肌动蛋白(α-SMA)、成纤维细胞特异性蛋白-1(FSP-1)、蜗牛同源物1/2(Snail1/2)等表达增多为特征。当EMT超越间充质上皮转化(MET)占据主导地位时,肝脏修复主要通过形成纤维化进行,而MET多于EMT时正常的上皮增生和纤维化减少,因此抑制EMT可减少或逆转肝纤维化过程[17]。肝细胞、胆管上皮细胞、肝祖细胞及肝星状细胞均可通过调控EMT促进肝纤维化[18]。
我们前期研究已经通过动物模型和临床标本验证证实血浆与肝组织YAP 水平与肝纤维化程度密切相关,并探明其作用机制为YAP/TAZ通过诱导肝星状细胞活化、促进TGF-β/Smad通路激活及抑制铁死亡等促进肝纤维化形成[19, 20]。然而,YAP是否通过调控上皮间质转化参与肝纤维化发生,及其具体调控机制仍需要深入研究。本研究对抑制YAP基因的小鼠肝组织进行了转录组及蛋白组学测序技术,探明YAP与上皮间质转化发生的相关性,有望为肝纤维化的精准诊断和治疗提供新的靶点。
1 材料和方法
1. 1 材料
1.1.1 实验动物 雄性SPF 级8 周龄C57BL/6 小鼠,体质量20±2 g,来源于河南斯克贝斯生物科技股份有限公司,实验动物生产许可证编号为SCXK(豫)2020-0005。饲养于蚌埠医科大学第一附属医院动物实验中心,温度24±2 ℃,湿度55%,小鼠自由摄取饲料和饮用水,光照与黑暗各12 h循环。本研究方案符合实验室动物管理与使用准则并通过蚌埠医科大学第一附属医院实验动物伦理委员会审批(伦理批号:伦动科批字[2022]第KY078号)。
1.1.2 主要试剂及仪器 1× 柠檬酸钠抗原修复液(Solarbio);一抗GAPDH(abways);YAP1、Vimentin、Twist(Proteintech);N-cadherin、α‑SMA、E-cadherin(cell signaling technology);免疫组化羊抗兔IgG二抗(中杉金桥);Western blotting 羊抗兔IgG 二抗(BIOGOT);双抗体夹心酶联免疫吸附检测试剂盒(包括YAP1、N-cadherin、Vimentin 及Twist1 等,上海茁彩生物科技有限公司)。化学发光凝胶成像仪(上海嘉鹏科技公司)、高效液相色谱仪(岛津)、质谱仪timsTOFPro(Bruke)。
1.1.3 病例选择 选取蚌埠医科大学第一附属医院感染科慢性乙型肝炎患者60例、肝硬化患者60例,选择同期就诊于体检中心的健康体检者60 例作为对照组,留取相关资料及外周血标本,将性别、年龄进行匹配。排除标准:合并严重心肺功能障碍;合并血液系统疾病;恶性肿瘤。该研究经蚌埠医科大学第一附属医院医学伦理委员会审查批准(伦理批号:2022KY078),研究对象均已签署知情同意书。
1.2 实验方法
1.2.1 小鼠肝纤维化模型建立及分组 动物实验根据不同干预分为3组,6只/组,正常对照组(Control组):腹腔注射橄榄油5 mL/kg,3 次/周,共8 周;肝纤维化模型组(CCl4组):腹腔注射橄榄油/CCl4溶液(9∶1)5 mL/kg,3次/周,共8 周;YAP 抑制剂维替泊芬干预组(CCl4+VP组),在肝纤维化模型组干预基础上,第7~9周腹腔注射维替泊芬溶液100 mg/kg,3次/周,共3周。进行转录组、蛋白组学测序及生信分析。为验证YAP与EMT的调控关系,动物根据不同干预分为4组,6只/组,正常对照组和肝纤维化模型组处理方式同上;Twist 抑制剂组(Harmine组):在肝纤维化模型组干预基础上,第7~9周腹腔注射Harmine溶液10 mg/kg,3次/周,共3周;Twist抑制剂和YAP激动剂共同干预组(Harmine+XMU-MP-1组):在肝纤维化模型组干预基础上,第7~9周先后腹腔注射Harmine 溶液10 mg/kg 及YAP 激动剂XMUMP-1溶液1 mg/kg,3次/周,共3周。
1.2.2 肝组织HE、Masson 和网状纤维染色 用剪刀剖开小鼠腹腔,充分暴露肝脏,取出肝脏后,在肝右叶同一位置切取2块0.5 cm×0.5 cm×0.3 cm大小的肝组织,放进福尔马林溶液中,用于HE染色,剩余肝组织分装后,于-80 ℃冰箱低温保存。肝组织在福尔马林溶液中固定1 d后取出,进行梯度浓度乙醇逐级脱水,二甲苯透明,并包埋于石蜡,行组织切片。分别进行苏木精-伊红染色、Masson三色和网状纤维嗜银染色,最后中性树胶封片,显微镜下观察并拍照、保存。
1.2.3 肝脏生化学检测 留取外周血于1.5 mL离心管,4 ℃静置30 min 后,离心15 min,3500 r/min,吸取上清并分装于1.5 mL EP管中,于-80 ℃下储存。血浆解冻,分别采用丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)检测试剂盒(BIOBASE),按照试剂盒上的步骤操作检测。
1.2.4 肝组织免疫组织化学染色 将切片组织固定,常规脱蜡水化、洗涤,修复液修复及磷酸盐缓冲液洗涤。切片滴加内源性过氧化物酶试剂阻断10 min,洗涤、封闭后4 ℃加入一抗YAP1(1∶100)、Vimentin(1∶2500)、Ncadherin(1∶100)、Twist (1∶200)或α-SMA(1∶500)湿盒孵育过夜。次日取片复温40min, 清洗后加入二抗,室温孵育30 min,洗涤后DAB显色,苏木精复染后中性树胶封片。
1.2.5 Western blotting 检测铁死亡关键蛋白表达水平取20 mg 冷冻肝组织,细胞裂解液处理,离心后取上清,测定蛋白浓度。进行SDS-PAGE 电泳,将蛋白转至PVDF 上,用含5%脱脂奶粉的TBST 封闭,清洗后加入一抗α-SMA(1∶1000)、YAP1(1∶8000)、GAPDH(1∶8000)、E-cadherin(1∶1000)、N-cadherin(1∶1000)、Twist(1∶2500),4 ℃孵育过夜,TBST 洗涤后加二抗(1∶10 000),置于室温1 h,TBST洗涤后ECL显影并拍照保存。采用 Image J 对蛋白条带进行灰度分析。
1.2.6 小鼠肝组织转录组学测序 选取对照组4例、肝纤维化组4例、维替泊芬组3例肝组织进行质量检测,符合转录组测序和蛋白组学测序样品质量标准。肝组织转录组测序:Triol提取小鼠肝组织总RNA进行样品检测,对于检测合格的总RNA样品使用oligo(dT)磁珠富集mRNA。mRNA中加入打断试剂,将其片段化,配制一链、二链反应体系合成cDNA。修复双链cDNA末端,在3'末端加上A碱基,并配制接头连接反应体系,使接头与cDNA连接。通过PCR反应体系对产物进行扩增,文库质检,合格的文库进行环化。单链环状DNA分子通过滚环复制,形成一个包含多个拷贝的DNA纳米球(DNB)。将得到的DNBs采用高密度DNA 纳米芯片技术,加到芯片上的网状小孔内,在DNBSEQ 平台上进行测序。测序得到的原始数据使用SOAPnuke进行过滤。
1.2.7 肝组织蛋白质组学测序 提取小鼠肝组织蛋白,Bradford定量蛋白浓度,提取10 μg蛋白质进行SDS聚丙烯酰胺凝胶电泳,蛋白酶解为肽段。所有样本等量肽段混合,流动相A稀释并进样,采用液相系统对样品进行液相分离。监测洗脱峰、收集组分,结合色谱洗脱峰图合并样品得到10个组分并冷冻抽干。将抽干的肽段样品复溶,离心取上清进样,通过nanoElute分离,纳升液相分离末端直接连接质谱仪进行检测。经过液相分离的肽段通过CSI纳升源离子化后进入到timsTOF Pro进行依赖采集(DDA)模式检测。下机的DDA数据使用MaxQuant整合的Andromeda引擎完成鉴定,接着使用Spectronaut对该结果进行谱图库构建。同时肽段离子化后进入timsTOF Pro进行非依赖采集(DIA)模式检测,使用mProphet算法完成数据分析和质控。
1.2.8 临床资料采集 采集60例健康体检者、慢性乙型肝炎、肝硬化患者的性别、年龄及实验室检查资料,包括白细胞(WBC)、血小板(PLT)、白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、谷氨酰转肽酶(GGT);计算无创血清学模型APRI=[AST(U/L)/ULN(U/L)]/PLT(×109/L)×100,ULN:正常值上限;FIB-4=[age(years)×AST(U/L)][/ PLT(×109/L)×ALT(U/L)1/2]。
1.2.9 血清YAP、N-cadherin、Vimentin、Twist 检测 空腹12 h抽取患者外周静脉血4 mL于无抗凝真空采血管中,4 ℃离心,-80 ℃冰箱保存备用。采用双抗体夹心酶联免疫吸附法试剂盒统一检测血清中YAP1、Ncadherin、Vimentin及Twist1表达水平,操作按照产品说明书进行。
1.3 统计学分析
采用SPSS25.0 统计软件进行数据分析,并使用GraphPad Prism 8.0制图。计量资料根据是否符合正态分布采用均数±标准差或中位数及四分位数间距M(IQR)表示。多组间比较采用单因素方差分析,进一步两两比较采用LSD检验。血清YAP与其他血清指标的相关性采用Spearman相关性分析进行评价。当Plt;0.05时以为差异具有统计学意义。
2 结果
2.1 YAP抑制剂维替泊芬改善肝纤维化
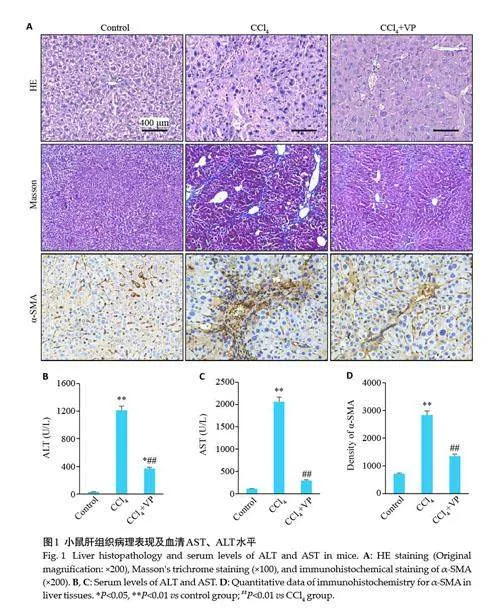
与对照组小鼠相比,肝纤维化组小鼠假小叶形成,肝纤维化造模成功,经YAP抑制剂维替泊芬干预肝纤维化程度改善。HE染色显示肝纤维化组汇管区可见炎性细胞增多,正常肝小叶结构破坏,肝索重新排布,维替泊芬组肝组织切片内未见明显炎细胞浸润,小叶结构稍紊乱,可见纤细纤维间隔。Masson染色显示与对照组相比,肝纤维化组可见组织内中央静脉和门静脉区胶原纤维沉积明显,形成假小叶,维替泊芬组与肝纤维化组相比胶原纤维沉积减少,纤维间隔变细甚至消退,部分小叶结构恢复(图1A)。免疫组织化学染色显示对照组未见明显α-SMA阳性表达,肝纤维化组阳性表达显著增多,主要位于成纤维细胞,沿纤维条索分布,经维替泊芬干预阳性表达区域明显减少(图1A、D)。肝纤维化小鼠ALT、AST水平较对照组显著升高(Plt;0.01),同时腹腔注射维替泊芬可使ALT、AST明显下降(Plt;0.01,图1B、C)。
2.2 转录组联合蛋白组测序分析YAP与上皮间质转化的相关性
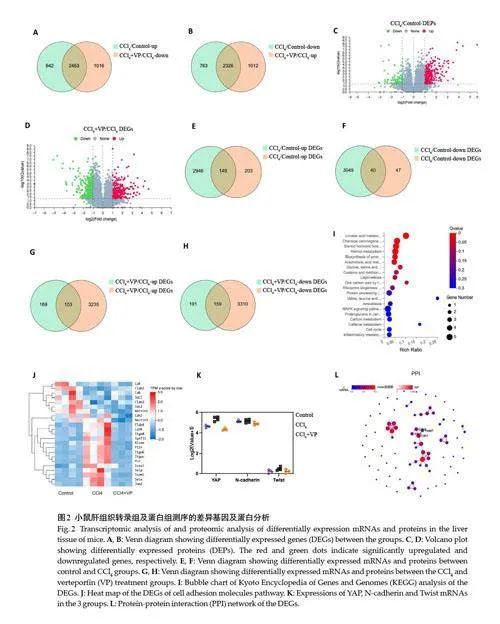
转录组测序结果显示,与对照组相比,CCl4组差异表达的基因为6184个,与纤维化组相比,维替泊芬(VP)组差异基因为6807个;其中肝纤维化相对于对照组上调和VP相对CCl4组下调的共同差异基因为2453个,肝纤维化相对于对照组下调和VP相对肝纤维化组上调的共同差异基因为2326 个(图2A、B)。同时对肝组织进行蛋白组学测序,CCl4组相对于对照组上调和下调的差异蛋白分别为267和87个,CCl4+VP组相对于CCl4组上调和下调的蛋白分别为273和353个(图2C、D)。将转录组和蛋白组测序结果联合分析,与对照组相比,CCl4组149个基因在mRNA和蛋白水平上均上调,40个基因均下调(图2E、F);与CCl4组相比,VP组103个基因mRNA和蛋白的表达均上调,159个基因均下调(图2G、H)。3组间共有88个共同差异表达基因,进行KEGG富集分析发现主要归集于亚油酸代谢、化学致癌和甾体激素生物合成等功能通路(图2I)。聚类热图展示了23 个细胞粘附分子通路的基因在3组间表达情况,其中EMT相关基因Cdh2、Nectin3 等在CCl4组显著上调、CCl4+VP组下调(图2J)。YAP、N-cadherin、Twist在3组间的基因表达量如图2K所示,将上述及其他显著差异基因纳入PPI网络分析,发现YAP与E-cadherin、N-cadherin相关联(图2L)。
2.3 抑制YAP减轻上皮间质转化
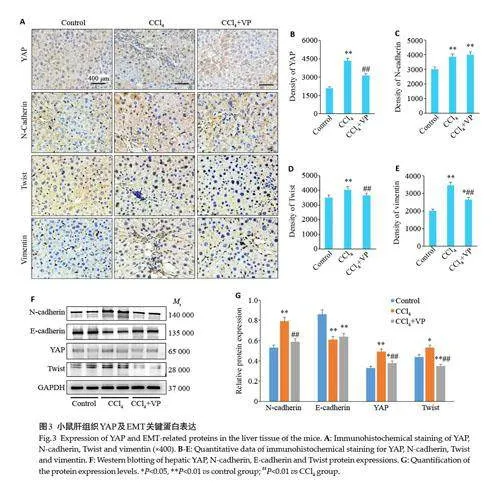
对YAP 及上皮间质转化的关键蛋白N-cadherin、Twist、Vimentin进行免疫组化检测,结果显示对照组可见YAP表达于肝细胞胞质,与其相比,肝纤维化小鼠肝小叶的窦周细胞和纤维化区域的肌成纤维细胞胞核内YAP阳性表达显著增加,而VP干预后YAP阳性细胞数显著降低(图3A、B)。对照组可见少量N-cadherin、Twist、Vimentin表达,肝纤维化组的肝细胞及汇管区间叶组织各区域上述指标可见阳性表达,经VP 干预后Twist、Vimentin 表达显著减少(图3A、3C~E)。采用Western blotting 技术检测肝组织YAP 及N-cadherin、E-cadherin、Twist蛋白表达,结果显示CCl4显著提高了YAP、N-cadherin 和Twist 蛋白表达,降低了E-cadherin表达,而VP使YAP、N-cadherin和Twist 表达较肝纤维化组降低(图3F、G)。
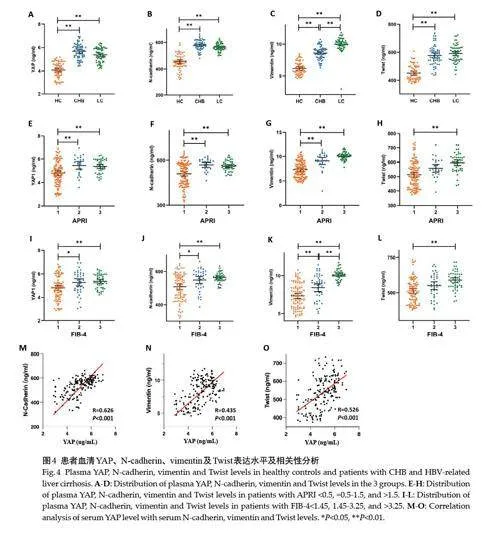
2.4 不同程度肝硬化患者血清YAP、N-cadherin、Vimentin及Twist表达
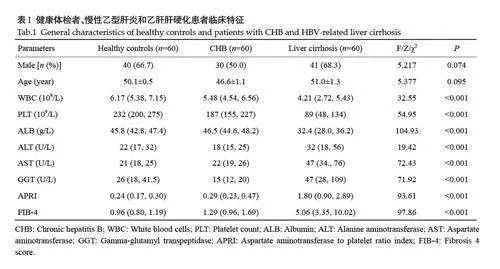
纳入性别、年龄匹配的健康体检者、慢性乙型肝炎及乙肝肝硬化患者各60 例,采集基本情况及实验室检查资料,留取外周血以检测血清中YAP、N-cadherin、Vimentin及Twist表达水平。3组间WBC、PLT、ALB随肝炎、肝硬化发生呈下降趋势,AST、APRI、FIB-4 评分呈上升趋势(表1)。与健康体检组相比,慢性乙型肝炎及乙肝肝硬化患者血清YAP 水平显著升高(Plt;0.01),健康对照、肝炎、肝硬化患者的YAP 平均水平分别为4.09、5.69和5.36 ng/mL(Plt;0.01,图4A)。EMT关键蛋白血清N-cadherin、Vimentin、Twist 水平均随肝炎及肝硬化发生升高,其中Vimentin在乙肝肝硬化患者中表达显著高于肝炎患者,其在3组间的表达水平分别为6.18、8.57和10.02 ng/mL(Plt;0.01,图4B~D)。将患者分别按照APRIlt;0.5、0.5~1.5、gt;1.5 及FIB-4lt;1.45、1.45~3.25、gt;3.25分为3组,发现APRIgt;0.5或FIB-4gt;1.45患者的血清YAP、N-cadherin和Vimentin水平显著增高(Plt;0.05),APRIgt;1.5 或FIB-4gt;3.25 患者的血清Twist水平显著升高(Plt;0.01,图4E~L)。Spearman相关性分析血清YAP水平与N-cadherin、Vimentin及Twist表达均呈显著正相关,R值分别为0.626、0.435、0.526(Plt;0.01,图4M~O)。
2.5 激活YAP逆转抑制Twist引起的肝纤维化改善
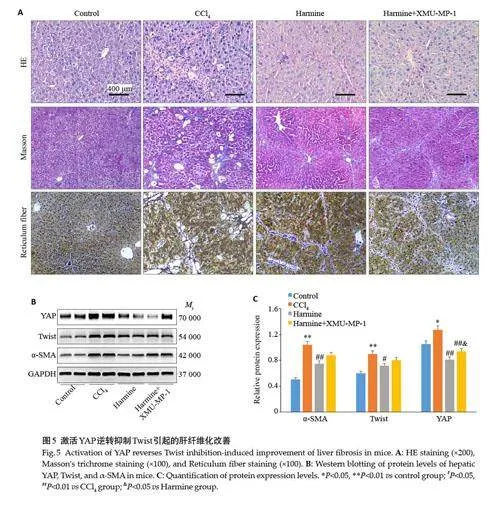
采用Twist 抑制剂Harmine 抑制小鼠肝组织内EMT 关键蛋白Twist 表达,并在抑制Twist 同时采用XMU-MP-1 活化YAP,对比两组肝纤维化程度以探明EMT在肝纤维化过程中是否受到YAP调控。与肝纤维化小鼠相比,HE染色显示Harmine干预使组织炎细胞浸润减少、脂肪变性减轻,Masson染色及网状纤维染色显示Harmine组纤维间隔变细,小叶结构破坏减轻。小鼠应用Harmine基础上予以XMP-MU-1腹腔注射可观察到肝组织炎细胞增多,可见部分假小叶,与Harmine组相比中央静脉和门静脉区胶原纤维沉积更加明显(图5A)。Western blotting 技术检测肝组织α-SMA、YAP及Twist蛋白表达,结果显示与对照组相比,3者均在肝纤维化组高表达(Plt;0.05),Harmine下调其表达水平(Plt;0.05),在此基础上激活YAP可部分恢复α-SMA和YAP高表达(图5B、C)。
3 讨论
我们既往研究发现抑制YAP显著改善肝纤维化,然而上皮间质转化作为肝纤维化发生的重要机制之一,YAP是否影响其发生值得探讨。通过对肝组织进行转录组和蛋白组学测序及联合生信分析,我们发现YAP与上皮间质转化关键基因N-cadherin 和E-cadherin 存在关联,随后在肝纤维化及维替泊芬干预小鼠肝组织中检测其蛋白表达进行验证,明确抑制YAP减轻上皮间质转化。此外,我们采集慢乙肝及肝硬化患者血清标本检测YAP、N-cadherin、vimentin 等表达水平,其表达均随肝硬化形成增加,且YAP 与N-cadherin、vimentin 等表达显著正相关。抑制小鼠EMT基因Twist表达使肝组织纤维化明显减轻,若同时过表达YAP则部分恢复纤维化情况。因此,YAP对上皮间质转化的调节作用加深了我们对YAP在肝纤维化中作用机制的认识,为采用血清YAP水平动态观察肝纤维化治疗效果及以其为靶点研发治疗药物提供理论依据。
EMT在组织发育、伤口愈合和组织纤维化过程中起着至关重要的作用,参与了许多癌细胞在肿瘤发展过程中的侵袭和迁移过程[21]。EMT伴随着上皮细胞标志物E-cadherin 表达逐渐减少,间质细胞标志物Ncadherin、vimentin 表达不断增多。通过EMT,肝脏内静止期HSC、肝细胞、胆管上皮细胞等均可转化为具有间质表型的肌成纤维样细胞,参与肝纤维化发生发展。本研究通过肝组织病理学检查、生化指标ALT、AST检测证实腹腔注射四氯化碳诱导肝纤维化造模成功,模型组E-cadherin表达相对减少,N-cadherin、vimentin表达增多,证实了EMT参与四氯化碳诱导的肝纤维化形成。此前,有研究发现长期砷暴露导致SD大鼠肝脏HA、LN、PIIINP、Col-IV表达增加,E-cadherin 表达水平下降,N-cadherin、vimentin、Snail 增高,因此证实EMT与砷致肝纤维化损伤过程密切相关[22]。肝纤维化进程中多个信号通路均对EMT具有调控作用,其中TGF-β1激活smad2/3与smad4结合并移位至细胞核,在细胞核内激活转录因子Snail、ZEB1、Twist等,调控肝上皮细胞、HSC 及干/祖细胞(HPC)发生上皮间质转化[22]。此外Hedgehog通路、Notch信号通路、Wnt/β-catenin信号通路均可诱导EMT发生,得到大量研究证实[23-26]。Hippo信号通路是一种生长抑制相关通路,参与了干细胞的癌变、组织再生和功能调控等过程[27]。当Hippo信号通路失活时,去磷酸化的YAP/TAZ与转录因子相互作用,促进生长相关基因表达,最终介导增殖和迁移。在肝纤维化过程中EMT是否受到YAP调控尚需探明。
本研究中,YAP抑制剂维替泊芬干预可减轻肝组织内胶原沉积,减少N-cadherin、vimentin表达。因此本研究提出YAP可能通过诱导肝细胞向肌成纤维细胞等间质细胞转化参与肝纤维化发生发展。随后,我们对对照组、肝纤维化小鼠和维替泊芬干预小鼠的肝组织进行转录组及蛋白组学测序并联合分析,发现N-cadherin、Twist的mRNA和蛋白水平在3 组具有显著差异,纳入YAP、E-cadherin、N-cadherin及其他显著差异基因进行PPI网络分析,发现YAP与E-cadherin、N-cadherin存在关联。此结果得到温州医科大学一项研究的支持,其指出心肌梗死相关转录物(MIAT)通过miR-3085-5p/YAP/EMT途径促进肝纤维化进展[28]。该研究采用荧光素酶实验、Pull-down 实验及流式分析等技术证实了HSC 细胞质中MIAT 和miR-3085-5p 存在共定位,即miR-3085-5p是MIAT的靶标,并进一步研究发现YAP是miR-3085-5p的靶标,过表达YAP可增强MIAT敲减所致的EMT和胶原沉积减少。因此,该研究提出调控YAP表达可影响EMT发生,二者变化趋势一致。此外,发表于J Hepatol的一篇研究[29]深入探讨了部分肝切除术(PH)后肝细胞发生的改变,发现YAP在PH 15 min后开始在肝细胞核中迅速积累,并在1 h后广泛表达。而PH前在肝细胞膜显著表达的E-cadherin于PH后24或48 h 显著下降,其机制为YAP通过pSmad2/Snai1 表达抑制上皮基因,诱导肌成纤维细胞标志物,促进上皮细胞向间质细胞转化。因此部分肝切除术中存在肝细胞EMT现象,并由YAP介导调控,证实了YAP与EMT的调控关系。
基于多组学测序及生物信息学分析结果,我们发现了肝纤维化中YAP与EMT的相关性,并采用小鼠肝组织和患者血清标本对其进行验证。免疫组化及Western blotting结果显示肝纤维化组织中N-cadherin、Twist、Vimentin呈高表达,E-cadherin表达降低,而维替泊芬可减轻上述变化。因此,维替泊芬可能通过抑制上皮间质转化发挥抗纤维化作用。E-cadherin 为目前发现的整合素家族之中的成员,抑制E-cadherin表达导致上皮细胞间的结构破坏,激活EMT过程转变为间质细胞,参与肝纤维化的进程。N-cadherin作为一种跨膜蛋白,其表达增加导致β-catenin 在细胞表面累积,导致HSC激活、胶原合成,并降低胶原降解[30]。Twist作为转录因子,与E-cadherin 的下调及N-cadherin 的上调有关,在肝硬化和HCC患者中均可观察到较高的Twist1表达。有研究显示Twist1的激活可能归因于染色质重塑蛋白BRG1和各种组蛋白修饰酶之间的动态相互作用[31]。此外,Twist1可以诱导miR-199a-3p在HSC中表达,促进HSC的活化[32]。我们调控EMT发生显示,抑制Twist使CCl4诱导的小鼠肝纤维化程度减轻,抑制Twist同时过表达YAP则使纤维化程度再次加重,因此在肝纤维化进程中YAP调控EMT发挥重要作用。
我们采集健康体检者、慢性乙型肝炎及乙肝肝硬化患者血清,检测血清中YAP、N-cadherin、vimentin 及Twist表达水平以验证YAP与EMT的相关性及临床转化可能。结果显示,与健康体检组相比,慢性乙型肝炎及乙肝肝硬化患者血清YAP水平显著升高,但APRI评分在0.5以上或FIB-4在1.45以上其未随评分升高呈上升趋势。YAP作为Hippo通路中的关键效应因子,其在HBsAg转染小鼠中显著表达。免疫组化显示在8月龄的HBsAg转基因小鼠肝组织细胞核和胞浆中均可观察到YAP 表达,并在12 月龄小鼠中表达显著增加,表明YAP在HBsAg感染过程中从炎症至肿瘤形成过程中表达逐渐增加[33]。另一研究采用免疫组化检测91例病毒性肝炎患者肝组织中YAP表达,并采用 H评分进行定量分析,肝组织纤维化及炎症分级采用Ishak评分判定。发现在坏死性炎症9~18分患者中YAP的H评分较1~8分显著升高,纤维化3~4分(45.3)及5~6分患者(45.0)间H评分无显著差异,高于1~2 分患者(11.5)[34]。此与我们的研究结果一致,即YAP随纤维化发生升高,但达到一定纤维化程度不再呈上升趋势。此外,结果显示vimentin水平随肝炎、肝硬化发生逐步升高。vimentin是中间丝的一种蛋白质,提供微管及肌动蛋白所没有的弹性,负责维持细胞骨架的完整性。有研究发现来自人类VIM基因的环状RNA片段hsa_circ_0017884在乙肝肝纤维化患者中显著高表达,其诊断肝纤维化的ROC为0.895[35],证实了vimentin 评估肝纤维化发生的准确性。Spearman 相关性分析显示血清YAP 水平与Ncadherin、vimentin 及Twist 表达均呈显著正相关,此为首次在肝纤维化这一疾病中进行YAP与EMT关键基因的相关性分析,具有一定的参考意义。
综上所述,本研究发现肝纤维化过程中抑制YAP可减少上皮间质转化发生,YAP 与EMT 标志物Ncadherin、vimentin 及Twist 表达具显著相关性,且通过YAP与Twist的分子调控实验明确了YAP调控EMT在肝纤维化发生发展中具有重要作用。该研究旨在补充YAP作为抗纤维化新型诊疗策略分子靶点的依据,且vimentin血清水平随乙型肝炎、乙肝肝硬化发生逐步升高,因此,临床采用YAP及vimentin水平动态观察抗纤维化治疗效果值得进一步验证及推广。
参考文献:
[1] Devarbhavi H, Asrani SK, Arab JP, et al. Global burden of liver
disease: 2023 update[J]. J Hepatol, 2023, 79(2): 516-37.
[2] Ginès P, Krag A, Abraldes JG, et al. Liver cirrhosis[J]. Lancet,
2021, 398(10308): 1359-76.
[3] Younossi ZM, Wong G, Anstee QM, et al. The global burden of liver
disease[J]. Clin Gastroenterol Hepatol, 2023, 21(8): 1978-91.
[4] GBD Alcohol Collaborators. Alcohol use and burden for 195
countries and territories, 1990-2016: a systematic analysis for the
Global Burden of Disease Study 2016[J]. Lancet, 2018, 392
(10152): 1015-35.
[5] Zhai MM, Long JH, Liu SS, et al. The burden of liver cirrhosis and
underlying etiologies: results from the global burden of disease
study 2017[J]. Aging, 2021, 13(1): 279-300.
[6] Allen AM, Kim WR, Moriarty JP, et al. Time trends in the health
care burden and mortality of acute on chronic liver failure in the
United States[J]. Hepatology, 2016, 64(6): 2165-72.
[7] Fabrellas N, Moreira R, Carol M, et al. Psychological burden of
hepatic encephalopathy on patients and caregivers[J]. Clin Transl
Gastroenterol, 2020, 11(4): e00159.
[8] Arroyo V, Moreau R, Jalan R. Acute-on-chronic liver failure[J]. N
Engl J Med, 2020, 382(22): 2137-45.
[9] Zhang DY, Zhang YG, Sun B. The molecular mechanisms of liver
fibrosis and its potential therapy in application[J]. Int J Mol Sci,
2022, 23(20): 12572.
[10]Mannaerts I, Leite SB, Verhulst S, et al. The Hippo pathway effector
YAP controls mouse hepatic stellate cell activation[J]. J Hepatol,
2015, 63(3): 679-88.
[11]Martin K, Pritchett J, Llewellyn J, et al. PAK proteins and YAP-1
signalling downstream of integrin beta-1 in myofibroblasts promote
liver fibrosis[J]. Nat Commun, 2016, 7: 12502.
[12]Grijalva JL, Huizenga M, Mueller K, et al. Dynamic alterations in
Hippo signaling pathway and YAP activation during liver
regeneration[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 307
(2): G196-G204.
[13]Machado MV, Michelotti GA, Pereira TA, et al. Accumulation of
duct cells with activated YAP parallels fibrosis progression in nonalcoholic
fatty liver disease[J]. J Hepatol, 2015, 63(4): 962-70.
[14]Piersma B, Bank RA, Boersema M. Signaling in fibrosis: TGF- β,
WNT, and YAP/TAZ converge[J]. Front Med, 2015, 2: 59.
[15]Swiderska-Syn M, Xie GH, Michelotti GA, et al. Hedgehog
regulates yes-associated protein 1 in regenerating mouse liver[J].
Hepatology, 2016, 64(1): 232-44.
[16]Grannas K, Arngården L, Lönn P, et al. Crosstalk between hippo and
TGFβ: subcellular localization of YAP/TAZ/smad complexes[J]. J
Mol Biol, 2015, 427(21): 3407-15.
[17]Serrano-Gomez SJ, Maziveyi M, Alahari SK. Regulation of
epithelial-mesenchymal transition through epigenetic and posttranslational
modifications[J]. Mol Cancer, 2016, 15: 18.
[18]Xie GH, Diehl AM. Evidence for and against epithelial-tomesenchymal
transition in the liver[J]. Am J Physiol Gastrointest
Liver Physiol, 2013, 305(12): G881-90.
[19]Zhao W, Zhang XX, Hou MM, et al. Traditional Chinese medicine
Yiqi Huoxue recipe attenuates hepatic fibrosis via YAP/TAZ
signaling[J]. Histol Histopathol, 2021, 36(9): 967-79.
[20]Zhao W, Lei M, Li JF, et al. Yes-associated protein inhibition
ameliorates liver fibrosis and acute and chronic liver failure by
decreasing ferroptosis and necroptosis[J]. Heliyon, 2023, 9(4):
e15075.
[21]Zhang Y, Weinberg RA. Epithelial-to-mesenchymal transition in
cancer: complexity and opportunities[J]. Front Med, 2018, 12(4):
361-73.
[22]Mizutani A, Koinuma D, Tsutsumi S, et al. Cell type-specific target
selection by combinatorial binding of Smad2/3 proteins and
hepatocyte nuclear factor 4alpha in HepG2 cells[J]. J Biol Chem,
2011, 286(34): 29848-60.
[23]Syn WK, Choi SS, Liaskou E, et al. Osteopontin is induced by
hedgehog pathway activation and promotes fibrosis progression in
nonalcoholic steatohepatitis[J]. Hepatology, 2011, 53(1): 106-15.
[24]Xie GH, Karaca G, Swiderska-Syn M, et al. Cross-talk between
Notch and Hedgehog regulates hepatic stellate cell fate in mice[J].
Hepatology, 2013, 58(5): 1801-13.
[25]Xu XC, Zhang Y, Wang X, et al. Substrate stiffness drives epithelial
to mesenchymal transition and proliferation through the NEAT1-wnt/
β-catenin pathway in liver cancer[J]. Int J Mol Sci, 2021, 22(21):
12066.
[26]Zhang K, Zhang MX, Yao QB, et al. The hepatocyte-specifically
expressed lnc-HSER alleviates hepatic fibrosis by inhibiting
hepatocyte apoptosis and epithelial-mesenchymal transition[J].
Theranostics, 2019, 9(25): 7566-82.
[27]Ma SH, Meng ZP, Chen R, et al. The hippo pathway: biology and
pathophysiology[J]. Annu Rev Biochem, 2019, 88: 577-604.
[28]Zhan YT, Tao QQ, Meng QS, et al. LncRNA-MIAT activates hepatic
stellate cells via regulating Hippo pathway and epithelial-tomesenchymal
transition[J]. Commun Biol, 2023, 6(1): 285.
[29]Oh SH, Swiderska-Syn M, Jewell ML, et al. Liver regeneration
requires Yap1-TGFβ -dependent epithelial-mesenchymal transition
in hepatocytes[J]. J Hepatol, 2018, 69(2): 359-67.
[30]Ge WS, Wang YJ, Wu JX, et al. β-catenin is overexpressed in hepatic
fibrosis and blockage of Wnt/β‑catenin signaling inhibits hepatic
stellate cell activation[J]. Mol Med Rep, 2014, 9(6): 2145-51.
[31]Dong WH, Kong M, Zhu YW, et al. Activation of TWIST
transcription by chromatin remodeling protein BRG1 contributes to
liver fibrosis in mice[J]. Front Cell Dev Biol, 2020, 8: 340.
[32]Yang XX, Ma LP, Wei R, et al. Twist1-induced miR-199a-3p
promotes liver fibrosis by suppressing caveolin-2 and activating
TGF-β pathway[J]. Signal Transduct Target Ther, 2020, 5(1): 75.
[33]Luo XF, Zhang R, Schefczyk S, et al. Nuclear translocation of YAP
drives BMI-associated hepatocarcinogenesis in hepatitis B virus
infection[J]. Liver Int, 2023, 43(9): 2002-16.
[34]Abdallah RA, Shaban MI, Taie DM, et al. Relation between
immunohistochemical expression of hippo pathway effectors and
chronic hepatitis induced fibrosis in Egyptian patients[J]. Turk
Patoloji Derg, 2020, 36(1): 48-63.
[35]Zhou ZX, Zhang RR, Li XM, et al. Circular RNA cVIM promotes
hepatic stellate cell activation in liver fibrosis via miR-122-5p/miR-
9-5p-mediated TGF-β signaling cascade[J]. Commun Biol, 2024, 7
(1): 113.
(编辑:经 媛)

