甘油三酯-葡萄糖指数与非肥胖型非酒精性脂肪性肝病的相关性
摘要:目的 探究甘油三酯-葡萄糖指数(TyG)与非肥胖型非酒精性脂肪性肝病(NAFLD)的相关性及诊断预测价值。方法 收集2020 年5 月~2023 年12 月于我院健康体检体质量指数(BMI)lt;25 kg/m2的非肥胖者,根据上腹部彩超结果分为健康对照组与NAFLD组。采用限制性立方样条(RCS)探索TyG与非肥胖型NAFLD之间非线性关系,采用LASSO回归进行变量筛选,多因素Logistic 回归探究TyG与非肥胖型NAFLD风险之间相关性。受试者工作特征(ROC)曲线评估TyG对非肥胖型NAFLD的诊断预测价值,并进行敏感性分析。结果 最终纳入3723例非肥胖型体检者,其中NAFLD患者432例,患病率为11.6%。与健康对照组相比,非肥胖型NAFLD患者中收缩压、舒张压、总胆固醇、甘油三酯、LDL-C、血尿酸、空腹血糖与TyG指数升高,HDLC降低,差异均具有统计学意义(Plt;0.05)。多因素Logistic回归结果显示,在充分校正混杂因素后,TyG每增加1个单位,非肥胖型NAFLD风险增加约2.22 倍(OR=3.22,95% CI:2.53-4.12,Plt;0.001)。与最低四分位Q1 组相比,TyG指数Q2、Q3、Q4 组的NAFLD患病风险将分别增加1.52倍(OR=2.52,95% CI:1.20-5.95)、3.56倍(OR=4.56,95% CI:2.28-10.46)与8.66倍(OR=9.66,95% CI:4.83-22.18)。RCS 曲线显示TyG指数与非肥胖型NAFLD风险显著相关,两者间呈近似线性关系(非线性检验P=0.019)。ROC曲线下面积为0.819,敏感性为78.0%,特异性为71.2%,具有较好的预测诊断价值。结论 TyG指数与非肥胖型NAFLD发生风险显著相关,可作为健康体检人群中脂肪肝早期筛查指标。
关键词:非肥胖型脂肪肝;甘油三酯-葡萄糖指数;血脂异常;胰岛素抵抗
非酒精性脂肪性肝病(NAFLD)在全球成人中患病率已达38%,是目前慢性肝病的主要原因[1]。NAFLD与腹型肥胖、内脏脂肪蓄积密切相关,然而有约40%的NAFLD患者为非肥胖者,近1/5甚至为瘦型[2]。研究表明,瘦型或非肥胖型NAFLD患者中代谢异常情况相较超重或肥胖型NAFLD患者较轻,更少合并有糖尿病、高血压、腹型肥胖及代谢综合征[3]。然而,也有研究发现,瘦型NAFLD进展期的患者中肝纤维化程度更重,心血管发病率与全因死亡率或更高[3]。NAFLD被认为是代谢综合征在肝脏的主要表现,与其他代谢性疾病之间存在密切关联,并且随着肥胖、糖尿病的增加其发病率正在不断升高[4]。心血管疾病(CVD)是NAFLD最常见的肝外并发症并且是NAFLD患者的首要死因[4, 5]。NAFLD可通过多种机制促进CVD发生与进展,包括糖脂代谢异常、胰岛素抵抗、免疫与系统炎症、神经内分泌稳态失衡、血栓形成激活以及肾素-血管紧张素系统亢进等[4]。根据美国国家健康与营养调查数据显示,即使调整人口学、疾病史与代谢因素后,罹患NAFLD仍将导致CVD发病风险增加23%[6]。甘油三酯-葡萄糖指数(TyG)作为系统胰岛素抵抗的简易替代指标,已被普遍应用于临床研究与实践中。既往研究表明,TyG指数可以较好地预测NAFLD的发生及严重程度[7-9],但目前尚无大规模人群研究TyG指数在非肥胖型NAFLD中的关系。因此,本研究通过收集本院健康体检数据,探究TyG指数与非肥胖型NAFLD的相关性及预测价值。
1 资料和方法
1.1 研究对象
收集2020年5月~2023年12月于西安交通大学第二附属医院健康体检的非肥胖者,根据上腹部彩超结果分为健康对照与NAFLD组。纳入标准:年龄≥18 岁;BMIlt;25 kg/m2;性别不限,具有上腹部彩超检查结果。排除标准:无身高、体质量、腰围等人体学数据;无血常规、血脂结果;肝功结果不全者。该研究为横断面调查,不涉及患者个人隐私信息,豁免知情同意。研究经西安交通大学第二附属医院医学伦理委员会审查批准(伦理批号:2022202)。
本研究非肥胖型NAFLD诊断标准为:上腹部超声结果提示脂肪肝;BMIlt;25 kg/m2 (亚洲人群)[10]。
1.2 血浆生化指标检测
收集患者一般人口学资料、人体学数据、吸烟史与实验室化验结果。所有患者均于入院次日清晨抽取空腹静脉血,血常规、肝肾功、血脂、血糖、血尿酸等化验统一送由我院检验科进行检测,包括空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、γ氨基转肽酶(GGT)、碱性磷酸酶(ALP)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、肌酐(Cr)、血尿酸(SUA)。TyG指数计算公式为ln[ TG( mg/dL)×FPG( mg/dL)/2][11]。
1.3 上腹部超声检查
上腹部超声由高年资经验丰富的超声科医生负责检查。受检者需在空腹12 h后于上午接受检查,采取平卧位或者左右侧卧位,充分暴露上腹部,涂抹适量耦合剂后,采用凸阵式B型超声诊断仪(飞利浦)进行检查,频率为3.5 Hz。检查顺序按剑突下、右肋缘下、右肋间、左肋缘下及左肋间对受检者上腹部脏器进行斜、纵、横等多方面扫查,观察肝胆情况并进行详细记录。典型脂肪肝声像图表现为肝区前场弥漫性点状高回声,肝区后场回声衰减、光点稀疏,肝脏可轻度或中度肿大[12]。
1.4 统计学分析
采用R Studio软件进行统计分析与绘图。采用随机森林法对缺失值进行插补。计量资料以均数±标准差表示,符合正态分布者组间比较采用独立样本t检验,非正态分布者采用Mann-Whitney U非参数检验;计数资料以率或百分比表示,组间比较采用χ2检验或Fisher精确检验。采用最小绝对值收敛和选择算子算法(LASSO)回归进行变量筛选,多因素Logistic回归探究TyG与非肥胖型NAFLD发病之间相关性,模型1 未校正其他变量,模型2调整年龄、性别、BMI,模型3调整在模型2基础上进一步调整收缩压、舒张压、腰围、HDL-C、LDL-C、谷丙转氨酶、血尿酸、肌酐。利用R 中“plotRCS”包基于Logistic 回归对模型3 中协变量进行校正,以TyG值的第5、35、65、95 百分位数点作为参考点,设置4个结点绘制限制性立方样条图(RCS),以探究TyG与非肥胖型NAFLD患病风险之间的非线性关系。采用ROC曲线评估TyG指数对非肥胖型NAFLD的诊断预测价值。采用双侧检验,Plt;0.05 认为差异具有统计学意义。
2 结果
2.1 临床特征比较
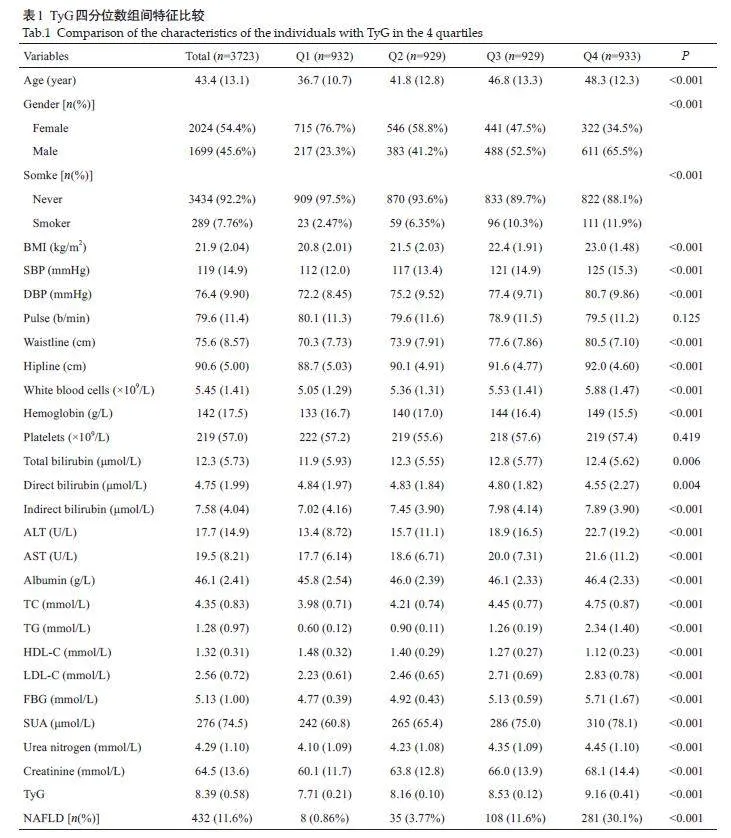
最终共纳入3723 例患者,其中NAFLD患者432例,占比11.6%。与对照组相比,非肥胖型NAFLD患者年龄、男性、吸烟者、BMI、腰围SBP、DBP、FBG、TC、TG、LDL-C、GGT、ALP、AST、ALT、Cr、SUA及TyG指数均显著升高,而HDL-C水平则明显降低(Plt;0.05)。根据TyG四分位数由低到高分为Q1~Q4组,除血小板计数外,4组间人口学、血常规、肝肾功、血脂、FBG、SUA差异具有统计学意义(均Plt;0.05)。4组间NAFLD患病率分别为0.86%、3.77%、11.6%与30.1%,呈剂量反应关系,差异具有统计学意义(Plt;0.05,表1)。
2.2 Logistic回归分析
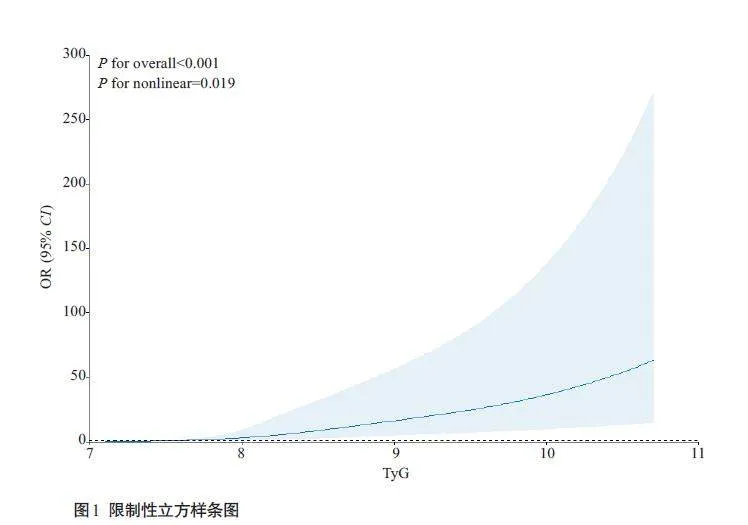
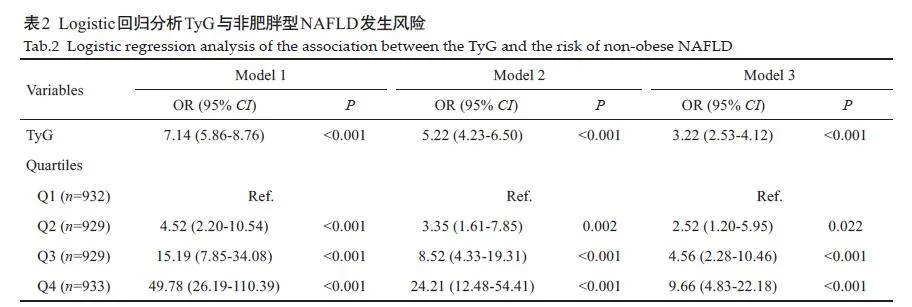
以是否患有NAFLD作为因变量,多因素Logistic回归分析结果显示,在校正年龄、性别、BMI、收缩压、舒张压、腰围、HDL-C、LDL-C、谷丙转氨酶、血尿酸、肌酐后,TyG指数每增加1 个单位,非肥胖型NAFLD的发病风险增加2.22 倍(OR=3.22,95% CI:2.53-4.12,Plt;0.001)。将TyG四分位数组按照等级有序变量纳入Logistic 回归,以最低Q1 组为参照,模型3 中Q2、Q3、Q4组的NAFLD患病风险将分别增加1.52倍(OR=2.52,95% CI:1.20-5.95)、3.56 倍 (OR=4.56,95% CI:2.28-10.46)与8.66 倍(OR=9.66,95% CI:4.83-22.18),呈现剂量反应关系(表2)。RCS结果显示,随着TyG指数的增加,非肥胖人群中NAFLD患病风险显著增加,两者间呈近似线性相关(非线性检验P=0.019,图1)。
2.3 ROC曲线
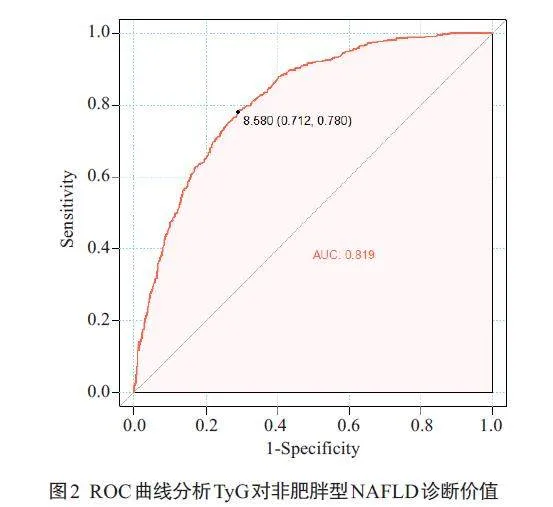
ROC曲线分析TyG指数对非肥胖型NAFLD患病风险预测效能,曲线下面积为0.819,最佳截断值为8.580,其敏感性为78.0%,特异性为71.2%(图2)。
2.4 敏感性分析
进一步限定BMIlt;23 kg/m2 的瘦型体检人群(n=2339),瘦型NAFLD与对照组间临床特征比较。根据TyG 四分位数分组,4 组NAFLD 患病率逐步增加(Q1 0.51%,Q2 0.51%,Q3 2.91%, Q4 15.0%),差异具有统计学意义(Plt;0.001)。Logistic回归结果显示,在充分校正混杂因素后,TyG指数升高与瘦型NAFLD风险显著相关(OR=3.31,95% CI:2.23-4.95)。并且与最低分位数Q1 组相比,Q4 组的NAFLD风险明显升高(OR=7.90,95% CI:2.65-34.09)。RCS 曲线显示,TyG与瘦型NAFLD风险呈非线性相关(Plt;0.001,非线性检验P=0.009)。
3 讨论
NAFLD是一种多系统疾病,其中胰岛素抵抗和相关代谢紊乱在NAFLD及其相关肝脏并发症(肝硬化、肝衰竭与肝细胞癌)和肝外并发症(心血管疾病、2型糖尿病、慢性肾脏病及某些类型肝外癌症)的发展中起着关键致病作用[1, 13]。目前三个大型国际肝病协会均推荐使用代谢障碍相关性脂肪性肝病替代传统NAFLD诊断[1, 14]。由于本研究所引用文献中仍多使用NAFLD这一称谓,为保持统一,本文仍旧沿用NAFLD指代脂肪肝病。本研究最终纳入3723例非肥胖型体检者,其中NAFLD 患者432 例,粗患病率为11.6%。非肥胖型NAFLD患者中SBP、DBP、TC、TG、LDL-C、SUA、FBG与TyG指数较健康对照组均显著升高,HDL-C则降低。TyG指数升高与非肥胖人群中NAFLD风险显著相关,ROC曲线下面积为0.819,敏感性为78.0%,特异性为71.2%,具有较好的预测诊断价值。
据统计,NAFLD全球成人患病率已达38%,其中相当部分患者为瘦型或非肥胖型。一项大型荟萃分析结果显示, NAFLD患者中19.2% 表现为瘦型,40.8%为非肥胖型。而在普通人群中,非肥胖型NAFLD的平均患病率为12.1%,瘦型NAFLD为5.1%[2]。本研究基于西北地区某大型三甲医院健康体检数据,其中非肥胖型NAFLD患病率为11.7%,与荟萃分析结果非常接近。目前对于非肥胖型NAFLD的病理生理机制与危险因素尚未完全阐明,认为与胰岛素抵抗、动脉粥样硬化性血脂异常及体脂成分改变密切相关,部分患者还可能具有遗传易感性[15]。有报道,非肥胖型NAFLD患者进展为非酒精性脂肪性肝炎(NASH)或晚期纤维化的比例较肥胖型患者略低[16]。然而与单纯性肥胖者相比,非肥胖型NAFLD患者中代谢异常情况仍要更加普遍且严重,甚至女性患者中心脏-代谢风险要高于肥胖型NAFLD患者[17]。本研究中非肥胖型NAFLD患者普遍存在血脂异常,包括高甘油三酯血症、高LDL-C与低HDL-C 血症等。致动脉粥样硬化性血脂异常是NAFLD患者CVD风险增加的重要危险因素,也成为脂肪肝患者的首要死亡原因[18]。同时,无论非肥胖型或瘦型NAFLD患者中TyG指数均显著升高,提示系统性胰岛素抵抗在其发病与进展中仍可能发挥着关键作用。
NAFLD由早期单纯性脂肪变性进展为NASH或晚期纤维化后,其肝脏并发症与心血管风险将显著增加[19]。因此早筛查、早诊断、尽早生活方式干预尤为重要。TyG指数作为胰岛素抵抗的替代性指标已在许多研究中得到证实[20]。与传统NAFLD预测指标如脂肪肝指数、肝脂肪变性指数等相比,TyG指数计算更为简便经济,且预测效能良好。同时,研究表明NAFLD合并冠心病患者中TyG指数显著高于无冠心病患者,提示TyG指数还与NAFLD患者心血管风险密切相关[21]。此外,TyG指数能更好地反映非肥胖型NAFLD患者体内胰岛素抵抗和代谢紊乱程度,更加贴近其病理生理机制,可用于治疗效果评估与监测。对于正常体质量范围内NAFLD患者,生活方式干预与减重可能效果有限,亟需揭示新的治疗靶点与干预措施。近期一项研究表明,非肥胖型NAFLD患者粪便中胆汁酸和丙酸水平显著升高[22],并通过菌群测序成功鉴别出四种与肝纤维化进展相关的菌属,这为调节肠道微生物及代谢产物改善脂肪肝提供了新的思路。
本研究存在一定不足。首先,本研究为单中心、横断面调查,无法进行因果推断,且人群多为汉族并长期居住于西安地区,考虑到种族、地域与饮食习惯差别,结论外推时需谨慎。其次,研究中NAFLD诊断依靠上腹部超声检查而非肝活检病理诊断,对于肝脂肪变性较轻患者可能存在漏诊。最后,研究未能进探究TyG指数与NAFLD严重程度之间相关性。综上,本研究通过多因素回归与敏感性分析证实,TyG指数与体检人群中非肥胖型NAFLD风险显著相关,并具有良好的诊断预测效能,有助于NAFLD早期筛查和尽早干预。
参考文献:
[1] Targher G, Byrne CD, Tilg H. MASLD: a systemic metabolicdisorder with cardiovascular and malignant complications[J]. Gut,2024, 73(4): 691-702.
[2] Ye Q, Zou BY, Yeo YH, et al. Global prevalence, incidence, andoutcomes of non-obese or lean non-alcoholic fatty liver disease: asystematic review and meta-analysis[J]. Lancet GastroenterolHepatol, 2020, 5(8): 739-52.
[3] Xu RH, Pan JS, Zhou WJ, et al. Recent advances in lean NAFLD[J].Biomed Pharmacother, 2022, 153: 113331.
[4] Targher G, Byrne CD, Tilg H. NAFLD and increased risk ofcardiovascular disease: clinical associations, pathophysiologicalmechanisms and pharmacological implications[J]. Gut, 2020, 69(9): 1691-705.
[5] Cai JJ, Zhang XJ, Ji YX, et al. Nonalcoholic fatty liver diseasepandemic fuels the upsurge in cardiovascular diseases[J]. Circ Res,2020, 126(5): 679-704.
[6] Stepanova M, Younossi ZM. Independent association betweennonalcoholic fatty liver diease and cardiovascular disease in the USpopulation[J]. Clin Gastroenterol Hepatol, 2012, 10(6): 646-50.
[7] 卢 蓉, 李 慧, 张 超, 等. 甘油三酯/葡萄糖指数预测非酒精性脂肪性肝病严重程度效能研究[J]. 实用肝脏病杂志, 2023, 26(6): 805-10.
[8] 张 沥, 陈海滨, 宋俊华. TyG-BMI对非酒精性脂肪性肝病的预测价值分析[J]. 中华保健医学杂志, 2023, 25(2): 151-4.
[9] 康 娟, 刘文徽, 常 青, 等. 三酰甘油-葡萄糖指数及其衍生指数与老年男性代谢相关脂肪性肝病的相关性分析[J]. 解放军医学杂志,2023, 48(11): 1344-52.
[10]Long MT, Noureddin M, Lim JK. AGA clinical practice update:diagnosis and management ofNonalcoholic fatty liver disease in leanindividuals: ExpertReview[J]. Gastroenterology, 2022, 163(3): 764-74.e1.
[11]Wu ZG, Liu L, Wang WW, et al. Triglyceride-glucose index in theprediction of adverse cardiovascular events in patients with premature coronary artery disease: a retrospective cohort study[J].Cardiovasc Diabetol, 2022, 21(1): 142.
[12]Ozturk A, Kumar V, Pierce TT, et al. The future is beyond bright: theevolving role of quantitative US for fatty liver disease[J].Radiology, 2023, 309(2): e223146.
[13]Cobbina E, Akhlaghi F. Non-alcoholic fatty liver disease (NAFLD) -pathogenesis, classification, and effect on drug metabolizingenzymes and transporters[J]. Drug Metab Rev, 2017, 49(2):197-211.
[14]Chan WK, Chuah KH, Rajaram RB, et al. Metabolic dysfunctionassociatedsteatotic liver disease (MASLD): a state-of-the-art review[J]. J Obes Metab Syndr, 2023, 32(3): 197-213.
[15]Phipps M, Wattacheril J. Non-alcoholic fatty liver disease (NAFLD)in non-obese individuals[J]. Frontline Gastroenterol, 2020, 11(6):478-83.
[16]Tan EX, Lee JW, Jumat NH, et al. Non-obese non-alcoholic fattyliver disease (NAFLD) in Asia: an international registry study[J].Metabolism, 2022, 126: 154911.
[17]Zhang ZY, Zhang L, Jiang WY, et al. Non-obese NAFLD had nobetter cardio-metabolic risk profile than obese NAFLD in type 2diabetic patients[J]. Cardiovasc Diabetol, 2022, 21(1): 210.
[18]Deprince A, Haas JT, Staels B. Dysregulated lipid metabolism linksNAFLD to cardiovascular disease[J]. Mol Metab, 2020, 42: 101092.
[19]Yoshitaka H, Hamaguchi M, Kojima T, et al. Nonoverweightnonalcoholic fatty liver disease and incident cardiovascular disease:a post hoc analysis of a cohort study[J]. Medicine, 2017, 96(18):e6712.
[20]Er LK, Wu S, Chou HH, et al. Triglyceride glucose-body mass indexis a simple and clinically useful surrogate marker for insulinresistance in nondiabetic individuals[J]. PLoS One, 2016, 11(3):e0149731.
[21]Zhao JQ, Fan HX, Wang T, et al. TyG index is positively associatedwith risk of CHD and coronary atherosclerosis severity amongNAFLD patients[J]. Cardiovasc Diabetol, 2022, 21(1): 123.
[22]Lee G, You HJ, Bajaj JS, et al. Distinct signatures of gut microbiomeand metabolites associated with significant fibrosis in non-obeseNAFLD[J]. Nat Commun, 2020, 11(1): 4982.
(编辑:余诗诗)
基金项目:国家自然科学基金青年项目(82100359);陕西省自然科学基金一般项目(2020JQ-552; 2023-JC-YB-709)

