芎归汤通过抑制氧化应激诱导的心肌凋亡减轻小鼠心梗后心衰引起的心肌损伤
摘要:目的 基于网络药理学结合实验验证探索芎归汤对心梗后心衰小鼠心脏功能、心脏病理的改善及作用机制。方法 通过TCMSP、GeneCards、CTD等数据库搜索药物活性成分作用靶点与疾病相关靶点,并将二者取交集。采用DAVID数据库对交集靶点进行GO、KEGG通路富集分析。体内实验采用冠脉结扎构建心梗后心衰小鼠模型,分为假手术组(Sham,n=8)、模型组(Model,n=8)和芎归汤治疗组(XGT,3 g/kg,n=8)。体外实验采用叔丁基过氧化氢诱导H9C2细胞凋亡,分为常规培养的对照组(Control)、 叔丁基过氧化氢组(TBHP)、芎归汤低剂量组(XGT,50 μg/mL)和芎归汤高剂量组(XGT,100 μg/mL)。通过HE、Masson、qPCR、免疫组化、CCK8、ROS、MDA、SOD、Hoechst 33342/PI和JC-1检测,探索芎归汤抗心衰的作用机制。结果 网络药理学分析结果显示,芎归汤治疗心衰的潜在作用靶点共62 个,其核心靶点包括PTGS2、ESR1、Caspase3、PPARG、HSP90AA1、BCL2、JUN、GSK3B等,富集分析显示这些靶点可能涉及细胞凋亡、AGE-RAGE信号通路、P53 信号通路、PI3KAkt信号通路、VEGF信号通路等。体内结果显示,芎归汤能够减少心衰小鼠心肌细胞损伤、减轻心室重构,从而改善心衰小鼠心功能(Plt;0.05)。芎归汤能够抑制心肌凋亡相关蛋白Caspase3 和BAX的表达,促进BCL2 的表达(Plt;0.05)。体外实验表明,芎归汤通过抑制氧化应激,从而减轻叔丁基过氧化氢诱导的心肌细胞凋亡(Plt;0.05)。结论 芎归汤能减轻心梗后心衰引起的心肌损伤,改善心衰小鼠心功能,芎归汤可能通过抑制氧化应激诱导的心肌凋亡发挥抗心衰的作用。
关键词:芎归汤;心力衰竭;网络药理学;细胞凋亡;氧化应激
心血管疾病是世界范围内死亡的主要原因,给社会带来了巨大的经济负担。因此,预防和治疗这些疾病以及开展相关研究至关重要。由于血运重建技术的普及,急性心肌梗死的死亡率持续下降,大多数心梗患者已进入心脏恢复期,随着人口老龄化,心力衰竭的患病率逐渐增加[1]。心肌梗死恢复期的过度修复会导致心脏功能障碍并促进心室重塑,最终导致心衰,心肌细胞死亡是心梗后心衰的重要病理基础,并贯穿整个疾病过程[2]。延缓心肌细胞死亡被认为是保护心脏功能的有效策略。因此,开发有效的药物疗法来延缓心肌细胞死亡是当务之急。
芎归汤出自宋代著名医家许叔微的《普济方》卷三四五引《通真子秘方》,由当归和川芎两味中药组成,具有活血散瘀、通络止痛的作用。川芎作为君药,具有活血化瘀,行气止痛的作用,现代药理研究表明,川芎含苯酞类化合物、生物碱类及有机酸等化学成分,具有抗氧化、保护心肌、抗炎和抗凋亡等功效[3]。当归作为臣药,具有补血活血、调经止痛的作用,现代药理研究表明,其具有抗氧化、抗衰老、抗炎、抗肿瘤、镇痛和保护缺血损伤细胞等功效[4, 5]。川芎和当归配伍,养血而不滋腻, 活血而不伤正,柔络以缓络脉之拘急, 通补兼施, 通调并举,此方在临床一直被应用于心血管疾病的治疗,疗效显著,但目前关于芎归汤治疗心衰的机制尚未有报道[6]。
为了更系统、全面地阐明芎归汤治疗心衰的机制,本研究采用网络药理学方法收集芎归汤主要活性成分的靶标和心衰的靶标。建立了有效成分和疾病相互作用靶标的PPI网络。然后使用基因本体论(GO)分析和京都基因和基因组百科全书(KEGG)富集分析来研究生物功能和功效的信号通路。最后,利用小鼠冠脉结扎构建心梗后心衰模型和叔丁基过氧化氢诱导H9C2 心肌细胞凋亡模型,在体内和体外对所提出的功能成分和主要靶标进行了实验验证。中药具有多成分多靶点的特点,本研究通过网络药理学构建药物-疾病-靶点互作网络,预测芎归汤治疗心衰的作用靶点和药理作用机制,再利用体内外实验进行验证,为临床应用芎归汤治疗心衰提供科学依据,为中药治疗疾病的物质基础和作用机制提供新的见解。
1 材料和方法
1.1 芎归汤成分筛选
从TCMSP(https://old.tcmsp-e.com/tcmsp.php)数据库中获得芎归汤中川芎和当归的化合物及其相应靶标。药物进入人体后进入循环系统的量被称为口服生物利用度(OB)。药物相似性(DL)是指化学品和已知药物之间的相似性。用于检索药代动力学数据的过滤器设置为OB≥30%和DL≥0.18[7]。随后,获得了芎归汤的主要成分和相应的靶蛋白。
1.2 芎归汤治疗心衰靶点预测
将关键字“ 心衰”输入GeneCards(https://www.genecards.org/)数据库和CTD(http://ctdbase.org/)数据库获得疾病靶点。并与芎归汤靶点取交集。为了收集药物和疾病的重叠靶点,将芎归汤的潜在活性成分靶点和心衰靶点导入Venn数据库取交集。
1.3 蛋白互作网络(PPI)的构建与分析
将药物和疾病的重叠靶点导入STRING 数据库(https://string-db.org/)以获得关于蛋白质相互作用网络的信息。利用Cytoscape3.8.2 进行可视化,并构建PPI网络。并使用Network Analyzer插件分析网络节点的度值,活性成分的该数值越大,说明其成为网络中关键成分的可能性就越大。
1.4 GO富集和KEGG通路分析
利用DAVID (https://david.ncifcrf.gov/) database数据库收集GO分析和KEGG数据。GO分析用于筛选生物过程(BP)、细胞成分(CC)和分子功能(MF)。KEGG富集分析可以发现参与生物过程的重要信号通路。
1.5 实验动物
6 周龄的SFP 级健康雄性C57/BL6 小鼠,体质量18~20 g,购买自南方医科大学实验动物中心,许可证号SCXK(粤)2021-0041。在南方医科大学实验动物中心SPF级动物实验室进行饲养和实验操作。所有操作均遵循南方医科大学机构动物护理和使用委员会的指导(伦理批号:L2021061)。
1.6 试验药物及材料
芎归汤方药物组成为:川芎10 g、当归10 g,所用中药饮片购自南方医院中药房,水煎煮后旋蒸仪浓缩至20 mL,使药液1 mL相当于原生药1 g药材。肌酸激酶(CK)检测试剂盒、乳酸脱氢酶(LDH)试剂盒、天门冬氨酸氨基转移酶(AST)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);活性氧(ROS)检测试剂盒、JC-1线粒体膜电位荧光探针试剂盒(碧云天生物技术公司);BAX 一抗(Proteintech),Caspase3 一抗(Proteintech)。
1.7 分组及造模
采用冠脉结扎造模。将小鼠麻醉(50 mg/kg戊巴比妥钠,腹腔注射),用胶带固定在仰卧位,并使用小动物呼吸机辅助呼吸。在左胸骨边界的第3和第4肋间间隙之间做了一个小的水平皮肤切口,然后在分离下面的肌肉后暴露心脏。在立体显微镜下,我们使用8-0丝线结扎左前降支。左心室前壁的立即苍白和心肌活动的减少表明结扎成功[8]。假手术组(n=8)除结扎外,均采用相同的手术方法。手术后3 d,将存活的C57/BL6小鼠随机分为2 组(n=8):模型组、芎归汤组(灌胃3 g·kg-1·d-1)组。假手术组和模型组的小鼠灌胃予芎归汤组相同体积的生理盐水。常规饲养4周。
1.8 超声心动图检测小鼠心功能
使用超声高频成像系统(VisualSonics)和相应的中心频率为38 MHz 的探针(MS400)评估麻醉下小鼠的心脏功能(1.5%异氟醚)。左心室最小体积和最大体积的时相分别为收缩末期和舒张末期。测量左侧胸骨旁长轴切面的M型超声心动图收缩期左心室直径(LVDs)和舒张期左心室直径(LVDd),计算射出分率(EF)和分数缩短率(FS)。
1.9 组织病理学检查
快速取出心脏组织,用磷酸盐缓冲盐水(PBS)冲洗,固定在4%多聚甲醛中,用分级乙醇脱水,用二甲苯玻璃化,包埋在石蜡中,并切成5 μm的切片。然后通过苏木精-伊红(HE)和Masson三色染色处理心脏切片,并在倒置光学显微镜下观察。
1.10 免疫组化染色
超灵敏™ SP IHC试剂盒(MXB Biotechnologies)用于检测BAX和Caspase3的表达。简言之,通过在柠檬酸缓冲液中加热,在37 ℃下与内源性过氧化物酶阻断溶液孵育10 min。随后,将获得的切片与一抗(BAX、BCL2、Caspase3 抗体稀释比例均为1∶200)在4 ℃下孵育。第2天,将切片与生物素缀合的二抗(抗体稀释比例为1∶100)在37 ℃下孵育2 h,然后与链霉亲和素过氧化物酶在37 ℃孵育0.5 h。然后使用DAB(MXBBiotechnologies)对切片进行可视化。每个切片随机选择五个视野,并使用ImageJ软件分析积分光密度。
1.11 LDH、CK和AST检测
取材收集的血液样品在4 ℃离心机以3000 r/min离心获得血清样品。然后,按照南京建城生物工程研究所的指示,测定血浆天冬氨酸转氨酶(AST)、乳酸脱氢酶(LDH)和肌酸激酶(CK)水平。
1.12 心脏组织MDA和SOD检测
心脏组织样品在生理盐水中进行匀浆。取匀浆上清液,4 ℃下,12 000 g离心20 min。采用专用检测试剂盒(南京建成生物工程研究所)按照试剂盒说明书检测分析组织中MDA含量和SOD活性。
1.13 细胞培养
H9C2细胞在添加10%胎牛血清(FBS)和1%青霉素和链霉素的Dulbecco 改良Eagle 培养基(DMEM,Gibco)中培养,环境为5% CO2和95%空气,温度37 ℃。细胞分组:对照组(Control组)、TBHP组和XGT治疗组(XGT+TBHP)。根据后续实验结果,确定给药浓度。
1.14 细胞活力测定
通过CCK-8 测定法(Dojindo,Kumamoto)评估细胞增殖。将H9C2 心肌细胞以5×103/孔的密度接种到96孔板中,并饥饿血清24 h,然后用指定的处理浓度孵育并刺激。随后,向每个孔中加入10 μL CCK-8试剂,并在37 ℃下孵育3 h。A490nm吸光度使用微孔板读数器进行测量。
1.15 细胞ROS、SOD、MDA和JC-1测定
将H9C2细胞用不同浓度的芎归汤(50和100 μg/mL)孵育24 h,然后用200 μmol/L的TBHP处理1 h。根据制造商的方案,使用各自的商业检测试剂盒检测ROS、SOD、MDA 和JC-1 水平。使用 Cell Image Multi-Mode Microplate Reader (Cytation5, BioTek)检测ROS 和JC-1 的结果,而分别在450 nm和532 nm处用自动微板阅读器(Gene Company)分光光度法测量SOD和MDA的吸光度。
1.16 Hoechst 33342/PI 荧光染色
将药物干预后的细胞用冷 PBS 洗涤两次后,用Hoechst 33342 在室温下黑暗中染色30 min,然后用PI复染5 min。选择5个随机场,观察和量化细胞凋亡指数。
1.17 统计学分析
采用SPSS 26.0软件进行统计学分析,数据均以均数±标准差表示。数据符合方差齐时,多组比较采用单因素方差分析和LSD 事后检验,方差不齐时采用Dunnett's T3检验,Plt;0.05为差异具有统计学意义。
2 结果
2.1 芎归汤有效成分治疗心衰的潜在作用靶点
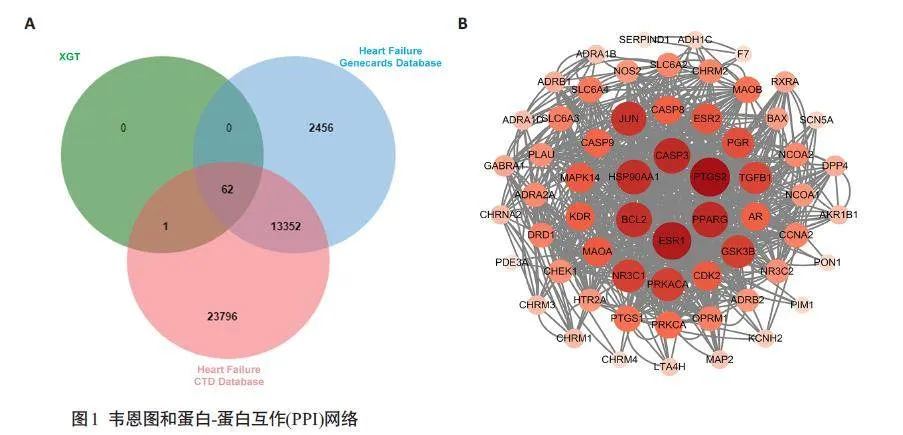
从TCMSP数据库收集芎归汤潜在靶点63个,通过Gene Cards数据库筛选心衰相关靶点15870个,CTD数据库筛选心衰相关靶点37211个,运用VENNY 2.1.0将芎归汤有效成分相关靶点与心衰相关靶点取交集,获得芎归汤治疗心衰的潜在作用靶点62个,绘制韦恩图(图1A)。
2.2 芎归汤治疗心衰核心靶点的蛋白相互作用(PPI)网络
利用Network analysis 分析PPI 网络,其中Degree值排名前10 的靶点为PTGS2、ESR1、Caspase3、PPARG、HSP90AA1、BCL2、JUN、GSK3B、NR3C1、PRKACA(图1B)。
2.3 芎归汤治疗心衰关键靶点的GO、KEGG富集分析
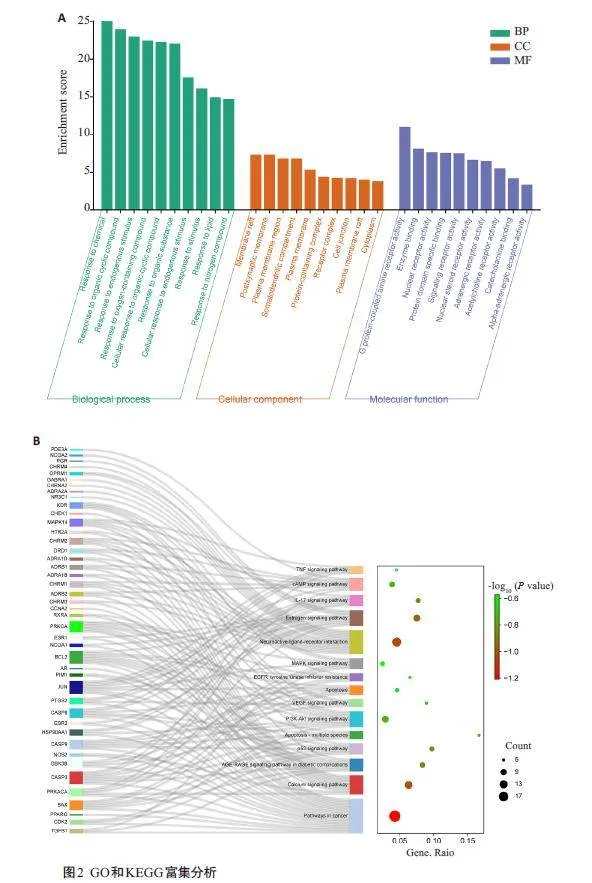
将62个潜在靶点通过DAVID数据库进行GO功能富集分析(图2A),结果发现MF主要有G蛋白偶联胺受体活性、酶结合、肾上腺素能受体活性等;CC主要包括膜筏、质膜区、细胞质等;BP主要包括对内源刺激的反应、对含氧化合物的反应、刺激反应、对脂质的反应等。为了探讨芎归汤治疗心衰的信号通路机制,我们进行了KEGG富集分析(图2B),结果显示前15条信号通路,涉及AGE-RAGE 信号通路在糖尿病并发症中的作用、P53信号通路、细胞凋亡、PI3K-Akt信号通路、VEGF信号通路等。
2.4 实验验证
2.4.1 芎归汤改善心衰小鼠的心功能
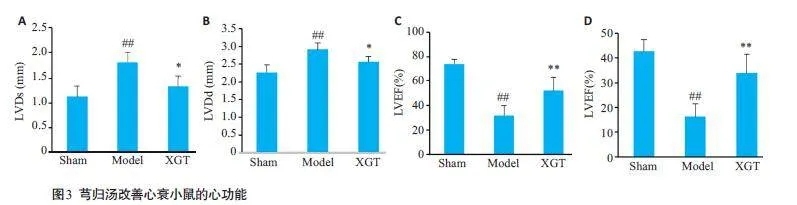
在给予芎归汤4周后,使用超声心动图测量心功能。与假手术组相比,模型组的LVEF和LVFS显著下调,LVDd和LVDs显著上调(图3A~D)。然而,与模型组相比,芎归汤组的LVEF和LVFS显著增加,LVDd和LVDs显著降低(Plt;0.05,Plt;0.01)。
2.4.2 芎归汤减轻心衰小鼠的心肌损伤
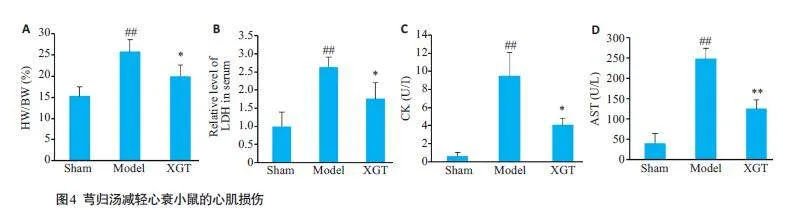
与假手术组相比,模型组的HW/BW显著增加,而芎归汤的给药降低了这一参数(图4A)。此外,芎归汤治疗能够降低LDH、CK和AST水平(图4B、D,Plt;0.05,Plt;0.01)。
2.4.3 芎归汤减轻心衰小鼠的心肌细胞坏死和炎症
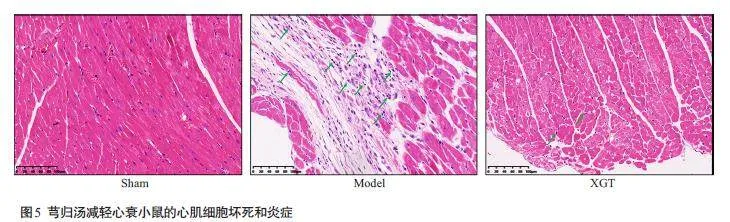
与假手术的正常心肌组织结构相比,模型组出现广泛坏死和严重炎性细胞浸润,而芎归汤给药减少坏死并减弱炎性细胞的浸润(图5)。
2.4.4 芎归汤减轻心衰小鼠的心肌纤维化
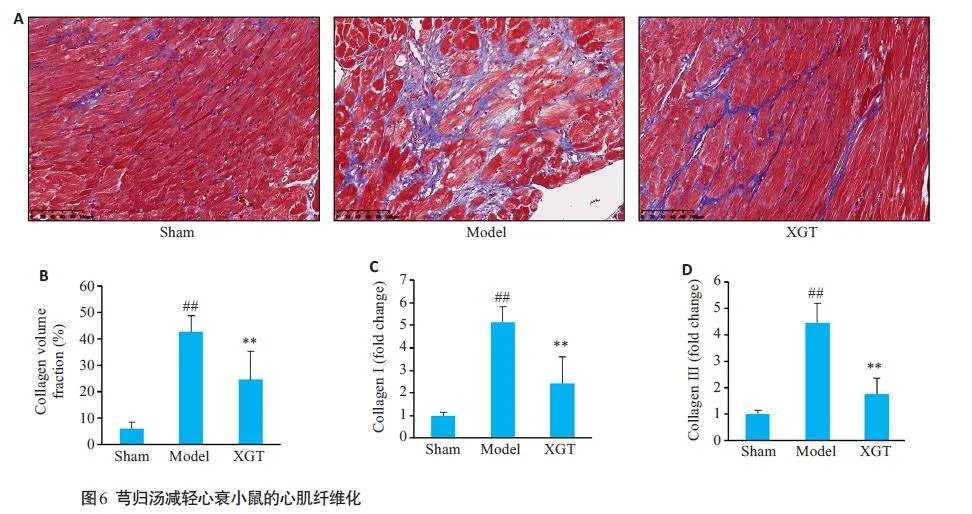
Masson 染色结果提示,在模型组中,胶原合成和沉积显著增加。而芎归汤治疗减少了胶原沉积(图6A、B,Plt;0.01)。qPCR检测心脏Ⅰ型胶原和Ⅲ型胶原水平得到类似的结果(图6C、D,Plt;0.01)。
2.4.5 芎归汤减轻心肌细胞凋亡
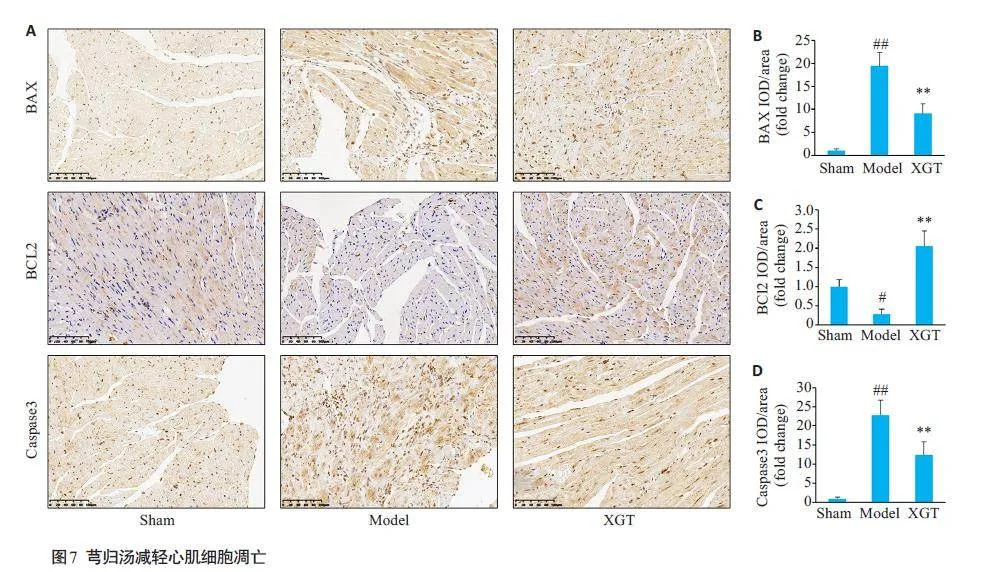
对凋亡相关蛋白BAX、BCL2 和Caspase3 进行检测。免疫组化结果提示,心衰小鼠心脏组织中BAX和Caspase3蛋白表达升高,BCL2 蛋白表达降低,而芎归汤治疗能够降低BAX 和Caspase3 蛋白表达,并升高BCL2 蛋白表达(图7,Plt;0.05,Plt;0.01)。
2.4.6 芎归汤减轻氧化应激诱导心肌细胞损伤
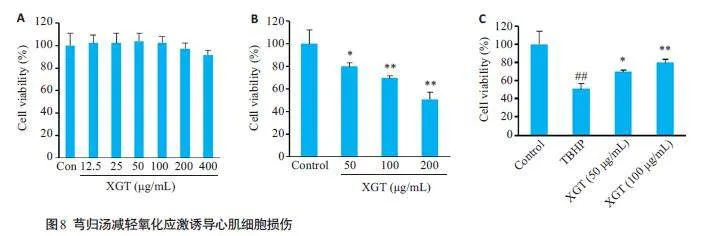
CCK8结果提示,12.5~200 μg/mL浓度的芎归汤对心肌细胞无明显毒副作用(图8A)。而50~200 μmol/L的叔丁基过氧化氢(TBHP)刺激增加了心肌细胞死亡(图10B),其中200 μmol/L TBHP抑制率达到了50%,因此选择该浓度进行后续实验。与对照组相比,叔丁基过氧化氢(TBHP)(200 μmol/L)刺激了H9C2 细胞的死亡,但芎归汤(50 和100 μg/mL)处理减轻了心肌细胞死亡(Plt;0.05,Plt;0.01,图8C)。
2.4.7 芎归汤保护心肌细胞免受氧化应激
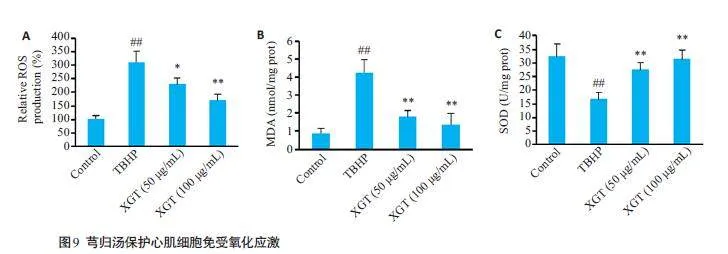
与对照组相比,用TBHP处理H9C2 细胞后,ROS水平显著升高(图9A)。与TBHP组相比,芎归汤处理显示ROS水平以剂量依赖性方式降低。与对照组相比,TBHP 处理后SOD活性显著降低,MDA生成显著增加。但芎归汤预处理显著降低了MDA生成,提高了SOD活性(Plt;0.05,Plt;0.01,图9B、C)。
2.4.8 芎归汤减轻氧化应激诱导的心肌细胞凋亡
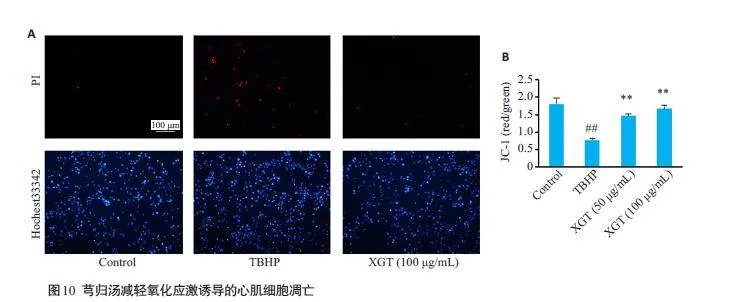
用Hochest33342/PI荧光染色法检测,TBHP组中凋亡细胞显著增多,芎归汤减轻氧化应激诱导的心肌细胞凋亡(图10A)。JC-1染色结果提示,TBHP导致心肌细胞线粒体膜电位损伤,芎归汤能够减轻TBHP 引起的心肌细胞线粒体膜电位损伤,从而减少心肌细胞凋亡(图10B,Plt;0.01)。
3 讨论
心血管疾病是全球最主要的死亡原因,每年夺走的生命甚至超过癌症。在未来几十年,随着人口老龄化、肥胖和糖尿病发病率的增加,与心血管疾病相关的疾病和医疗费用预计将在全球范围内显着增加[9]。心肌细胞凋亡是心肌细胞损失的主要原因,在心室重塑和随后的心力衰竭过程中起着关键作用[10]。因此,找到一种安全有效的抗心梗后心肌细胞凋亡的治疗策略具有重要意义,并将大大改善心衰患者的预后。
芎归汤由川芎和当归两味药组成。川芎常用于活血行气,祛风止痛,当归具有补血活血、调经止血、润肠通便的功效。川芎当归作为心血管保护中药药对,在临床上广泛使用。现代药理学研究表明,川芎具有抗氧化、抗炎、抗凋亡和抗增殖等作用[11],当归具有抗氧化、抗衰老、抗炎和保护缺血损伤细胞等作用[12]。芎归汤在现代临床往往应用于治疗以气滞血瘀为根本病机的心衰、心律失常、冠心病、心血管神经官能症等,但关于芎归汤的作用机制以及药效物质基础仍然不清楚。
网络药理学是一种流行的分析方法,已被广泛用于草药化合物的研究。网络药理学能够整合生物学和药理学的相关内容,全面、多方面地研究药物靶向疾病之间的关系[13]。本研究利用网络药理学对芎归汤治疗心衰的作用靶点和相关通路进行挖掘,并通过动物实验对其相关机制进行了初步验证。
网络药理学分析结果显示,芎归汤治疗心衰的潜在作用靶点共62个,其核心靶点包括PTGS2、ESR1、Caspase3、PPARG、HSP90AA1、BCL2、JUN、GSK3B等,富集分析显示这些靶点可能涉及细胞凋亡、AGE-RAGE信号通路、P53信号通路、PI3K-Akt信号通路、VEGF信号通路等。结果提示芎归汤汤通过多靶点、多个通路共同作用来改善心衰。
Caspase3、BAX和BCL2 是细胞凋亡的关键蛋白。在细胞凋亡过程中,活化的Caspase3 切割多种下游底物,导致凋亡细胞的典型形态学变化[14]。Caspase3介导的DNA断裂是细胞凋亡的标志。BCL2蛋白家族是细胞凋亡程序的关键调节组分,存在于线粒体和内质网,由抑制蛋白、促凋亡蛋白(BAX)和死亡效应因子组成,正常情况下线粒体及内质网中抑制蛋白与BAX结合,可抑制BAX的促细胞凋亡活性,而BAX被激活,可引发线粒体释放Caspase前体蛋白参与细胞凋亡过程[15]。这些蛋白具有特殊的意义,因为它们可以决定细胞是否会凋亡或终止这一过程[16]。通过PPI 分析我们发现Caspase3 和BCL2 是芎归汤治疗心衰的核心靶点,KEGG分析同样提示细胞凋亡在芎归汤治疗心衰中具有重要作用。Caspase3/BCL2/BAX信号通路是通过线粒体途径调控细胞凋亡的经典信号通路,通过诱导细胞凋亡,从而影响多种炎症因子,成为心梗后心衰的重要发病基础。基于此,我们推测抑制心肌细胞凋亡可能是芎归汤治疗心衰的关键机制。为此,我们进一步利用体内外实验对芎归汤治疗心衰的作用进行探索。我们采用冠脉结扎构建小鼠心梗后心衰模型,我们的结果显示,芎归汤能够减少心衰小鼠心肌细胞损伤、减轻心室重构,从而改善心衰小鼠心功能。且芎归汤能够抑制心肌凋亡相关蛋白Caspase3 和BAX的表达,促进BCL2的表达。这与网络药理学分析结果一致。体外实验表明,芎归汤通过抑制氧化应激,从而减轻叔丁基过氧化氢诱导的心肌细胞凋亡。
线粒体在细胞凋亡的过程中起着枢纽作用,而线粒体跨膜电位的下降发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,被认为是细胞凋亡级联反应过程中最早发生的事件,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。JC-1可结合到线粒体基质,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低[17]。本研究结果提示,氧化应激诱导心肌细胞线粒体膜电位下降,从而诱导心肌细胞凋亡,而芎归汤治疗能够减轻氧化应激诱导的心肌细胞凋亡。
氧化应激反映了ROS产生和抗氧化系统去除ROS的能力之间的不平衡[18]。越来越多的证据表明,在病理生理条件下,ROS的慢性和急性过量产生在心衰的发展中起着重要作用[19]。过量的ROS产生会对心肌细胞造成严重损伤,影响氧化-抗氧化系统的平衡,导致细胞凋亡[20]。因此,抑制氧化应激诱导的损伤和细胞凋亡是心血管疾病的重要干预策略。先前的研究表明,脂质过氧化产物,如MDA,可以间接反映氧化应激下ROS的产生,细胞抗氧化酶,如SOD,可以降低细胞内ROS的含量。在本研究中,我们发现芎归汤处理降低了MDA含量,提高了SOD活性,表明芎归汤可能改善了氧化-抗氧化系统的平衡。此外,我们证明芎归汤治疗抑制了氧化应激诱导的心肌细胞凋亡。这些结果有力地表明,芎归汤对氧化应激和氧化应激诱导的心肌细胞凋亡起保护作用。
本研究使用网络药理学方法构建了芎归汤与心衰相关的差异基因的网络关系图,并进行了富集分析,阐明了芎归汤抗心衰的主要作用靶点和潜在机制。并通过体内外实验,我们证明芎归汤能够减轻心衰小鼠心肌损伤,改善小鼠心功能,这与其能够抑制氧化应激诱导的心肌凋亡有关。这些数据对于阐明芎归汤介导的心衰改善的潜在机制有重要意义,同时为其他中药复方对于心衰的治疗提供研究思路和参考方向。
参考文献:
[1] Virani SS, Alonso A, Aparicio HJ, et al. Heart disease and strokestatistics-2021 update: a report from the American heart association[J]. Circulation, 2021, 143(8): e254-e743.
[2] Zhao W, Zhao J, Rong J. Pharmacological modulation of cardiacremodeling after myocardial infarction[J]. Oxid Med Cell Longev,2020, 2020: 8815349.
[3] Chen ZJ, Zhang C, Gao F, et al. A systematic review on the rhizomeof Ligusticum chuanxiong Hort. (Chuanxiong) [J]. Food ChemToxicol, 2018, 119: 309-25.
[4] Lv XF, Wen RQ, Liu K, et al. Role and molecular mechanism oftraditional Chinese medicine in preventing cardiotoxicity associatedwith chemoradiotherapy[J]. Front Cardiovasc Med, 2022, 9:1047700.
[5] Huang CY, Kuo WW, Kuo CH, et al. Protective effect of Danggui(Radix Angelicae Sinensis) on angiotensin II-induced apoptosis inH9c2 cardiomyoblast cells[J]. BMC Complement Altern Med,2014, 14: 358.
[6] 王心意, 鞠建庆, 樊懿萱, 等. 基于数据挖掘的国家级名老中医治疗冠心病用药规律研究[J]. 辽宁中医药大学学报, 2021, 23(3):159-63.
[7] 谢凌鹏, 周楚莹, 吕志平. 基于网络药理学探讨黄连抗肝细胞癌的作用机制[J]. 中医肿瘤学杂志, 2022, 4(1): 29-35.
[8] Chen GH, Xu HL, Xu T, et al. Calycosin reduces myocardial fibrosisand improves cardiac function in post-myocardial infarction mice bysuppressing TGFBR1 signaling pathways[J]. Phytomedicine, 2022,104: 154277.
[9] Branch of Cardiovascular Physicians, Chinese Medical DoctorAssociation; China Cardiovascular Health Alliance; The ExpertConsensus Working Group on the Prevention and Treatment ofHeart Failure After Myocardial Infarction. 2020 心肌梗死后心力衰竭防治专家共识[J]. 中国循环杂志, 2020, 35(12): 1166-80.
[10]Teringova E, Tousek P. Apoptosis in ischemic heart disease[J]. JTransl Med, 2017, 15(1): 87.
[11] Li WX, Tang YP, Chen YY, et al. Advances in the chemical analysisand biological activities of Chuanxiong[J]. Molecules, 2012, 17(9):10614-51.
[12]董培良, 李 慧, 韩 华. 当归及其药对的研究进展[J]. 中医药信息,2019, 36(2): 127-30.
[13]Zhou Z, Chen B, Chen S, et al. Applications of networkpharmacology in traditional Chinese medicine research[J]. EvidBased Complement Alternat Med, 2020: 1646905.
[14]Eskandari E, Eaves CJ. Paradoxical roles of caspase-3 in regulatingcell survival, proliferation, and tumorigenesis[J]. J Cell Biol, 2022,221(6): e202201159.
[15]Cory S, Adams JM. The Bcl2 family: regulators of the cellular lifeor-death switch[J]. Nat Rev Cancer, 2002, 2(9): 647-56.
[16]Elmore S. Apoptosis: a review of programmed cell death[J].Toxicol Pathol, 2007, 35(4): 495-516.
[17]Perelman A, Wachtel C, Cohen M, et al. JC-1: alternative excitationwavelengths facilitate mitochondrial membrane potential cytometry[J]. Cell Death Dis, 2012, 3(11): e430.
[18]Panth N, Paudel KR, Parajuli K. Reactive oxygen species: a keyhallmark of cardiovascular disease[J]. Adv Med, 2016: 9152732.
[19]Brieger K, Schiavone S, Miller FJ, et al. Reactive oxygen species:from health to disease[J]. Swiss Med Wkly, 2012, 142: w13659.
[20]Krylatov AV, Maslov LN, Voronkov NS, et al. Reactive oxygenspecies as intracellular signaling molecules in the cardiovascularsystem[J]. Curr Cardiol Rev, 2018, 14(4): 290-300.
(编辑:余诗诗)
基金项目:广东省自然科学基金(2023A1515011200)

