直肠癌炎症蛋白因子的遗传驱动:孟德尔随机化方法在临床预后研究中的应用


摘要:目的 利用孟德尔随机化(MR)方法,探索炎症蛋白因子与直肠癌风险之间的因果关系,为直肠癌的预防和治疗提供新的策略。方法 从全基因组关联分析(GWAS)数据集中选取与直肠癌相关的信息,使用91 个炎症蛋白因子作为暴露变量。采用双样本MR分析模型评估炎症蛋白因子与直肠癌的因果联系,并通过异质性、多效性和敏感性分析评估结果的稳健性。使用5种MR分析模型,包括逆方差加权法(IVW)、加权中位数法(Weighted median)、模型选择法(MR-Egger)、简单模型法和加权模型法。选择2021 年12 月~2023 年12 月南方医科大学南方医院收治的86 例未经治疗的直肠腺癌患者开展临床研究,使用RTqPCR技术定量分析程序性死亡配体1(PD-L1)、轴突诱导蛋白1(AXIN1)和β-神经生长因子(β-NGF)基因表达,使用Spearman秩相关系数分析基因表达与临床特征(包括吸烟情况、肿瘤最大直径、是否有转移、肿瘤-淋巴结-转移分期、分化程度和病理分型)之间的相关性。结果 MR分析显示AXIN1(OR=0.866,95% CI:0.754-0.994,P=0.040;IVW模型)、β-NGF(OR=0.914,95%CI:0.843-0.990,P=0.028;IVW模型)(OR=0.884,95% CI:0.784-0.998,P=0.047,Weighted median 模型)和PD-L1(OR=0.903,95% CI:0.824-0.989,P=0.028,IVW模型)风险降低有与直肠癌显著的因果关系。研究中不存在异质性(IVW法和MR Egger法检测的Pgt;0.05),不存在多效性(Pgt;0.05),模型稳定。敏感性分析显示,AXIN1、β-NGF和PD-L1的剩余单核苷酸多态性(SNP)效应值的均值分别为-0.1425、-0.0973和-0.1011,均与各自的主效应值-0.144、-0.1和-0.1接近,验证了结果的可靠性。临床研究显示,PD-L1基因的表达量与直肠癌的TNM分期显著相关,尤其是在TNM分期IV期患者中,PD-L1的表达量显著高于I、II、III期(P=0.007)。AXIN1 和β-NGF基因的表达量与肿瘤的分化程度显著相关;低分化的直肠癌样本中,AXIN1 和β-NGF的表达量显著高于中分化和高分化样本(Plt;0.001)。结论 炎症蛋白因子AXIN1、β-NGF和PD-L1的水平降低与直肠癌风险降低有显著的因果关系,且这些因子的表达量与直肠癌的TNM分期和肿瘤分化程度相关,可能是直肠癌治疗和预防的新靶点。
关键词:直肠癌;炎症蛋白因子;孟德尔随机化;临床研究
直肠癌的发病率和死亡率在全球范围内呈现上升趋势。根据加拿大的数据,直肠癌占所有结直肠癌新发病例的1/3。2020年,加拿大诊断出26 900例结直肠癌,比2000年的17 000例增加了58%[1]。中国直肠癌的发病率呈现上升趋势,其年龄相关死亡率和发病率在女性中也呈上升趋势[2]。近年来,针对特定分子标志物的靶向治疗和利用免疫系统攻击癌细胞的免疫治疗为直肠癌患者提供了更多治疗选择[3]。既往研究探索了几种与结直肠癌相关的生物标志物,近期研究强调,基于血细胞的炎症标志物,如中性粒细胞与淋巴细胞比值(NLR)和血小板与淋巴细胞比值(PLR),以及一个新提出的包含血红蛋白浓度(NP/LHb)的指数,在早期诊断和预测结直肠癌中的重要性。这些标志物展示了提高结直肠癌检测能力和理解其临床病理特征(包括TNM分期和肿瘤位置)的潜力[4]。但关于直肠癌的病因和发病机制的详细理解仍然有限,炎症蛋白因子方面的研究尤其欠缺。随机对照试验(RCT)是建立因果关系的黄金标准,但由于其高成本、医学伦理限制等因素,某些RCT难以实现[5]。孟德尔随机化(MR)提供了一种替代方法,通过使用遗传变异作为工具变量(IV)来探索风险因素与结局变量之间的因果关系,克服了传统观察性研究中混杂因素和反向因果的限制[6, 7]。尽管之前的研究已经使用MR分析探讨了炎症生物标志物与多种癌症之间的关系[8],并发现结直肠癌与更高的脂肪酸和脂蛋白水平相关联[9],但对特定炎症蛋白因子如AXIN1、β-NGF、PD-L1与直肠癌风险之间的因果关系的研究仍然缺乏。
本研究利用MR方法,探索91 个炎症蛋白因子与直肠癌风险之间的因果关系,并对其中具有显著因果关系的AXIN1、β-NGF、PD-L1三个基因在直肠癌患者中的表达情况进行验证,评估其与患者临床特征之间的相关性。这不仅有助于揭示直肠癌的病因和发病机制,也为直肠癌的预防和治疗提供了新的策略,具有重要的创新和意义。
1 资料和方法
1.1 MR研究设计
本研究从全基因组关联分析(GWAS)数据集中选择与直肠癌相关的GWAS数据信息作为结局变量。使用了91个炎症蛋白因子[10]作为暴露因素,用双样本MR分析模型评估炎症蛋白因子对直肠癌的因果关系,进行异质性、多效性和敏感性分析评估结果的稳健性。本研究采用5 种MR 分析模型进行评价(IVW、Weightedmedian、MR Egger、Simple mode 和Weighted mode)。直肠癌的汇总统计数据来自最大的GWAS(id:ebi-a-GCST90018808)。该GWAS 数据(2021 年)测试了多达24 182 361 个直肠癌基因型单核苷酸多态性(SNP)之间的关联,其中包括欧洲血统的470 002 人(6581 例病例和463 421例对照)。MR需满足3个关键假设:关联性假设,工具变量与暴露因素之间是强相关性;独立性假设,工具变量与混杂因素之间是独立性的;排他性假设,工具变量只能通过暴露因素对结局产生影响[11]。
1.2 SNP的筛选
通过关联性和连锁不平衡分析确定了与91个炎症蛋白因子相关的SNP作为IV,设置参数为clump_r2lt;0.001,clump_kblt;10000,Plt;5E-06。此外,从大型GWAS (id:ebi-a-GCST90018808)数据中获取了24 182 361 个直肠癌基因型snp 的信息。GWAS分析所依托的研究均已通过相关审查机构的伦理认可。本研究仅使用了这些研究的汇总统计数据,所以不需要进一步的伦理审批。
1.3 MR分析
使用“Two Sample MR”包进行双样本的孟德尔随机化研究,以评估炎症蛋白因子对直肠癌的因果关系。5 种MR 分析模型被用于该研究当中,分别为IVW、Weighted median、MR Egger、Simple mode 和Weightedmode。本文主要基于IVW方法,其他方法作为补充,以OR值来评估炎症蛋白因子对直肠癌的因果关系。采用IVW法和MR Egger 法检测评估异质性;若Plt;0.05,说明研究中存在异质性。通过MR-Egger截距测试,可以检测数据的多效性,并且评估结果的稳健性。如果Pgt;0.05,说明数据不存在多效性,才满足MR假设中独立性假设和排他性假设。最后通过敏感性分析来评估MR分析结果的有效性和可靠性。本研究使用的是留一法(leave-one-out)敏感性分析,逐步剔除每个SNP,计算剩余SNP的元数据(meta)效应,观察剔除每个SNP后结果是否发生变化。
1.4 临床研究
1.4.1 基线信息
选择2021 年12 月~2023 年12 月在南方医科大学南方医院治疗的86例直肠癌患者为研究对象。纳入标准:通过病理学检查确认的直肠腺癌患者;年龄gt;18岁;所有TNM分期的患者;未接受过任何抗癌治疗,包括手术、放疗、化疗或靶向治疗;可提供详细的临床特征信息,包括吸烟情况、肿瘤最大直径、转移情况、TNM分期、分化程度和病理分型等;愿意参与研究并签署知情同意书。排除标准:有严重并发症或共存疾病,包括但不限于重大心脏病、肝肾功能严重障碍;之前或当前患有其他类型的恶性肿瘤;无法获得有效的病理组织样本;在过去的30 d内接受过任何形式的抗癌治疗(手术、放疗、化疗或靶向治疗)的患者。
1.4.2 PD-L1、AXIN1 和β-NGF 基因在86 例直肠癌患者中的表达分析
86 例直肠癌患者PD-L1、AXIN1 和β-NGF 3个基因的表达情况由RT-qPCR技术测定。从所有患者中收集的肿瘤组织样本中提取总RNA,使用Trizol试剂(Invitrogen)按照制造商的说明进行;提取的RNA 浓度和纯度通过NanoDrop 2000 光谱光度计(Thermo Fisher Scientific)评估,且RNA 完整性通过1%瓜尔胶凝胶电泳确认;使用反转录试剂盒(TakaraBio)将1 μg 总RNA逆转录为cDNA。实时PCR采用SYBR Green I Master Mix(Roche)在LightCycler®480 II Real-Time PCR System(Roche)上进行。每个样本均设置3 个重复,以确保结果的可靠性。PD-L1、AXIN1和β-NGF基因的特异性引物序列设计如表1所示。实验中采用甘油醛-3-磷酸脱氢酶(GAPDH)基因作为内参基因,以对所有样品的表达量进行标准化。PCR反应条件设置为初步变性95 ℃,10 min;之后40个循环,每个循环包括95 ℃变性15 s,60 ℃退火和延伸30 s。最后进行熔解曲线分析,确保引物特异性和扩增产物的纯度。基因表达水平的相对量化使用2-ΔΔCt方法计算,其中ΔCt为目标基因Ct值与内参基因GAPDH Ct值之差,ΔΔCt为实验组ΔCt值与对照组ΔCt值之差。
1.5 统计学分析
MR分析中所有统计分析均使用R 4.3.1进行。临床研究中所有数据分析均使用SPSS 27.0 软件(IBM,USA)进行,结果以均数±标准差表示,基因表达水平与临床特征之间的相关性通过Spearman 秩相关分析,Plt;0.05时认为差异具有统计学意义。
2 结果
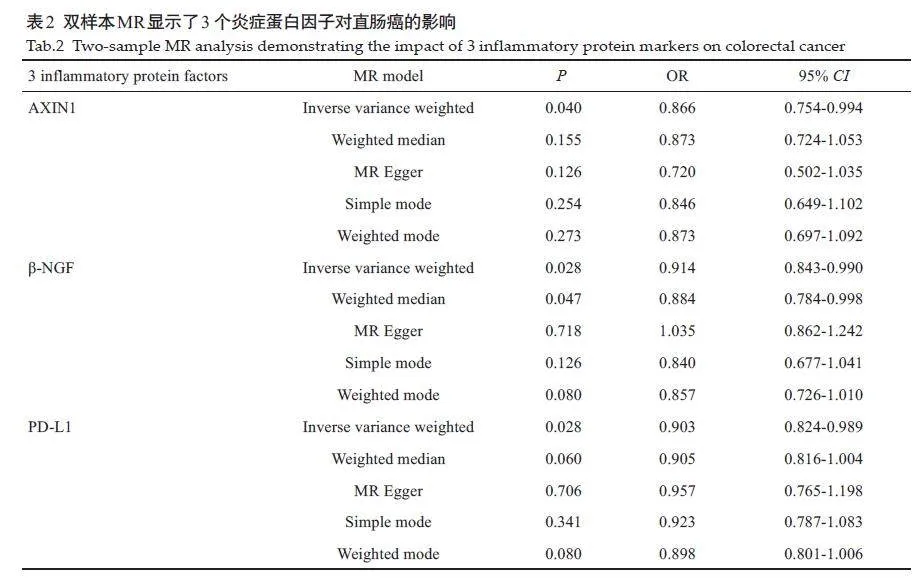
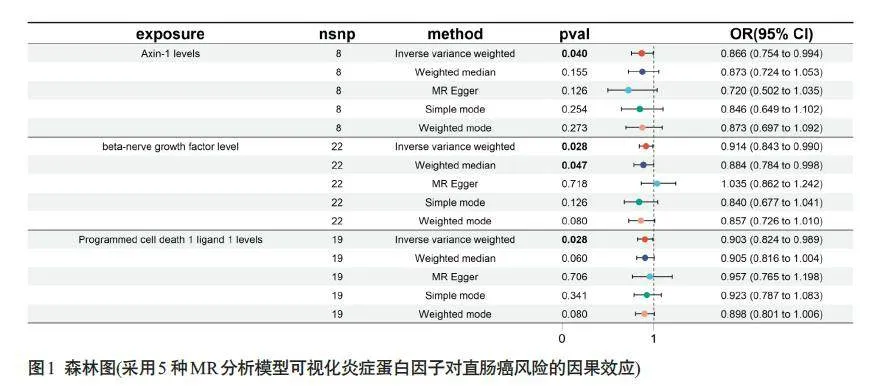
2.1 91个炎症蛋白因子对直肠癌的影响
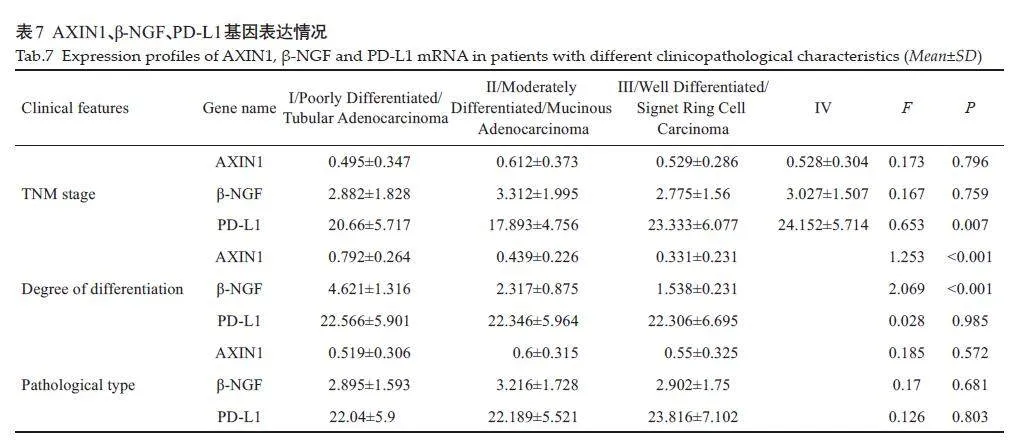
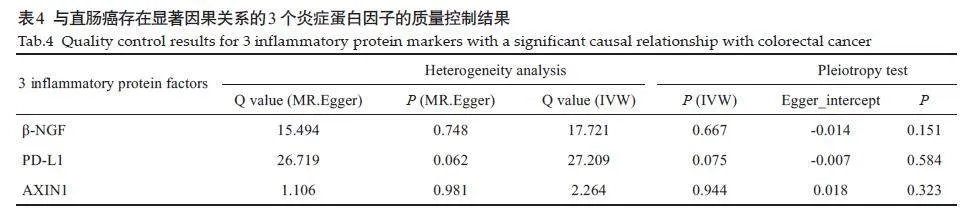
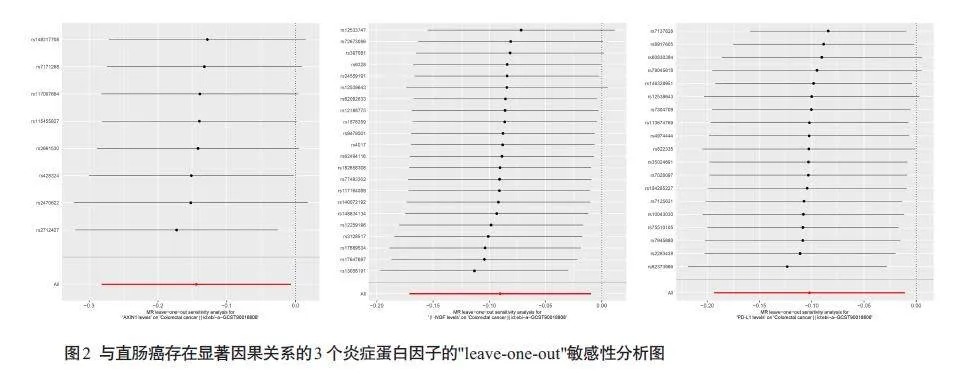
AXIN1水平和直肠癌风险降低有显著的因果关系(OR=0.866;95% CI,0.754-0.994;P=0.040;IVW模型)。β-NGF水平和直肠癌风险降低有显著的因果关系(OR=0.914;95% CI,0.843-0.990;P=0.028;IVW模型)(OR=0.884;95% CI,0.784-0.998;P=0.047;Weighted median模型)。PD-L1水平和直肠癌风险降低有显著的因果关系(OR=0.903;95% CI,0.824-0.989;P=0.028;IVW模型,图1、表2)。AXIN1、β-NGF、PD-L1 和直肠癌风险降低有显著的因果关系。其它88个炎症蛋白因子的阴性结果见表3。对纳入研究的3个炎症蛋白因子进行异质性分析和多效性检验显示,研究中不存在异质性(IVW法和MREgger 法检测的Pgt;0.05)。研究中数据不存在多效性(Pgt;0.05),MR假设中独立性假设和排他性假设成立(表4)。“leave-one-out”敏感性分析结果显示:逐步剔除每个SNP,剩余SNP 的效应值都与主效应值很接近。具体如下:AXIN1的剩余SNP效应值的均值为-0.1425,与主效应值-0.144 接近;β-NGF 的剩余SNP效应值的均值为-0.0973,与主效应值-0.1接近;PD-L1 的剩余SNP 效应值的均值为-0.1011,与主效应值-0.1 接近。其整体的因果关系没有发生显著变化(图2)。
2.2 直肠癌患者的基线信息
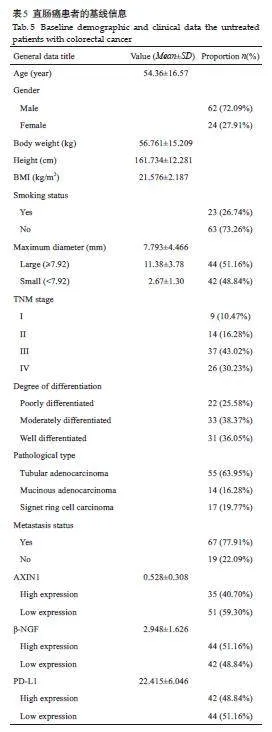
本研究汇总了86例直肠癌患者的基线信息。患者平均年龄为54.36岁,男性占多数(72.09%)。平均体质量为56.76 kg,平均身高为161.73cm,平均BMI 为21.58。吸烟者占26.74%,非吸烟者占73.26%。肿瘤最大直径平均为7.793 mm,TNM分期显示I~IV期患者分布不均,分化程度从低到高均有分布,主要病理分型为管状腺癌(63.95%)。77.91%的患者有转移。基因表达方面,AXIN1、β-NGF、PD-L1 的高低表达比例接近,其中AXIN1和PD-L1低表达占多数,而β-NGF高表达占多数(表5)。
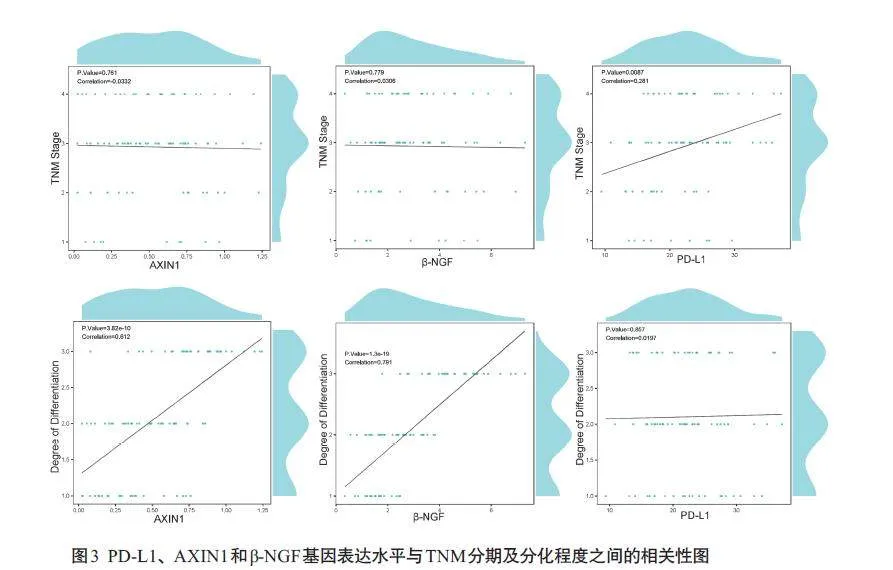
2.3 PD-L1、AXIN1和β-NGF基因表达水平与临床特征之间的相关性
PD-L1基因的表达量与直肠癌的TNM分期显著相关,尤其是在TNM分期IV期患者中,PD-L1 的表达量显著高于I、II、III 期,差异具有统计学意义(P=0.007)。AXIN1和β-NGF基因的表达量与肿瘤的分化程度显著相关;低分化的直肠癌样本中,AXIN1和β-NGF的表达量显著高于中分化和高分化样本(Plt;0.001)。同时吸烟状态、肿瘤最大直径、转移情况及病理分型对PD-L1、AXIN1和β-NGF基因表达水平不具有显著统计学影响(Pgt;0.05,表6、7,图3)。
3 讨论
直肠癌作为一种常见的消化道恶性肿瘤,其治疗与管理挑战巨大,对患者的生理和心理健康造成了严重影响[12]。本研究首次通过孟德尔随机化方法探讨了炎症蛋白因子与直肠癌风险之间的因果关系,并在临床样本中验证了相关基因表达与直肠癌临床特征的相关性。
Axin1是Wnt/β-Catenin信号通路的重要负向调节剂,Axin1低表达会导致β-连环蛋白(β-Catenin)和下游癌基因过度转录,从而促使肿瘤发生[13]。一项研究显示,CDK5激酶调节亚基相关蛋白1(CDK5RAP1)高表达可使SW480 细胞Axin1 的蛋白表达水平降低,而敲低CDK5RAP1表达则可使HCT-116细胞的Axin1的蛋白表达水平升高[14]。此外,AXIN1 与直肠癌有显著关联。在直肠癌中AXIN1的表达显著高于结肠腺瘤和相邻非肿瘤黏膜[15]。研究证实了AXIN1 基因rs1805105基因多态性与结直肠癌的易感性相关[16]。梁家宏等研究显示,神经生长因子(NGF)在结直肠癌组织中的表达(阳性率57.5%)比癌旁正常结直肠组织(阳性率25%)高。NGF的表达与结直肠癌细胞分级、临床分期、淋巴结转移有关[17]。研究显示,NGF 在结直肠癌中表达上调,与结直肠癌患者低生存率密切相关,NGF的高表达可作为结直肠癌患者潜在的预后指标[18]。通麻汤联合穴位注射应用于结直肠癌奥沙利铂化疗相关外周神经毒性患者中,可显著改善神经传导速度,上调NGF 水平,提高患者的生活质量[19]。在直肠癌中,PD-L1 通过与PD-1相互作用,参与放疗后CRC细胞的免疫逃逸机制。PD-L1是直肠癌放疗后免疫逃逸和治疗抵抗的关键因子[20]。一项直肠癌的研究发现,放疗后PD-L1+细胞的中位数增加,放疗分割对PD-L1+细胞比率无显著影响。高PD-L1表达与更好的生存结果相关[21]。直肠癌高PD-L1 表达和低血管内皮生长因子受体2 表达与更好的总生存率相关[22]。新辅助放化疗可以增加直肠腺癌患者的PD-L1表达,这与良好的预后相关。在临床试验中结合放疗和PD-1/PD-L1途径阻断可能是有益的。肿瘤和炎症细胞上PD-L1表达低是直肠腺癌患者总生存率的独立负面预后标记[23]。此外,在接受新辅助化疗和放疗的局部晚期直肠癌患者中,肿瘤浸润的髓系衍生抑制细胞、PD-1+/CD8+肿瘤浸润淋巴细胞比例和PD-L1在间质免疫细胞及肿瘤细胞中的表达与预后相关[24]。研究表明,肿瘤CD274(PD-L1)表达水平与结直肠癌组织中FOXP3+淋巴细胞的密度成反比。肿瘤CD274表达与高水平微卫星不稳定性状态在结直肠癌中呈负相关[25]。
有研究强调了PD-L1 与更高T分期(p=0.03)的显著相关性,表明PD-L1在肿瘤细胞中的表达与直肠癌的局部进展程度密切相关[26]。Shan等[27]的研究中,PD-L1表达与TNM分期(P=0.009)、淋巴结转移(P=0.000)、远处转移(P=0.014)显著相关,表明PD-L1表达水平的增加与肿瘤的更高分期和转移风险密切相关。PD-L1表达增加与高组织学等级(P=0.011)、更高的病理T分期(P=0.007)、淋巴结转移(P=0.002)、远处转移(Plt;0.001)有显著相关性,表明PD-L1在预测直肠癌患者的临床病理特征和预后方面的价值,尤其是其与TNM分期系统的相关性[28]。以上研究共同支持了PD-L1表达量与直肠癌TNM分期的显著相关性,与我们研究结果相吻合。在结直肠癌基因表达模式的研究中,发现AXIN1在结直肠肿瘤与邻近正常组织相比显著下调(p=0.04)。AXIN1的表达量与肝细胞癌和乳腺癌等多种癌症的发展及患者预后显著相关,其在肿瘤分化程度上的作用可通过调节特定Wnt和Hippo 等信号通路及与免疫渗透的关联来实现[29]。研究发现,NGF-β的过表达促进了QBC939 细胞的增殖、集落形成能力,并抑制了细胞凋亡,同时增强了体内的肿瘤形成能力。NGF-β的表达水平与肿瘤的侵袭性和分化程度之间存在显著的相关性[30]。目前尚无AXIN1和β-NGF在直肠癌肿瘤分化程度上的关联研究,但在其他肿瘤分化程度的研究中,AXIN1和β-NGF的表达与肿瘤分化程度有一定相关性。
本研究通过MR方法探索了炎症蛋白因子与直肠癌风险之间的因果关系,并通过临床样本验证了这些发现,但存在以下局限性:基于的GWAS数据集可能受人群结构差异影响,结果的普适性有限;临床样本规模较小,可能影响结果的可信度和适用范围;基因表达与疾病风险的关系可能受环境因素和生活方式影响,本研究未充分调查这些交互作用。未来研究需采用更大样本规模、更广泛人群和更深入的分子机制研究,为直肠癌的预防和治疗提供更准确的靶点。
总之,孟德尔随机化分析表明炎症蛋白因子AXIN1、β-NGF和PD-L1的水平与直肠癌风险降低之间存在显著因果关系,这些炎症蛋白因子可能是直肠癌治疗和预防的新靶点。临床研究结果验证了PD-L1、AXIN1和β-NGF基因在直肠癌中的表达;显示PD-L1 的表达量与直肠癌的TNM分期显著相关,AXIN1和β-NGF的表达量与肿瘤分化程度显著相关。这对于理解直肠癌的分子机制和发展针对性的治疗策略具有重要意义。
参考文献:
[1] Moon J, Garfinkle R, Zelkowitz P, et al. Incidence and factorsassociated with mental health disorders in patients with rectal cancerpost-restorative proctectomy[J]. Dis Colon Rectum, 2023, 66(9):1203-11.
[2] Xu ZL, Li Y, Cui YY, et al. Identifications of candidate genessignificantly associated with rectal cancer by integratedbioinformatics analysis[J]. Technol Cancer Res Treat, 2020, 19:1533033820973270.
[3] Belli F. Special issue“ current management of early and advancedrectal cancer”[J]. Cancers, 2023, 15(14): 3574.
[4] Hernandez-Ainsa M, Velamazan R, Lanas A, et al. Blood-cell-basedinflammatory markers as a useful tool for early diagnosis incolorectal cancer[J]. Front Med, 2022, 9: 843074.
[5] Markozannes G, Kanellopoulou A, Dimopoulou O, et al. Systematicreview of Mendelian randomization studies on risk of cancer[J].BMC Med, 2022, 20(1): 41.
[6] Silva S, Fatumo S, Nitsch D. Mendelian randomization studies oncoronary artery disease: a systematic review and meta-analysis[J].Syst Rev, 2024, 13(1): 29.
[7] Ho J, Mak CCH, Sharma V, et al. Mendelian randomization studiesof lifestyle-related risk factors for osteoarthritis: a PRISMA reviewand meta-analysis[J]. Int J Mol Sci, 2022, 23(19): 11906.
[8] Bouras E, Karhunen V, Gill D, et al. Circulating inflammatorycytokines and risk of five cancers: a Mendelian randomizationanalysis[J]. BMC Med, 2022, 20(1): 3.
[9] Bull CJ, Hazelwood E, Bell JA, et al. Identifying metabolic featuresof colorectal cancer liability using Mendelian randomization[J].medRxiv, 2023: 2023.03.10.23287084.
[10]Zhao JH, Stacey D, Eriksson N, et al. Genetics of circulatinginflammatory proteins identifies drivers of immune-mediateddisease risk and therapeutic targets[J]. Nat Immunol, 2023, 24(9):1540-51.
[11] Ference BA, Holmes MV, Smith GD. Using Mendelianrandomization to improve the design of randomized trials[J]. ColdSpring Harb Perspect Med, 2021, 11(7): a040980.
[12]Perez RO, São Julião GP. Rectal cancer management and the longlist of unanswered questions[J]. Ann Surg Oncol, 2023, 30(8):4566-7.
[13]Zhu JR, Wu YQ, Lao SX, et al. Targeting TRIM54/Axin1/β-cateninaxis prohibits proliferation and metastasis in hepatocellularcarcinoma[J]. Front Oncol, 2021, 11: 759842.
[14]蒋漫琦, 何师茜, 杨 洪, 等. CDK5RAP1通过Wnt/β-Catenin信号通路调控结直肠癌发生和进展的研究[J]. 国际消化病杂志, 2023, 43(4): 246-56.
[15]Rudeen AJ, Douglas JT, Xing ML, et al. The 15-amino acid repeatregion of adenomatous polyposis coli is intrinsically disordered andretains conformational flexibility upon binding β -catenin[J].Biochemistry, 2020, 59(41): 4039-50.
[16]孙跃胜, 潘江华, 窦巩昊, 等. 结直肠癌的Wnt信号通路相关基因突变的研究[J]. 浙江创伤外科, 2019, 24(3): 437-9.
[17]梁家宏, 郑周红, 尹朝晖. 神经生长因子及受体在结直肠肿瘤中的表达及临床意义[J]. 当代医学, 2013, 19(28): 1-3.
[18]雷 雲, 杨 铃, 张 涛. 神经生长因子对结直肠癌发展和不良预后的影响[J]. 成都医学院学报, 2021, 16(2): 148-52.
[19]刘丹丹. 通麻汤联合穴位注射治疗结直肠癌奥沙利铂化疗相关外周神经毒性的效果及对患者生活质量的影响[J]. 临床医学研究与实践, 2022, 7(18): 128-30.
[20]Hsieh RC, Krishnan S, Wu RC, et al. ATR-mediated CD47 and PDL1up-regulation restricts radiotherapy-induced immune primingand abscopal responses in colorectal cancer[J]. Sci Immunol, 2022,7(72): eabl9330.
[21]Boustani J, Derangère V, Bertaut A, et al. Radiotherapy schemeeffect on PD-L1 expression for locally advanced rectal cancer[J].Cells, 2020, 9(9): 2071.
[22]Ding Y, Fu YY, Wei W, et al. Simultaneous high PD-L1 and lowVEGFR2 expression is associated with better overall survival inrectal cancer[J]. Transl Cancer Res, 2021, 10(1): 499-508.
[23]Cornista AM, Giolito MV, Baker K, et al. Colorectal cancerimmunotherapy: state of the art and future directions[J]. Gastro HepAdv, 2023, 2(8): 1103-19.
[24]Lim YJ, Koh J, Choi M, et al. Prognostic stratification based on thelevels of tumor-infiltrating myeloid-derived suppressor cells and PD-1/PD-L1 axis in locally advanced rectal cancer[J]. Front Oncol,2022, 12: 1018700.
[25]Ugai T, Shimizu T, Kawamura H, et al. Inverse relationship betweenFusobacterium nucleatum amount and tumor CD274 (PD-L1)expression in colorectal carcinoma[J]. Clin Transl Immunology,2023, 12(8): e1453.
[26]Srivastava P, Husain N, Shukla S, et al. PD-L1 Expression incolorectal carcinoma and its correlation with clinicopathologicalparameters, microsatellite instability and BRAF mutation[J]. IndianJ Pathol Microbiol, 2021, 64(3): 490-6.
[27]Qiu QQ, Tan D, Chen QF, et al. Clinical implications of PD-L1expression and pathway-related molecular subtypes in advancedAsian colorectal cancer patients[J]. Am J Cancer Res, 2024, 14(2):796-808.
[28]Secinti IE, Ozgur T, Dede I. PD-L1 expression in colorectaladenocarcinoma is associated with the tumor immunemicroenvironment and epithelial-mesenchymal transition[J]. Am JClin Pathol, 2022, 158(4): 506-15.
[29]Moradifard S, Minuchehr Z, Ganji SM. An investigation on the c-MYC, AXIN1, and COL11A1 gene expression in colorectal cancer[J]. Biotechnol Appl Biochem, 2022, 69(4): 1576-86.
[30]Ferraguti G, Terracina S, Tarani L, et al. Nerve growth factor and therole of inflammation in tumor development[J]. Curr Issues MolBiol, 2024, 46(2): 965-89.
(编辑:余诗诗)
基金项目:广东省胃肠道肿瘤精准医学重点实验室(2020B121201004);广东省重大人才项目(2019JC05Y361);广东省区域联合基金(2020A1515110140);广州市科技计划项目(202206011130280011)

