金缕半枫荷的水提取物抑制胰腺癌的作用机制:活性成分、关键靶点和信号通路
摘要:目的 采用网络药理学及分子对接技术预测金缕半枫荷抗胰腺癌的关键靶点及信号通路,并通过胰腺癌细胞模型验证金缕半枫荷抗胰腺癌作用机制。方法 通过网络药理学数据库预测药物及疾病的靶点,构建蛋白互作网络图,分析通路、功能富集和分子对接。通过CCK-8法筛选金缕半枫荷对8种癌细胞的活性,并采用侵袭、迁徙、增殖、凋亡实验方法验证金缕半枫荷对胰腺癌的作用。采用Western blotting验证网络药理学的结果。结果 网络药理学共筛选得到金缕半枫荷活性成分18个,调控胰腺癌的潜在关键靶点21个。生物富集结果主要与蛋白质的磷酸化、信号传导、细胞凋亡等有关,通路主要与癌症信号通路、PI3K-Akt信号通路等有关。金缕半枫荷对胰腺癌细胞最敏感且显著抑制胰腺癌细胞Panc-1侵袭、迁徙和增殖,并且促进细胞凋亡(Plt;0.05)。Western blotting 结果表明金缕半枫荷可以显著抑制PI3K和AKT的磷酸化水平(Plt;0.001)。结论 金缕半枫荷通过多成分、多靶点、多通路发挥抗胰腺癌作用,其中抑制PI3K-Akt通路是其机制之一。
关键词:金缕半枫荷;胰腺癌;网络药理学;分子对接;通路分析
胰腺癌恶性程度高,进展迅速,死亡率和病发率逐年上升[1],5年生存率低于8%[2]。目前的药物治疗方法毒副作用强、耐药性强、预后差[3],寻找低毒有效的药物迫在眉睫。中药在改善机体内环境、带瘤生存和防治肿瘤转移复发等方面优势明显。中药能减少因手术、放化疗等损伤性治疗给患者带来的不良反应,而且毒副反应少[4]。金缕半枫荷为金缕梅科半枫荷属植物,药用记录最早记载于《岭南采药录》[5],主要用于风湿痹痛、皮肤瘙痒、外伤出血、产后风瘫等[6,7]。现代药理学研究表明,半枫荷具有抗炎镇痛、活血化瘀的作用。炎症是癌症的发生、发展的因素之一[8-10],所以抑制炎症是防止癌症发生、发展的手段之一[11, 12]。既往研究发现中发现很多具备抗炎活性的中药[13-16],在治疗癌症方面有很好的疗效[17-20]。这为开发抗癌药物提供了思路。本课题组前期研究证实了金缕半枫荷具有抗炎作用[21],提示可以进一步探索其是否具备抗癌活性,但目前还未有金缕半枫荷具有抗癌活性以及将其应用于胰腺癌的相关报道。本文首次从网络药理学、分子对接和细胞实验探究金缕半枫荷对胰腺癌的作用,为将金缕半枫荷开发为抗胰腺癌药物提供基础。
1 材料和方法
1.1 材料
金缕半枫荷(批号20211005),购于广西南宁市中药材市场,经广西壮族自治区中医药研究院黄云峰副研究员鉴定为金缕梅科半枫荷的干燥根。金缕半枫荷水提物的制备:取半枫荷1 kg,加入6 L蒸馏水浸泡60 min,加热至98 ℃提取60 min,过滤,收集滤液;滤渣再加入6 L蒸馏水加热至98 ℃提取60 min,过滤,收集滤液;滤渣再加入6 L蒸馏水加热至98 ℃提取60 min,过滤,收集滤液;合并3次提取液,浓缩至1.0~1.2g/L即得。5氟尿嘧啶(批号51-24-8);凋亡试剂盒(广州易欣生物科技有限公司)。
1.2 细胞培养
人胰腺癌细胞株Panc-1、人肝癌细胞HePG2、人乳腺癌细胞MCF-7、人脑胶质瘤细胞T98G、人恶性黑色素瘤细胞A375 完全培养基条件为DMEM 培养基90%+胎牛血清10%。人结肠癌细胞HCT116、肺癌细胞A549和NCI-H1299完全培养基条件为1640培养基90%+胎牛血清10%。培养条件为5%CO2、37 ℃。
1.3 CCK8检测细胞活力
取对数期生长的各类细胞以5×103/孔接种于96孔细胞培养板中,待细胞贴壁后,加入含不同药物浓度的培养液(100 μL/孔),同一浓度设置6个复孔。继续孵育细胞48 h后,检测细胞存活率。
1.4 金缕半枫荷靶点的筛选及数据库
以金缕半枫荷为关键词,通过中国知网、PubMed检索文献[22-25],收集金缕半枫荷的化学成分。通过SwissTargetPrediction 数据库和TCMIP 数据库预测金缕半枫荷的活性成分靶点,汇总删除重复项。SwissTargetPrediction 的筛选条件为Probabilitygt;0,TCMIP的筛选条件为相似性阈值≥0.8。
1.5 胰腺癌靶点的构建
以“pancreatic cancer”为关键词,通过DisGeNET数据库、GeneCards数据库、DrugBank数据库等收集胰腺癌靶点,汇总并删除重复项。DisGeNET数据库的筛选条件为Scoregdagt;0.1;GeneCards数据库的筛选条件为Relevancescore≥2×中位数。
1.6 构建活性成分-交集靶点网络
将活性成分靶点与疾病靶点进行靶点互作绘制韦恩图,获得交集靶点。采用Cytoscape3.9.1软件构建活性成分-交集靶点网络,进行网络拓扑分析,并根据Degree值选取金缕半枫荷抗胰腺癌的关键成分。
1.7 构建蛋白质相互作用网络
将交集靶点导入String 数据库,设置物种为“Homo Sapiens”,靶点关联的置信度为0.90,获得PPI网络关系,导入到Cytoscape3.9.1软件中绘制PPI网络图。进行网络拓扑分析,并筛选Degree值gt;2×中位数的基因作为关键靶点(Hubs)。
1.8 GO富集分析和KEGG通路富集分析
将金缕半枫荷活性成分靶点与胰腺癌的交集靶点导入生物学信息注释数据库DAVID数据库进行生物功能富集和通路分析。根据P值从低到高排序,选取Plt;0.01的前15条做GO分析和KEGG通路分析。
1.9 分子对接验证
从Pubchem数据库下载各药物成分的3D结构。通过UniProt数据库下载各核心靶点的PDB结构,使用PYMOL软件对各结构进行加氢、去水等预处理,将预处理后的蛋白结构和活性成分结构转换为pdbqt格式,最后使用AutoDockVina 1.2.0进行分子对接模拟,并统计结合能。结合能lt;-5 kcal/mol表明对接越稳定[26]。
1.10 划痕实验检测细胞迁移能力
将Panc-1 细胞以3×105/孔接种于6 孔细胞培养板上36 h后,用灭菌的20 μL枪头尖端部位在没孔细胞表面划出一条直线“伤口”,在常规条件下培养。在光学显微镜下观察记录细胞在0、48 h的细胞划痕宽度。
1.11 克隆实验检测细胞增殖能力
将Panc-1 细胞以500/孔接种于6 孔细胞培养板上过夜,加入含不同药物浓度的培养液48 h,用新鲜培养液培养5~6 d,观察是否有克隆形成及克隆大小,并进行计数。
1.12 侵袭实验检验细胞侵袭能力
首先取Matrigel 基质胶稀释包被Transwell 小室,成胶后以无血清的培养基封闭30 min,在Transwell 小室上室和下室中分别加入200 μL 各组Panc-1 细胞悬液、750 μL含胎牛血清的DMEM培养基,48 h后,甲醇固定(30 min)、1%结晶紫染色(20 min)。采用Image-J图像分析软件计算各组Panc-1侵袭细胞数。
1.13 凋亡实验检测细胞凋亡
首先收集各组Panc-1 细胞,然后用预冷过的PBS冲洗2次,随后加入500 μL 1×Binding buffer进行重悬,最后加入5 μL 的Annexin V-FITC 和PI 染液,充分混匀。在室温下遮光染色15 min,最后采用上流式细胞仪检测各组Panc-1细胞凋亡情况。
1.14 Western blotting检测PI3K和AKT的磷酸化水平
将处于对数生长期细胞接种于6孔板,培养过夜,细胞融合率达70%时,加入金缕半枫荷提取物溶液(1 mg/mL),培养48 h后,加裂解液提取细胞蛋白,并以BCA法蛋白定量,蛋白经95 ℃变性5 min后保存。取等量蛋白样品,经10%SDS-PAGE电泳分离,蛋白转移至PVDF膜,加入一抗(1∶2000),4℃过夜,次日以PBST洗膜3次。加入二抗1∶2000),室温孵育1 h。PBST洗膜3次,加入ECL显影剂后置于化学发光成像仪成像,采用Image J软件测定蛋白条带灰度值。以GAPDH为内参,计算蛋白的相对表达量。
1.15 统计学分析
采用GraphPad Prism 8.0 软件对数据进行统计分析。所有数据以均数±标准差表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以Plt;0.05为差异有统计学意义。所有实验重复3次。
2 结果
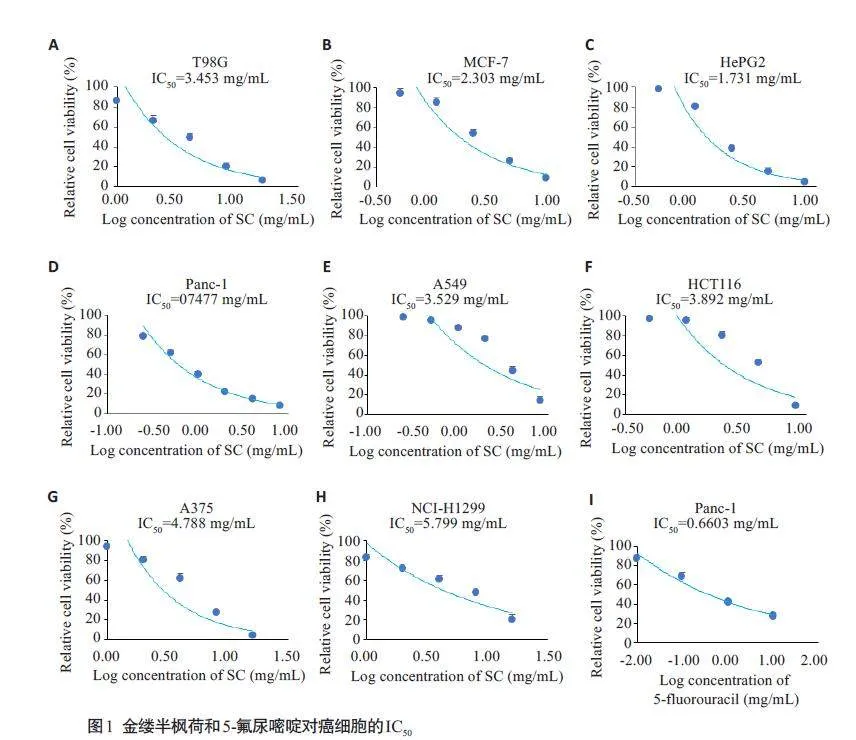
2.1 金缕半枫荷对Panc-1细胞的IC50
金缕半枫荷对胰腺癌细胞Panc-1的IC50低于其他癌细胞,5-FU对胰腺癌细胞Panc-1的IC50为0.6603 μmol/L(图1)。因此选择胰腺癌细胞Panc-1进行后续实验。
2.2 金缕半枫荷活性成分及其靶点的筛选
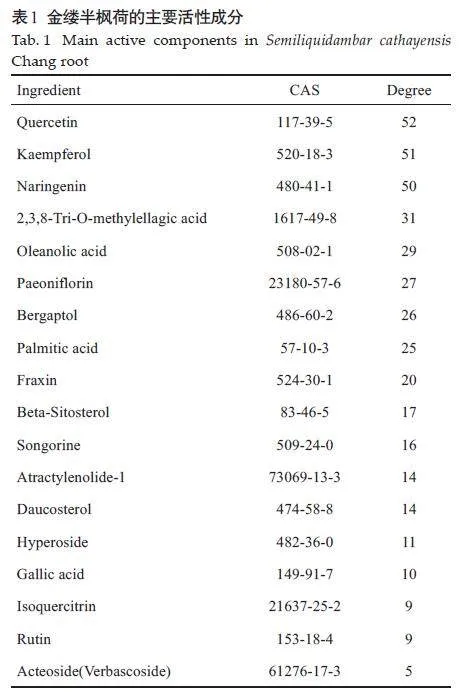
文献查询共得到活性成分18 种(表1)。综合SwissTargetPrediction和TCMIP的筛选条件,去掉重复项,最后得到药物成分靶点659个。
2.3 胰腺癌靶点预测
综合DisGeNET、DrugBank、GeneCards 3个数据库的预测结果,去掉重复项后,共收集得到胰腺癌靶点985个。
2.4 关键成分预测
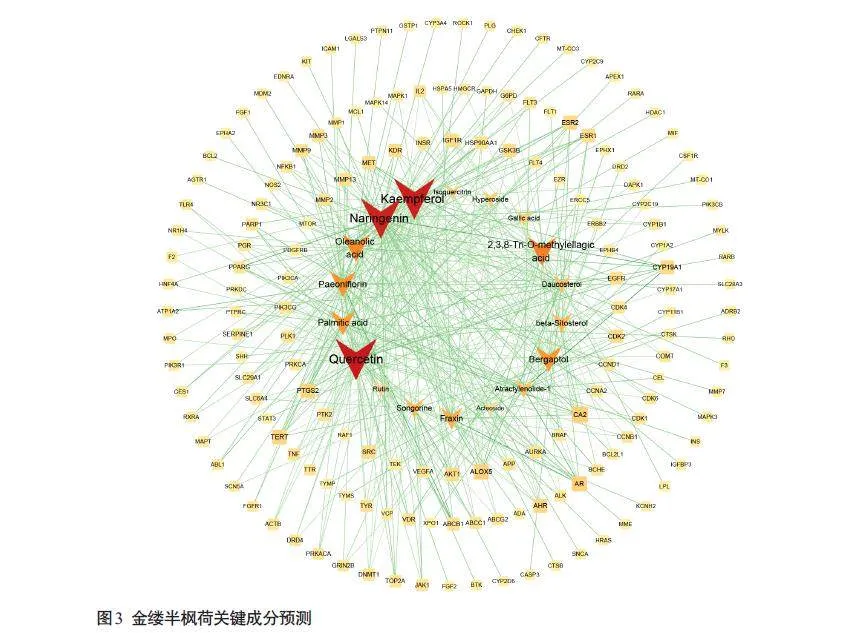
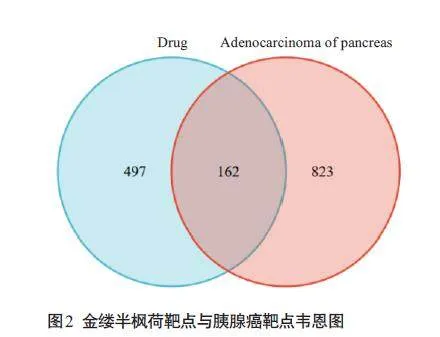
将活性成分靶点与疾病靶点进行靶点互作绘制韦恩图,获得交集靶点162个(图2)。将金缕半枫荷活性成分与关键靶点导入Cytoscape软件,共有160个节点,417 条边,平均节点度值4.63。Degree值最高的5 个化学成分分别为槲皮素、山奈酚、柚皮素、2,3,8-Tri-Omethylellagicacid、齐墩果酸(图3)。
2.5 PPI网络分析
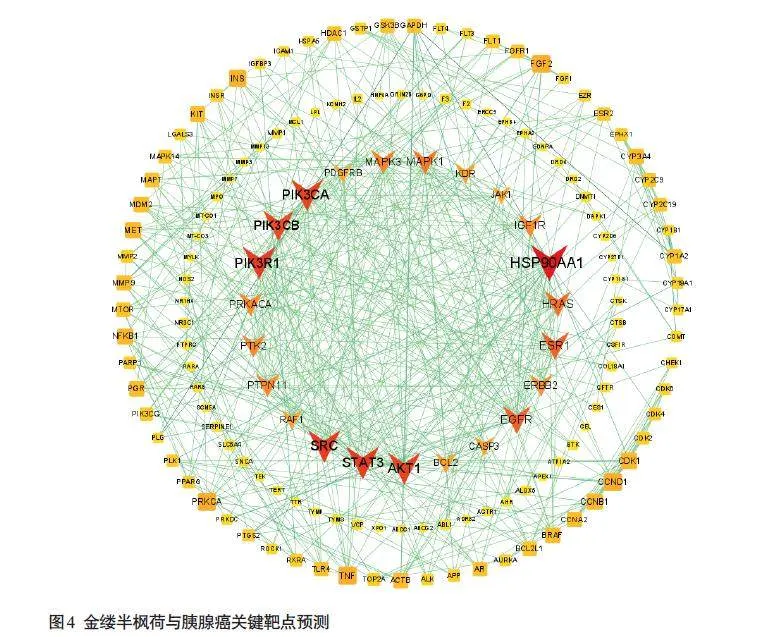
将162个交集靶点上传至String数据库,隐藏无关联节点,获得PPI 网络TSV 文件。将TSV 文件导入Cytoscape软件,构建PPI网络,共有150个节点,522条边,平均节点度值6.92。根据Degree值筛选,得到21个关键靶点,选取度值排名前5的靶点,分别为HSP90AA1、SRC、STAT3、PIK3R1、AKT1(图4)。
2.6 GO和KEGG富集分析
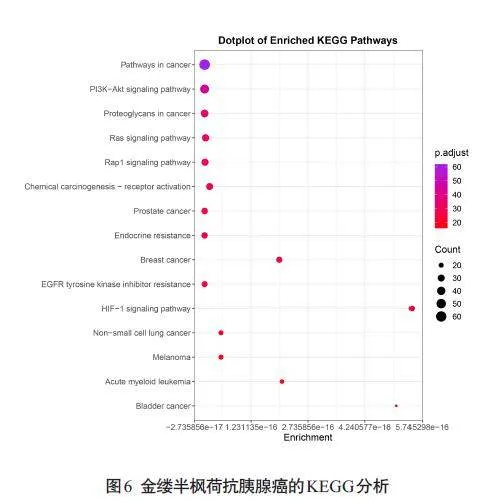
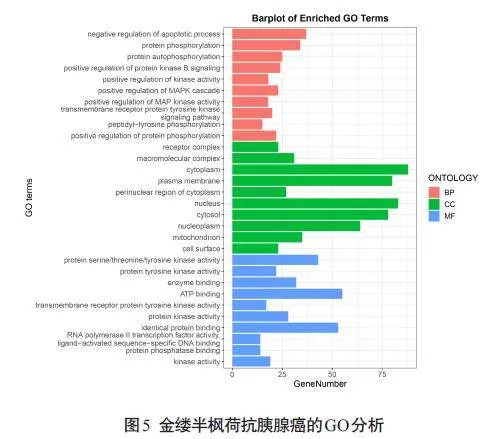
对162个交集靶点进行GO功能富集分析,共得到984条信号通路,其中生物过程735条,细胞组分99条,分子功能150条,各自选取P值最小的前10条通路绘制三色图(图5)。对162个交际靶点进行KEGG功能富集分析,共得到169条信号通路,选取P值最小的前15条通路绘制气泡图(图6)。
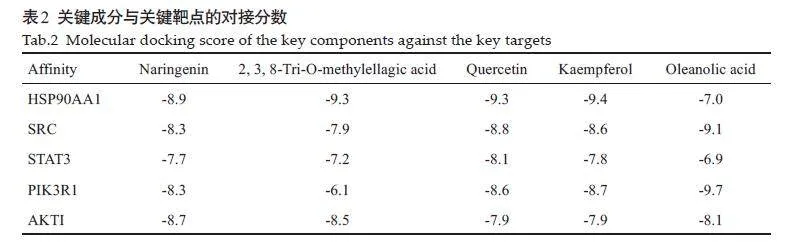
2.7 分子对接验证
根据筛选出的关键成分与关键基因进行分子对接验证,结果显示,各组合结合能均lt;-5 kcal/mol。多数组合结合能lt;-7 kcal/mol(表2)。
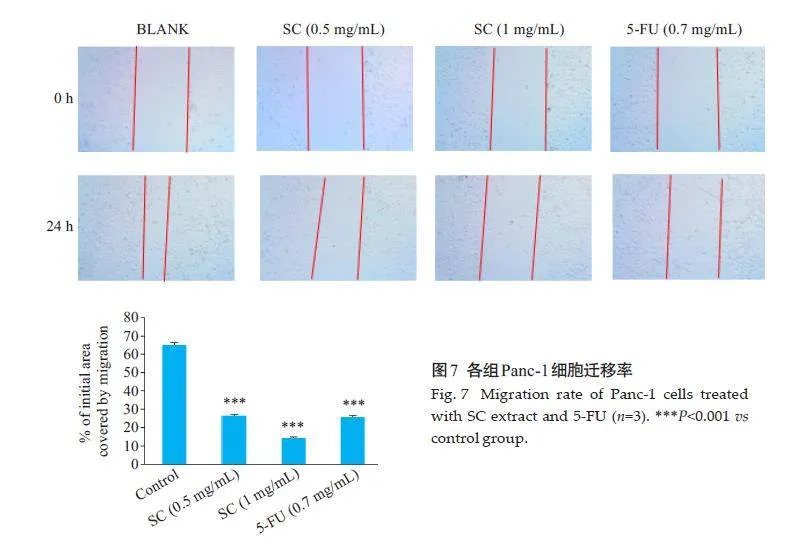
2.8 金缕半枫荷对Panc-1细胞迁移能力的影响
划痕实验结果表明,与对照组比较,金缕半枫荷低、高浓度组和阳性组5-FU对Panc-1 细胞划痕愈合率降低,差异有统计学意义(Plt;0.001,图7)。
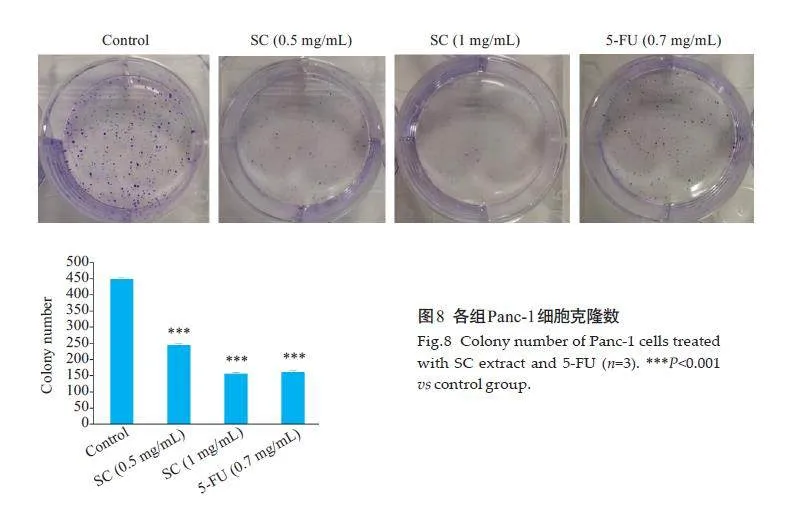
2.9 金缕半枫荷对panc-1细胞克隆能力的影响
克隆形成实验结果显示,与对照组比较,金缕半枫荷低、高浓度组和阳性组5-FU对Panc-1细胞克隆数降低,差异有统计学意义(Plt;0.001,图8)。
2.10 金缕半枫荷对panc-1细胞侵袭能力的影响
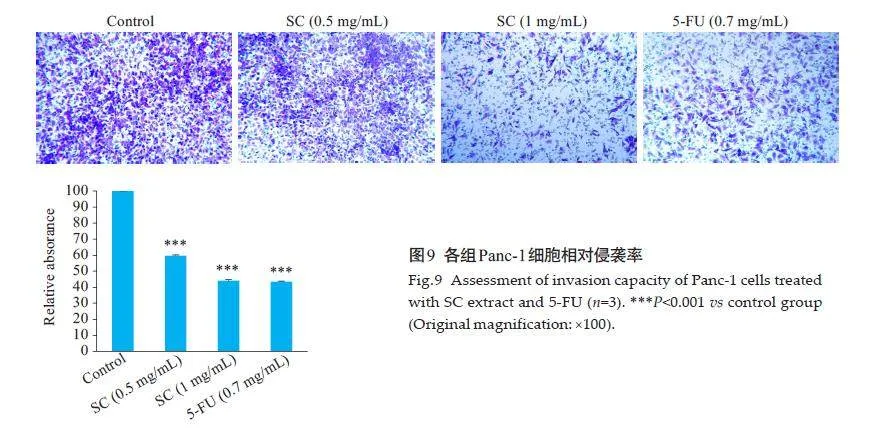
Transwell实验进一步表明,与对照组比较,金缕半枫荷低、高浓度组和阳性组5-FU对Panc-1细胞侵袭数降低,差异有统计学意义(Plt;0.001,图9)。
2.11 金缕半枫荷对panc-1细胞凋亡的影响
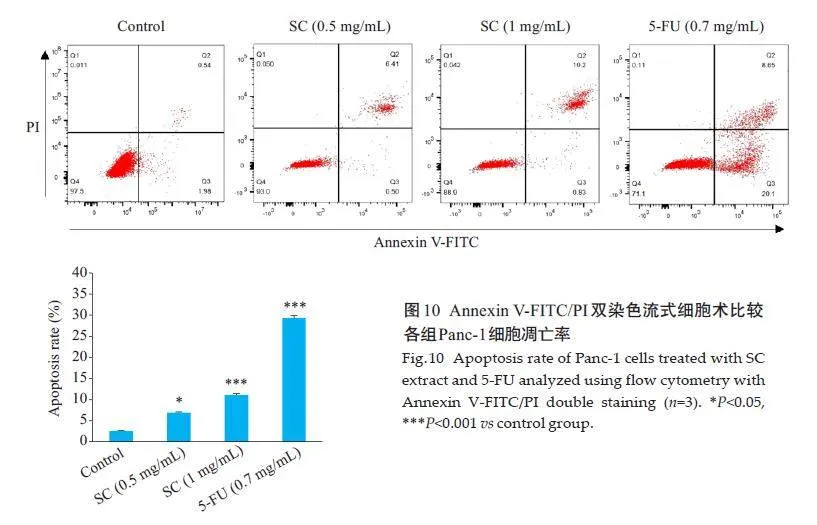
流式细胞术分析结果表明,与对照组相比,金缕半枫荷低、高浓度组和阳性组5-FU对Panc-1细胞凋亡率逐渐升高,差异有统计学意义(Plt;0.05,图10)。
2.12 Western blotting检测PI3K和AKT的磷酸化水平
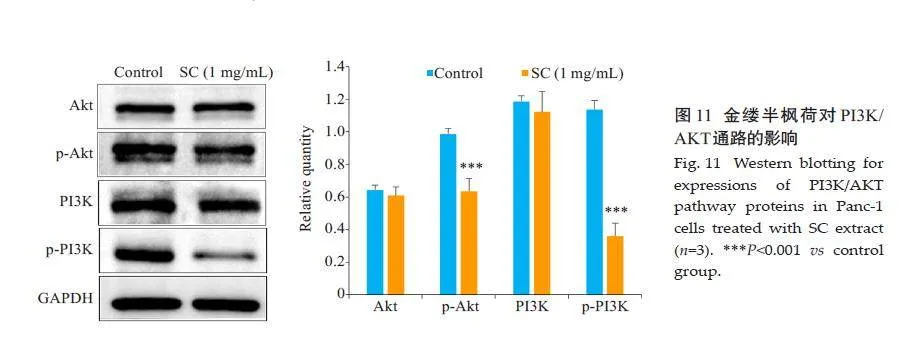
Western blotting实验显示,与对照组相比,金缕半枫荷可降低PI3K和AKT的磷酸化水平(Plt;0.001,图11)。
3 讨论
金缕半枫荷具有抗炎镇痛、活血化瘀的作用,既往用于治疗风湿性关节炎。本研究首次证明金缕半枫荷具有抗癌活性且对胰腺癌细胞Panc-1最敏感,呈浓度依赖性降低胰腺癌细胞Panc-1 的细胞活力;与对照组相比,其可以显著降低人胰腺癌细胞Panc-1划痕愈合率、侵袭数及克隆数,表明金缕半枫荷能抑制Panc-1细胞增殖、迁移、侵袭,促进凋亡,具有抗胰腺癌的作用。
中药具有多成分、多靶点、多途径的治疗作用[27]。本研究通过网络药理学共获得了162个疾病-药物靶点,运用多个数据库构建金缕半枫荷药物成分靶点网络、药物成分-疾病靶点交集网络等,并通过GO及KEGG富集分析预测金缕半枫荷抗胰腺癌的可能靶点。GO分析显示,金缕半枫荷可能通过调控细胞周期,抑制癌症细胞增殖、迁移和侵袭来抗胰腺癌;KEGG分析显示,其主要与癌症信号通路、癌症中的蛋白聚糖、PI3K-Akt信号通路、化学致癌-受体激活、前列腺癌、EGFR酪氨酸激酶抑制剂耐药性、内分泌抗性等通路密切相关,其中癌症信号通路P值最低,连接靶点数最多。本研究显示金缕半枫荷通过多靶点、多个通路共同作用发挥抗胰腺癌作用。胰腺癌治疗通路极其复杂,其中较为重要且已被证实的有PI3K-Akt信号通路。PI3K/AKT/mTOR信号通路是KRAS的主要下游效应体,也是参与调节胰腺癌的关键标志[28]。活化后的PI3K/Akt 信号通路,可以通过上调VEGF-C mRNA转录及其蛋白表达水平,诱导胰腺肿瘤淋巴管生成,导致癌细胞通过淋巴管进一步扩散[29]。SQLE通过调控PI3K/Akt信号通路减弱内质网应激和激活脂质筏来促进胰腺癌的生长[30]。本研究通过Western blot实验发现,与对照组相比,金缕半枫荷可以显著降低PI3K和AKT的磷酸化水平,表明金缕半枫荷可以显著抑制PI3K/AKT通路的磷酸化,结合以上网络药理学的分析结果,提示PI3K/AKT通路可能在金缕半枫荷抗胰腺癌过程中发挥重要作用。
目前尚无金缕半枫荷活性组分抗胰腺癌的相关研究,本研究通过关键成分PPI预测分析推测金缕半枫荷抗胰腺癌的活性组分,根据金缕半枫荷化学成分与靶点网络图可知,Degree 值最高的是槲皮素、山奈酚、柚皮素、2,3,8-Tri-O-methylellagic acid、齐墩果酸。槲皮素及其衍生物具有较好的抗炎、抗菌、抗肿瘤的作用,槲皮素诱导miR-200b-3p调节胰腺癌自我更新分裂[31];柚皮素和橙皮素联合治疗通过诱导caspase-3分裂抑制人胰腺癌细胞生长和迁移[32];山奈酚通过TGM2 介导Akt/mTOR信号传导诱导胰腺癌细胞中ROS依赖性细胞凋亡[33];齐墩果酸衍生物 K73-03 上调miR-421 调节胰腺癌细胞中表观遗传SPINK1转录,导致代谢变化和增强细胞凋亡[34]。这些活性成分通过影响癌细胞周期、凋亡、增殖、炎症等多途径实现协同抗癌作用,是金缕半枫荷抗胰腺癌的主要物质基础。
本研究通过蛋白互作网络分析推测金缕半枫荷抗胰腺癌靶点,结果显示,在蛋白互作网络中,根据Degree值,HSP90AA1、SRC、STAT3、PIK3R1、AKT1可能是金缕半枫荷抗胰腺癌的作用靶点。有研究结果显示HSP90α是晚期NSCLC化疗的有价值预测因子,其水平与化疗后肿瘤缓解呈正相关[35]。在结肠腺癌和胰腺导管腺癌中,KRAS/BRAF/MARP 激酶、PI3K/Akt/mTOR和JAK/STAT信号通路可能促进肿瘤的生长和进展[36-38]。活性Akt1 与活性突变体KRasG12D合作加速胰腺癌的发生和进展,并增加Akt通路中下游效应子的磷酸化[39]。JAK2磷酸化STAT3并激活JAK2-STAT3信号通路触发KRASG12DPDAC淋巴管生成和LN转移[40]。本研究通过分子对接分析显示,金缕半枫荷活性成分能够与核心基因中HSP90AA1、SRC、STAT3、PIK3R1、AKT1存在良好的结合能力,表明金缕半枫荷可能是通过这些核心基因发挥抗胰腺癌作用。
综上所述,本研究首次证明金缕半枫荷具有抗胰腺癌作用,首次通过网络药理学和分子对接对金缕半枫荷抗胰腺癌的作用机制和靶点进行了预测,发现金缕半枫荷可能通过多靶点、多通路发挥作用抗胰腺癌,在分子水平上证实了金缕半枫荷对胰腺癌的作用,并系统阐述了其可能的作用机制和靶点。但研究仍然存在一些局限性:生物活性成分的获取是基于现有的数据库和文献,可能不全面;实验验证不足,缺少动物实验,但本研究为研究金缕半枫荷的药理机制提供新的思路并为开发金缕半枫荷成为抗胰腺癌药物提供了科学依据。
参考文献:
[1] Huang JJ, Lok V, Ngai CH, et al. Worldwide burden of, risk factorsfor, and trends in pancreatic cancer[J]. Gastroenterology, 2021, 160(3): 744-54.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CACancer J Clin, 2016, 66(1): 7-30.
[3] Park W, Chawla A, O’Reilly EM. Pancreatic cancer: a review[J].JAMA, 2021, 326(9): 851-62.
[4] Lin WF, Lu JY, Cheng BB, et al. Progress in research on the effectsof traditional Chinese medicine on the tumor microenvironment[J].J Integr Med, 2017, 15(4): 282-7.
[5] 苏玉平, 刘 宇, 马晓琴, 等. 贵州黔东南地区半枫荷的研究进展[J].中央民族大学学报: 自然科学版, 2022, 31(1): 92-6.
[6] 唐 娟, 刘晓龙, 胡成刚, 等. 半枫荷化学成分及药理作用研究进展[J]. 广州化工, 2022, 50(21): 7-10, 35.
[7] 田晓明, 颜立红, 蒋利媛, 等. 半枫荷抗炎镇痛活性部位筛选及其成分分析[J]. 陕西中医药大学学报, 2021, 44(5): 63-8.
[8] Shadhu K, Xi CH. Inflammation and pancreatic cancer: an updatedreview[J]. Saudi J Gastroenterol, 2019, 25(1): 3-13.
[9] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-74.
[10]Stone ML, Beatty GL. Cellular determinants and therapeuticimplications of inflammation in pancreatic cancer[J]. PharmacolTher, 2019, 201: 202-13.
[11] Farajzadeh Valilou S, Keshavarz-Fathi M, Silvestris N, et al. Therole of inflammatory cytokines and tumor associated macrophages(TAMs) in microenvironment of pancreatic cancer[J]. CytokineGrowth Factor Rev, 2018, 39: 46-61.
[12]Florean C, Dicato M, Diederich M. Immune-modulating and antiinflammatorymarine compounds against cancer[J]. Semin CancerBiol, 2022, 80: 58-72.
[13]韩东波, 何俊慧, 贾春莲, 等. 基于NF-κB/TNF-α/IL-6通路探讨拟黑多刺蚁活性组分对脂多糖诱导抑郁小鼠神经炎症的影响[J]. 中药材, 2023, 46(10): 2551-7.
[14]何 飞, 李冬梅, 苏启表, 等. 拟黑多刺蚁活性组分治疗小鼠皮肤瘙痒的实验研究[J]. 中药材, 2018, 41(5): 1200-3.
[15]Pu XY, Tian K, Sun JX, et al. Anti-inflammatory monoterpene estersfrom the stems of Illigera aromatica[J]. Nat Prod Res, 2021, 35(6):960-6.
[16]Su QB, Su H, Nong ZH, et al. Hypouricemic and nephroprotectiveeffects of an active fraction from Polyrhachis vicina Roger onpotassium oxonate-induced hyperuricemia in rats[J]. Kidney BloodPress Res, 2018, 43(1): 220-33.
[17]韦 洁, 李冬梅, 何俊慧, 等. 香青藤提取物通过Wnt/β-catenin信号通路抑制胶质瘤U87细胞的间质转化[J]. 中国免疫学杂志, 2023, 39(7): 1431-6.
[18]韦 贤, 李冬梅, 何俊慧, 等. 拟黑多刺蚁活性组分通过miR-186-5p/Cx43 促进结直肠癌SW116 细胞凋亡的作用[J]. 中成药, 2022, 44(6): 1783-91.
[19]Li DM, Zhong M, Su QB, et al. Active fraction of Polyrhachis vicinaRogers (AFPR) suppressed breast cancer growth and progression viaregulating EGR1/lncRNA-NKILA/NF- κB axis[J]. BiomedecinePharmacother, 2020, 123: 109616.
[20]Li DM, Zhu FC, Wei J, et al. The Active Fraction of Polyrhachisvicina Roger (AFPR) activates ERK to cause necroptosis incolorectal cancer[J]. J Ethnopharmacol, 2023, 312: 116454.
[21]何俊慧, 韦 洁, 李冬梅, 等. 基于网络药理学、分子对接和动物实验探究壮药金缕半枫荷对抑郁症炎症的作用机制[J]. 中国药理学通报,2023, 39(7): 1362-70.
[22]卢海啸, 吕思颖, 姚水莲, 等. 金缕半枫荷甲醇部位化学成分研究[J]. 中药材, 2022, 45(3): 606-10.
[23]裘 硕, 陈月圆, 颜小捷, 等. 金缕半枫荷叶化学成分研究[J]. 中药材,2020, 43(5): 1134-7.
[24]Yang L, Liu RH, He JW. Rapid analysis of the chemicalcompositions in Semiliquidambar cathayensis roots by ultra highperformanceliquid chromatography and quadrupole time-of-flighttandem mass spectrometry[J]. Molecules, 2019, 24(22): 4098.
[25]Zhu D, Qu XC, Sun XM, et al. Comparative authentication ofSemiliquidambar cathayensis and its substituted species viamacroscopic and microscopic features[J]. Chin Herb Med, 2022, 14(4): 535-42.
[26]Hsin KY, Ghosh S, Kitano H. Combining machine learning systemsand multiple docking simulation packages to improve dockingprediction reliability for network pharmacology[J]. PLoS One,2013, 8(12): e83922.
[27]Zhao L, Zhang H, Li N, et al. Network pharmacology, a promisingapproach to reveal the pharmacology mechanism of Chinesemedicine formula[J]. J Ethnopharmacol, 2023, 309: 116306.
[28]Mortazavi M, Moosavi F, Martini M, et al. Prospects of targetingPI3K/AKT/mTOR pathway in pancreatic cancer[J]. Crit Rev OncolHematol, 2022, 176: 103749.
[29]Kong Y, Li YT, Luo YM, et al. circNFIB1 inhibits lymphangiogenesisand lymphatic metastasis via the miR-486-5p/PIK3R1/VEGF-C axis in pancreatic cancer[J]. Mol Cancer, 2020, 19(1): 82.
[30]Xu RY, Song JL, Ruze R, et al. SQLE promotes pancreatic cancergrowth by attenuating ER stress and activating lipid rafts-regulatedSrc/PI3K/Akt signaling pathway[J]. Cell Death Dis, 2023, 14(8): 497.
[31]Nwaeburu CC, Abukiwan A, Zhao ZF, et al. Quercetin-induced miR-200b-3p regulates the mode of self-renewing divisions in pancreaticcancer[J]. Mol Cancer, 2017, 16(1): 23.
[32]Lee J, Kim DH, Kim JH. Combined administration of naringeninand hesperetin with optimal ratio maximizes the anti-cancer effect inhuman pancreatic cancer via down regulation of FAK and p38signaling pathway[J]. Phytomedicine, 2019, 58: 152762.
[33]Wang FJ, Wang L, Qu C, et al. Kaempferol induces ROS-dependentapoptosis in pancreatic cancer cells via TGM2-mediated Akt/mTORsignaling[J]. BMC Cancer, 2021, 21(1): 396.
[34]Shopit A, Li XD, Tang ZY, et al. MiR-421 up-regulation by theoleanolic acid derivative K73-03 regulates epigenetically SPINK1transcription in pancreatic cancer cells leading to metabolic changesand enhanced apoptosis[J]. Pharmacol Res, 2020, 161: 105130.
[35]Zhong B, Shen JX, Zhang CY, et al. Plasma heat shock protein 90alpha: a valuable predictor of early chemotherapy effectiveness inadvanced non-small-cell lung cancer[J]. Med Sci Monit, 2021, 27:e924778.
[36]Bardelli A, Siena S. Molecular mechanisms of resistance tocetuximab and panitumumab in colorectal cancer[J]. J Clin Oncol,2010, 28(7): 1254-61.
[37]Higginbotham JN, Demory Beckler M, Gephart JD, et al.Amphiregulin exosomes increase cancer cell invasion[J]. Curr Biol,2011, 21(9): 779-86.
[38]Yotsumoto F, Fukami T, Yagi H, et al. Amphiregulin regulates theactivation of ERK and Akt through epidermal growth factor receptorand HER3 signals involved in the progression of pancreatic cancer[J]. Cancer Sci, 2010, 101(11): 2351-60.
[39]Albury TM, Pandey V, Gitto SB, et al. Constitutively active Akt1cooperates with KRas(G12D) to accelerate in vivo pancreatic tumoronset and progression[J]. Neoplasia, 2015, 17(2): 175-82.
[40]Kong Y, Luo YM, Zheng SY, et al. Mutant KRAS mediatescircARFGEF2 biogenesis to promote lymphatic metastasis of pancreaticductal adenocarcinoma[J]. Cancer Res, 2023, 83(18): 3077-94.
(编辑:郎 朗)
基金项目:国家自然科学基金(81703769);广西人才基地项目(AD22035055);广东省自然科学基金(2019A1515011669)

