5′-N-乙基酰胺基腺苷对心肌线粒体自噬和呼吸功能的影响

[摘要]" 目的: 探讨选择性腺苷A2受体激动剂5′-N-乙基酰胺基腺苷(5′-N-ethylcarboxamido adenosine,NECA)对心肌线粒体自噬和呼吸功能的影响及可能机制。方法: 培养大鼠心肌H9c2细胞,给予不同浓度NECA(10、100、1 000 nmol/L)处理2 h,对照组给予等体积PBS处理2 h。CCK-8法检测细胞活性;蛋白质印迹实验检测线粒体自噬及相关因子的表达水平;运用线粒体膜电位探针四甲基罗丹明乙酯(TMRE)检测线粒体膜电位;运用线粒体红色荧光探针Mitotracker Red和溶酶体绿色荧光探针Lysotracker Green同时标记细胞,并用激光共聚焦扫描显微镜记录线粒体和溶酶体的共定位情况;应用Oxygraph-2k高分辨率呼吸仪检测细胞线粒体呼吸功能。结果: 与对照组相比,不同浓度NECA组细胞活力和线粒体膜电位均无显著变化。蛋白质印迹实验结果显示,与对照组相比,10 nmol/L和100 nmol/L NECA处理组线粒体的线粒体外膜转位酶20(TOM20)和内膜蛋白细胞色素C氧化酶Ⅳ亚型(COX Ⅳ)增高,1 000 nmol/L处理后,TOM20和COX Ⅳ较对照组无明显差异;而NECA对线粒体内膜转位酶23(TIM23)表达水平无显著影响。与对照组相比,加入10 nmol/L NECA处理后线粒体自噬相关因子FUN14结构域包含蛋白1(FUNDC1)表达明显增加,100、1 000 nmol/L NECA处理对FUNDC1表达无显著影响;而NECA对同源性磷酸酶张力蛋白诱导激酶1(PINK1)和帕金森蛋白(Parkin)表达水平无明显影响。共聚焦显微镜可见,与对照组相比,NECA处理组的溶酶体与线粒体共定位降低。Oxygraph-2k高分辨率呼吸仪检测结果显示,NECA处理组心肌H9c2细胞线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅳ的活性与对照组相比无明显变化。结论: NECA抑制心肌H9c2细胞线粒体自噬但对线粒体呼吸功能无影响。
[关键词]" 5′-N-乙基甲酰胺基腺苷;线粒体自噬;线粒体呼吸功能;冠心病
[中图分类号]" R542.2" [文献标志码]" A" [文章编号]" 1671-7783(2024)05-0388-07
DOI: 10.13312/j.issn.1671-7783.y230292
[引用格式]王蕴琦,黄家康,王瑶,等. 5′-N-乙基酰胺基腺苷对心肌线粒体自噬和呼吸功能的影响[J]. 江苏大学学报(医学版), 2024, 34(5): 388-394.
[基金项目]中央引导地方科技发展资金项目(226Z7711G);河北省引进留学人员资助项目(C20220354);华北理工大学公共卫生学院青年人才托举计划(QNRC202313)
[作者简介]王蕴琦(1996—),女,硕士研究生;徐菁蔓(通讯作者),副教授,博士,E-mail: xujm@ncst.edu.cn
Effects of 5′-N-ethylcarboxamido adenosine on myocardial mitophagy and
mitochondrial respiratory function
WANG Yunqi1, HUANG Jiakang1, WANG Yao1, TIAN Wei2,3,4, XU Jingman1,2,3
(1. School of Public Health, Norh China University of Science and Technology; 2. Hebei Coordinated Innovation Center of Occupational Health and Safety; 3. Hebei Key Laboratory of Organ Fibrosis; 4. Laboratory Animal Center, Norh China University of Science and Technology, Tangshan Hebei 063200, China)
[Abstract]" Objective: To investigate the effect and its possible mechanism of 5′-N-ethylcarboxamido adenosine (NECA), a selective adenosine A2 receptor agonist, on myocardial mitophagy and mitochondrial respiratory function. Methods: Rat myocardial H9c2 cells were cultured and treated with different concentrations of NECA,while the control group was treated with equal volume PBS for 2 h. CCK-8 was used to test cell viability. The expression levels of mitophagy related proteins were detected by Western blotting. Mitochondrial membrane potential was measured by Tetramethyl rhodamine ethyl ester (TMRE) fluorescent probe. Mitochondrial red fluorescence probe Mitotracker Red and lysosome green fluorescence probe Lysotracker Green were used to label the cells simultaneously, and the co-localization of mitochondria and lysosome was recorded by laser confocal scanning microscope. The mitochondrial respiratory function was measured with Oxygraph-2k high resolution respiratory apparatus. Results: Comparing to the control group, NECA (10, 100 and 1 000 nmol/L) could not change both the cell viability and the mitochondrial membrane potential. Western blotting results showed that compared with the control group, translocase of the outer mitochondrial membrane 20 (TOM20) and inner membrane protein cytochrome C oxidase Ⅳ (COX Ⅳ) in the NECA (10, 100 nmol/L) group were increased, and there was no significant difference between TOM20 and COX Ⅳ after 1 000 nmol/L treatment. There was no significant change in the expression level of translocase of inner mitochondrial membrane 23 (TIM23). Compared with the control group, the expression of mitophagy related factor FUN14 domain-containing protein 1 (FUNDC1) was significantly increased after the addition of NECA (10 nmol/L), while 100 and 1 000 nmol/L NECA treatments had no significant effect on FUNDC1 expression. The expression levels of homologous phosphatase tensin induced kinase 1 (PINK1) and Parkinson′s protein (Parkin) were not changed markedly. Confocal results showed that compared with the control group, the co-localization of lysosome to mitochondrial was reduced in the NECA treatment group. The results of Oxygraph-2k high resolution respiratory apparatus showed that compared with the control group, the activity of mitochondrial respiratory chain complex Ⅰ, Ⅱ and Ⅳ of myocardial H9c2 cells in the NECA treatment group had no significant change. Conclusion: NECA inhibited mitophagy but had no effect on mitochondrial respiratory function in cardiac H9c2 cells.
[Key words]" NECA; mitophagy; mitochondrial respiratory function; coronary heart disease
冠状动脉粥样硬化性心脏病(简称冠心病)是严重危害人类健康的一类疾病。研究表明腺苷及其类似物可能是最具潜力的心脏保护药物,其能够减轻冠心病引起的心肌损伤[1]。多项实验研究发现腺苷A2受体激动剂5′-N-乙基酰胺基腺苷(5′-N-ethylcarboxamido adenosine,NECA)能够减轻再灌注诱发的心肌损伤[2-4]。心肌组织能量需求大,富含线粒体,线粒体稳态的维持对心肌细胞能量代谢和细胞凋亡调控都有重要的作用。维持线粒体数量和质量的动态平衡对细胞正常生命活动至关重要[5]。本课题组前期也证实NECA可激活线粒体Src酪氨酸激酶,促进呼吸链复合体Ⅰ的酪氨酸位点磷酸化,抑制其活性,减少活性氧的产生,同时增加抗氧化酶活性,促进活性氧的分解,进而减轻心肌氧化应激损伤[6]。然而,NECA对心肌线粒体结构和功能的影响仍未完全阐明。本研究主要探讨NECA对心肌线粒体自噬和呼吸功能的影响及其可能机制,为完善NECA的心脏保护机制提供可靠的实验依据。
1" 材料和方法
1.1" 仪器与试剂
多功能酶标仪(美国Molecular Devices公司);FV1000激光共聚焦扫描显微镜(日本OLYMPUS公司);Oxygraph-2k线粒体呼吸测定系统(奥地利OROBOROS公司)。
NECA以及线粒体呼吸功能测定相关试剂(美国Sigma公司);线粒体外膜转位酶20(translocase of the outer mitochondrial membrane 20,TOM20),线粒体内膜转位酶23(translocase of inner mitochondrial membrane 23,TIM23),细胞色素C氧化酶Ⅳ亚型(cytochrome C oxidase Ⅳ,COX Ⅳ),β-tubulin抗体(美国Cell Signaling Technology公司);同源性磷酸酶张力蛋白诱导激酶1(homologous phosphatase tensin induced kinase 1,PINK1),帕金森蛋白(Parkin),FUN14结构域包含蛋白1(FUN14 domain containing 1,FUNDC1)抗体(成都正能公司);CCK8检测试剂盒,四甲基罗丹明乙酯(tetramethylrhodamine ethyl ester,TMRE)检测试剂盒,Mitotracker Red和Lysotracker Green均购自上海碧云天公司。
1.2" 细胞培养
大鼠心肌H9c2细胞系购自美国ATCC细胞库。用含10%胎牛血清和1%青霉素/链霉素的DMEM,在37 ℃、5% CO2培养箱中培养,待细胞密度达到80%~90%时,用0.25%胰蛋白酶消化,计数后传代培养。实验设对照组(给予等体积PBS处理2 h)和不同浓度NECA组(分别给予10、100和1 000 nmol/L NECA处理2 h)。
1.3" CCK-8检测H9c2细胞活力
取对数生长期的H9c2细胞,以5×103个/孔的密度接种于96孔板中,每孔100 μL,待密度达到80%左右时,按照分组处理细胞,PBS清洗后,每孔加入含10% CCK-8的DMEM 100 μL,37 ℃、5% CO2培养箱中培养1 h,于450 nm波长下检测光密度值。每组设6个复孔,同时设置空白对照。
1.4" TMRE荧光探针检测线粒体膜电位
按照分组处理细胞结束后,取出细胞培养小皿,弃去培养基,PBS洗涤3次,更换含有100 nmol/L线粒体膜电位探针TMRE的新培养基,在37 ℃、5% CO2培养箱中培养20 min,弃去培养基,PBS洗涤3次,更换不含荧光探针的培养基,置于激光共聚焦扫描显微镜上,设置激发波长为543 nm,发射波长为575 nm,采集图像,利用Image J软件分析图像荧光强度值,反映线粒体膜电位的高低。
1.5" 蛋白质印迹检测线粒体自噬相关蛋白及相关因子表达水平
按照分组处理细胞,加入含100 nmol/L苯甲基磺酰氟(PMSF)的裂解液,冰上裂解30 min,刮取细胞,超声破碎20~30 s,1.1×104 r/min离心15 min,提取上清液。经BCA测定蛋白浓度,100 ℃变性5 min后,进行聚丙烯酰胺凝胶电泳。蛋白转膜后,用10%脱脂奶粉室温封闭1 h,0.1% TBST洗膜3次,用鼠源TOM20、兔源COX Ⅳ、鼠源TIM23、兔源FUNDC1、兔源PINK1、兔源Parkin一抗(1∶1 000)于4 ℃分别孵育过夜。0.1% TBST洗膜3次,室温孵育同源二抗(1∶1 000)2 h,0.1% TBST洗膜3次,用ECL显色并采集图像,使用Image J软件对条带进行灰度值分析,记录数据并进行统计分析。
1.6" Mitotracker Red和Lysotracker Green检测线粒体和溶酶体共定位
按照分组处理细胞结束后,取出细胞培养小皿,弃去培养基,PBS洗涤3次,更换含有Mitotracker Red(1∶1 000)和Lysotracker Green(1∶1 000)荧光探针的新培养基,在37 ℃、5% CO2培养箱中培养30 min,弃去培养基,PBS洗涤3次,更换不含荧光探针的培养基,置于激光共聚焦扫描显微镜上,设置激发波长分别为488 nm/543 nm,发射波长分别为525 nm/575 nm,采用序列扫描方式采图。
1.7" Oxygraph-2k高分辨率呼吸仪测定线粒体呼吸链复合体活性
每次实验前需进行空气校准,向仓内加入按照实验分组处理完成的H9c2细胞悬液(2×105/mL),完全插入金属塞后待曲线平稳即可依次加入反应试剂:洋地黄皂苷(digitonin,8 μmol/L)用以破坏细胞膜;细胞色素c(cytochrome,4 mmol/L)用以评价线粒体外膜完整性;苹果酸(malic acid,5 mmol/L)和谷氨酸(glutamic acid,10 mmol/L)以诱导复合体Ⅰ依赖性呼吸;二磷酸腺苷(ADP,2.5 mmol/L)以诱导复合体Ⅰ最大呼吸速率;复合体Ⅰ抑制剂鱼藤酮(rotenone,0.2 μmol/L)抑制复合体Ⅰ呼吸;复合体Ⅱ底物琥珀酸(succinicacid,10 mmol/L)以诱导复合体Ⅱ依赖性呼吸;复合体Ⅱ抑制剂抗霉素A(antimycin A,5 μmol/L)抑制复合体Ⅱ活性;复合体Ⅳ底物四甲基对苯二胺二盐酸盐(TMPD,0.25 mmol/L)+抗坏血酸(ascorbate,1 mmol/L)以诱导复合体Ⅳ依赖性呼吸;复合体Ⅳ抑制剂叠氮化钠(sodium azide,5 mmol/L)以抑制复合体Ⅳ活性。
1.8" 统计学方法
应用SPSS 23.0软件对数据进行统计分析,数据以均数±标准差(x±s)表示,两组均数比较采用t检验,三组及以上组间比较采用单因素方差分析,进一步两组间均数比较采用LSD-t检验,Plt;0.05为差异有统计学意义。
2" 结果
2.1nbsp; NECA对心肌H9c2细胞活性和线粒体膜电位无明显影响
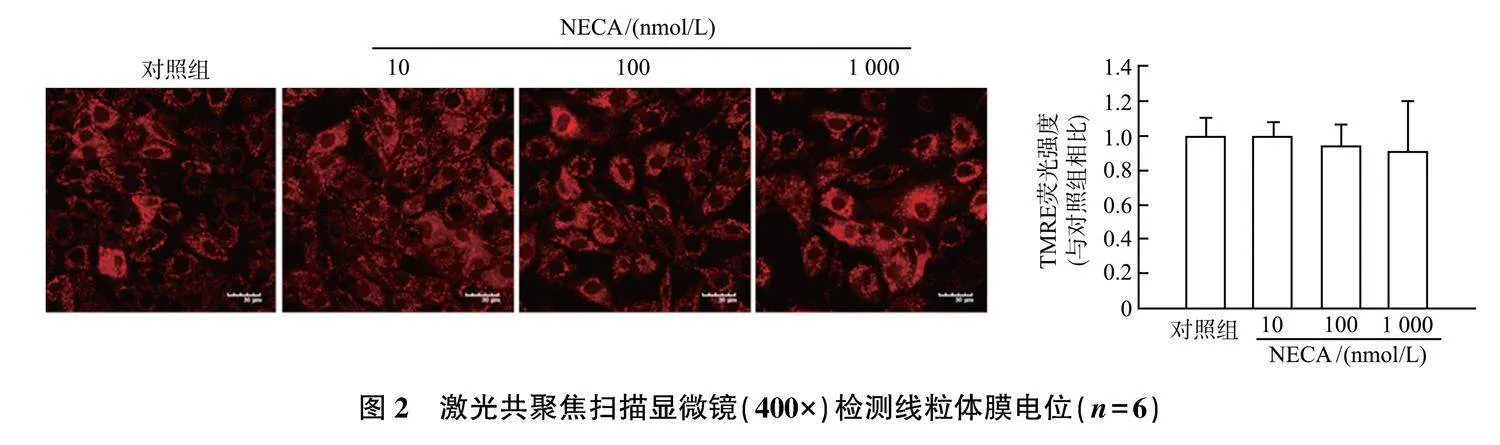
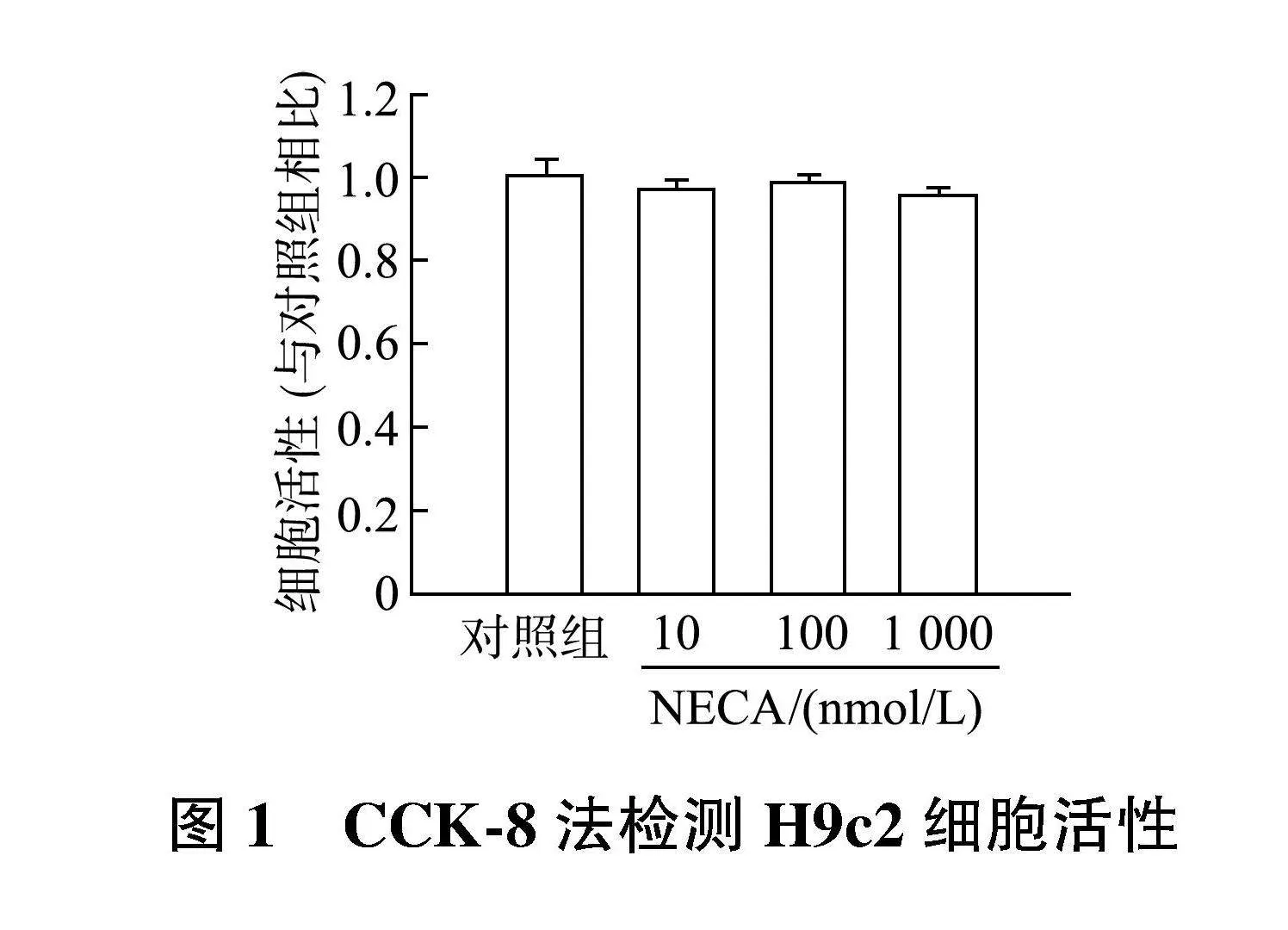
CCK-8实验结果(图1)显示,与对照组相比,不同浓度NECA(10、100和1 000 nmol/L)处理对H9c2细胞的活性无显著影响,表明实验中NECA对心肌细胞无毒性作用。与对照组相比,加入NECA(10、100和1 000 nmol/L)后,TMRE荧光强度无明显变化,表明NECA对心肌线粒体膜电位也无显著影响(图2)。
2.2" NECA抑制心肌H9c2细胞线粒体自噬
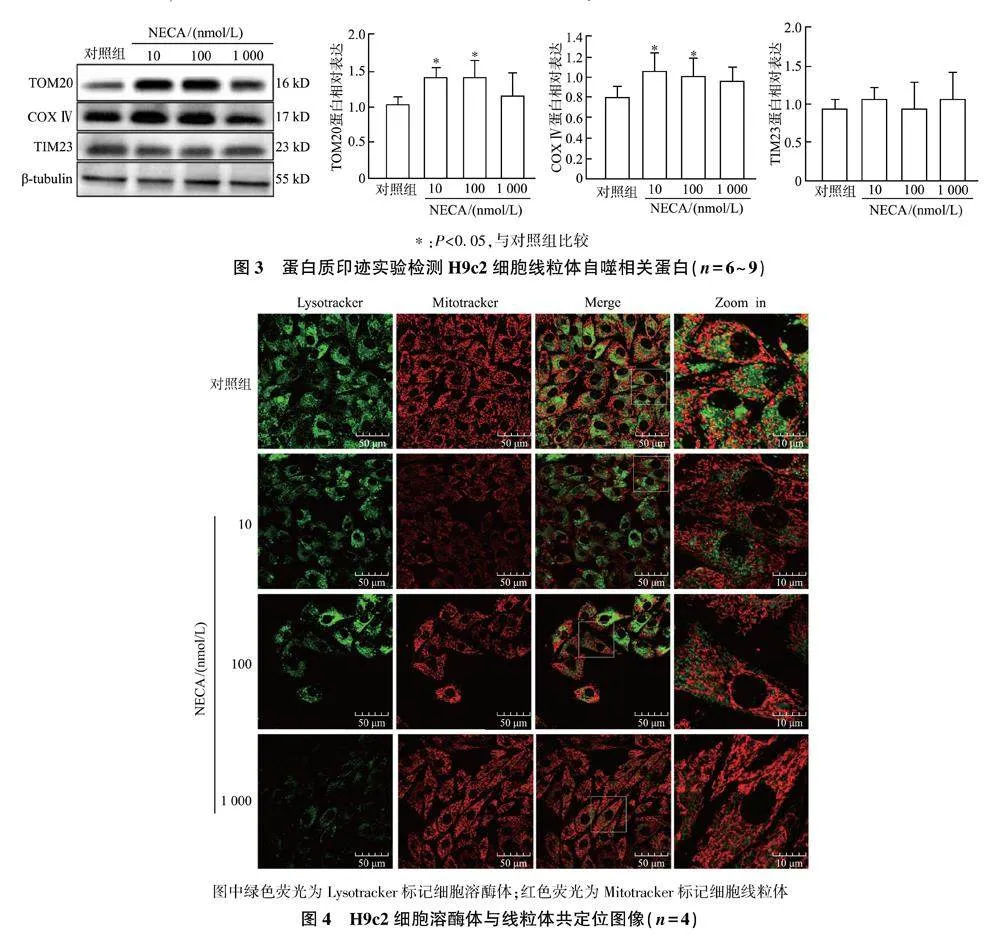
线粒体自噬相关蛋白的蛋白质印迹结果如图3所示,与对照组相比,加入10 nmol/L和100 nmol/L NECA处理后,TOM20和COX Ⅳ明显增高(Plt;0.05);1 000 nmol/L处理后,TOM20和COX Ⅳ与对照组无明显差异,表明NECA抑制心肌细胞线粒体自噬。而NECA对TIM23的表达水平无显著影响。
H9c2细胞溶酶体与线粒体共定位结果如图4所示,与对照组相比,NECA处理组的溶酶体与线粒体共定位减少,表明加入NECA后溶酶体对线粒体的捕获清除被抑制,由此说明NECA抑制了线粒体的自噬。
图中绿色荧光为Lysotracker标记细胞溶酶体;红色荧光为Mitotracker标记细胞线粒体
2.3" NECA对线粒体自噬相关因子的影响
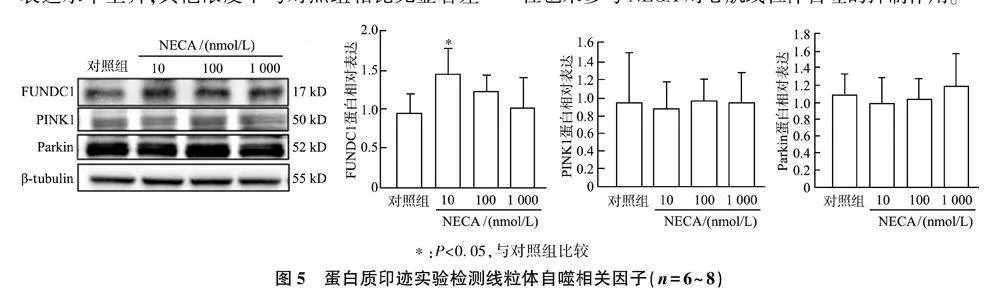
蛋白质印迹结果如图5所示,与对照组相比,加入10 nmol/L NECA处理后线粒体自噬相关因子FUNDC1表达水平上升,其他浓度下与对照组相比无显著差异,表明NECA并非通过下调FUNDC1表达抑制心肌H9c2细胞线粒体自噬。而NECA对PINK1和Parkin的表达水平无显著影响,说明PINK1/Parkin信号途径也未参与NECA对心肌线粒体自噬的抑制作用。
2.4" NECA对心肌H9c2细胞线粒体呼吸功能无明显影响
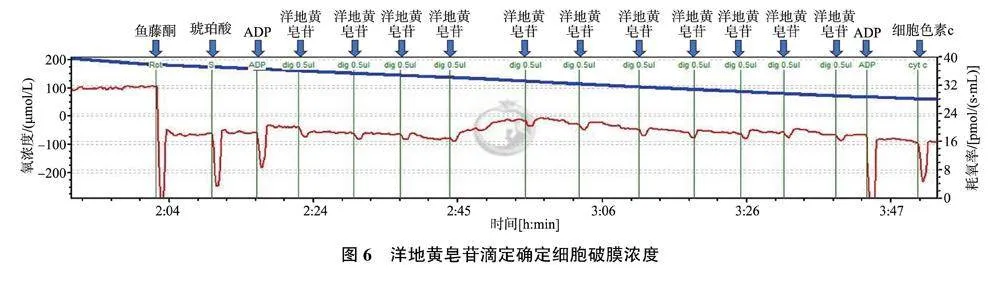
2.4.1" 洋地黄皂苷破膜浓度的滴定" 实验开始之前需要对细胞进行破膜处理,使得胞内线粒体呼吸链复合体能与加入的底物、抑制剂等试剂进行反应。应用Oxygraph-2k高分辨率呼吸仪滴定洋地黄皂苷以确定细胞破膜的最适浓度,结果如图6所示,当进行到第4次加入洋地黄皂苷时,耗氧量开始增加,说明复合体开始与底物进行反应,确定最适破膜浓度为8 μmol/L。
2.4.2" 细胞色素C滴定评价线粒体外膜的完整性" 在确定洋地黄皂苷破膜浓度后,需进一步验证该浓度下的线粒体外膜是否完整。当外膜完整性缺失时,细胞色素C可漏出线粒体,从而使呼吸速率下降,甚至抑制呼吸。此时,如果添加外源性细胞色素C将显著地刺激线粒体呼吸,导致其耗氧量增加。如图7所示,滴定细胞色素C,耗氧量没有上升,表明线粒体细胞色素C没有损失,说明洋地黄皂苷破膜浓度为8 μmol/L时,线粒体外膜仍具有完整性。
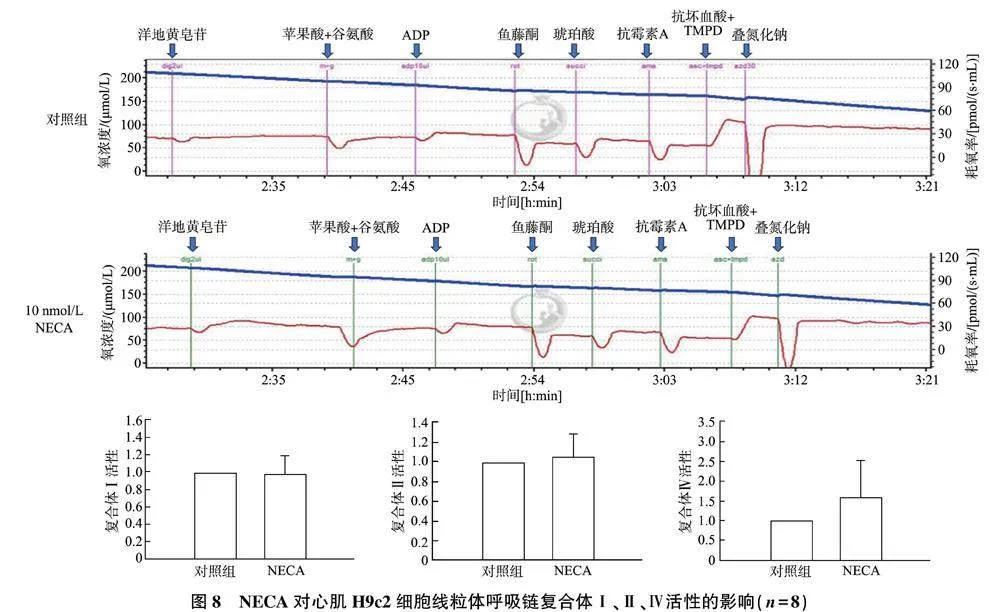
2.4.3" NECA对心肌H9c2细胞线粒体复合体活性的影响" 通过添加各复合体的底物、抑制剂和足量的ADP,以刺激或抑制相应复合体的呼吸,Oxygraph-2k高分辨率呼吸仪逐步测量复合体Ⅰ、Ⅱ、Ⅳ呼吸耗氧量,并定位功能障碍的复合体。图8所示为心肌H9c2细胞应用底物解偶联剂抑制剂滴定方案测定线粒体复合体呼吸耗氧量,与对照相比,10 nmol/L NECA处理组线粒体复合体Ⅰ、Ⅱ、Ⅳ呼吸耗氧量无显著变化,说明NECA处理对复合体活性无显著影响。
3" 讨论
线粒体是细胞的能量工厂,在生理条件下,其数量和质量的调节处于动态平衡,被称之为线粒体稳态。线粒体稳态的维持,是心肌细胞发挥正常生理功能所必需的。线粒体自噬能够清除受损的线粒体,在线粒体的质量控制和正常线粒体功能的维持中起着至关重要的作用[7],然而,过度的线粒体自噬导致腺苷三磷酸(adenosine triphosphate,ATP)产生减少和DNA突变,最终诱发细胞死亡[8]。
线粒体自噬为细胞自噬的一个重要类型,其变化趋势多与细胞自噬一致。线粒体内外膜标志蛋白是检验线粒体自噬的主要指标。大多数线粒体蛋白在细胞质基质中合成为含有N端靶向肽的前体蛋白,并通过线粒体外膜蛋白TOM和线粒体内膜蛋白TIM导入线粒体[9],COX Ⅳ是定位在线粒体内膜的蛋白,三者的表达水平能反映细胞内线粒体的数量变化。有研究报道NECA能够抑制再灌注时心肌细胞自噬[4],但其对心肌线粒体自噬的影响尚不清楚。本研究结果显示,加入NECA(10、100 nmol/L)后,线粒体自噬标志蛋白TOM20和COX Ⅳ表达水平增高,提示NECA抑制心肌细胞线粒体自噬。同时,NECA处理组的溶酶体与线粒体共定位减少,表明加入NECA后,溶酶体对线粒体的捕获清除被抑制,说明NECA抑制了线粒体的自噬。另外值得注意的是,线粒体内膜蛋白TIM23表达水平并无明显改变,这可能与抗体的特异性等因素相关。
为了探讨NECA抑制心肌线粒体自噬的可能机制,本研究检测了其对线粒体自噬相关因子的影响。PINK1/Parkin是介导线粒体自噬最经典的信号途径之一[10]。生理条件下,PINK1定位于线粒体膜间隙后被线粒体内膜早老素相关菱形样蛋白(presenilin associated rhomboid like protein,PARL)切割,释放至胞质,最终被蛋白酶体降解,维持在低水平状态[11-13]。然而当线粒体膜电位丧失时,PINKl会定位在线粒体外膜上,并募集Parkin到线粒体上,促进线粒体蛋白泛素化,诱发线粒体自噬。FUNDC1是一种新型的线粒体自噬相关蛋白,其定位于线粒体外膜,参与线粒体动力学和线粒体自噬过程,在各种人类疾病中起关键作用[8]。本研究中,NECA处理后PINK1、Parkin蛋白表达水平并未发生改变,提示其未参与NECA对心肌线粒体自噬的调控。但10 nmol/L NECA处理后FUNDC1的表达水平并未下降,这与NECA抑制心肌线粒体自噬的结果相矛盾。以上结果说明可能存在其他因素参与了NECA对心肌线粒体自噬的抑制作用。
为了探讨NECA对心肌线粒体自噬的抑制作用是否对线粒体呼吸功能造成影响,本研究检测了线粒体复合体的呼吸功能。线粒体通过氧化磷酸化为大多数细胞供应能量[14]。氧化磷酸化由嵌入线粒体内膜的5个复合体执行,即复合体Ⅰ-Ⅴ[15]。在此过程中,电子由定位于线粒体内膜的电子传递系统传递,同时在复合体Ⅰ、Ⅲ和Ⅳ水平上质子被泵至线粒体膜间隙。线粒体内外膜间形成的质子梯度被磷酸化系统用来产生ATP形式的能量[16]。在病理条件下,心脏中的超氧化物主要产生于线粒体电子传递链[17]。活性氧是有氧代谢中产生的高反应性还原氧分子[18],细胞内高浓度的活性氧会损伤蛋白质、膜脂质、DNA,并触发线粒体通透性转换孔开放[19]。本研究结果显示NECA对心肌H9c2细胞线粒体复合体Ⅰ、Ⅱ、Ⅳ活性无显著影响。
综上所述,本研究结果表明NECA抑制心肌H9c2细胞线粒体自噬,但对线粒体呼吸功能无明显影响。然而,NECA抑制心肌H9c2细胞线粒体自噬的分子机制尚不清楚,以及其对线粒体自噬的抑制是否对心肌的结构功能带来影响,仍有待于进一步研究。
[参考文献]
[1]" Wang QD, Pernow J, Sjoquist PO, et al. Pharmacological possibilities for protection against myocardial reperfusion injury[J]. Cardiovasc Res, 2002, 55(1): 25-37.
[2]" 王正刚, 柯剑娟, 王焱林, 等. 激活腺苷A2A受体对糖尿病大鼠心肌缺血再灌注损伤的影响: 与自噬的关系[J]. 中华麻醉学杂志, 2019, 39(4): 418-421.
[3]" 杜鹏辉, 周琦, 张贻凤. 腺苷A2a受体/Krüppel样因子5对缺血再灌注损伤大鼠心肌的影响[J]. 国际心血管病杂志, 2023, 50(3): 155-160.
[4]" 周慧敏, Mohamed Bassirou MY, 夏韵, 等. 激活腺苷A2B受体对大鼠心肌缺血再灌注时自噬的影响: PI3K/Akt信号通路在其中的作用[J]. 中华麻醉学杂志, 2021, 41(5): 612-615.
[5]" 孙侠, 赵倩茹, 袁伟. 心肌线粒体能量代谢在心血管疾病中的研究进展[J]. 中国心血管杂志, 2022, 27(1): 90-93.
[6]" Xu J, Bian X, Liu Y, et al. Adenosine A2 receptor activation ameliorates mitochondrial oxidative stress upon reperfusion through the posttranslational modification of NDUFV2 subunit of complex Ⅰ in the heart[J]. Free Radic Biol Med, 2017, 106(2): 208-218.
[7]" 张宁, 刘璐瑶, 张艺凡, 等. 自噬在钙化性主动脉瓣膜病中的研究进展[J]. 心肺血管病杂志, 2023, 42(5): 514-517.
[8]" Liu H, Zang C, Yuan F, et al. The role of FUNDC1 in mitophagy, mitochondrial dynamics and human diseases[J]. Biochem Pharmacol, 2022, 197(3): 114891.
[9]" 张书虎, 李甜甜. 自噬在心血管健康和疾病中的研究进展[J]. 实用老年医学, 2024, 38(1): 77-80.
[10]" Mao Z, Tian L, Liu J, et al. Ligustilide ameliorates hippocampal neuronal injury after cerebral ischemia reperfusion through activating PINK1/Parkin-dependent mitophagy[J]. Phytomedicine, 2022, 101: 154111.
[11]" Gong Y, Lin J, Ma Z, et al. Mitochondria-associated membrane-modulated Ca2+ transfer: A potential treatment target in cardiac ischemia reperfusion injury and heart failure[J]. Life Sci, 2021, 278: 119511.
[12]" Jin SM, Lazarou M, Wang C, et al. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL[J]. J Cell Biol, 2010, 191(5): 933-942.
[13]" Yamano K, Youle RJ. PINK1 is degraded through the N-end rule pathway[J]. Autophagy, 2013, 9(11): 1758-1769.
[14]" Kobayashi A, Azuma K, Ikeda K, et al. Mechanisms underlying the regulation of mitochondrial respiratory chain complexes by nuclear steroid receptors[J]. Int J Mol Sci, 2020, 21(18): 6683.
[15]" Signes A, Fernandez-Vizarra E. Assembly of mamma-lian oxidative phosphorylation complexes Ⅰ-Ⅴ and supercomplexes[J]. Essays Biochem, 2018, 62(3): 255-270.
[16]" Lemieux H, Warren BE. An animal model to study human muscular diseases involving mitochondrial oxidative phosphorylation[J]. J Bioenerg Biomembr, 2012, 44(4): 503-512.
[17]" Chen YR, Zweier JL. Cardiac mitochondria and reactive oxygen species generation[J]. Circ Res, 2014, 114(3): 524-537.
[18]" Larosa V, Remacle C. Insights into the respiratory chain and oxidative stress[J]. Biosci Rep, 2018, 38(5): BSR20171492.
[19]" Mazat JP, Devin A, Ransac S. Modelling mitochondrial ROS production by the respiratory chain[J]. Cell Mol Life Sci, 2020, 77(3): 455-465.
[收稿日期]" 2023-12-18" [编辑]" 何承志