基于机器学习构建类风湿关节炎合并骨质疏松患者临床预测模型

[摘要]" 目的: 开发一种有效且简单的工具,用于评估类风湿关节炎(rheumatoid arthritis,RA)患者发生骨质疏松症(osteoporosis,OP)的风险,以便提早进行干预,改善患者的预后和生活质量。方法: 通过回顾性研究,选取2018年1月至2023年6月期间我院RA患者53例及RA合并OP患者44例。收集24个预测因子,采用Lasso、Boruta和SVM-REF算法筛选关键预测因子,并使用多变量Logistic回归建立预测模型。进一步通过KNN及Lightgbm算法对模型进行验证。结果: 筛选出4个关键预测因子:白介素4(IL-4)、总甲状腺素(TT4)、抗环瓜氨酸肽抗体(Anti-CCP)和年龄。建立的临床预测模型C指数为0.82;ROC曲线下面积为0.821;临床决策曲线结果显示,在不损害其他患者利益的情况下,当阈值概率为0.02~0.90时临床净获益水平最高,显示模型具有良好的预测能力。KNN及Lightgbm结果显示,ROC曲线下面积均为0.973,PR曲线下面积分别为0.974和0.969。混淆矩阵结果显示,KNN预测模型敏感度为0.886,特异度为0.962,准确率为0.928,F1值为0.918;Lightgbm预测模型敏感度为0.955,特异度为0.925,准确率为0.938,F1值为0.933。结论: 本研究成功构建了一种针对RA合并OP的临床预测模型,发现年龄、Anti-CCP、TT4是高危因素,而IL-4是保护因素。
[关键词]" 类风湿关节炎;骨质疏松症;机器学习;Boruta;SVM-REF;临床预测模型
[中图分类号]" R593.22" [文献标志码]" A" [文章编号]" 1671-7783(2024)05-0377-06
DOI: 10.13312/j.issn.1671-7783.y230324
[引用格式]卢小平,蔡旭,陈新鹏,等. 基于机器学习构建类风湿关节炎合并骨质疏松患者临床预测模型[J]. 江苏大学学报(医学版), 2024, 34(5): 377-382.
[基金项目]广东省中医药管理局中医药科研项目(20221342)
[作者简介]卢小平(1984—),女,主治医师;肖剑伟(通讯作者),副主任医师,E-mail: 108812365@qq.com
Construction of a clinical prediction model for patients with rheumatoid arthritis and osteoporosis using machine learning
LU Xiaoping, CAI Xu, CHEN Xinpeng, HONG Yiwei, XIAO Jianwei
(Rheumatology, Shenzhen Futian Hospital for Rheumatic Diseases, Shenzhen Guangdong 518000, China)
[Abstract]" Objective: To develop an effective and straightforward tool for assessing the risk of osteoporosis (OP) development in patients with rheumatoid arthritis (RA), thus early intervention can be facilitated to enhance patient prognosis and quality of life. Methods: A retrospective study was conducted, selecting 53 RA patients and 44 RA patients with concurrent OP treated at our institution from January 2018 to June 2023. Twenty-four predictive factors were collected. Key predictors were identified using the Lasso,Boruta and SVM-REF algorithms, and a predictive model was established using multivariate Logistic regression. Further validation of the model was performed using KNN and Lightgbm algorithms. Results: Four critical predictive factors were identified: IL-4, TT4, Anti-CCP, and age. The developed clinical prediction model exhibited a C-index of 0.82 and an area under the ROC curve (AUC) of 0.821. Clinical decision curve analysis indicated the highest net clinical benefit when the threshold probability ranged from 0.02 to 0.90, demonstrating the model′s robust predictive capability. Machine learning validation revealed that the KNN and Lightgbm models had AUCs of 0.973 and 0.973, respectively, and areas under the PR curve of 0.974 and 0.969, respectively. Confusion matrix results showed the KNN prediction model had a sensitivity of 0.866, specificity of 0.962, accuracy of 0.928, and F1 score of 0.918; the Lightgbm prediction model had a sensitivity of 0.955, specificity of 0.925, accuracy of 0.938, and F1 score of 0.933. Conclusion: This study successfully constructed a clinical prediction model for RA patients at risk of developing OP, and age, Anti-CCP, and TT4 was identified as high-risk factors, while IL-4 as a protective factor.
[Key words]" rheumatoid arthritis; osteoporosis; machine learning; Boruta; SVM-REF; clinical prediction model
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎、滑膜细胞增殖、血管翳形成、骨与软骨破坏为特征的自身免疫性疾病,发病机制复杂,多种细胞、细胞因子及信号通路都参与了RA发病。骨质疏松症(osteoporosis,OP)是一种以骨量降低和骨组织微结构破坏为特征的代谢性骨病。研究发现[1-3],RA患者骨质疏松和骨密度下降发生率较健康人群高,其中我国RA患者中约42%合并骨质疏松,而健康人群这一比例为36%。RA患者继发OP后不仅增加了治疗难度,明显降低患者生活质量,而且显著增加骨折后致残率和死亡率。因而早期识别RA合并OP的高危患者,有助于及早干预,改善预后。
本研究的目的是开发一种有效且简单的预测工具来评估RA患者出现骨质疏松的风险,从而能够尽早干预,改善患者预后及生活质量。
1" 资料与方法
1.1nbsp; 一般资料
本研究采用回顾性研究,已通过医院伦理委员会审查批准。选取我院2018年1月至2023年6月住院部RA患者53例及RA合并OP患者44例。纳入标准:RA患者符合1987年美国风湿病学会(ARA)中的疾病诊断标准;OP患者符合《中国老年骨质疏松症诊疗指南(2018)》OP诊断标准。排除标准:近6个月内服用过激素类药物;合并有恶性肿瘤的患者。
基于既往骨质疏松患者常见的相关危险因素的研究[4-6],收集患者性别(Gender)、年龄(Age)、体重(Weight)及血沉(ESR)、三酰甘油(TG)、胆固醇(CHOL)、低密度脂蛋白胆固醇(LDL-C)、促甲状腺激素(TSH)、游离甲状腺素(FT4)、总甲状腺素(TT4)、游离三碘甲状腺原氨酸(FT3)、总三碘甲状腺原氨酸(TT3)、25羟维生素D(25-OH-D)、维生素D2(D2)、血清钙(Ca2+)、血清磷(P)、抗环瓜氨酸肽抗体(Anti-CCP)、类风湿因子(RF)、C反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)、白介素10(IL-10)、白介素6(IL-6)、白介素4(IL-4)、白介素2(IL-2)的检查结果,共收集24项数据作为预测因子。
1.2" 特征因子筛选
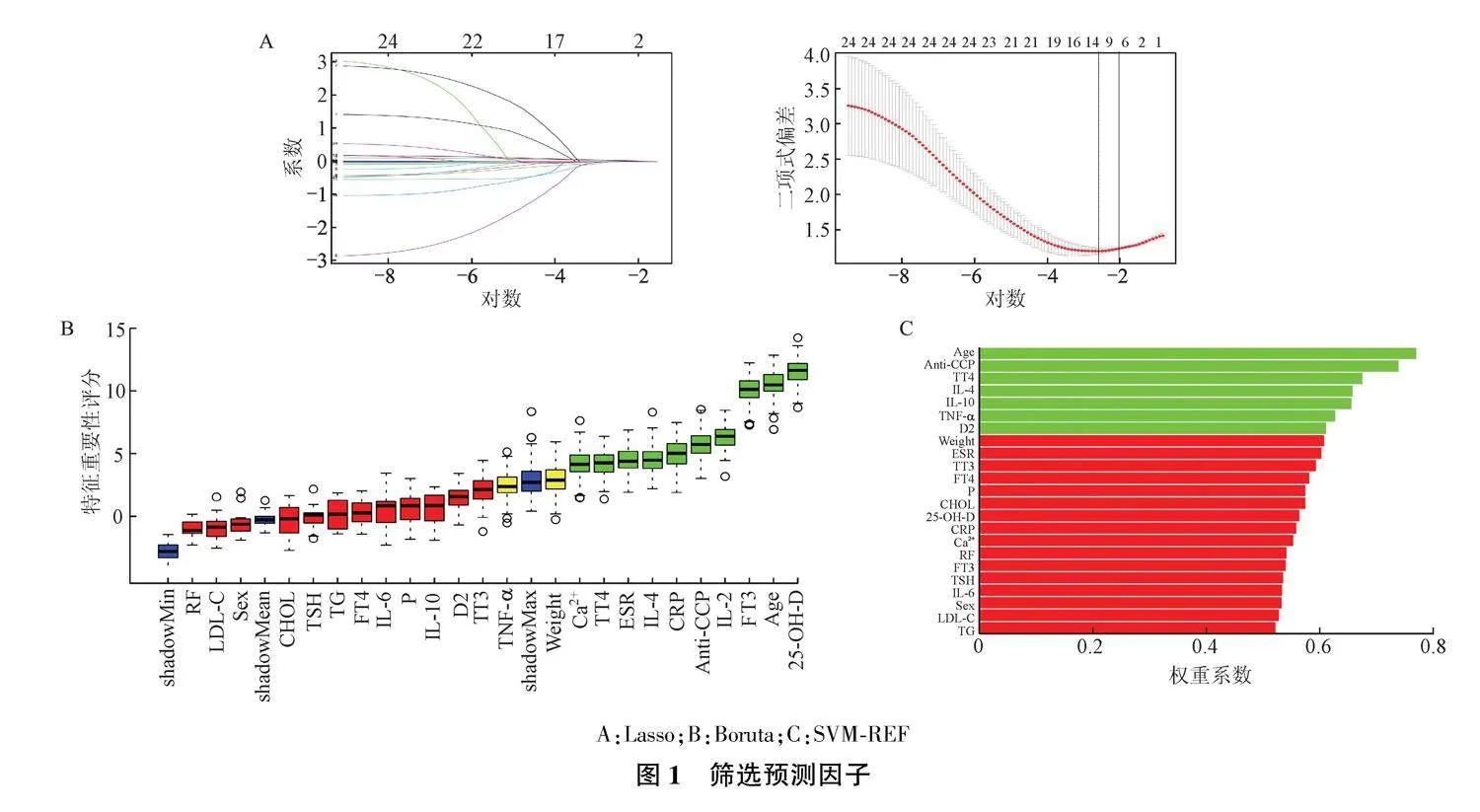
采用Lasso、Boruta及SVM-REF算法筛选预测因子。首先使用Lasso算法,nfolds设置为10,alpha设置为0.5;SVM-REF算法径向基核函数设置为“CV”,交叉验证次数为5。Boruta算法doTrace参数设置为2,最大迭代次数为60。将3种方法计算得到的结果取交集得到最佳预测因子。
1.3" 构建预测模型
对筛选获得的预测因子,使用多变量Logistic回归建立预测模型,同时绘制诺模图。通过测量C指数来辨别诺模图的预测能力,并进行内部验证(1 000个Bootstrap重新采样)以计算相对校正的C指数;绘制受试者工作特征(ROC)曲线及校准曲线评估预测模型的性能;绘制临床决策分析曲线来评估不同阈值概率下的净收益以确定预测模型的临床实用性。
1.4" 机器学习验证模型
使用KNN及Lightgbm对构建的模型进行验证。超参数寻优随机网格设置为20。通过ROC曲线、精确率召回率曲线(precision-recall curves,PR曲线)、混淆矩阵、F值验证模型预测能力。夏普利值可解释性模型(SHapley Additive exPlanation,SHAP)通过计算模型中各个特征因子的边际贡献来衡量其影响大小,进而对黑盒模型进行解释,本研究利用SHAP方法评估预测模型中各特征因子的相对重要性。
2" 结果
2.1" 预测因子获取
Lasso筛选得到预测因子6个(Age、Weight、TT4、Anti-CCP、IL-4、TNF-α),Boruta筛选得预测因子10个(Age、ESR、TT4、FT3、25-OH-D、Ca2+、Anti-CCP、CRP、IL-4、IL-2),SVM-REF筛选得到预测因子7个(D2、TNF-α、IL-10、IL-4、TT4、Anti-CCP、Age),见图1;将3个结果取交集共得到4个预测因子(IL-4、TT4、Anti-CCP、Age)。
2.2" 临床预测模型
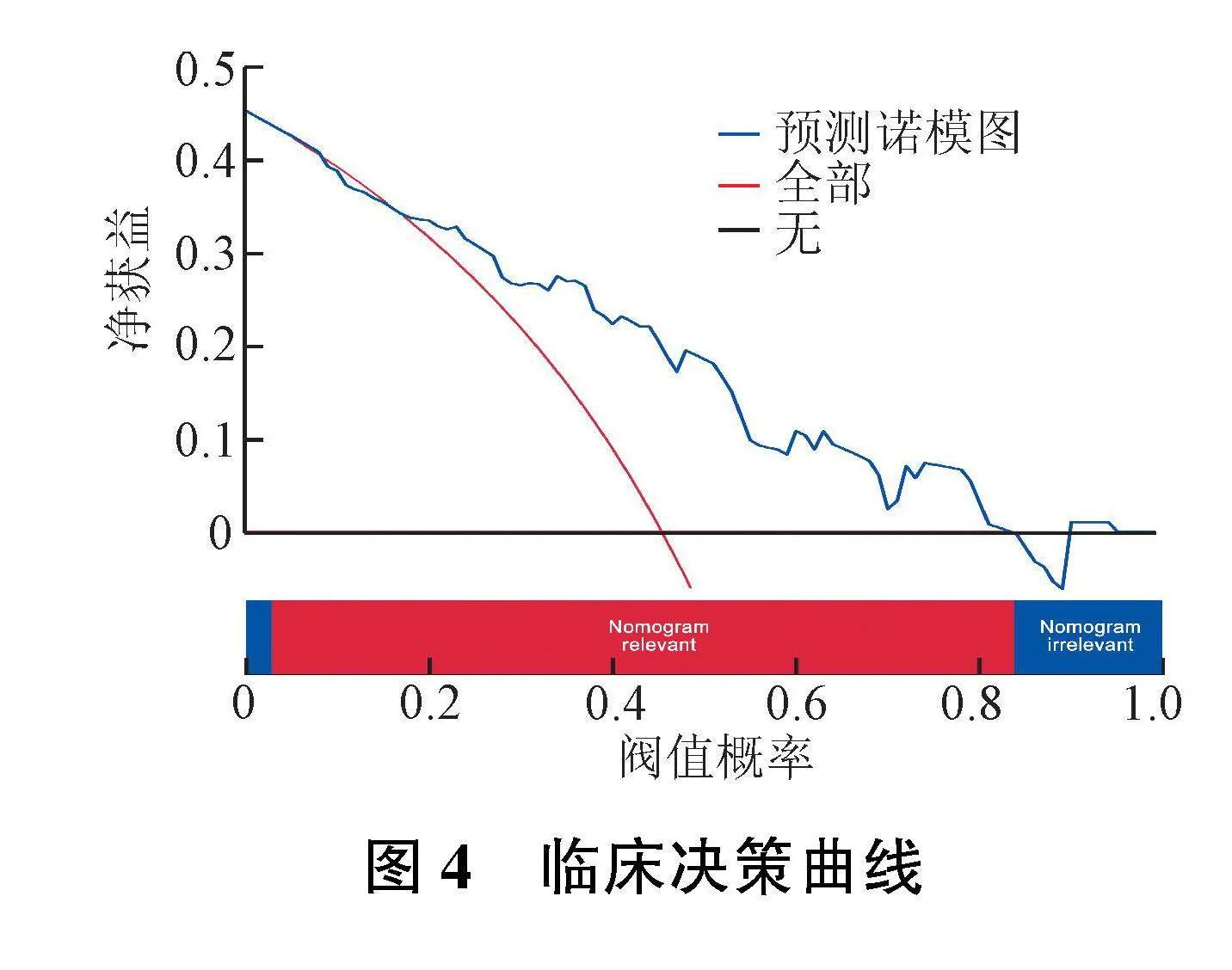
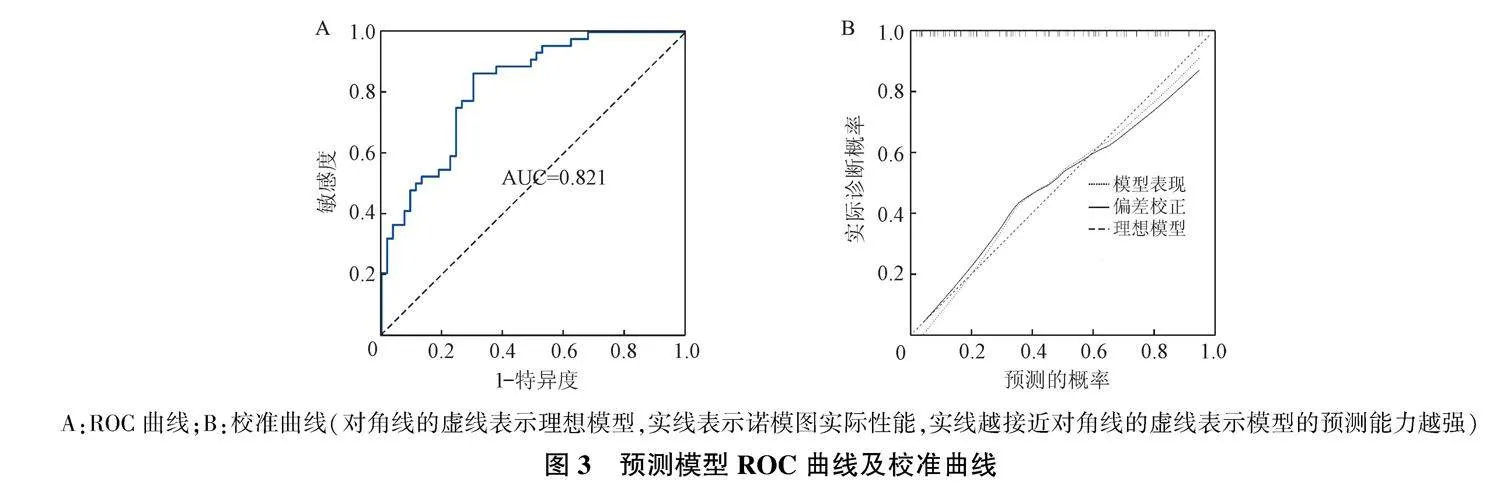
通过多变量Logistic回归将纳入的4个预测因子构建临床预测模型,通过诺模图可视化(图2)。模型C指数结果为0.82,经1 000次Bootstrap内部抽样验证证实C指数为0.86。ROC曲线显示AUC为0.821(图3A);校准曲线结果显示出良好的一致性(图3B)。临床决策曲线结果显示,在不损害其他患者利益的情况下,当阈值概率为0.02~0.90时临床净获益水平最高(图4)。
以红色标记为例,Anti-CCP分值为65分,TT4分值为56分,IL-4分值为60分,年龄分值为100分,总分为281,对应的骨质疏松概率为94.6%
2.3" 机器学习验证模型
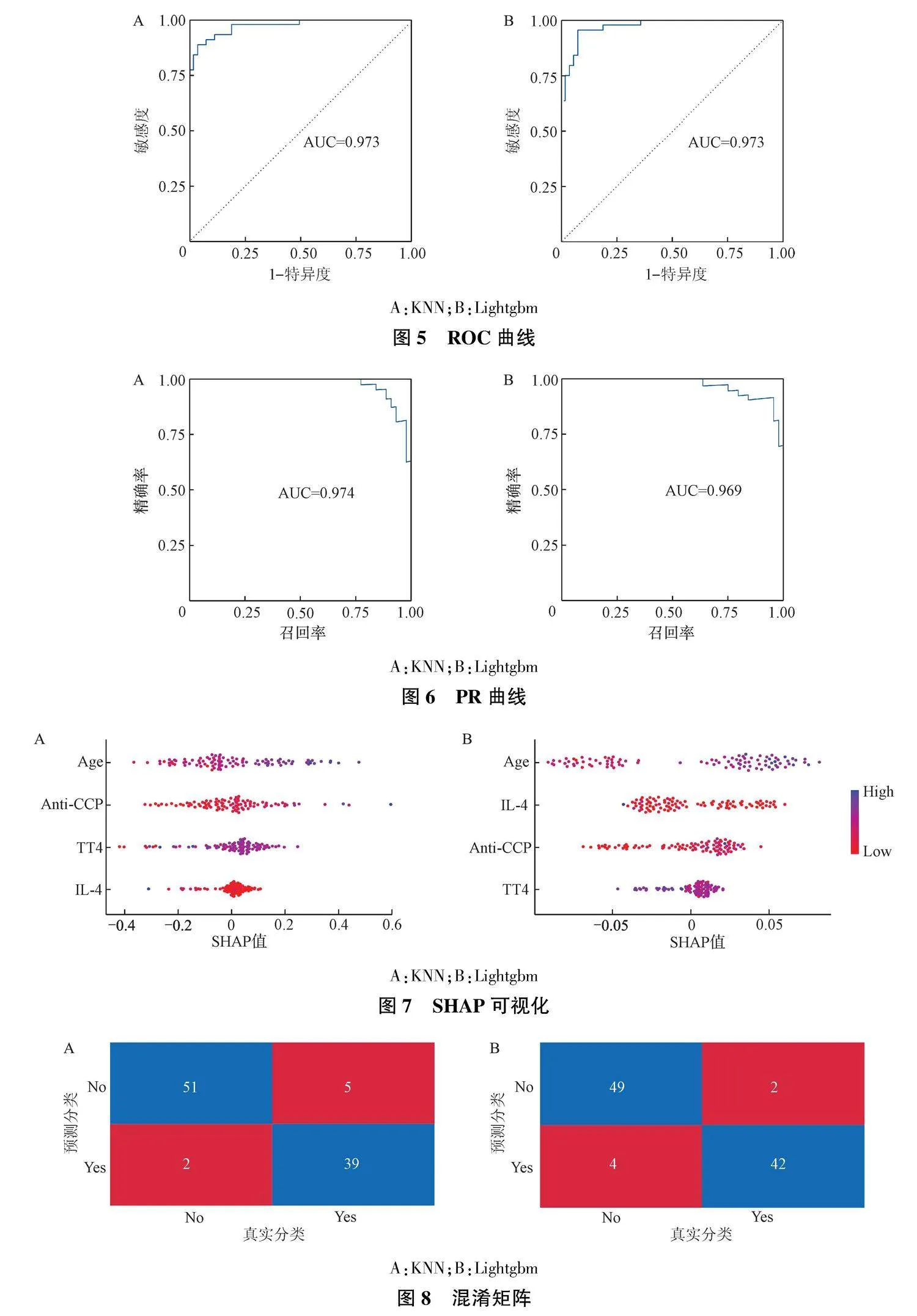
KNN及Lightgbm结果显示,ROC曲线的AUC均为0.973(图5),PR曲线的AUC分别为0.974和0.969(图6)。SHAP可视化结果显示,KNN算法变量重要性依次是年龄、Anti-CCP、TT4、IL-4,Lightgbm算法变量重要性依次是年龄、IL-4、Anti-CCP、TT4,见图7。与临床预测模型结果一致。混淆矩阵结果显示,KNN预测模型敏感度为0.886,特异度为0.962,准确率为0.928,F1值为0.918;Lightgbm预测模型敏感度为0.955,特异度为0.925,准确率为0.938,F1值为0.933(图8)。
3" 讨论
RA是一种以慢性、侵蚀性、对称性多关节炎为主要临床表现的自身免疫性疾病。RA可发生于任何年龄段,随着年龄的增加其发病率呈增长趋势,好发40~50岁人群,女性发病率为男性的3~5倍,全球发病率为0.5%~1.0%[7]。RA的病理学改变是慢性滑膜炎形成的血管翳侵蚀软骨与骨,这是RA导致关节破坏的病理基础。OP是一种以骨量降低和骨组织微结构破坏为特征的代谢性骨病,为RA常见的并发症之一。骨质疏松性骨折是RA患者的一个严重健康问题。英国一项研究显示,RA患者髋部骨折的相对危险度(RR)为2.0(95%CI:1.8~2.3),椎体骨折的RR为2.4(95%CI:2.0~2.8)[8]。这些脆性骨折会损害生活质量,并增加医疗成本和死亡率。韩国国家健康声明数据报告称,RA患者3年内骨质疏松性骨折的发生率高于普通人群(17.4% vs. 11.6%)[9]。然而,在临床实践中,OP的及时筛查和适当管理仍然不足。美国的一项回顾性研究报告称,在4.4年内,只有30%的RA患者接受了抗骨质疏松治疗[10]。RA合并OP不仅增加了治疗难度,明显降低患者生活质量,而且显著增加骨折后致残率和死亡率,加重了家庭和社会的负担。因而,在RA患者中识别高危OP是临床实践中的一个重要问题。
RA合并OP的发病机制复杂,目前研究发现多个信号通路、细胞因子、相关药物治疗等多因素参与了RA合并OP的发病。炎症因子的过度表达可增加RA患者发生OP的风险,如IL-6通过糖蛋白130相关的JAK,激活JAK/STAT通路上调核因子-κB受体活化因子配体(RANKL),导致破骨细胞分化,骨吸收增强[11]。TNF-α、IL-1为代表的促炎细胞因子能够诱导RANKL的表达刺激破骨细胞分化,增强骨吸收,打破骨形成和骨吸收间的平衡。
本研究的主要目的是开发并验证一个针对RA合并OP的临床预测模型,以便早期识别高危患者并改善其预后。通过综合分析,我们构建了一个包含IL-4、TT4、Anti-CCP和年龄四个关键预测因子的模型,诺模图的可视化结果显示,通过年龄、Anti-CCP、TT4及IL-4四个指标进行计算,能够预测RA患者合并OP的概率。ROC曲线及校准曲线结果显示该模型具有较高的分类效能。对于机器学习结果,本研究使用了ROC曲线和PR曲线从不同的角度来衡量模型的表现能力,均显示模型具有较高的分类性能。KNN及Lightgbm通过SHAP可视化显示在4个变量对模型的贡献值与诺模图展现的结果相一致,其中年龄、Anti-CCP、TT4是骨质疏松的风险因素,IL-4是保护因素。两种机器学习混淆矩阵结果显示,敏感度及特异度均大于0.850,提示模型能够较灵敏地预测RA患者出现OP的概率。而兼顾了阳性预测值和敏感度的F1值也均大于0.900,提示模型在预测值和敏感度之间有着良好的平衡。该模型在多个维度上展现了较高的预测性能。Anti-CCP为免疫球蛋白G类抗体,在早期RA患者体内可呈阳性,已被证实与RA的发生及发展密切相关[12]。多个研究显示,Anti-CCP可能与RA患者外周血抗原特异性T细胞的激活有关,可促使机体内产生大量的促炎因子,加剧炎症反应程度,诱发骨侵蚀[13-14]。甲状腺激素(特别是TT4)在骨骼发育和维持中起重要作用,其水平变化可直接影响成骨细胞和破骨细胞的活性[15-16]。IL-4则通过不同的信号通路,如NF-κB、MAPK信号通路,对成骨细胞和破骨细胞产生复杂的调控作用,既可直接抑制破骨细胞的生成,又可通过影响T细胞、B细胞和巨噬细胞间接调控骨改建过程[17-21]。
综上,本研究构建了RA合并OP诊断的临床预测模型,年龄、Anti-CCP、TT4是RA合并OP的高危因素,IL-4是保护因素。本研究模型在简便性和准确性方面具有优势,易于临床应用,能够为医生提供快速的风险评估,从而尽早识别RA合并OP的高危患者,有助于及早干预,改善预后,提高患者生存质量。对于模型预测为高危的患者,医生可以提前采取预防性治疗,如调整药物方案或增加监测频率。但本研究仍存在不足,主要是纳入患者数量较少,同时未能收集更多数据进行外部验证,需要在接下来的研究中进一步收集数据进行验证。
[参考文献]
[1]" Adami G, Saag KG. Osteoporosis pathophysiology, epidemiology, and screening in rheumatoid arthritis[J]. Curr Rheumatol Rep, 2019, 21 (7): 34.
[2]" Raterman HG, Bultink IE, Lems WF. Osteoporosis """"in patients with rheumatoid arthritis: an update in epidemiology, pathogenesis, and fracture prevention[J]. Expert Opin Pharmacother, 2020, 21(14): 1725-1737.
[3]" Wysham KD, Baker JF, Shoback DM. Osteoporosis and fractures in rheumatoid arthritis[J]. Curr Opin Rheumatol, 2021, 33(3): 270-276.
[4]" Buttgereit F, Palmowski A, Bond M, et al. Osteoporosis and fracture risk are multifactorial in patients with inflammatory rheumatic diseases[J]. Nat Rev Rheumatol, 2024, 20(7): 417-431.
[5]" Van Staa TP, Geusens P, Bijlsma JW, et al. Clinical assessment of the long-term risk of fracture in patients with rheumatoid arthritis[J]. Arthritis Rheum, 2006, 54(10): 3104-3112.
[6]" Kwon HY, Kim HH, Sung YK, et al. Incidence and mortality of osteoporotic fracture in rheumatoid arthritis in South Korea using nationwide claims data[J]. J Bone Metab, 2019, 26(2): 97-104.
[7]" Tanaka Y. Managing osteoporosis and joint damage in patients with rheumatoid arthritis: An overview[J]. J Clin Med, 2021, 10(6): 1241.
[8]" Amarnath AL, Franks P, Robbins JA, et al. Underuse and overuse of osteoporosis screening in a regional health system: a retrospective cohort study[J]. J Gen Intern Med, 2015, 30(12): 1733-1740.
[9]" Baker R, Narla R, Baker JF, et al. Risk factors for osteoporosis and fractures in rheumatoid arthritis[J]. Best Pract Res Clin Rheumatol, 2022, 36(3): 101773.
[10]" Kareem R, Botleroo RA, Bhandari R, et al. The impact of rheumatoid arthritis on bone loss: Links to osteoporosis and osteopenia[J]. Cureus, 2021, 13(8): e17519.
[11]" Sims NA. The JAK1/STAT3/SOCS3 axis in bone development, physiology, and pathology[J]. Exp Mol Med, 2020, 52(8): 1185-1197.
[12]" Li C, Zhang Y, Song H, et al. Anti-cyclic citrullinated peptide antibody predicts the development of rheumatoid arthritis in patients with undifferentiated arthritis[J]. Chin Med J (Engl), 2019, 132(24): 2899-2904.
[13]" Sulaiman FN, Wong KK, Ahmad WAW, et al. Anti-cyclic citrullinated peptide antibody is highly associated with rheumatoid factor and radiological defects in rheumatoid arthritis patients[J]. Medicine (Baltimore), 2019, 98(12): e14945.
[14]" Stropuviene· S, Baranauskaite· A, Bukauskiene· L, et al. The impact of anti-cyclic citrullinated peptide antibody status on the management of patients with early rheumatoid arthritis: observational study results from Lithuania[J]. Acta Med Litu, 2018, 25(2): 112-123.
[15]" Tsevis K, Trakakis E, Pergialiotis V, et al. The influence of thyroid disorders on bone density and biochemical markers of bone metabolism[J]. Horm Mol Biol Clin Investig, 2018, 35(1): /j/hmbci.2018.35.issue-1/hmbci-2018-0039/hmbci-2018-0039.xml.
[16]" Williams GR, Bassett JHD. Thyroid diseases and bone health[J]. J Endocrinol Invest, 2018, 41(1): 99-109.
[17]" Amarasekara DS, Kim S, Rho J. Regulation of osteoblast differentiation by cytokine networks[J]. Int J Mol Sci, 2021, 22(6): 2851.
[18]" Wu M, Liu J. Inhibitory effect of exogenous IL-4 on orthodontic relapse in rats[J]. Oral Dis, 2022, 28(2): 469-479.
[19]" Takaki H, Ichiyama K, Koga K, et al. STAT6 inhibits TGF-β-mediated Foxp3 induction through direct binding to the Foxp3 promoter, which is reverted by retinoic acid receptor[J]. J Biol Chem, 2008, 283(22): 14955-14962.
[20]" Komatsu N, Win S, Yan M, et al. Plasma cells promote osteoclastogenesis and periarticular bone loss in autoimmune arthritis[J]. J Clin Invest, 2021, 131(6): e143060.
[21]" Sun W, Meednu N, Rosenberg A, et al. B cells inhibit bone formation in rheumatoid arthritis by suppressing osteoblast differentiation[J]. Nat Commun, 2018, 9(1): 5127.
[收稿日期]" 2023-12-21" [编辑]" 何承志