HPLC法同时测定不同基原甘草中8种黄酮类成分的含量



[摘要] 目的: 建立一种同时测定甘草中芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草查尔酮B、甘草素、异甘草素、甘草查尔酮A含量的方法,并对乌拉尔甘草、光果甘草与胀果甘草药材中上述成分含量进行测定。方法: 采用InertSustainTM ODS-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈0.1%乙酸水溶液,梯度洗脱,流速为1.0 mL/min,检测波长为276 nm和360 nm,柱温为30 ℃。结果: 芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷在10~500 μg/mL范围内具有良好的线性关系(r≥0.999 7),甘草查尔酮B、甘草素、异甘草素、甘草查尔酮A在1~50 μg/mL范围内线性关系良好(r≥0.999 8),平均加样回收率为98.73%~100.54%,精密度、稳定性、重复性试验的相对标准偏差(RSD)均小于3%。芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草素、异甘草素在乌拉尔甘草中的含量最高,甘草查尔酮A和甘草查尔酮B在胀果甘草中的含量最高。结论: 本研究建立了同时测定甘草药材中8种黄酮类成分的HPLC方法,该方法简便、高效、准确,可为甘草药材的质量控制提供有益参考。
[关键词] 乌拉尔甘草;光果甘草;胀果甘草;高效液相色谱法;含量测定;质量控制;黄酮类成分
[中图分类号] R917" [文献标志码] A" [文章编号] 1671-7783(2024)04-0349-05
DOI: 10.13312/j.issn.1671-7783.y230174
[引用格式]魏旭,周丽红,姬孝轩,等. HPLC法同时测定不同基原甘草中8种黄酮类成分的含量[J]. 江苏大学学报(医学版), 2024, 34(4): 349-353,363.
[基金项目]国家自然科学基金资助项目(82074286);江苏省“六大人才高峰”高层次人才(SWYY-013);江苏省自然科学基金资助项目(BK20191428);江苏省中医药管理局中医药科技发展专项(2020ZX21);镇江市国际科技合作项目(GJ2021012)
[作者简介]魏旭(1998—),男,硕士研究生;冯春来(通讯作者),教授,博士生导师,E-mail: feng@ujs.edu.cn
甘草为我国中医处方中使用最为广泛的一味药材,素有“国老”之称,具有补脾益气、清热解毒、祛咳止痰等功效[1]。研究表明[2-3],甘草中的主要活性成分为黄酮类和三萜皂苷类,其中黄酮类成分最多,共发现300余种,这些黄酮类成分主要包括黄酮、黄酮醇、二氢黄酮、查尔酮、异黄酮等。黄酮类化合物对于评价甘草的质量具有极其重要的作用,在2005版中国药典中还将甘草中二氢黄酮类成分甘草苷新增为甘草中成分含量控制的指标之一。在甘草众多黄酮类化合物中,二氢黄酮类和查尔酮类含量较高,研究也最为广泛,其中二氢黄酮类成分具有抗抑郁、抗炎等药理作用[4-5],代表成分有芹糖甘草苷、甘草素、甘草苷;查尔酮类成分具有抗癌、抗炎等药理作用[6-7],代表成分有芹糖异甘草苷、异甘草苷、甘草查尔酮B、异甘草素、甘草查尔酮A。研究甘草的药效以及质量控制,准确测定以上8种黄酮类成分的方法具有重要意义。本研究拟在中国药典规定的3种基原的甘草(乌拉尔甘草、胀果甘草或光果甘草)[8]中建立以上8种黄酮类成分的高效液相色谱(HPLC)检测方法。
1 材料与方法
1.1 主要仪器与试剂
Agilent 1260高效液相色谱仪(美国Agilent公司),BSA 124S型电子天平(赛多利斯仪器有限公司),KQ-250DB型超声波清洗仪(昆山超声仪器有限公司),高速多功能粉碎机(武义海纳电器有限公司)。对照品芹糖甘草苷(批号:CYR-G0042)、甘草苷(批号:CYR-G0058)、芹糖异甘草苷(批号:CYR-Q0080)、异甘草苷(批号:CYR-Y0074)、甘草素(批号:CYR-G0020)、甘草查尔酮B(批号:CYR-G0018)、异甘草素(批号:CYR-Y0199)、甘草查尔酮A(批号:CYR-G0017)均购自四川翠益润生物科技有限公司,质量分数≥98%;乙腈、甲醇为色谱纯,购自国药集团;超纯水为实验室自制;其余试剂均为分析纯。实验所用甘草样品为市售的乌拉尔甘草(批号:20211101)、光果甘草(20211104)和胀果甘草(20211109),经江苏大学药学院欧阳臻教授鉴定为豆科植物乌拉尔甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza inflata Bat.和光果甘草Glycyrrhiza glabra L.的干燥根及根茎。
1.2 实验方法
1.2.1 混合对照品溶液的制备 精密称取50 mg芹糖甘草苷对照品、50 mg甘草苷对照品、50 mg芹糖异甘草苷对照品、50 mg异甘草苷对照品、5 mg甘草查尔酮B对照品、5 mg甘草素对照品、5 mg异甘草素对照品、5 mg甘草查尔酮A对照品于10 mL容量瓶中,加色谱级甲醇溶解,定容,摇匀,得到8个成分质量浓度依次为5.0、5.0、5.0、5.0、0.5、0.5、0.5、0.5 mg/mL的混合对照品溶液。
1.2.2 供试品溶液的制备 首先将甘草药材用粉碎机进行粉碎,过60目筛,精密称取1 g甘草药材粉末,放置于具塞锥形瓶中,按照料液比1∶20加入20 mL 的95%乙醇,在室温下采用水浴式超声提取45 min(25 ℃,250 W,40 kHz),待冷却至室温后用95%乙醇补足失重,然后抽滤,将滤液在3 700 r/min离心10 min后取上清液,用0.22 μm微孔滤膜过滤,取滤液作为供试品溶液。
1.2.3 色谱条件 采用InertSustainTM C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)0.1%乙酸水溶液(B),梯度洗脱(0~10 min,20%~30% A;10~30 min,30%~60% A;30~40 min,60%~70% A);进样量为20 μL;流速为1.0 mL/min;柱温为30 ℃;检测波长为276 nm(芹糖甘草苷、甘草苷、甘草素),360 nm(芹糖异甘草苷、异甘草苷、甘草查尔酮B、异甘草素、甘草查尔酮A)。
1.2.4 线性关系考察 精密吸取“1.2.1”项下混合对照品溶液适量,用色谱级甲醇分别稀释10、20、50、100、500倍,按“1.2.3”项下色谱条件依次进样测定,记录待测成分的峰面积。
1.2.5 精密度试验 精密吸取“1.2.1”项下制备的混合对照品溶液适量,稀释一定倍数后,按照“1.2.3”项下色谱条件连续进样6次,记录待测成分的峰面积,计算相对标准偏差(RSD)。
1.2.6 稳定性试验 取光果甘草药材(批号:20211104),按照“1.2.2”项下方法制备供试品溶液,分别在室温下放置0、2、4、6、8、12 h后,按照“1.2.3”项下色谱条件进行测定,记录待测成分的峰面积,计算RSD值。
1.2.7 重复性试验 取光果甘草药材粉末(批号:20211104)6份,按照“1.2.2”项下方法制备供试品溶液,在“1.2.3”项下色谱条件进行测定,记录待测成分的峰面积,计算RSD值。
1.2.8 加样回收率试验 取待测成分含量已知的光果甘草药材粉末(批号:20211104)6份,每份1 g,按“1.2.2”项下方法制备供试品溶液,并分别加入对照品溶液适量。然后按“1.2.3”项下色谱条件进样测定,记录待测成分的峰面积,计算平均加样回收率及其RSD值。
1.2.9 样品含量测定 取3种不同基原的甘草药材(乌拉尔甘草批号:20211101、光果甘草批号:20211104、胀果甘草批号:20211109),按照“1.2.2”项下方法制备供试品溶液。精密吸取各供试品溶液20 μL,按“1.2.3”项下的色谱条件进行测定,记录待测成分的峰面积。
2 结果
2.1 色谱条件考察
按照“1.2.3”项下的色谱条件进样,混合对照品溶液及不同基原甘草供试品溶液的色谱图见图1。8种待测成分与其相邻色谱峰分离度均大于1.5,理论塔板数以各色谱峰计算均不低于5 000。
2.2 线性关系考察
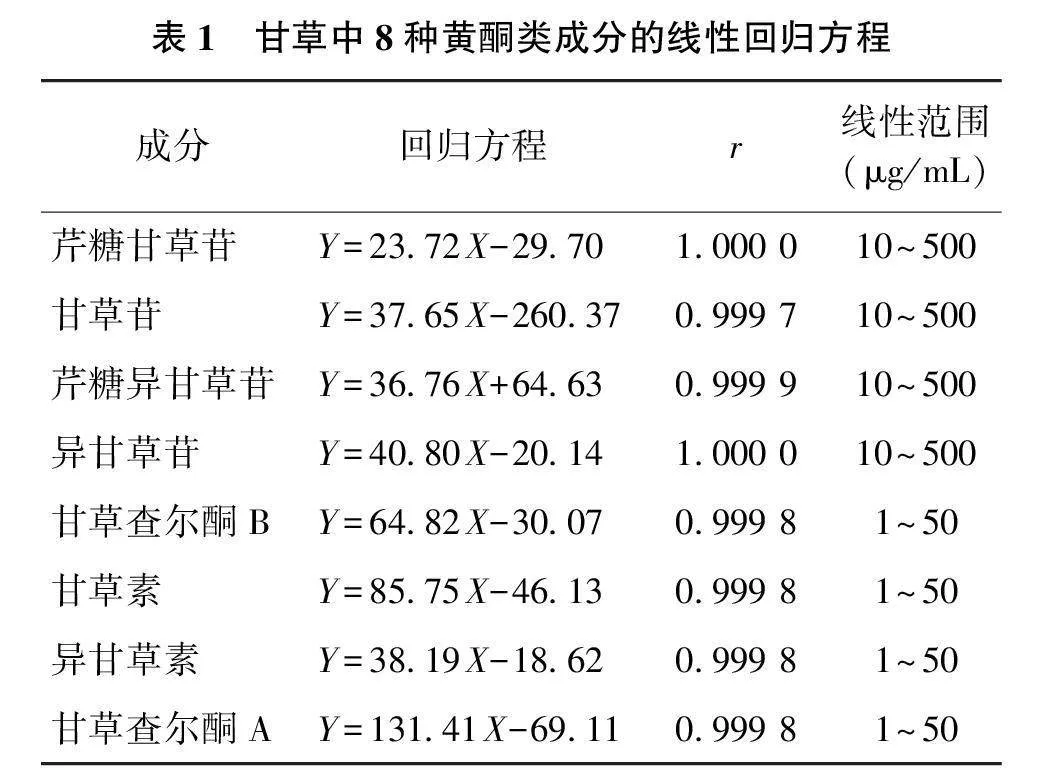
以对照品的质量浓度(μg/mL)为横坐标(X),以峰面积为纵坐标(Y),绘制标准曲线,计算得到回归方程及相关系数(表1)。结果显示,8种待测成分在设置的浓度范围内均具有良好的线性关系。
2.3 精密度考察
计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草查尔酮B、甘草素、异甘草素、甘草查尔酮A峰面积的RSD依次为0.70%、0.66%、0.95%、0.64%、0.80%、0.51%、0.52%和0.59%,8种成分的RSD均小于2%,表明仪器的精密度良好。
2.4 稳定性考察
计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草查尔酮B、甘草素、异甘草素、甘草查尔酮A峰面积的RSD依次为1.69%、0.95%、1.49%、1.06%、1.15%、0.61%、1.47%和1.00%,8种成分的RSD均小于2%,表明供试品溶液在室温下放置12 h内稳定性良好。
2.5 重复性考察
计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草查尔酮B、甘草素、异甘草素、甘草查尔酮A峰面积的RSD依次为1.42%、1.89%、1.47%、2.63%、0.87%、0.86%、0.56%和0.87%,8种成分的RSD均小于3%,表明本方法重复性良好。
2.6 加样回收率考察
计算得到芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草查尔酮B、甘草素、异甘草素、甘草查尔酮A的平均加样回收率依次为99.56%、98.73%、99.08%、100.09%、99.64%、99.21%、99.80%和100.54%(表2),RSD依次为1.28%、0.76%、0.76%、1.55%、1.61%、1.00%、0.59%和0.85%,8种成分平均加样回收率为98.73%~100.54%,RSD均小于2%,表明该方法准确度良好。
2.7 样品含量测定结果
分别计算3种不同基原甘草中芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草查尔酮B、甘草素、异甘草素、甘草查尔酮A的含量,结果表明,芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草素、异甘草素在乌拉尔甘草中的含量最高,分别为2.878、5.794、1.715、2.898、0.699、0.759 mg/g;甘草查尔酮A和甘草查尔酮B在胀果甘草中的含量最高,分别为0.093、0.137 mg/g;光果甘草中8种黄酮类成分均较低(表3)。
3 讨论
本研究通过紫外检测器在200~800 nm波长范围内对甘草中8种待测成分进行全波长扫描,结果发现芹糖甘草苷、甘草苷、甘草素在276 nm处有最大吸收,芹糖异甘草苷、异甘草苷、甘草查尔酮B在360 nm处有最大吸收,其余2种成分(异甘草素、甘草查尔酮A)在360 nm也有良好的吸收。其次,8种待测成分在各自设置的波长处响应值均较高,且分离较为理想。因此,本研究选择276 nm和360 nm作为检测波长[9-12]。
本实验对比了甲醇水、甲醇0.1%乙酸水、乙腈0.1%乙酸水等流动相系统,结果发现流动相为乙腈0.1%乙酸水时的分离效果最理想,峰形均较好且无拖尾现象,故在此基础上进一步考察了不同流动相比例的梯度洗脱效果,最终确定了“1.2.3”项下的色谱条件。
本实验前期以水、不同比例的甲醇和乙醇为溶剂考察了提取溶剂对甘草中8种黄酮类成分含量的影响。结果发现95%乙醇的提取效果最佳,各待测成分的含量均较高,且分离效果较好。同时,分别对45、90和120 min这三个提取时长进行考察,结果发现无明显差异。因此,本研究选择45 min作为提取时间。
芹糖甘草苷与芹糖异甘草苷、甘草苷与异甘草苷、甘草素与异甘草素为3对同分异构体,研究发现它们是甘草发挥抗炎、抗氧化等多种药理作用的关键成分[13-18]。本实验结果表明,芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草素、异甘草素在乌拉尔甘草中的含量最高,甘草查尔酮A和甘草查尔酮B在胀果甘草中的含量最高,光果甘草中8种黄酮类成分均较低。因此,根据不同药理活性需求,选择不同基原甘草,有利于发挥更好的治疗作用。
本研究建立了一种双波长条件下同时测定甘草中芹糖甘草苷、甘草苷、芹糖异甘草苷、异甘草苷、甘草查而酮B、甘草素、异甘草素、甘草查尔酮A 8种黄酮类成分的HPLC方法。所建立的方法简单高效,准确可靠,重复性良好,可以为不同基原甘草的质量控制提供参考。
[参考文献]
[1] 郭跃山, 唐娟. 甘草油的历史沿革、临床应用和现代药理研究[J]. 中国医药导报, 2024, 21(5): 57-60.
[2] 肖先, 李春燕, 刘晓龙, 等. 甘草的主要化学成分及药理作用研究进展[J]. 新乡医学院学报, 2023, 40(3): 280-285.
[3] 邓桃妹, 彭灿, 彭代银, 等. 甘草化学成分和药理作用研究进展及质量标志物的探讨[J]. 中国中药杂志, 202 46(11): 2660-2676.
[4] Xia X, Zhang Y, Zhu L, et al. Liquiritin apioside alleviates colonic inflammation and accompanying depression-like symptoms in colitis by gut metabolites and the balance of Th17/Treg[J]. Phytomedicine, 2023, 120: 155039.
[5] Hua Q, Ren L. The SIRT1/Nrf2 signaling pathway mediates the anti-pulmonary fibrosis effect of liquiritigenin[J]. Chin Med, 2024, 19(1): 12.
[6] Liou CJ, Lee YK, Ting NC, et al. Protective effects of licochalcone A ameliorates obesity and non-alcoholic fatty liver disease via promotion of the Sirt-1/AMPK pathway in mice fed a high-fat diet[J]. Cells, 2019, 8(5): 447.
[7] Chen Z, Ding W, Yang X, et al. Isoliquiritigenin, a potential therapeutic agent for treatment of inflammation-associated diseases[J]. J Ethnopharmacol, 2024, 318(Pt B): 117059.
[8] 国家药典委员会. 中华人民共和国药典. 一部[M]. 北京: 中国医药科技出版社, 2020: 88.
[9] 蔡淑慧, 赵华聪, 贾萌, 等. 基于HPLC指纹图谱和多成分定量分析的炒甘草饮片质量评价研究[J]. 中国中药杂志, 202 46(1): 118-124.
[10] 彭勍, 孟硕, 苗兰, 等. HPLC波长切换法同时测定黄芩甘草药对中9种成分含量[J]. 中国中医药信息杂志, 2020, 27(5): 65-69.
[11] 韩洁, 张玉玲, 王婷, 等. 肠菌群体外转化对甘草药用成分及抗炎作用的影响[J]. 时珍国医国药, 201 23(3): 657-658.
[12] 吴晓云, 李思龙, 刁飞燕, 等. 多波长HPLC-DAD法同时测定美白类化妆品中8种甘草化学成分[J]. 药学研究, 2023, 42(9): 680-684.
[13] Huang Z, Zhao Q, Chen M, et al. Liquiritigenin and liquiritin alleviated monocrotaline-induced hepatic sinusoidal obstruction syndrome via inhibiting HSP60-induced inflammatory injury[J]. Toxicology, 2019, 428: 152307.
[14] Wang ZF, Liu J, Yang YA, et al. A review: the anti-inflammatory, anticancer and antibacterial properties of four kinds of licorice flavonoids isolated from licorice[J]. Curr Med Chem, 2020, 27(12): 1997-2011.
[15] 付传君, 陶家盛, 杨靓, 等. 异甘草素治疗糖尿病脑病的网络药理学分析和实验验证[J]. 南京中医药大学学报, 2023, 39(11): 1113-1121.
[16] 齐爽, 张飞, 王佳贺. 甘草抗衰老药理作用及机制的研究进展[J]. 实用老年医学, 2024, 38(4): 325-329.
[17] Zeng J, Chen Y, Ding R, et al. Isoliquiritigenin alleviates early brain injury after experimental intracerebral hemorrhage via suppressing ROS- and/or NF-κB-mediated NLRP3 inflammasome activation by promoting Nrf2 antioxidant pathway[J]. J Neuroinflammation, 2017, 14(1): 119.
[18] 胡耿, 黄绮韵, 张甜, 等. 甘草黄酮类化学成分研究[J]. 中草药, 2019, 50(21): 5187-5192.
[收稿日期] 2023-07-11" [编辑] 郭 欣