姜黄素通过降低miR-135b-5p和FEN1表达增强卵巢癌OVCAR-3细胞顺铂敏感性



[摘要] 目的: 探究姜黄素对卵巢癌OVCAR-3细胞顺铂敏感性的影响及其潜在机制。方法: (1) 体外常规培养卵巢癌亲本细胞OVCAR-3并构建顺铂耐药OVCAR-3/DDP细胞,将OVCAR-3细胞分为Control(常规培养)、DDP-1(1 μmol/L顺铂)、DDP-5(5 μmol/L顺铂)、DDP-10(10 μmol/L顺铂)、DDP-15(15 μmol/L顺铂)、DDP-20(20 μmol/L顺铂)、DDP-30(30 μmol/L顺铂)、姜黄素+DDP-1(20 μmol/L姜黄素+1 μmol/L顺铂)、姜黄素+DDP-5(20 μmol/L姜黄素+5 μmol/L顺铂)、姜黄素+DDP-10(20 μmol/L姜黄素+10 μmol/L顺铂)、姜黄素+DDP-15(20 μmol/L姜黄素+15 μmol/L顺铂)、姜黄素+DDP-20(20 μmol/L姜黄素+20 μmol/L顺铂)、姜黄素+DDP-30组(20 μmol/L姜黄素+30 μmol/L顺铂);将OVCAR-3/DDP细胞分为Control(常规处理)、DDP-10(10 μmol/L顺铂)、DDP-20(20 μmol/L顺铂)、DDP-30(30 μmol/L顺铂)、DDP-40(40 μmol/L顺铂)、DDP-50(50 μmol/L顺铂)、DDP-60(60 μmol/L顺铂)、姜黄素+DDP-10(20 μmol/L姜黄素+10 μmol/L顺铂)、姜黄素+DDP-20(20 μmol/L姜黄素+20 μmol/L顺铂)、姜黄素+DDP-30(20 μmol/L姜黄素+30 μmol/L顺铂)、姜黄素+DDP-40(20 μmol/L姜黄素+40 μmol/L顺铂)、姜黄素+DDP-50(20 μmol/L姜黄素+50 μmol/L顺铂)、姜黄素+DDP-60组(20 μmol/L姜黄素+60 μmol/L顺铂),CCK-8法检测细胞活性,计算顺铂半数抑制浓度(IC50),筛选顺铂和姜黄素的合适作用浓度。(2) 将OVCAR-3细胞分为对照组(常规处理)、DDP组(20.5 μg/mL顺铂)、姜黄素组(20 μmol/L姜黄素)、姜黄素+DDP组(20 μmol/L姜黄素+20.5 μg/mL顺铂);将OVCAR-3/DDP细胞分为对照组(常规处理)、DDP组(42.1 μg/mL顺铂)、姜黄素组(20 μmol/L姜黄素)、姜黄素+DDP组(20 μmol/L姜黄素+42.1 μg/mL顺铂),采用流式细胞术检测细胞凋亡率,实时荧光定量(qRT)-PCR检测miR-135b-5p表达,qRT-PCR和免疫印迹法分别检测瓣状核酸内切酶-1(flap endonuclease 1,FEN1)mRNA和蛋白表达。结果: 相同顺铂浓度时,与DDP组比较,姜黄素+DDP联合组OVCAR-3和OVCAR-3/DDP细胞活性明显降低(P均lt;0.001)。DDP作用于OVCAR-3和OVCAR-3/DDP细胞的IC50分别为20.5 μg/mL和42.1 μg/mL。与OVCAR组或OVCAR/DDP组相较,姜黄素或顺铂致OVCAR-3和OVCAR-3/DDP细胞凋亡率明显增加(P均lt;0.001),两者联合作用时效果更显著。此外,姜黄素或顺铂处理可明显降低OVCAR-3和OVCAR-3/DDP细胞中miR-135b-5p表达及FEN1表达(Plt;0.01或lt;0.001),两者联合时效果更显著。结论: 姜黄素可增强卵巢癌OVCAR-3细胞顺铂敏感性,其可能与降低miR-135b-5p和FEN1表达相关。
[关键词] 姜黄素;miR-135b-5p;瓣状核酸内切酶-1(FEN1);卵巢癌;顺铂敏感性
[中图分类号] R737.31" [文献标志码] A" [文章编号] 1671-7783(2024)04-0324-07
DOI: 10.13312/j.issn.1671-7783.y230123
[引用格式]马蓉,李娟,王芳. 姜黄素通过降低miR-135b-5p和FEN1表达增强卵巢癌OVCAR-3细胞顺铂敏感性[J]. 江苏大学学报(医学版), 2024, 34(4): 324-330.
[基金项目]新疆维吾尔自治区自然科学基金资助项目(2021D01C237)
[作者简介]马蓉(1983—),女,硕士,副主任医师,主要从事中西医结合妇科肿瘤的研究。
Curcumin enhances cisplatin sensitivity of OVCAR-3 cells by decreasing the expression of miR-135b-5p and FEN1
MA Rong, LI Juan, WANG Fang
(Department of Gynaecology, Xinjiang Uygur Autonomous Region Hospital of Traditional Chinese Medicine, Urumqi Xinjiang 830099, China)
[Abstract] Objective: To investigate the effect of curcumin on cisplatin (DDP) sensitivity of ovarian cancer OVCAR-3 cells and its potential mechanism. Methods: (1) Ovarian cancer parental cell line OVCAR-3 was routinely cultured in vitro and cisplatin-resistant cell line OVCAR-3/DDP was constructed. OVCAR-3 cells were divided into Control (conventional culture), DDP-1 (1 μmol/L cisplatin), DDP-5 (5 μmol/L cisplatin), DDP-10 (10 μmol/L cisplatin), DDP-15 (15 μmol/L cisplatin), DDP-20 (20 μmol/L cisplatin), DDP-30 (30 μmol/L cisplatin), curcumin+DDP-1 (20 μmol/L curcumin+1 μmol/L cisplatin), curcumin+DDP-5 (20 μmol/L curcumin+5 μmol/L cisplatin), curcumin+DDP-10 (20 μmol/L curcumin+10 μmol/L cisplatin), curcumin+DDP-15 (20 μmol/L curcumin+15 μmol/L cisplatin), curcumin+DDP-20 (20 μmol/L curcumin+20 μmol/L cisplatin) and curcumin+DDP-30 groups (20 μmol/L curcumin+30 μmol/L cisplatin). OVCAR-3/DDP cells were divided into Control, DDP-10 (10 μmol/L cisplatin), DDP-20 (20 μmol/L cisplatin), DDP-30 (30 μmol/L cisplatin), DDP-40 (40 μmol/L cisplatin), DDP-50 (50 μmol/L cisplatin), DDP-60 (60 μmol/L cisplatin), curcumin+DDP-10 (20 μmol/L curcumin+10 μmol/L cisplatin), curcumin+DDP-20 (20 μmol/L curcumin+20 μmol/L cisplatin), curcumin+DDP-30 (20 μmol/L curcumin+30 μmol/L cisplatin), curcumin+DDP-40 (20 μmol/L curcumin+40 μmol/L cisplatin), curcumin+DDP-50 (20 μmol/L curcumin+50 μmol/L cisplatin), curcumin+DDP-60 (20 μmol/L curcumin+60 μmol/L cisplatin) groups. CCK-8 method was used to detect the cell viability, the median inhibitory concentration of cisplatin (IC50) was calculated, and the appropriate concentration of cisplatin and curcumin was screened. (2) OVCAR-3 cells were divided into Control group, DDP group (20.5 μg/mL cisplatin), curcumin group (20 μmol/L curcumin) and curcumin+DDP group (20 μmol/L curcumin+20.5 μg/mL cisplatin). OVCAR-3/DDP cells were divided into Control group, DDP group (42.1 μg/mL cisplatin), curcumin group (20 μmol/L curcumin) and curcumin+DDP group (20 μmol/L curcumin+42.1 μg/mL cisplatin). The apoptosis rate was detected by flow cytometry, the expression of miR-135b-5p was detected by quantitative real-time PCR (qRT-PCR), and the mRNA and protein expressions of flap endonuclease 1 (FEN1) were detected by qRT-PCR and Western blotting, respectively. Results: Compared with DDP group, the activity of OVCAR-3 and OVCAR-3/DDP cells in curcumin+DDP group was significantly decreased at the same cisplatin concentration (Plt;0.001). The IC50 of DDP on OVCAR-3 and OVCAR-3/DDP cells were 20.5 μg/mL and 42.1 μg/mL, respectively. Compared with OVCAR group or OVCAR/DDP group, curcumin or cisplatin significantly increased the apoptosis rate of OVCAR-3 and OVCAR-3/DDP cells (all Plt;0.001), and the combined effect of curcumin and cisplatin was more significant. In addition, curcumin or cisplatin treatment significantly decreased the expression of miR-135b-5p and FEN1 expression in OVCAR-3 and OVCAR-3/DDP cells (Plt;0.01 or lt;0.001), and the combined effect was more significant. Conclusion: Curcumin could enhance cisplatin sensitivity in ovarian cancer OVCAR-3 cells, which may be attributed to the reducing expression of miR-135b-5p and FEN1.
[Key words] Curcumin; miR-135b-5p; flap endonuclease 1 (FEN1); ovarian cancer; cisplatin sensitivity
卵巢癌是全球第七大常见癌症和女性癌症死亡的第二大常见原因[1]。研究发现,2023年卵巢癌新发病例数约为19 710,死亡病例数约为13 270[2]。传统的根治性手术联合术后以铂类药物为基础的一线化疗仍是卵巢癌的主要治疗手段,然而顺铂耐药是影响卵巢癌患者预后的重要因素[3]。相关数据显示,手术联合放、化疗后3年内出现复发的卵巢癌患者高达70%~80%,且5年生存率仅30%[4]。
姜黄素是从姜黄的根茎中提取的一种多酚类活性物质,具有抗癌、抗氧化、降血脂和免疫调节等多种药理活性[5]。此外,姜黄素可通过抑制细胞增殖和血管生成并促进细胞凋亡进而抑制卵巢癌进展[6]。进一步研究发现,姜黄素可降低上皮性卵巢癌细胞顺铂耐药性[7]。已有研究表明,姜黄素可通过靶向微小RNA(microRNA,miRNA)并调控其表达进而在癌症中发挥保护作用[8]。miRNA是一类广泛参与基因转录后调控的非编码小分子RNA。大量研究表明,miRNA表达失调是恶性肿瘤发生发展的重要因素[9-12]。研究表明,miR-135b-5p与卵巢癌恶性进展密切相关[13-14]。瓣状核酸内切酶-1(flap endonuclease 1,FEN1)蛋白是参与DNA复制和修复的一类结构特异性核酸内切酶[15]。研究显示,FEN1在上皮性卵巢癌组织中表达升高,且与临床分期、分化程度和化疗有效性相关[16]。多项研究发现,FEN1在卵巢癌中发挥促癌作用[17-18]。进一步研究发现,姜黄素可显著降低FEN1蛋白表达进而增强乳腺癌细胞的顺铂敏感性[19]。因此,本文拟分析姜黄素对卵巢癌细胞顺铂敏感性的影响及其潜在的机制。
1 材料和方法
1.1 细胞、主要试剂和仪器
人卵巢癌OVCAR-3细胞由美国菌种保藏中心(ATCC)提供;DMEM高糖培养基、RIPA蛋白裂解液、BCA蛋白定量试剂盒、Trizol提取试剂均购自合肥Biosharp公司;10%胎牛血清购自美国Gibco公司;顺铂(DPP)购自美国Sigma公司;姜黄素购自上海源叶生物科技有限公司;CCK-8试剂购自日本Dojindo公司;Annexin V-FITC/PI试剂盒购自美国BD公司;miRNA逆转录试剂盒和miRNA Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技股份有限公司;第1链cDNA合成试剂盒和SYBR Green Master Mix购自上海翌圣生物科技股份有限公司;兔抗人FEN1、抗β-肌动蛋白和HRP标记的羊抗兔IgG均购自美国Abcam公司;ECL发光液购自美国Millipore公司;实时荧光定量(qRT)-PCR仪购自美国Roche公司;细胞培养箱购自美国Thermo公司;酶标仪购自美国Molecular Devices公司;流式细胞仪购自美国BD公司。
1.2 细胞培养
1.2.1 细胞培养 人卵巢癌OVCAR-3细胞用含10%胎牛血清的DMEM,于37 ℃,5% CO2细胞培养箱中培养。
1.2.2 OVCAR-3/DDP耐药细胞构建 采用药物大剂量冲击法构建耐药OVCAR-3/DDP细胞。取处于对数生长期的OVCAR-3细胞接种至6 cm细胞培养皿中。当细胞密度达70%~80%时,加入10 μg/mL顺铂,作用48 h后,更换为常规DMEM。细胞恢复生长后,重复上述药物冲击、换液、传代等步骤。90 d后成功构建OVCAR-3/DDP耐药细胞。
1.2.3 CCK-8检测细胞活性以筛选顺铂和姜黄素合适的作用浓度 将OVCAR-3细胞接种于96孔板中(3×104细胞/mL),分为Control(常规培养)、DDP-1(1 μmol/L顺铂)、DDP-5(5 μmol/L顺铂)、DDP-10(10 μmol/L顺铂)、DDP-15(15 μmol/L顺铂)、DDP-20(20 μmol/L顺铂)、DDP-30(30 μmol/L顺铂)、姜黄素+DDP-1(20 μmol/L姜黄素[20]+1 μmol/L顺铂联合处理)、姜黄素+DDP-5(20 μmol/L姜黄素+5 μmol/L顺铂联合处理)、姜黄素+DDP-10(20 μmol/L姜黄素+10 μmol/L顺铂联合处理)、姜黄素+DDP-15(20 μmol/L姜黄素+15 μmol/L顺铂联合处理)、姜黄素+DDP-20(20 μmol/L姜黄素+20 μmol/L顺铂联合处理)、姜黄素+DDP-30组(20 μmol/L姜黄素+30 μmol/L顺铂联合处理);将OVCAR-3/DDP细胞接种于96孔板中,分为Control(常规培养)、DDP-10(10 μmol/L顺铂)、DDP-20(20 μmol/L顺铂)、DDP-30(30 μmol/L顺铂)、DDP-40(40 μmol/L顺铂)、DDP-50(50 μmol/L顺铂)、DDP-60(60 μmol/L顺铂)、姜黄素+DDP-10(20 μmol/L姜黄素+10 μmol/L顺铂联合处理)、姜黄素+DDP-20(20 μmol/L姜黄素+20 μmol/L顺铂联合处理)、姜黄素+DDP-30(20 μmol/L姜黄素+30 μmol/L顺铂联合处理)、姜黄素+DDP-40(20 μmol/L姜黄素+40 μmol/L顺铂联合处理)、姜黄素+DDP-50(20 μmol/L姜黄素+50 μmol/L顺铂联合处理)、姜黄素+DDP-60组(20 μmol/L姜黄素+60 μmol/L顺铂联合处理),按照组别予以相应处理24 h;加入15 μL CCK-8试剂孵育3 h;于酶标仪450 nm处检测光密度值。
1.3 实验方法
1.3.1 流式细胞术检测细胞凋亡率 取处于对数生长期的OVCAR-3细胞接种于6孔板中(1×105细胞/mL),分为对照(常规培养)、DDP(20.5 μg/mL顺铂处理)、姜黄素(20 μmol/L姜黄素处理)、姜黄素+DDP组(20 μmol/L姜黄素+20.5 μg/mL顺铂联合处理);取处于对数生长期的OVCAR-3/DDP细胞接种于6孔板中,分为对照(常规培养)、DDP(42.1 μg/mL顺铂处理)、姜黄素(20 μmol/L姜黄素处理)、姜黄素+DDP组(20 μmol/L姜黄素+42.1 μg/mL顺铂联合处理)。用不含EDTA的胰酶消化、收集细胞;1 500 r/min 4 ℃离心5 min;用预冷PBS重悬细胞沉淀;加入300 μL结合缓冲液。根据试剂盒操作说明,先后加入10 μL Annexin V-FITC和5 μL PI,避光染色15 min;采用流式细胞仪分析细胞凋亡率。
1.3.2 qRT-PCR检测miR-135b-5p和FEN1 mRNA相对表达水平 取“1.3.1”分组处理24 h后的OVCAR-3和OVCAR-3/DDP细胞,采用Trizol试剂分离细胞中的miRNA,并经miRNA逆转录试剂盒逆转录为cDNA,随后加入miRNA Universal SYBR qPCR Master Mix行PCR扩增。采用2-ΔΔCt法计算miR-135b-5p相对于内参U6的表达水平。
利用Trizol试剂分离细胞中的总RNA,并经第1链cDNA合成试剂盒逆转录为cDNA,行qRT-PCR。反应体系:SYBR Green Master Mix 10 μL,cDNA 4 μL,上、下游引物(10 mol/L)各1 μL,无菌蒸馏水4 μL;反应步骤:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,68 ℃延伸45 s,共40个循环。RNA引物由广州锐博生物科技有限公司设计。FEN1上游引物:5′-ATGACATCAAGAGCTACTTTGGC-3′,下游引物:5′-GGCGAACAGCAATCAGGAACT-3′;GAPDH上游引物:5′-AATGGGCAGCCGTTAGGAAA-3′,下游引物:5′-GCGCCCAATACGACCAAATC-3′。采用2-ΔΔCt法计算FEN1 mRNA相对表达水平。
1.3.3 蛋白质免疫印迹检测FEN1蛋白表达 取“1.3.1”处理24 h后OVCAR-3和OVCAR-3/DDP细胞,加入RIPA裂解液冰上裂解30 min,每5 min振荡1次;12 000 r/min 4 ℃离心10 min;收集总蛋白,采用BCA法检测其浓度;加入4×上样缓冲液,稀释成1×上样缓冲液,煮沸10 min;将变性的蛋白样品逐一加样,220 V电泳60 min;300 mA转膜2 h,将蛋白转至PVDF膜;3%牛血清白蛋白溶液封闭2 h;加入一抗FEN1和β-肌动蛋白(稀释比均为1∶1 000),4 ℃孵育过夜;TBST洗膜;加入HRP标记的羊抗兔IgG二抗稀释液(1∶2 000),37 ℃孵育1 h;用ECL发光试剂盒检测目的蛋白;采用Image J软件进行条带定量分析。
1.4 统计学分析
采用SPSS 22.0软件处理数据,计量资料用均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较行单因素方差分析,进一步实验组与对照组间比较采用Dunnett-t检验。Plt;0.05为差异有统计学意义。
2 结果
2.1 顺铂和(或)姜黄素对OVCAR-3和OVCAR-3/DDP细胞活性的影响
经过90 d诱导后,成功构建耐药OVCAR-3/DDP细胞,判断标准为细胞在10 μg/mL顺铂中稳定生长并重复传代。如图1所示,CCK-8检测结果显示,与Control组比较,1 μmol/L顺铂组OVCAR-3细胞活性无明显改变,5、10、15、20、30 μmol/L顺铂组OVCAR-3细胞活性明显降低(Plt;0.01或lt;0.001);10 μmol/L顺铂组OVCAR-3/DDP细胞活性无明显改变,20、30、40、50、60 μmol/L顺铂组OVCAR-3/DDP细胞明显降低(Plt;0.01或lt;0.001);相同顺铂浓度时,与DDP组比较,姜黄素+DDP联合组OVCAR和OVCAR-3/DDP细胞活性明显降低(P均lt;0.001)。此外,经不同浓度顺铂处理后,亲本OVCAR-3细胞IC50为20.5 μg/mL,OVCAR-3/DDP耐药细胞IC50为42.1 μg/mL。因此,分别选择20.5 μg/mL、42.1 μg/mL顺铂处理OVCAR-3、OVCAR-3/DDP细胞进行后续实验。
2.2 姜黄素对OVCAR-3和OVCAR-3/DDP细胞凋亡的影响
流式细胞术分析结果显示,在OVCAR细胞中,与对照组比较,姜黄素组细胞凋亡率明显增加(Plt;0.001);与DDP组比较,姜黄素+DDP组细胞凋亡率明显增加(Plt;0.001)。在OVCAR-3/DDP细胞中,与对照组相较,姜黄素组细胞凋亡率明显增加(Plt;0.001);与DDP组比较,姜黄素+DDP组细胞凋亡率明显增加(Plt;0.001)。见图2。
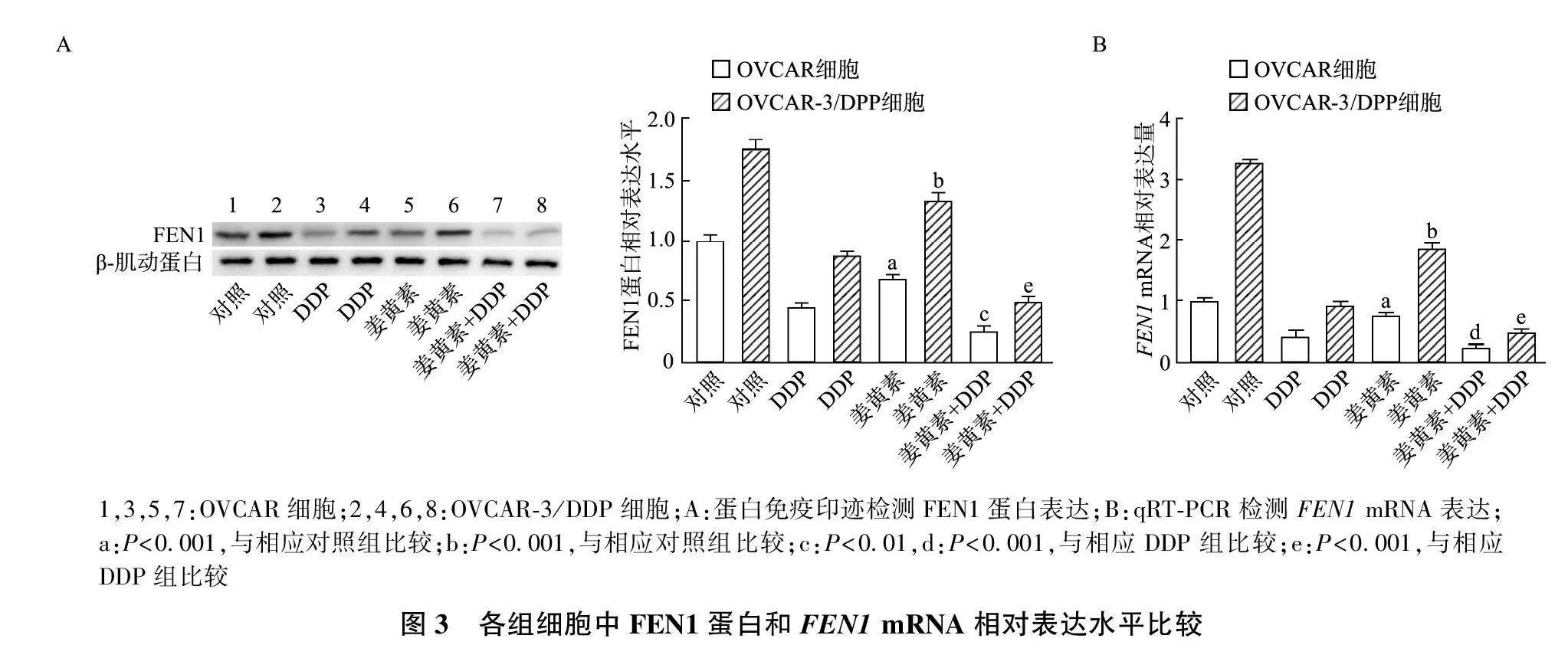
2.3 姜黄素对FEN1表达的影响
蛋白免疫印迹和qRT-PCR结果显示,在OVCAR细胞中,与对照组比较,姜黄素组FEN1蛋白和FEN1 mRNA表达明显降低(P均lt;0.001);与DDP组比较,姜黄素+DDP组FEN1蛋白和FEN1 mRNA表达明显降低(Plt;0.01或lt;0.001)。在OVCAR-3/DDP细胞中,与对照组比较,姜黄素组FEN1蛋白和FEN1 mRNA表达明显降低(P均lt;0.001);与DDP组比较,姜黄素+DDP组中FEN1蛋白和FEN1 mRNA表达显著降低(P均lt;0.001)。见图3。
2.4 姜黄素对miR-135b-5p表达的影响
qRT-PCR检测结果显示,与对照组相比,姜黄素组miR-135b-5p表达显著降低(Plt;0.001);与DDP组相比,姜黄素+DDP组miR-135b-5p表达显著降低(Plt;0.001)。在OVCAR-3/DDP细胞中,与对照组比较,OVACR-3/DDP+姜黄素组miR-135b-5p表达显著降低(Plt;0.001);与DDP组相比,姜黄素+DDP组miR-135b-5p表达明显降低(P均lt;0.001)。见图4。
3 讨论
研究报道,姜黄素可通过抑制肿瘤增殖、侵袭和转移,以及调节细胞凋亡和自噬等发挥潜在的抗癌作用[21-23]。近来研究发现,姜黄素与顺铂联合治疗可减轻顺铂相关副作用并降低耐药风险[24]。Wang等[25]研究发现,姜黄素可通过介导内质网应激信号通路从而增加非小细胞肺癌细胞顺铂敏感性,还可通过调控耐药相关蛋白——多重耐药蛋白1(MRP1)和P-糖蛋白1表达进而抑制宫颈癌细胞顺铂耐药[26]。大量研究表明,姜黄素可通过调控多种信号通路在卵巢癌进展中起抑癌作用并显著降低卵巢癌细胞顺铂耐药性[6-7,27]。本研究结果显示,姜黄素可致卵巢癌OVCAR-3细胞和OVCAR-3/DDP耐药细胞活性降低,并诱导细胞凋亡,且顺铂与姜黄素联合处理更为显著,初步表明姜黄素在卵巢癌细胞中具有抗顺铂耐药作用,与上述研究结果相一致。由此提示,在卵巢癌化疗过程中,姜黄素可增强顺铂化疗效果并降低顺铂耐药性。
研究发现,miRNA异常表达可影响肿瘤细胞对化疗药物的敏感性,从而导致耐药[28]。其中,miR-135b-5p可通过促进细胞增殖、迁移和侵袭从而参与卵巢癌的恶性进展[13-14]。此外,研究发现,miR-135b-5p表达降低可增强食管癌、胃癌和子宫内膜癌细胞顺铂敏感性[29-31]。本研究发现姜黄素可降低miR-135b-5p在卵巢癌亲本细胞OVCAR-3和耐药细胞OVCAR-3/DDP中表达,表明姜黄素可能通过抑制miR-135b-5p表达而影响卵巢癌细胞顺铂敏感性。另有研究发现,姜黄素可增强乳腺癌细胞的顺铂敏感性,其机制可能与降低FEN1表达有关[19,32]。FEN1在卵巢癌中发挥促癌作用,且可作为卵巢癌治疗的有效靶点[16-17]。Mesquita等[33]指出,抑制FEN1表达可增加耐药卵巢癌细胞的顺铂敏感性。本研究发现,姜黄素可致卵巢癌OVCAR-3细胞和OVCAR-3/DDP细胞中FEN1 mRNA和蛋白表达明显降低。由此表明,姜黄素可能通过调控miR-135b-5p及FEN1表达进而参与调控卵巢癌顺铂敏感性。
综上所述,姜黄素可能通过下调miR-135b-5p及FEN1表达进而提高卵巢癌细胞顺铂敏感性。但是,miR-135b-5p与FEN1间的靶向调控关系仍不清楚,后续有待深入探究。
[参考文献]
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[2] Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48.
[3] Song M, Cui M, Liu K. Therapeutic strategies to overcome cisplatin resistance in ovarian cancer[J]. Eur J Med Chem, 202 232: 114205.
[4] Ledermann JA, Raja FA, Fotopoulou C, et al. Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29(Suppl 4): iv259.
[5] Patel SS, Acharya A, Ray RS, et al. Cellular and molecular mechanisms of curcumin in prevention and treatment of disease[J]. Crit Rev Food Sci Nutr, 2020, 60(6): 887-939.
[6] Mohamadian M, Bahrami A, Moradi Binabaj M, et al. Molecular targets of curcumin and its therapeutic potential for ovarian cancer[J]. Nutr Cancer, 202 74(8): 2713-2730.
[7] Muhanmode Y, Wen MK, Maitinuri A, et al. Curcumin and resveratrol inhibit chemoresistance in cisplatin-resistant epithelial ovarian cancer cells via targeting P13K pathway[J]. Hum Exp Toxicol, 202 41: 9603271221095929.
[8] Sadoughi F, Maleki Dana P, Asemi Z, et al. Targeting microRNAs by curcumin: implication for cancer therapy[J]. Crit Rev Food Sci Nutr, 202 62(28): 7718-7729.
[9] Momtazi AA, Shahabiopour F, Khatibi S, et al. Curcumin as a microRNA regulator in cancer: A review[J]. Rev Physiol Biochem Pharmacol, 2016, 171: 1-38.
[10] Hill M, Tran N. miRNA interplay: mechanisms and consequences in cancer[J]. Dis Model Mech, 202 14(4): dmm047662.
[11] 唐德平, 邢梦洁, 宋文涛, 等. microRNA治疗在癌症及其他疾病中的研究进展[J]. 中国生物工程杂志, 202 41(11): 64-73.
[12] Ali Syeda Z, Langden SSS, Munkhzul C, et al. Regulatory mechanism of microRNA expression in cancer[J]. Int J Mol Sci, 2020, 21(5): 1723.
[13] Yu S, Yu M, Chen J, et al. Circ_0000471 suppresses the progression of ovarian cancer through mediating mir-135b-5p/dusp5 axis[J]. Am J Reprod Immunol, 2023, 89(4): e13651.
[14] Chen H, Mao M, Jiang J, et al. Circular RNA CDR1as acts as a sponge of miR-135b-5p to suppress ovarian cancer progression[J]. Onco Targets Ther, 2019, 12: 3869-3879.
[15] Shi R, Wang Y, Gao Y, et al. Succinylation at a key residue of FEN1 is involved in the DNA damage response to maintain genome stability[J]. Am J Physiol Cell Physiol, 2020, 319(4): C657-C666.
[16] 梁培丽, 张莘, 徐国才, 等. FEN-1和AXL表达与上皮性卵巢癌化疗耐药相关分析[J]. 现代生物医学进展, 2016, 16(13): 2533-2536, 2558.
[17] Wu H, Yan Y, Yuan J, et al. miR-4324 inhibits ovarian cancer progression by targeting FEN1[J]. J Ovarian Res, 202 15(1): 32.
[18] Zhao M, Ji H, Fu Q, et al. MicroRNA-134-3p inhibits ovarian cancer progression by targeting flap structure-specific endonuclease 1 in vitro[J]. Oncol Rep, 202 45(1): 119-128.
[19] 邹娇, 陈彬, 李强, 等. 姜黄素对乳腺癌细胞顺铂敏感性的影响[J]. 第三军医大学学报, 2016, 38(16): 1809-1814.
[20] 许琮, 夏超, 李德民, 等. 姜黄素联合吉西他滨对胰腺癌细胞体外增殖、凋亡及肿瘤干细胞表型特征的影响[J]. 华中科技大学学报(医学版), 2015, 44(5): 499-504.
[21] Giordan A, Tommonaro G. Curcumin and cancer[J]. Nutrients, 2019, 11(10): 2376.
[22] Ming T, Tao Q, Tang S, et al. Curcumin: An epigenetic regulator and its application in cancer[J]. Biomed Pharmacother, 202 156: 113956.
[23] Bhatia M, Bhalerao M, Cruz-Martins N, et al. Curcumin and cancer biology: Focusing regulatory effects in different signalling pathways[J]. Phytother Res, 202 35(9): 4913-4929.
[24] Hussain Y, Islam L, Khan H, et al. Curcumin-cisplatin chemotherapy: A novel strategy in promoting chemotherapy efficacy and reducing side effects[J]. Phytother Res, 202 35(12): 6514-6529.
[25] Wang L, Hu R, Dai A. Curcumin increased the sensitivity of non-small-cell lung cancer to cisplatin through the endoplasmic reticulum stress pathway[J]. Evid Based Complement Alternat Med, 202 2022: 6886366.
[26] Roy M, Mukherjee S. Reversal of resistance towards cisplatin by curcumin in cervical cancer cells[J]. Asian Pac J Cancer Prev, 2014, 15(3): 1403-1410.
[27] Kalinina EV, Hasan AAS, Tatarskiy VV, et al. Suppression of PI3K/Akt/mTOR signaling pathway and antioxidant system and reversal of cancer cells resistance to cisplatin under the effect of curcumin[J]. Bull Exp Biol Med, 202 173(3): 371-375.
[28] Chen B, Dragomir MP, Yang C, et al. Targeting non-coding RNAs to overcome cancer therapy resistance[J]. Signal Transduct Target Ther, 202 7(1): 121.
[29] Di Y, Jiang Y, Shen X, et al. Downregulation of miR-135b-5p suppresses progression of esophageal cancer and contributes to the effect of cisplatin[J]. Front Oncol, 202 11: 679348.
[30] Shao L, Chen Z, Soutto M, et al. Helicobacter pylori-induced miR-135b-5p promotes cisplatin resistance in gastric cancer[J]. FASEB J, 2019, 33(1): 264-274.
[31] 寇印巧, 李健飞, 高媛媛. 微小RNA-135b-5p调控子宫内膜癌细胞对顺铂耐药性的机制研究[J]. 中国临床药理学杂志, 2020, 36(15): 2269-227 2281.
[32] Zou J, Zhu L, Jiang X, et al. Curcumin increases breast cancer cell sensitivity to cisplatin by decreasing FEN1 expression[J]. Oncotarget, 2018, 9(13): 11268-11278.
[33] Mesquita KA, Ali R, Doherty R, et al. FEN1 blockade for platinum chemo-sensitization and synthetic lethality in epithelial ovarian cancers[J]. Cancers (Basel), 202 13(8): 1866.
[收稿日期] 2023-04-16" [编辑] 刘星星