吉马酮对大鼠缺血性脑卒中的神经保护作用研究
屈战利 曾锦明 熊建 张杨威 杨旭 季一飞


〔摘要〕 目的 研究吉马酮对缺血性脑卒中大鼠和缺氧缺糖神经元细胞损伤的保护作用及可能机制。方法 将SD大鼠随机分为假手术组(等体积生理盐水)、模型组(等体积生理盐水)、阳性药组(尼莫地平,10 mg/kg)及吉马酮低(5 mg/kg)、中(10 mg/kg)、高(20 mg/kg)剂量组,每组20只。采用线栓法制备缺血性脑卒中大鼠模型,用药组均于缺血1.5 h时腹腔注射给药1次。记录各组大鼠术后24 h的脑指数、脑组织含水量、神经功能评分、海马区组织形态学及脑组织胱天蛋白酶-3(cysteine aspartic acid specific protease-3, Caspase-3)活性和细胞凋亡水平,检测血清中氧化应激因子包括超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)水平,检测血清炎症因子包括肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-1β(interleukin-1β, IL-1β)水平。原代大鼠神经元分为对照组、模型组、阳性药组(尼莫地平,1 μmol/L)及吉马酮低(50 μmol/L)、中(100 μmol/L)、高(200 μmol/L)剂量组。细胞预处理24 h后,除对照组外,各组细胞均进行氧糖剥夺和复糖复氧实验。实验结束后,检测各组细胞生存率、Caspase-3活性和细胞凋亡情况。结果 与假手术组相比,模型组大鼠脑指数、脑组织含水量、神经功能评分均增加(P<0.05或P<0.01),血清中炎症因子TNF-α、IL-6和IL-1β的水平升高(P<0.01),氧化应激因子SOD和GSH-Px水平降低(P<0.01),MDA水平升高(P<0.01),Caspase-3活性增强(P<0.01),神经元细胞出现典型的坏死特征,细胞凋亡率增加(P<0.01)。与模型组相比,阳性药组和吉马酮不同剂量组大鼠脑指数、脑组织含水量、神经功能评分均下降(P<0.05或P<0.01),血清中炎症因子TNF-α、IL-6和IL-1β水平降低(P<0.05或P<0.01),氧化应激因子SOD和GSH-Px水平升高(P<0.05或P<0.01),MDA水平降低(P<0.05或P<0.01),Caspase-3活性及细胞凋亡率降低(P<0.05或P<0.01)。与对照组相比,模型组细胞的存活率明显降低(P<0.01),Caspase-3活性和细胞凋亡率升高(P<0.01)。与模型组相比,阳性药组和吉马酮不同剂量组细胞存活率明显升高(P<0.01),Caspase-3活性和细胞凋亡率下降(P<0.05或P<0.01)。结论 吉马酮对缺血性脑卒中大鼠和缺氧缺糖造成的神经元细胞损伤具有显著改善作用,其机制可能与抑制神经元细胞凋亡有关。
〔关键词〕 吉马酮;缺血性脑卒中;神经元细胞;氧化应激;细胞凋亡
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.06.003
Neuroprotective effects of germacrone on rats with ischemic stroke
QU Zhanli1, ZENG Jinming2, XIONG Jian1, ZHANG Yangwei1, YANG Xu1, JI Yifei1*
1. Department of Neurology, Nanchong Hospital of Beijing Anzhen Hospital (Nanchong Central Hospital) of Capital Medical University, Nanchong, Sichuan 637000, China; 2. Department of Anesthesiology, Nanchong Hospital of Beijing Anzhen Hospital (Nanchong Central Hospital) of Capital Medical University, Nanchong, Sichuan 637000, China
〔Abstract〕 Objective To study the protective effects and possible mechanism of germacrone on rats with ischemic stroke and on neuron damage caused by oxygen-glucose deprivation. Methods SD rats were randomized into sham-operated group (an equal volume of saline), model group (an equal volume of saline), positive drug group (nimodipine, 10 mg/kg), and low- (5 mg/kg), medium- (10 mg/kg), and high-dose (20 mg/kg) germacrone groups, with 20 rats in each group. The ischemic stroke rat model was prepared by the thread embolism method, and each drug group was injected intraperitoneally with the corresponding drug once at 1.5 h post-ischemia. Postoperative measurements at 24 hours for each group of rats included brain index, brain tissue water content, neurological function score, hippocampal tissue morphology, and cysteine aspartic acid specific protease-3 (Caspase-3) activity and apoptosis levels in the brain tissue. The serum levels of oxidative stress factors, including superoxide dismutase (SOD), malondialdehyde (MDA), and glutathione peroxidase (GSH-Px), as well as those of inflammatory factors, including tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), and interleukin-1β (IL-1β) were all measured. Primary rat neurons were divided into control group, model group, positive drug group (nimodipine, 1 μmol/L), and low- (50 μmol/L), medium- (100 μmol/L), and high-dose (200 μmol/L) germa?鄄
crone groups. After 24 h of cell pre-treatment, the cells in all groups were subjected to oxygen-glucose deprivation and reglucose-reoxygenation except the control group. After the experiment, the survival rate, Caspase-3 activity, and apoptosis of cells were measured in each group. Results Compared with the sham-operated group, the model group exhibited increased brain index, brain tissue water content, and neurological function score (P<0.05 or P<0.01); the serum levels of inflammatory factors TNF-α, IL-6, and IL-1β were elevated (P<0.01); the serum levels of oxidative stress factors SOD and GSH-Px were reduced (P<0.01), while that of MDA increased (P<0.01); Caspase-3 activity was higher (P<0.01), and the neurons showed typical necrotic features with an increased apoptosis rate (P<0.01). Compared with the model group, the positive drug group and the various germacrone dose groups exhibited decreased brain index, brain tissue water content, and neurological function scores (P<0.05 or P<0.01), decreased levels of inflammatory factors TNF-α, IL-6, and IL-1β in the serum (P<0.05 or P<0.01), increased levels of oxidative stress factors SOD and GSH-Px (P<0.05 or P<0.01), decreased MDA level (P<0.05 or P<0.01), as well as reduced Caspase-3 activity and apoptosis rate (P<0.05 or P<0.01). The experiment of the primary rat neurons revealed that, compared with the control group, cells in the model group showed significantly reduced survival rate (P<0.01), with increased Caspase-3 activity and apoptosis rates (P<0.01); compared with the model group, cells in the positive drug group and various germacrone dose groups showed significantly higher survival rate (P<0.01), and lower Caspase-3 activity and apoptosis rates (P<0.05 or P<0.01). Conclusion Germacrone has a significantly ameliorative effect on the injury of rats with ischemic stroke and neuron damage caused by oxygen-glucose deprivation, and its mechanism may be related to the inhibition of neuronal apoptosis.
〔Keywords〕 germacrone; ischemic stroke; neuron; oxidative stress; apoptosis
卒中是世界范围内主要死亡原因之一,脑缺血被认为是卒中最常见的致病原因[1]。脑缺血/再灌注(ischemia/reperfusion, I/R)损伤因血栓、栓塞或灌注不足,中断脑供血,不可逆地损害脑功能,最终导致死亡或残疾[2]。迄今为止,对于缺血性脑卒中尚无有效的治疗方法。I/R损伤的防治在缺血性脑血管病的治疗中至关重要。诸多文献研究表明,I/R发病机制包括能量代谢紊乱、氧化应激反应、炎症反应和细胞凋亡等[3-4]。据报道,神经炎症和氧化应激在I/R过程中显著上调,已被证明在脑卒中的神经元损伤中发挥重要作用[5]。其中,神经炎症是缺血性脑卒中发病过程中促进细胞凋亡的主要因素之一[6]。
吉马酮是从莪术中分离出的倍半萜类化合物,是莪术的主要有效成分之一,已有研究表明,吉马酮具有抗炎、抗病毒、抗氧化、抗肿瘤和调节血脂代谢等多种药理作用[7-8]。吉马酮可通过抑制神经元凋亡和小胶质细胞的活化明显改善创伤性脑损伤导致的小鼠运动和学习功能障碍[9]。细胞研究发现,吉马酮能够上调miR-297的表达,从而抑制过氧化氢诱导的小鼠神经元细胞凋亡和氧化应激[10]。但是吉马酮对缺血性脑卒中起到何种作用以及其对于I/R损伤的具体分子机制仍需深入研究。
为进一步明确吉马酮对缺血性脑卒中的保护作用及其机制,本文采用可逆性大鼠大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)手术在体诱导大鼠I/R损伤模型,采用体外氧糖剥夺(oxygen glucose deprivation, OGD)实验建立大鼠皮质神经元细胞缺糖缺氧模型,研究吉马酮对体内、体外脑缺血模型的保护作用,以期为吉马酮的临床应用提供更有价值的参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周SPF级健康雄性大鼠120只[北京维通利华实验动物技术有限公司,合格证号:SYXK(鄂)2019-0106],大鼠饲养于川北医学院动物实验中心,光照/黑暗12 h周期循环,温度22~24 ℃,相对湿度为50%~60%,自由进食和饮水,适应性喂养1周后开始后续实验。本实验方案经本院动物伦理委员会审批(审批号:2024062)。
1.1.2 主要药品及主要试剂 吉马酮(临沂艾泽拉斯生物科技有限公司,批号:D0655);尼莫地平(美国MCE公司,批号:N149);胱天蛋白酶-3(cysteine aspartic acid specific protease-3, Caspase-3)活性检测试剂盒(批号:C111)、TUNEL检测试剂盒(批号:C1088)均购自上海碧云天生物技术有限公司;DMEM培养基(批号:21010046)、胎牛血清(批号:10100147)、青霉素-链霉素双抗(批号:15070063)均购自美国Gibco公司;MTT试剂盒(批号:M8180)、HE染色试剂盒(批号:G1120)均购自索莱宝科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号:H052-1)、白细胞介素-6(interleukin-6,IL-6)检测试剂盒(批号:H007-1-1)、白细胞介素-1β(interleukin-1β, IL-1β)检测试剂盒(批号:H002)、超氧化物歧化酶(superoxide dismutase, SOD)检测试剂盒(批号:A001-3-2)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号:A003-1-2)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)检测试剂盒(批号:A005-1-2)均购自南京建成生物工程研究所。
1.1.3 主要仪器 小动物呼吸机(型号:ALC-V8D,上海奥尔科特生物科技有限公司);电子天平(型号:AE160,瑞士Mettler Toledo公司);切片机、包埋机、烘干机、展片机(型号:RM2235、EG1150、HI1220、HI1210,德国Leica公司);冷冻离心机、细胞培养箱(型号:ST16R、42590923,美国Thermo公司);酶标仪(型号:M200,日本TECA公司)。
1.2 方法
1.2.1 分组与给药 将120只大鼠常规饲养1周后,随机分为假手术组、模型组、阳性药组、吉马酮低剂量组、吉马酮中剂量组和吉马酮高剂量组,每组20只。具体给药方案如下:(1)假手术组、模型组:灌胃等体积生理盐水;(2)阳性药组:灌胃尼莫地平10 mg/kg[11];(3)吉马酮低、中、高剂量组:腹腔注射吉马酮5、10、20 mg/kg[12]。以上各组大鼠均于缺血1.5 h时,即再灌注前腹腔注射给药1次。
1.2.2 MCAO模型制备 参考既往文献方法[12],各组大鼠经异氟烷麻醉后,置于加热垫仰卧位固定,用脱毛膏脱去前颈毛,并进行颈部消毒。沿颈部中线处进行切口,沿胸锁乳突肌内钝性分离颈总动脉、颈内动脉和颈外动脉。将一条直径为0.2 mm的尼龙丝从颈外动脉插入颈内动脉,并将线插入指定位置系好。假手术组进行同样手术操作,不进行线栓。缺血1.5 h后,小心取下细尼龙丝,进行再灌注。再灌注24 h后,各组大鼠进行指标测量和样本采集。
1.2.3 神经功能评分评估 各组大鼠缺血再灌注24 h后,参照Longa法[12]对各组大鼠神经功能进行评分,评估各组大鼠神经功能缺损情况。具体标准如下:0分为无神经功能缺损,可正常行走;1分为可正常行走,缺血对侧前肢不能完全伸展;2分为无法直立行走,仅能对侧打转;3分为易跌倒,直立向对侧倾斜;4分为不能自发行走,意识水平低下。
1.2.4 脑指数和脑组织含水量测定 各组大鼠断头,取完整脑组织,称重(湿重)。大脑组织置于恒温干燥箱中100 ℃、48 h,称重(干重)。脑指数=湿重/体质量×100%;脑组织含水量=(湿重-干重)/湿重×100%。
1.2.5 炎症因子和氧化应激相关因子检测 采用腹主动脉取血,于低温高速离心机3 000 r/min离心10 min(离心半径为10 cm),取上清液,-80 ℃保存备用。采用试剂盒,按照说明书方法检测TNF-α、IL-6、IL-1β、SOD、MDA和GSH-Px水平。
1.2.6 海马区病理学检测 取各组大鼠海马组织,冷生理盐水冲洗后于4%多聚甲醛中固定72 h。组织继续进行不同浓度乙醇梯度脱水,石蜡包埋,切片(4 μm)。待检切片进行以下操作:二甲苯脱蜡,乙醇水化,经HE染色,封片,于光学显微镜下进行镜检。
1.2.7 Caspase-3活性检测 使用试剂盒检测各组大鼠脑组织或神经元细胞的Caspase-3活性。每10 mg组织或200×104个细胞加入100 μL裂解液,冰浴匀浆,冰上再裂解5 min。用低温高速离心机20 000 r/min离心15 min(离心半径为10 cm),取上清液,按说明书进行检测。
1.2.8 原代大鼠神经元的培养 新生SD大鼠经75%乙醇消毒,断头后置于冰上。无菌条件下剥离大脑海马组织,用冷PBS冲洗。剪碎,经0.125%胰酶37 ℃消化30 min,加入胎牛血清终止消化,静止2 min后弃去上层液体。消化后的组织继续用新鲜培养基吹打洗涤,筛网过滤后移入离心管,弃上清液。沉淀细胞,用含5%胎牛血清的培养基置于培养箱中培养,4~6 h后更换为神经元专用无血清培养基。
1.2.9 OGD神经元模型的建立与分组 经培养的原代大鼠神经元分为以下组别:对照组、模型组、阳性药组(尼莫地平,1 μmol/L)[11]、吉马酮低剂量组(50 μmol/L)、吉马酮中剂量组(100 μmol/L)和吉马酮高剂量组(200 μmol/L)[10]。各组处理方法如下[13]:阳性药组和吉马酮不同剂量组先用相应剂量的药物预处理24 h,然后置换为无糖无血清的培养基,置于95% N2、5% CO2混合气的培养箱中4 h。结束后,进行复糖复氧处理,即置换为含糖含血清的培养基,置于37 ℃、5% CO2的培养箱中继续常规培养。
1.2.10 细胞活性测定 以上各组细胞置于96孔板中,于37 ℃、5% CO2的培养箱中培养。经给药预处理和OGD实验后,给予复糖复氧实验。加入MTT(终浓度为0.5 mg/mL)继续培养细胞4 h,弃去培养基,加入DMSO(150 μL/孔),于摇床低速震荡10 min,待结晶全部溶解后,用酶标仪读取各孔吸光度,计算各组细胞存活率。
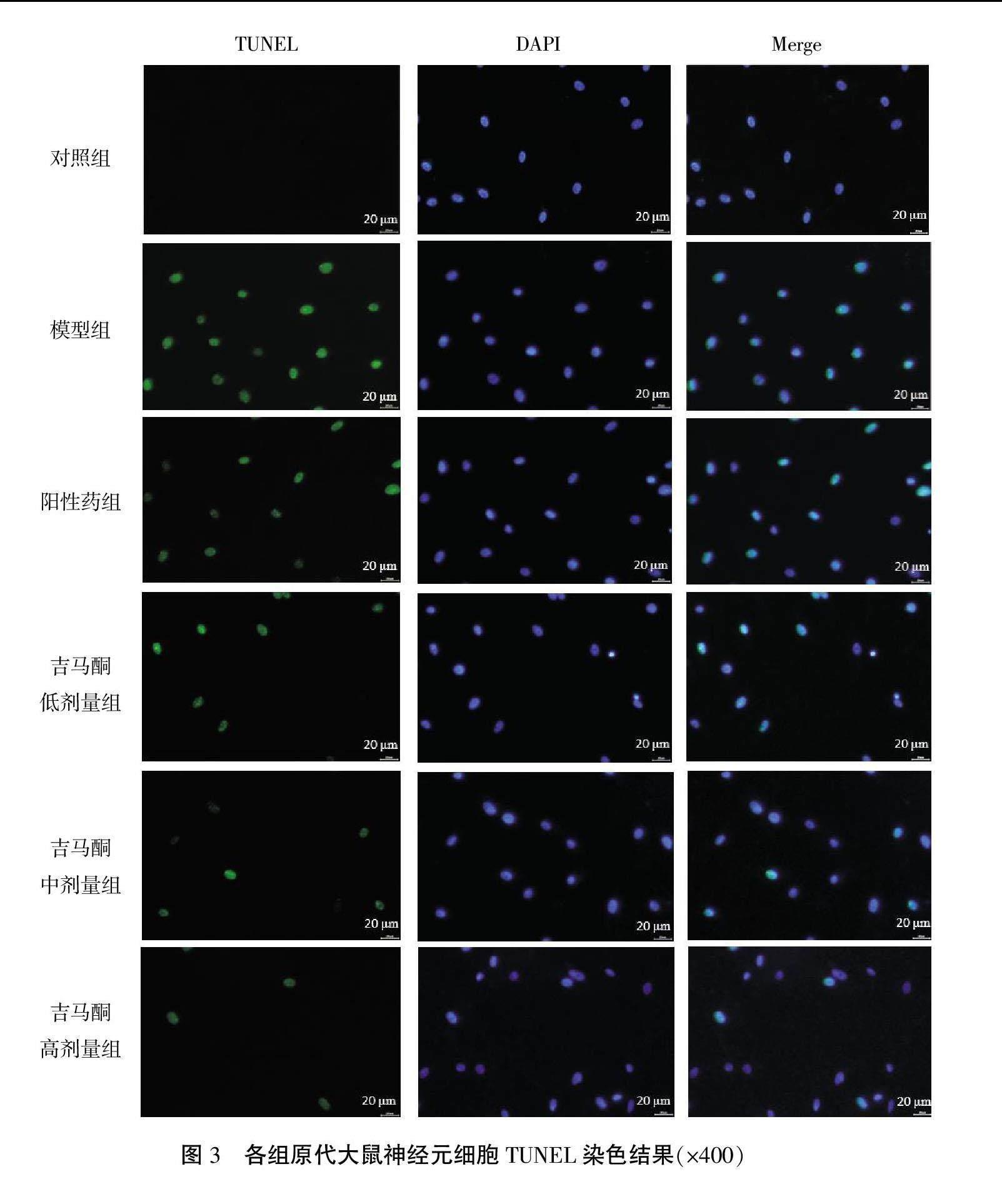
1.2.11 TUNEL染色 海马组织石蜡切片和预先用4%多聚甲醛固定30 min的神经元细胞用0.3% Triton X-100室温孵育5 min,之后PBS洗涤2次。按说明书配制TUNEL检测液,各孔加50 μL TUNEL染色液,37 ℃避光孵育60 min,PBS洗涤3次。用DAPI处理细胞,染细胞核10 min,PBS洗涤。用抗荧光淬灭封片液封片后,荧光显微镜下观察,绿色荧光为TUNEL染色阳性细胞,蓝色荧光为细胞核。根据TUNEL阳性细胞数/DAPI阳性细胞数的比值计算细胞凋亡率。
1.3 统计学分析
采用SPSS 21.0统计软件进行数据分析。数据均以“x±s”表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能评分比较
与假手术组比较,模型组大鼠神经功能评分升高(P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组神经功能评分降低(P<0.05或P<0.01)。详见表1。
2.2 各组脑指数和脑组织含水量比较
与假手术组比较,模型组大鼠脑指数和脑组织含水量升高(P<0.05或P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组脑指数和脑组织含水量降低(P<0.05或P<0.01)。与吉马酮低剂量组比较,吉马酮高剂量组脑指数降低(P<0.05)。详见表2。
2.3 各组血清和脑组织中炎症因子和氧化应激因子比较
与假手术组比较,模型组大鼠血清中TNF-α、IL-6和IL-1β、MDA水平升高(P<0.01),SOD和GSH-Px水平降低(P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组血清中TNF-α、IL-6和IL-1β、MDA的水平降低(P<0.05或P<0.01),SOD和GSH-Px水平升高(P<0.05或P<0.01)。与阳性药组比较,吉马酮高剂量组血清中IL-6和IL-1β水平降低(P<0.05),SOD的水平升高(P<0.05)。与吉马酮低剂量组比较,吉马酮高剂量组血清中TNF-α、IL-6和IL-1β、MDA水平降低(P<0.05),SOD和GSH-Px水平升高(P<0.05)。详见表3。
2.4 各组脑组织海马区HE染色结果及细胞调亡率比较
假手术组大鼠海马区未见明显病理损伤,细胞结构完整,细胞排列紧密,排列清晰均匀,细胞核完整,细胞间隙完整。模型组大鼠脑组织可见典型坏死神经元,细胞数量减少,细胞核萎缩,细胞排列稀疏无序。而阳性药组和吉马酮不同剂量组大鼠脑组织损伤明显改善,具体表现为正常神经元数量增加,细胞核形态与细胞间隙均表现正常。详见图1。
与假手术组比较,模型组大鼠海马组织细胞凋亡率升高(P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组大鼠海马组织细胞凋亡率均降低(P<0.01或P<0.05),且吉马酮各剂量组细胞凋亡率的降低呈剂量依赖性(P<0.01或P<0.05)。详见表4、图2。
2.5 各组脑组织Caspase-3活性比较
与假手术组比较,模型组大鼠脑组织Caspase-3活性增加(P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组大鼠脑组织Caspase-3活性下降(P<0.05或P<0.01)。与吉马酮低剂量组比较,吉马酮高剂量组Caspase-3活性下降(P<0.05)。详见表5。
2.6 各组原代大鼠神经元细胞存活率比较
与对照组比较,模型组细胞存活率降低(P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组细胞存活率升高(P<0.01)。详见表6。
2.7 各组神经元细胞Caspase-3活性比较
与对照组比较,模型组细胞Caspase-3活性增加(P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组细胞Caspase-3活性下降(P<0.05或P<0.01),且吉马酮不同剂量组细胞Caspase-3活性的降低呈剂量依赖性(P<0.05)。详见表7。
2.8 各组原代大鼠神经元细胞凋亡率比较
与对照组比较,模型组细胞凋亡率增加(P<0.01)。与模型组比较,阳性药组和吉马酮不同剂量组细胞凋亡率减少(P<0.01),且吉马酮不同剂量组细胞凋亡率的降低呈剂量依赖性(P<0.05或P<0.01)。详见表8、图3。
3 讨论
据报道,缺血性脑卒中已造成全球数百万人死亡[14]。然而,在临床上,血管再通治疗效果不佳,而且再灌注本身会诱导神经元损伤,致损伤大脑恢复缓慢[15]。中医学认为,缺血性脑卒中主要是由于外感风邪、内伤情志、饮食不节、劳倦过度等因素导致气血运行失常、经络阻塞和脏腑功能失调[16]。脑卒中的临床治疗应以益气活血、化瘀通络为主要原则[17]。中药莪术具有行气破血、消积止痛的功效,对缺血性脑卒中具有保护作用[18]。作为中药莪术的主要有效成分之一,吉马酮具有显著的抗氧化应激、抗炎和抗细胞凋亡的作用[9-10],进而推测其可能对I/R大鼠具有保护作用。而且已有研究表明,吉马酮对创伤性脑损伤大鼠的神经元具有保护作用[9]。因此,我们进一步研究吉马酮能否通过抗氧化应激和抗炎作用起到抗神经元凋亡的作用,从而对I/R引起的大脑损伤具有保护作用。
炎症和氧化应激与神经变性和神经元凋亡密切相关[19]。I/R后可见大量细胞凋亡[20]。炎症反应会破坏完整的血脑屏障,导致周围炎性细胞进入受损脑组织,加重炎症反应;尤其在急性缺血期,TNF-α、IL-6和IL-1β在受损脑组织中表达水平显著升高,加重神经损伤[21]。发生I/R时,脑组织血管的通透性增加,形成血管源性脑水肿;随着细胞复氧,线粒体功能受损,活性氧生成增加,诱导氧化应激反应加强,导致细胞水肿、凋亡甚至组织梗死[22]。因此,本研究建立脑梗死大鼠模型和原代大鼠神经元OGD模型,通过体内、体外实验研究吉马酮抗炎、抗氧化应激和抗细胞凋亡的作用。研究结果表明,吉马酮可升高大鼠血清SOD和GSH-Px水平,降低MDA水平,从而显著抑制脑梗死大鼠体内氧化应激反应。同时,吉马酮可显著降低大鼠血清炎症因子TNF-α、IL-6和IL-1β水平,从而抑制大鼠体内炎症反应。Caspase-3活性检测和TUNEL染色结果显示,吉马酮对脑梗死造成的大鼠脑组织神经元凋亡,以及OGD导致的原代大鼠神经元凋亡均有明显的保护作用。因此,本研究猜测吉马酮可能通过抑制大鼠I/R引起的炎症反应和氧化应激反应,从而抑制损伤部位神经元细胞凋亡,保护受损大脑。
I/R会导致神经元细胞凋亡及组织梗死,因此,动物出现异常的神经行为学表现[23]。本研究评价各组大鼠神经功能评分、脑指数、脑组织含水量以及观察脑组织形态学变化,以上指标可充分反映大鼠I/R的损伤程度。研究结果表明,与模型组相比,吉马酮可降低脑梗死大鼠的脑指数、脑组织含水量和神经功能评分,改善大鼠脑组织细胞数量减少、核固缩、细胞水肿等病理学改变。以上结果提示,吉马酮可以缓解I/R损伤引起的损伤。
综上所述,吉马酮可以缓解急性MCAO造成的大鼠脑损伤,此保护作用可能与减轻大鼠脑组织炎症反应、抑制氧化应激反应、减少神经元细胞凋亡有关。
参考文献
[1] TSAO C W, ADAY A W, ALMARZOOQ Z I, et al. Heart disease and stroke statistics-2023 update: A report from the American heart association[J]. Circulation, 2023, 147(8): e93-e621.
[2] JURCAU A, SIMION A. Neuroinflammation in cerebral ischemia and ischemia/reperfusion injuries: From pathophysiology to therapeutic strategies[J]. International Journal of Molecular Sciences, 2021, 23(1): 14.
[3] XIANG M, LU Y D, XIN L Y, et al. Role of oxidative stress in reperfusion following myocardial ischemia and its treatments[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 6614009.
[4] ZHAO Y L, XU J F. Sanggenon C ameliorates cerebral ischemia-reperfusion injury by inhibiting inflammation and oxidative stress through regulating RhoA-ROCK signaling[J]. Inflammation, 2020, 43(4): 1476-1487.
[5] STOLL G, NIESWANDT B. Thrombo-inflammation in acute ischaemic stroke-implications for treatment[J]. Nature Reviews Neurology, 2019, 15(8): 473-481.
[6] CHENG Y Y, CHENG L K, GAO X, et al. Covalent modification of Keap1 at Cys77 and Cys434 by pubescenoside a suppresses oxidative stress-induced NLRP3 inflammasome activation in myocardial ischemia-reperfusion injury[J]. Theranostics, 2021, 11(2): 861-877.
[7] 李泽宇, 郝二伟, 杜正彩, 等. 吉马酮的药理作用及其作用机制的研究进展[J]. 现代药物与临床, 2022, 37(3): 644-652.
[8] RIAZ A, RASUL A, KANWAL N, et al. Germacrone: A potent secondary metabolite with therapeutic potential in metabolic diseases, cancer and viral infections[J]. Current Drug Metabolism, 2020, 21(14): 1079-1090.
[9] ZHUANG S J, LIU B G, GUO S F, et al. Germacrone alleviates neurological deficits following traumatic brain injury by modulating neuroinflammation and oxidative stress[J]. BMC Complementary Medicine and Therapies, 2021, 21(1): 6.
[10] 朱太平, 孟令源, 张艺恬. 吉马酮通过调控miR-297表达对H2O2诱导的小鼠海马神经元细胞凋亡和氧化应激的影响[J]. 中国药师, 2021, 24(6): 1035-1039.
[11] LI F, FEI Q S, MAO D, et al. Comparative pharmacokinetics of nimodipine in rat plasma and tissues following intraocular, intragastric, and intravenous administration[J]. AAPS PharmSciTech, 2020, 21(6): 234.
[12] WU T H, YIN F, KONG H M, et al. Germacrone attenuates cerebral ischemia/reperfusion injury in rats via antioxidative and antiapoptotic mechanisms[J]. Journal of Cellular Biochemistry, 2019, 120(11): 18901-18909.
[13] 王建君, 余清平, 郭 丹, 等. 基于铁调素调控铁代谢相关蛋白探讨脑泰方干预氧糖剥夺损伤的神经元保护机制[J]. 湖南中医药大学学报, 2022, 42(4): 542-547.
[14] NTAIOS G. Embolic stroke of undetermined source: JACC review topic of the week[J]. Journal of the American College of Cardiology, 2020, 75(3): 333-340.
[15] ZHAO M M, HOU S, FENG L S, et al. Vinpocetine protects against cerebral ischemia-reperfusion injury by targeting astrocytic Connexin43 via the PI3K/AKT signaling pathway[J]. Frontiers in Neuroscience, 2020, 14: 223-237.
[16] WOOD H. Selective neuronal loss could limit penumbral rescue after stroke[J]. Nature Reviews Neurology, 2018, 14(7): 380-381.
[17] 刘 丹, 李文志. 缺血性脑卒中的中医治疗的研究进展[J]. 心血管康复医学杂志, 2023, 32(6): 625-628.
[18] 黄瑀莘,王柳萍,吴桂甫,等. 莪术对局灶性脑缺血模型大鼠的神经保护作用[J]. 广西医科大学学报, 2015, 32(6): 883-887.
[19] 刘春华, 刘 捷. 神经元凋亡与Caspase家族及细胞周期研究进展[J]. 人民军医, 2018, 61(7): 641-644.
[20] LIU H Q, LIU W, QIU H L, et al. Salvianolic acid B protects against myocardial ischaemia-reperfusion injury in rats via inhibiting high mobility group box 1 protein expression through the PI3K/Akt signalling pathway[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2020, 393(8): 1527-1539.
[21] JURCAU A, ARDELEAN I A. Molecular pathophysiological mechanisms of ischemia/reperfusion injuries after recanalization therapy for acute ischemic stroke[J]. Journal of Integrative Neuroscience, 2021, 20(3): 727-744.
[22] ZHANG Q, JIA M, WANG Y F, et al. Cell death mechanisms in cerebral ischemia-reperfusion injury[J]. Neurochemical Research, 2022, 47(12): 3525-3542.
[23] 李青青, 范倩倩, 左慧颖, 等. 脑缺血/再灌注导致神经元损伤机制的研究进展[J]. 中国医药科学, 2023, 13(2): 35-38.

