藻蓝蛋白对小鼠皮肤损伤的治疗效果
邵丽林 解佑银 张雷芳

摘要:为探讨藻蓝蛋白(CPC)对小鼠皮肤损伤的治疗效果,将ICR小鼠分为正常对照组(Con)、模型组(Mod)、空白敷料组(BD)、藻蓝蛋白敷料组(CPC TDD)和藻蓝蛋白敷料+藻蓝蛋白腹腔注射组(CPC+ip.)5个处理组进行小鼠烫伤试验。结果表明,CPC TDD组和CPC+ip.组伤口愈合时间最短,可以降低血清中丙二醛(MDA)含量,提高超氧化物歧化酶(SOD)含量,降低血清中炎症因子TNF-α和IL-6的水平。藻蓝蛋白通过增强机体抗氧化能力,降低炎症因子水平,从而对皮肤损伤的愈合起到促进作用。
关键词:藻蓝蛋白;小鼠;皮肤损伤;伤口愈合;烫伤;海水浸泡
中图分类号:R965 文献标识码:A
文章编号:0439-8114(2024)06-0141-10
DOI:10.14088/j.cnki.issn0439-8114.2024.06.023 开放科学(资源服务)标识码(OSID):
The therapeutic effect of phycocyanin on skin damage in mice
SHAO Li-lin, XIE You-yin, ZHANG Lei-fang
(School of Food and Pharmacy, Zhejiang Ocean University/Zhejiang Provincial Engineering Technology Research Center of Marine Biomedical Products , Zhoushan 316022, Zhejiang, China)
Abstract:To investigate the therapeutic effect of C-phycocyanin (CPC) on skin injuries in mice, ICR mice were divided into five groups: normal control group (Con), model group (Mod), blank dressing group (BD), CPC-treated dressing group (CPC TDD), and CPC-treated dressing plus intraperitoneal injection of CPC group (CPC+ip.) for conducting mouse scalding experiments. The results showed that the wound healing time was the shortest in the CPC TDD and CPC+ip. groups, which could reduce the content of malondialdehyde (MDA) in serum, increase the content of superoxide dismutase (SOD), and decrease levels of inflammatory factors TNF-α and IL-6 in serum. Phycocyanin could promote skin injury healing by enhancing antioxidant capacity and reducing levels of inflammatory factors.
Key words: C-phycocyanin; mice; skin injury; wound healing; scalding; seawater immersion
随着中国海洋事业活动日益频繁,周边海洋局势较为复杂,海上事故合并烧伤发生率日益增高[1,2]。海水具有高渗、碱性、低温、有菌等特殊理化性质,烧伤合并海水浸泡会造成机体高渗状态、电解质紊乱、血流动力学紊乱以及创面组织微循环障碍;继发损伤较重,易造成多脏器功能衰竭,如急性肺损伤[3]。
藻蓝蛋白(C-phycocyanin,CPC)呈蓝色粉末状,溶于水,不溶于脂类物质。藻蓝蛋白分子由开链四吡咯化合物和脱辅蛋白经硫醚键结合形成[4]。螺旋藻的藻蓝蛋白生产率和单位生物量中藻蓝蛋白含量均为相对较高[5]。在药学研究中,CPC已被应用于治疗氧化应激诱导的疾病以及作为强大的抗炎剂[6-8]和抗氧化剂[9-11]。近几年,关于藻蓝蛋白的研究主要有色素藻蓝蛋白,藻蓝蛋白荧光性,藻蓝蛋白的抗氧化、抗癌活性以及藻蓝蛋白改性与稳定性研究等[12]。目前,国内外已有报道藻蓝蛋白具有强大的伤口愈合效果,安全系数很高。Madhyastha等[13]证实了CPC加速伤口愈合,一方面通过细胞周期依赖性激酶CDK1和CDK2诱导成纤维细胞增殖;另一方面促进细胞向伤口迁移,后续制备可生物降解的CPC支架[14],在小鼠皮肤损伤中应用加速伤口愈合的第一阶段。Manconi等[15]的研究发现常规磷脂微囊能够提高CPC在小鼠体内抗炎活性,并呈剂量依赖关系,而脂质体仅使用1/2的CPC剂量就能产生与游离蛋白相同的抗炎反应;Madhyastha等 [16]将藻蓝蛋白(CPC)作为原材料合成了毒性较低的真皮创面修复材料银纳米颗粒(AgCPCNPs),具有CPC作为创面修复剂和Ag纳米金属作为抗菌剂的双重优势。
本研究将藻蓝蛋白制备成敷料,通过小鼠皮肤损伤试验对其抗炎、抗氧化、加速创面愈合等治疗效果进行了探索。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性ICR小鼠90只(合格证号:20201130Abzz0105999214 SPF级),小鼠全身皮肤完好无损伤,体重20~25 g。饲养小鼠所用的60Co灭菌饲料和灭菌垫料均由浙江省实验动物中心提供。
1.1.2 仪器 YP1002N型电子天平、BT125D型分析天平(上海民侨精密科学仪器有限公司),UPT-II-60L型落地式超纯水机(上海四科仪器设备有限公司),CF16RN型高速台式冷冻离心机(日本HITACHI公司),DK-S24型电热恒温水浴锅(上海森信实验仪器有限公司),DHG-9140A型鼓风干燥箱(上海精宏实验设备有限公司)。
1.1.3 试剂 PVA-124、藻蓝蛋白(CPC)、乙醇、羟苯乙酯、丙二醇、氮酮、水合氯醛、硫化钠、氯化钠、氯化镁、硫酸镁、氯化钙、溴化钠、碳酸氢钠、氯化钾均购自国药集团化学试剂有限公司;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒购自上海碧云天生物技术有限公司;白介素-6(IL-6)试剂盒、肿瘤坏死因子(TNF-α)试剂盒购自艾博抗(上海)贸易有限公司。
1.2 方法
1.2.1 藻蓝蛋白敷料的制备 称取0.9 g PVA-124和0.03 g羟苯乙酯加入纯水中,置于90 ℃水浴中溶胀24 h,胶体冷却备用。称取0.03 g CPC加入胶体中溶解,再加入5 mL 无水乙醇、0.3 mL 1%丙二醇溶液及0.3 mL 1%氮酮溶液混合均匀,加入ddH2O定容至30 mL备用。
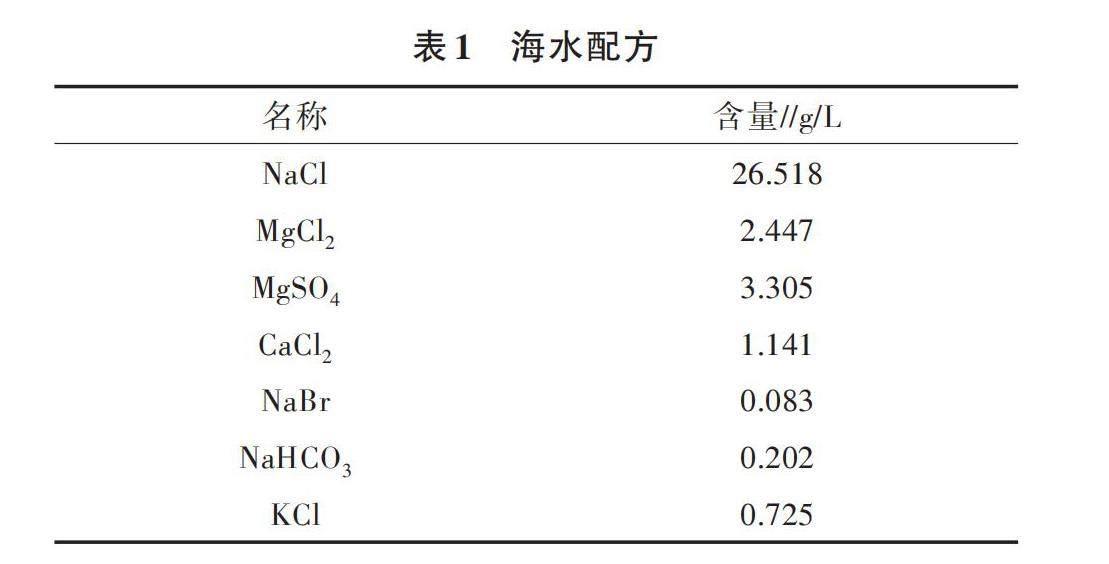
1.2.2 海水条件 所用海水按照国家海洋局第三海洋研究所配方配制(表1),主要成分及含量接近于中国东南沿海海水,pH 8.2、相对密度1.05、渗透压 1 300 mmol/L,利用0.22 μm过滤膜过滤后置于4 ℃保存备用。
1.2.3 动物模型的制备分组及给药
1)小鼠试验分组及给药。将小鼠随机分为正常对照组(Control group,Con)、模型组(Model group, Mod)、空白敷料对照组(Blank dressing group, BD)、藻蓝蛋白敷料组(C-phycocyanin transdermal drug delivery group, CPC TDD)、藻蓝蛋白敷料+藻蓝蛋白腹腔注射组(CPC transdermal drug delivery+CPC intraperitoneal injection group,CPC+ip.)。给药方法如表2所示。
2)烫伤试验。①取30只小鼠,自由进食和饮水,饲养在标准环境条件下[温度(24±2) ℃,40%~60%湿度和12 h光-暗循环],适应1周后进行试验。②脱毛:使用8 g NaS与100 mL ddH2O制作脱毛剂,给小鼠脱毛,放置24 h使其自然恢复。③造模:每只小鼠腹腔注射10%的水合氯醛溶液(0.04 mL/10 g),麻醉小鼠。然后将已预热的直径为1.5 cm的圆形砝码[(95±2) ℃],用摄子夹紧放在小鼠背部脱毛区域烫伤10 s,造成小鼠皮肤烫伤,保持每只小鼠烫伤区域一致。
3)烫伤后海水浸泡试验。重复上述烫伤试验,将烫伤后的小鼠马上捆绑固定,在预先准备的海水中浸泡1 h。将小鼠打捞出来后,用生理盐水冲洗伤口。
4)创伤后海水浸泡试验。小鼠脱毛区域用75%的乙醇溶液消毒,背部脊柱切割一个1 cm×1 cm的正方形伤口,伤口深至皮肤黏膜层。小鼠致伤后海水浸泡1 h,将小鼠打捞出水后,擦干体表的海水,用生理盐水冲洗伤口。
1.2.4 指标检测
1)体重。检测伤口愈合过程中小鼠体重变化,观察小鼠体重变化趋势。
2)伤口愈合时间。从致伤时开始,至创伤表面开始结痂伤口基本愈合为止,记录各组小鼠的伤口愈合时间。
3)伤口面积及伤口愈合率变化。在第3、7、14天记录小鼠创后的伤口面积,计算伤口愈合率。伤口愈合率=[(伤口初始面积-测量当日面积)/伤口初始面积]×100%。
4)组织学分析。在致伤后第3、7、14天,将小鼠麻醉后,于创伤表面切取大小为1 cm×1 cm,厚度不超过3 mm的组织标本,采用HE染色法观察皮肤组织学变化,评估其病理变化。
5)测定血清中炎症因子和抗氧化因子水平。测定血清中的TNF-α、IL-6、MDA和SOD含量。
1.2.5 数据分析 采用SPSS13.0统计分析软件对各组数据进行统计学分析,数据以平均值±标准差(x±S)表示。组内多重比较采用t 检验方法,然后采用纽曼-科伊尔斯检验。P<0.05时,对比组间差异显著。
2 结果与分析
2.1 烫伤试验结果
2.1.1 造模效果 造模效果见图1。
2.1.2 藻蓝蛋白对小鼠体重的影响 如图2所示,Con组小鼠体重平稳增长,除Con组外,其他处理组小鼠体重总体初期都有先降低后升高的趋势;CPC+ip.组体重恢复最快,CPC TDD组其次;烫伤后期CPC+ip.组恢复接近Con组。结果表明,由于烫伤初期,小鼠出现脱水、食欲降低、炎症等症状而导致小鼠体重下降,藻蓝蛋白治疗具有促进小鼠体重恢复的作用。
2.1.3 藻蓝蛋白对伤口面积变化影响 由图3、图4可知,Mod组伤口愈合速度最慢,在第14天时仍未完全愈合,BD组与Mod组状态相似。与Mod组相比,CPC TDD组愈合速度快,在第14天时伤口基本愈合。与其他组相比,CPC+ip.组的伤口愈合速度最快,在第14天时伤口已完全愈合并且体毛开始恢复。结果表明,小鼠背部烫伤后,组织液大量渗出,继而组织液干燥硬化,形成痂皮。空白敷料对皮肤愈合几乎无作用,藻蓝蛋白对皮肤愈合具有促进作用,并且辅以腹腔注射效果更佳。
2.1.4 组织学变化结果 如图5所示,在创面愈合过程中,早期大量的血小板聚集形成凝块,逐渐硬化形成痂皮。创缘毛细血管通透性增加,大量炎性细胞(淋巴细胞和单核巨噬细胞)渗出,主要集中于创缘周围。3 d时各组上皮细胞明显破坏,上皮组织大部分脱落;7 d时CPC TDD组和CPC+ip.组已经有较多愈合和即将愈合的部分;14 d时CPC TDD和CPC+ip.组镜下表皮细胞排列整齐、连续,上皮细胞着色良好,真皮层组织及附属结构清晰完整,真皮胶原细胞排列整齐。Mod和BD组可见表皮层次尚清楚,细胞出现肿胀,层次结构尚清楚,细胞核结构不清。结果表明,藻蓝蛋白能促进烫伤伤口结构修复,保护皮肤组织和细胞结构的完整性。
2.1.5 藻蓝蛋白对烫伤小鼠血清中MDA和SOD含量影响 由图6可知,与Mod组相比,CPC+ip.组血清中MDA含量显著减少,SOD含量显著增加(P<0.05),而CPC TDD组血清中MDA含量也有减少,SOD含量增加,但不显著。结果表明,藻蓝蛋白能促进小鼠的SOD表达,降低MDA含量来提高小鼠抗氧化能力,从而促进伤口愈合。
2.1.6 藻蓝蛋白对烫伤小鼠血清中TNF-α和IL-6含量影响 如图7所示,与Con组相比,Mod组血清中TNF-α和IL-6含量增加。与Mod组相比,CPC+ip.组血清中TNF-α和IL-6含量显著减少(P<0.05)。由此可见,藻蓝蛋白通过下调炎症因子表达来减轻烫伤小鼠的炎症反应。
2.2 烫伤后海水浸泡试验结果
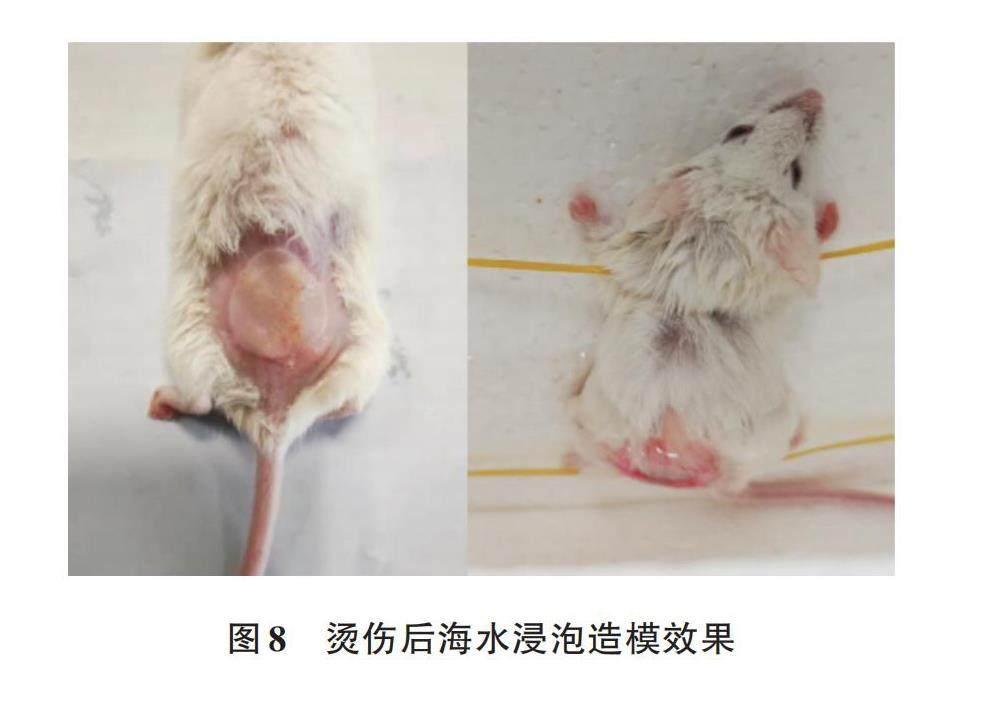
2.2.1 造模效果 造模效果如图8所示。
2.2.2 藻蓝蛋白对小鼠体重的影响 如图9所示,Con组体重基本呈平稳增长趋势,Mod组、BD组和CPC TDD组体重先下降再上升,CPC+ip.组体重呈上升趋势,明显高于其他处理组。结果表明,藻蓝蛋白可以促进小鼠体重恢复,且辅以腹腔注射效果更佳。
2.2.3 藻蓝蛋白对伤口面积变化影响 如图10、图11所示,Mod组和BD组14 d时伤口仍未愈合,伤口愈合率比其他两组都低,并还有结痂存在。CPC TDD和CPC+ip.两组小鼠掉痂所用时间均低于Mod和Con组,并且CPC+ip.组用时最短。CPC+ip.组在第14天时伤口已基本完全愈合。结果表明,藻蓝蛋白可以促进小鼠损伤皮肤愈合,并且辅以腹腔注射效果最佳。
2.2.4 组织学变化结果 由图12可知,小鼠致伤 3 d后所有处理组小鼠的创面组织都出现不同程度的炎症细胞浸润,黏膜下层疏松,毛囊被破坏。Mod组和BD两组创面组织的炎症程度较CPC+ip.和CPC TDD两组明显加重,黏膜上皮细胞脱落情况严重,细胞排列稀疏且不规整。第7天,CPC+ip.组小鼠炎症程度明显减轻,毛囊增多,表皮细胞结构完整且增殖旺盛,其他处理组表皮细胞还较稀疏,排列不规整。第14天,CPC+ip.和CPC TDD两组的小鼠创面已接近愈合,细胞结构完整且排列整齐。第21天,所有处理组小鼠创面表皮细胞均排列紧密且组织完整。
2.2.5 藻蓝蛋白对烫伤后海水浸泡小鼠血清中MDA和SOD含量影响 如图13所示,与Mod组相比,CPC TDD组和CPC+ip.组SOD含量上升,MDA含量下降,而CPC+ip.组有显著差异(P<0.05)。结果表明,藻蓝蛋白可以增强体内抗氧化应激反应,辅以腹腔注射效果更佳。
2.2.6 藻蓝蛋白对烫伤小鼠血清中TNF-α和IL-6含量影响 如图14所示,与Con组相比,Mod组血清中TNF-α和IL-6含量增加。与Mod组相比,CPC TDD和CPC+ip.组血清中TNF-α和IL-6含量下降,其中,CPC+ip.组血清中TNF-α和IL-6含量显著低于Mod组(P<0.05)。结果表明,藻蓝蛋白可以下调炎症因子表达。
2.3 创伤后海水浸泡试验
2.3.1 造模效果 造模效果如图15所示。
2.3.2 小鼠体重变化结果 如图16所示,Con组体重呈平稳增长趋势,CPC TDD组和CPC+ip.组的小鼠体重在5 d内出现一个平台期,之后体重开始迅速增长。
2.3.3 伤口愈合时间结果 如图17、图18所示,Mod组和BD组在14 d时伤口仍未愈合,伤口愈合率比其他两组都低,结痂所有组均都脱落。CPC TDD和CPC+ip.两组小鼠掉痂所用时间均低于Mod和Con组,并且与Mod组相比,CPC+ip.组有显著差异(P<0.05)。CPC+ip.组在第14天时伤口基本愈合。结果表明,藻蓝蛋白可以促进小鼠损伤皮肤愈合。
2.3.4 组织学变化结果 由图19可知,在第7天时,Mod组创面组织水肿,大量炎性细胞浸润,表皮细胞坏死,创面表面不完整。CPC TDD组和CPC+ip.组炎性细胞浸润减轻,表皮逐渐恢复。第14天时,Mod组部分创面坏死,表皮仍不完整,有疤痕和新生组织出现。CPC TDD组和CPC+ip.组表皮加厚且创面完整,皮肤结构层次清晰,可见肉芽组织形成。
2.3.5 藻蓝蛋白对烫伤后海水浸泡小鼠血清中MDA和SOD含量影响 如图20所示,与Con组相比,Mod组血清中SOD含量下降,MDA含量增加。与MOD组相比,CPC TDD组和CPC+ip.组SOD含量上升,MDA含量下降,其中CPC+ip.组有显著差异(P<0.05)。结果表明,藻蓝蛋白可以增强体内抗氧化应激反应,辅以腹腔注射效果更佳。
2.3.6 藻蓝蛋白对烫伤小鼠血清中TNF-α和IL-6含量影响 如图21所示,与Con组相比,Mod组血清中TNF-α和IL-6含量增加。与Mod组相比,CPC TDD和CPC+ip.组TNF-α和IL-6含量下降。其中,CPC+ip.组血清中TNF-α和IL-6含量显著低于Mod组(P<0.05)。结果表明,藻蓝蛋白可以下调炎症因子表达。
3 小结与讨论
SOD在机体内能够有效清除氧化自由基、维持机体自由基的均衡、保护组织免受氧化损伤。SOD含量低,氧自由基会大量堆积,发生脂质过氧化反应,产生大量脂质过氧化物MDA,损害机体。刘琪等[17]发现藻蓝蛋白对X射线辐射所引起的小鼠氧化系统损伤模型具有预防作用。与模型组相比,藻蓝蛋白预防组血清和肝组织中的SOD含量上升,MDA含量下降,肝组织中ROS和GSH-PX含量上升,表明藻蓝蛋白可以保护体内的氧化系统,提高机体的抗氧化能力。本研究使用藻蓝蛋白敷料的小鼠机体内SOD含量增加,MDA含量下降,并且辅以腹腔注射藻蓝蛋白的效果更显著。
TNF-α在受伤小鼠体内能诱导IL-1、IL-10、IFN-γ等细胞因子参与炎症反应。IL-6和TNF-α含量越高,表明小鼠体内炎症反应更剧烈,伤口愈合越慢。Grover等[18]发现藻蓝蛋白可以抑制炎症细胞因子(IL-1α、IL-1β、IL-2、IL-4、IL-6、IL-12、IL-13、IFN-c、TNF-a)产生,从而增加机体的免疫力。本研究证明CPC可以降低小鼠皮肤损伤模型血清中的IL-6和TNF-a的合成,减轻小鼠炎症反应,从而促进小鼠皮肤愈合,达到治疗作用。
藻蓝蛋白还具有抗肿瘤、抗纤维化、增强免疫力等功能活性[19]。孙英新[20]的研究发现藻蓝蛋白可以减轻百草枯诱导的大鼠肺纤维化,并降低血清和肺组织中的MDA含量,增加SOD抗氧化酶的含量,抑制TNF-α的活性并降低TGF-β1水平。翟诗翔[21]的研究发现藻蓝蛋白可以缓解在LPS诱导的肝星状细胞纤维化以及CCL4诱导的大鼠体内肝纤维化,并且发现藻蓝蛋白可以增加大鼠体内具有抗炎活性的肠道菌群丰度。韩敏敏[22]的研究发现藻蓝蛋白明显抑制人肝癌细胞、人胰腺癌细胞等8种肿瘤细胞的生长,能够促进小鼠免疫器官发育,增强机体免疫力。张昕等[23]的研究发现藻蓝蛋白及其α、β亚基对人肺腺癌SPC-A-1细胞有明显的抑制生长作用,并且细胞存活率与浓度呈反比。褚静等[24]的研究发现C-藻蓝蛋白诱导乳腺癌细胞凋亡并抑制其增殖,主要机制可能与激活p38MAPK和JNK信号传导有关。
参考文献:
[1] 夏照帆,马 兵.现代战争条件下海战创伤救治的几点思考[J].解放军医学杂志, 2016, 41(12): 973-976.
[2] 罗 丹, 王宜娜, 吴建新, 等. 士兵海战伤自救互救关键操作技能的掌握情况[J]. 解放军护理杂志, 2020, 37(7): 66-68.
[3] 马 军, 烧伤合并海水浸泡后急性肺损伤相关机制探讨[D]. 广州:南方医科大学, 2017.
[4] LIU L N, CHEN X L, ZHANG Y Z, et al. Characterization, structure and function of linker polypeptides in phycobilisomes of cyanobacteria and red algae: An overview[J]. BBA-bioenergetics,2005,1708(2):133-142.
[5] 方 蕙. 基于光谱技术对钝顶螺旋藻藻蓝蛋白含量的快速检测研究[D].杭州: 浙江大学, 2020.
[6] OU Y, ZHENG S, LIN L, et al. Protective effect of C-phycocyanin against carbon tetrachloride-induced hepatocyte damage in vitro and in vivo[J]. Chem Biol Interact, 2010,185(2): 94-100.
[7] MANCONIA M, PEND?S J, LED?N N, et al. Phycocyanin liposomes for topical anti-inflammatory activity:In-vitro in-vivo studies[J]. Pharm Pharmacol, 2009,61(4): 423-430.
[8] CADDEO C, CHESSA M, VASSALLO A, et al. Extraction, purification and nanoformulation of natural phycocyanin (from Klamath algae) for dermal and deeper soft tissue delivery[J]. Biomed Nanotechnol, 2013, 9(11): 1929-1938.
[9] THANGAM R, SURESH V, ASENATH P, et al. C-Phycocyanin from Oscillatoria tenuis exhibited an antioxidant and in vitro antip. roliferative activity through induction of apoptosis and G0/G1 cell cycle arrest[J]. Food Chem, 2013, 140(1-2): 262-272.
[10] MIN S K, KWON Y S, CHO M K, et al. Nasal delivery of antioxidants by cholesterol-incorporated liposomes extends the neuroprotective time window in cerebral ischemia[J]. Current pharmaceutical design, 2017, 23(40):6223-6230.
[11] CASTANGIA I, MANCA M L, CATAL?N-LATORRE A, et al. Phycocyanin-encapsulating hyalurosomes as carrier for skin delivery and protection from oxidative stress damage[J]. Mater Sci Mater Med, 2016, 27(4): 75.
[12] 沈向阳. 钝顶螺旋藻藻蓝蛋白的提取纯化精制研究及应用[D].南宁:广西大学,2019.
[13] MADHYASTHA H K, RADHA K S, NAKAJIMA Y,et al. uPA dependent and independent mechanisms of wound healing by C-phycocyanin[J]. Cell Mol Med, 2008, 12(6B): 2691-2703.
[14] MADHYASTHA H K, MADHYASTHA R, NAKAJIMA Y, et al. Regulation of growth factors-associated cell migration by C-phycocyanin scaffold in dermal wound healing[J]. Clin Exp Pharmacol Physiol, 2012, 39(1): 13-29.
[15] MANCONI M, MURA S, MANCA M L, et al. Chitosomes as drug delivery systems for C-phycocyanin: Preparation and characterization[J]. Int J Pharm, 2010, 392(1-2): 92-100.
[16] MADHYASTHA H K, MADHYASTHA R,THAKUR A, et al. c-Phycocyanin primed silver nano conjugates: Studies on red blood cell stress resilience mechanism[J]. Colloids Surf B Biointerfaces, 2020, 194: 111211.
[17] 刘 琪,李文军,陆丽娜,等.藻蓝蛋白对辐射致小鼠氧化损伤的保护作用[J].核技术,2018,41(1):31-36.
[18] GROVER P, BHATNAGAR A, KUMARI N, et al. C-Phycocyanin-a novel protein from Spirulina platensis-In vivo toxicity, antioxidant and immunomodulatory studies[J].Saudi J Biol Sci, 2021,28(3):1853-1859.
[19] 姜国庆,闫秋丽,李 东,等.螺旋藻中藻蓝蛋白提取、纯化及稳态化研究进展[J].食品安全质量检测学报,2021,12(6):2332-2338.
[20] 孙英新. 螺旋藻藻蓝蛋白抗百草枯诱导大鼠肺纤维化的研究[D].北京:中国科学院大学,2012.
[21] 翟诗翔. 螺旋藻藻蓝蛋白体内外抗肝纤维化机理研究[D].北京:中国科学院大学,2020.
[22] 韩敏敏. 钝顶螺旋藻藻蓝蛋白的抗肿瘤作用及其机制的研究[D].南宁:广西中医药大学,2021.
[23] 张 昕,郦剑勇,龚兴国. 螺旋藻C-藻蓝蛋白亚基分离及抗肿瘤活性研究[J].浙江大学学报(理学版),2010,37(3):319-323.
[24] 褚 静,周小兰,王立芹,等. C-藻蓝蛋白对乳腺癌细胞的抗癌作用研究[J].基因组学与应用生物学,2020,39(2):934-940.

